A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תרבית בתפזורת בלתי מופרעת של שרירי שלד עכבר כדי לשחזר נישה ושקט תאי גזע
* These authors contributed equally
In This Article
Summary
שרירי השלד מורכבים ממספר סוגי תאים, כולל תאי גזע תושבים, שלכל אחד מהם תרומה מיוחדת להומאוסטזיס והתחדשות שרירים. כאן מתוארת התרבית הדו-ממדית של תאי גזע שריריים ונישת תאי השריר בסביבה ex vivo המשמרת רבים מהמאפיינים הפיזיולוגיים, in vivo וסביבתיים.
Abstract
שרירי השלד הם הרקמה הגדולה ביותר בגוף ומבצעים תפקודים רבים, החל מתנועה ועד בקרת טמפרטורת הגוף. תפקודו והחלמתו מפציעות תלויים במספר רב של סוגי תאים ובאותות מולקולריים בין תאי שריר הליבה (מיופייבר, תאי גזע שריריים) לבין הנישה שלהם. רוב סביבות הניסוי אינן משמרות את המיקרו-סביבה הפיזיולוגית המורכבת הזו, והן גם אינן מאפשרות מחקר אקס ויו של תאי גזע שריריים במצב תא, מצב תאי חיוני עבורם. כאן, פרוטוקול מתואר עבור תרבית ex vivo של תאי גזע שריר עם רכיבים תאיים של הנישה שלהם. באמצעות פירוק מכני ואנזימטי של השרירים, מתקבלת תערובת של סוגי תאים, אשר מוכנס לתרבות דו-ממדית. Immunostaining מראה כי בתוך שבוע אחד, תאי נישה מרובים נמצאים בתרבית לצד myofibers, וחשוב מכך, תאים חיוביים Pax7 המציגים את המאפיינים של תאי גזע שריר שקט. תכונות ייחודיות אלה הופכות פרוטוקול זה לכלי רב עוצמה להגברת תאים וליצירת תאי גזע דמויי שקט שניתן להשתמש בהם כדי לענות על שאלות בסיסיות ותרגומיות.
Introduction
תנועה, נשימה, חילוף חומרים, תנוחת הגוף ושמירה על טמפרטורת הגוף תלויים כולם בשרירי השלד, ותקלות בשרירי השלד יכולות, לפיכך, לגרום לפתולוגיות מתישות (כלומר, מיופתיות, ניוון שרירים וכו '). 1. לאור תפקודיו החיוניים ושפעו, שרירי השלד משכו את תשומת ליבן של מעבדות מחקר ברחבי העולם השואפות להבין את ההיבטים המרכזיים התומכים בתפקוד תקין של השרירים ויכולים לשמש כמטרות טיפוליות. בנוסף, שרירי השלד הם מודל בשימוש נרחב לחקר התחדשות ותפקוד תאי גזע, שכן שריר בריא יכול לתקן את עצמו באופן מלא לאחר פציעה וניוון מוחלטים, בעיקר בשל תאי הגזע השוכנים בו2; אלה נקראים גם תאי לוויין והם ממוקמים מתחת ללמינה הבסיסית בפריפריה של סיבי השריר3.
תאי הליבה של שרירי השלד הבוגרים הם המיופייבר (תאים רב-גרעיניים סינסיטיאליים ארוכים) ותאי הלוויין (תאי גזע בעלי פוטנציאל מיוגני, שקטים עד שפציעה מפעילה אותם). התאים האחרונים הם התאים המרכזיים של התחדשות השריר, ותהליך זה אינו יכול להתרחש בהיעדרם 4,5,6,7. במיקרו-סביבה הקרובה שלהם, ישנם מספר סוגי תאים וגורמים מולקולריים שמאותתים להם. נישה זו מתבססת בהדרגה לאורך ההתפתחות ועד לבגרות8. שריר בוגר מכיל סוגי תאים מרובים (תאי אנדותל, פריציטים, מקרופאגים, אבות פיברו-אדיפוגניים-FAPs, תאי T רגולטוריים וכו ') 9,10 ורכיבי מטריצה חוץ-תאיים (למינינים, קולגן, פיברונקטין , פיברילינים, פריוסטין וכו') 11 המקיימים אינטראקציה זה עם זה ועם תאי הלוויין בהקשר של בריאות, מחלות והתחדשות.
שימור נישה מורכבת זו במסגרות ניסיוניות הוא בסיסי אך מאתגר. קשה לא פחות הוא לשמור או לחזור למצב שקט, מצב תאי שהוא קריטי עבור תאי לוויין9. הוכנסו מספר שיטות להתמודדות חלקית עם אתגרים אלה, כל אחת על יתרונותיה וחסרונותיה (המפורטת בחלק הדיון). כאן מוצגת שיטה שיכולה להתגבר חלקית על שני המחסומים הללו. השרירים נקצרים בתחילה ולאחר מכן מפורקים באופן מכני ואנזימטי לפני הכנסת תערובת התאים ההטרוגניים לתרבית. במהלך התרבית מתגלים סוגי תאים רבים של הגומחה ונצפים תאי לוויין שחזרו לשקט. כשלב אחרון של הפרוטוקול, מוצגים השלבים האימונופלואורסנטיים המאפשרים זיהוי של כל סוג תא באמצעות שימוש בסמנים מקובלים אוניברסליים.
Protocol
כל הניסויים עמדו בתקנות בעלי החיים של צרפת והאיחוד האירופי במכון Mondor de Recherche Biomédicale (INSERM U955), ובמיוחד ההנחיה 2010/63/UE. בעלי החיים הוחזקו בסביבה מבוקרת ומועשרת במתקני בעלי החיים עם מספרי הסמכה A94 028 379 ו-D94-028-028; הם טופלו רק על ידי חוקרים מוסמכים ומטפלים בבעלי חיים, והם נבדקו חזותית על ידי אנשי דיור לבעלי חיים לסימנים של אי נוחות במהלך חייהם. הם הומתו על ידי פריקת צוואר הרחם לפני הנתיחה. לא בוצעו הליכים התערבותיים במהלך חיי בעלי החיים; לפיכך, לא היה צורך בקבלת אישור להליך מוועדת אתיקה וממשרד ההשכלה הגבוהה, המחקר והחדשנות הצרפתי. אכן, לא נדרש אישור אתי להמתת חסד ולנתיחה לאחר המוות על פי ההנחיה 2010/63/UE. התוצאות המוצגות בכתב יד זה הן מקו C57BL/6NRj מסוג פרא (ראה טבלת חומרים) ומהקו המהונדס Tg:Pax7-nGFP 12 (שגודל על ידי הצוות שלנו). הפרוטוקול יושם על עכברים זכרים ונקבות בגילאי 8-12 שבועות.
1. מגיב וציוד הכנת מראש העיכול
- רססו את כלי הדיסקציה (מספריים ישרים ומעוקלים, מלקחיים, ראו טבלת חומרים) באתנול 70%, וייבשו אותם בנייר. מצפים צלחת שעם ברדיד אלומיניום, ושומרים בקרבת מקום צלחות פטרי בקוטר 10 ס"מ (אחת לכל חיה). יש נייר ו-70% אתנול בהישג יד.
הערה: בסוף הדיסקציה יש לשטוף את כלי הדיסקציה במים, לרסס אותם באתנול 70% ולייבש אותם בנייר. - הגדר אמבט מים מסתובב ל 37 ° C, והכן את תערובת העיכול (20 מ"ל / חי) על ידי שילוב DMEM עם 1% פניצילין-סטרפטומיצין, 0.5 U/mL collagenase, 3 U/mL dispase (ראה טבלה של חומרים), ו 0.2% BSA ב 50 מ"ל tube(s).
- מעבירים את תערובת העיכול דרך מסנן של 0.22 מיקרומטר במכסה מנוע של תרבית תאים.
הערה: מומלץ להכין את תערובת העיכול טרי בכל פעם.
2. ריאגנטים והכנת ציוד לאחר העיכול
- לאחר העיכול, התערובת יכולה להיות קפואה או בתרבית. להקפאה, להכין 10% DMSO: 90% סרום בקר עוברי (FBS), כמו גם קבוצה של cryotubes (1 מ"ל של השעיית תאים לכל 2 מ"ל cryotube). עבור התרבית, להכין מדיום תרבית (DMEM בתוספת 1% פניצילין-סטרפטומיצין, 4 ng / mL bFGF, ו 20% FBS) וקבוצה של 8 צלחות באר. יש לצפות את הלוחות לפני ציפוי התאים (פרטים מפורטים בשלב 7.1).
- עבור הצביעה, הכינו 4% פרפורמלדהיד (PFA) במי מלח חוצצי פוספט (PBS) (0.15 מ"ל/באר של צלחת 8 בארות) ותמיסת חסימה (אלבומין בסרום בקר 5% ללא IgG [BSA] ב-PBS; 0.15 מ"ל/באר של צלחת 8 הקידוחים).
אזהרה: אין לנשום את אבקת ה-PFA; הכינו וטפלו בו מתחת למכסה מנוע כימי.
3. דיסקציה
- רססו את בעל החיים שעבר המתת חסד באתנול 70%. בצע חתך אופקי (צד שמאל של הגוף לצד ימין) עם מספריים גדולים בגובה הבטן, ולחתוך סביב המותניים. משכו את העור מהגפיים האחוריות כדי לחשוף את השרירים (איור 1A).
- הניחו את בעל החיים על צלחת השעם המכוסה ברדיד אלומיניום, ונעצו את הגפה הקדמית והגפה האחורית הנגדיות. הסירו במהירות את כל שרירי הגפיים האחוריות (מלפנים ומאחור) לתוך צלחת פטרי בקוטר 10 ס"מ שהונחה על קרח (איור 1B,C). יש להקפיד במיוחד להסיר את רקמת השומן מהאזורים סביב הארבע ראשי והשרירים האחוריים. ניתן גם להסיר פאשיה, עצבים וגידים בשלב זה אם זה לא פוגע בזמן הכולל המושקע בדיסקציה.
הערה: זמן דיסקציה אופטימלי עבור שתי הגפיים האחוריות צריך להיות סביב 15-20 דקות. מומלץ כי זמן הנתיחה אינו עולה על 30 דקות. - הוסף טיפות DMEM לשרירים מדי פעם כדי לשמור אותם לחים, אבל לא יותר מדי, כמו זה יהפוך את חיתוך קשה. חזור על הפעולה עבור הגפה האחורית השנייה. ברגע שכל השרירים של חיה אחת נמצאים בצלחת הפטרי (איור 1D), קצצו אותם דק עם מספריים במשך 7-10 דקות כדי לקבל הומוגנט חלק (איור 1E).
הערה: בפרוטוקול זה, DMEM בתוספת L-גלוטמין, פירובט, ו 4.5 גרם / L D-גלוקוז משמש.
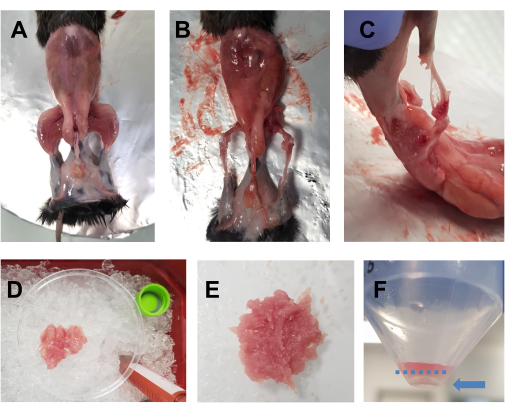
איור 1: הכנת שרירים לפני תרבית. (A) העור מוסר כדי לחשוף את שרירי הגפיים האחוריות, כמתואר בשלב 3.1. (ב,ג) כל שרירי הגפיים האחוריות נקצרים (B) סביב ו-(C) בין העצמות, כמתואר בשלב 3.2. (D) השרירים שנקטפו מונחים בצלחת פטרי בקוטר 10 ס"מ על קרח עם טיפות DMEM כדי לשמור עליהם לחים, כמתואר בשלב 3.3. (E) השרירים קצוצים דק במספריים עד לקבלת עיסה חלקה עם העקביות המתוארת בתמונה זו. (ו) תמונה של הגלולה לאחר הצנטריפוגה הסופית; החץ הכחול מדגיש את הכדור, שנמצא כנגד הצינור, מתחת לקו הכחול המקווקו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. עיכול
הערה: בסוף העיכול, צנטריפוגה ב 4 ° C, דלי קרח, שלוש מסננות תאים (100 אום, 70 אום, 40 אום), ושלושה צינורות 50 מ"ל (לכל חיה) נדרשים עבור סעיף 5.
- הכן וסנן את תערובת העיכול כמתואר בשלב 1.2. שומרים את התערובת על קרח.
- לאחר שכל השרירים קצוצים, מניחים את הומוגנט בצינור 50 מ"ל עם 20 מ"ל של תערובת העיכול. עטפו את שולי המכסה בסרט גמיש למניעת דליפה, והכניסו את הצינור לאמבט מים מטלטל בטמפרטורה של 37°C במהירות נמוכה עד בינונית (50 סל"ד).
- לאחר שעה אחת בטמפרטורה של 37°C, יש לפתוח את המכסה ולערבב בעדינות שבע פעמים למעלה ולמטה עם פיפטה של 10 מ"ל לקבלת תערובת הומוגנית. מרחו סרט חדש סביב המכסה, והחזירו אותו לאמבט המים הרועדים. לאחר שעה, הסר את הצינור וכבה את האמבטיה.
הערה: עבור תרבית, השתמש בזמן דגירה זה כדי לצפות את הצלחות כמתואר בשלב 7.1 לפני המעבר לסעיף 5.
5. סינון
- מלא את צינור העיכול עם DMEM קר (בתוספת 1% פניצילין-סטרפטומיצין) עד 50 מ"ל. מערבבים על ידי היפוך הצינור שלוש פעמים. שמור את DMEM בדלי קרח לשלבים הבאים.
- הניחו מסננת תאים של 100 מיקרומטר על צינור חדש של 50 מ"ל. מעבירים את התערובת המעוכלת דרך מסננת התאים לתוך הצינור החדש. צנטריפוגה ב 600 x גרם במשך 5 דקות ב 4 ° C. יוצקים את הסופרנאטנט לתוך מיכל פסולת נוזלית.
- להשעות את הגלולה ב 1 מ"ל של DMEM קר (בתוספת 1% פניצילין-סטרפטומיצין). מלא את הצינור עד 50 מ"ל עם אותו DMEM. הערה: אם מדלגים על הצנטריפוגה, יהיה קשה יותר לזהות ולתחזק את הגלולה הבאה.
- הניחו מסננת תאים של 70 מיקרומטר על צינור חדש של 50 מ"ל. העבירו את תערובת הצנטריפוגות/מרחפים דרך מסננת התא לתוך הצינור החדש. צנטריפוגה ב 80 x גרם במשך 5 דקות ב 4 ° C.
הערה: שלב זה אינו חובה, אך מומלץ לסלק פסולת תאים. - הניחו מסננת תאים בגודל 40 מיקרומטר על צינור חדש של 50 מ"ל. העבירו את הסופרנאטנט דרך מסננת התא לתוך הצינור החדש. צנטריפוגה ב 600 x גרם במשך 5 דקות ב 4 ° C, לשפוך את supernatant לתוך מיכל פסולת נוזלית, ולהשעות מחדש את הגלולה ב FBS מתחת מכסה המנוע תרבית. הגלולה קטנה מאוד בשלב הזה (איור 1F).
הערה: סינון דרך מסננת 40 מיקרומטר מסיר פסולת, אשר ייתן אות לא ספציפי בצביעה מאוחרת יותר של התרביות.
6. הקפאה (אופציונלית)
הערה: סעיף 6 הוא אופציונלי. ניתן להשהות את הפרוטוקול לאחר הסינון, אך זה יכול להפחית את הישרדות התא ואת הצלחת התרבית.
- הוסף DMSO כדי לקבל יחס של 10% DMSO:90% FBS, והעבר ל- cryotubes (1 מ"ל של גלולה תלויה לכל 2 מ"ל cryotube).
- הניחו את צינור ההקפאה בטמפרטורה של -80°C בקופסת פוליסטירן למשך הלילה. עבור ל -150 ° C למחרת לאחסון לטווח ארוך.
הערה: אחסון לטווח קצר ב -80 ° C אפשרי גם. - בעת הפעלת התרבית, הפשיר את צינור ההקפאה במהירות באמבט מים של 37 מעלות צלזיוס עד שתרחיף התא יפשיר. מערבבים עם 4 מ"ל DMEM מתחת למכסה המנוע של התרבית. סחור ב 600 x גרם במשך 5 דקות ב 4 ° C. פיפטה החוצה את supernatant, ולהמשיך כמתואר בשלב 7.2.
7. טיפוח
הערה: מתלי תאים קפואים או טריים צפויים למלא 24-32 בארות של שלוש עד ארבע צלחות 8 בארות.
- מצפים צלחות 8 בארות בתמיסת הציפוי, אותה יש להפשיר ב -4 מעלות צלזיוס או על קרח (תמיסת ציפוי מלאי נשמרת בדרך כלל ב -20 מעלות צלזיוס). מוסיפים 0.4 מ"ל של תמיסת ציפוי לבאר אחת, ומפיפטים אותה מבאר לבאר. לאחר העברת תמיסת הציפוי דרך כל הבארות, ניתן לאסוף אותה מחדש ולהקפיא אותה מחדש לתרבויות עתידיות. שמרו את הלוחות המצופים בטמפרטורה של 37°C למשך 30 דקות לפני ציפוי התאים.
- הוסף DMEM (בתוספת 1% פניצילין-סטרפטומיצין) בתוספת bFGF של 4 ננוגרם/מ"ל (ראה טבלת חומרים) לתרחיף תאי FBS כדי לקבל יחס DMEM של 20% FBS:80%.
הערה: למרות שהתוספת של bFGF יכולה להועיל בתרביות מיובלסטים ראשוניות ובייצור תאים דמויי לוויין בתרביות בתפזורת, הוספתו היא אופציונלית, מכיוון שהשמטתו בתרביות בתפזורת של ~7 ימים אינה פוגעת קשות בתפוקת התא. - צלחת 0.4 מ"ל של המתלה לכל באר (משלב 7.2) בצלחות 8 בארות מצופות.
הערה: חישוב 30 ס"מ2 של תרבית לכל בעל חיים עבור תכשירים קפואים וטריים. - לדגור את התרביות ב 37 ° C עם 5% CO2 עד 10 ימים, שינוי המדיום כל יום לאחר התרבות מתחיל להשתנות לצבע צהבהב (בדרך כלל 5-7 ימים).
הערה: כדי לכמת תאים בשלב S של מחזור התא13, הוסף 10 μM EdU שעתיים לפני הקיבוע. כדי ללכוד את שלב ה-S הראשון, הוסיפו 10 μM EdU מהציפוי וקבעו בתרבית של 40 שעות.
8. קיבעון
הערה: מקטעים 8-10 צריכים להתבצע בטמפרטורת החדר, אלא אם צוין אחרת.
- פיפטה החוצה את מדיום התרבית, ולתקן את התאים עם 4% PFA (0.15 מ"ל / טוב).
אזהרה: יש להוסיף PFA מתחת למכסה מנוע כימי.
הערה: אם כל הבארות קבועות בו זמנית, יש לדגור עם PFA בטמפרטורת החדר למשך 10 דקות. אם הבארות קבועות בנקודות זמן שונות, הוסף PFA לבארות שיש לתקן, ושמור את הצלחת באינקובטור ב 37 מעלות צלזיוס למשך 5 דקות. - פיפטה החוצה את PFA, ולהוסיף PBS עבור 10 שניות (0.15 מ"ל / טוב). פיפטה החוצה PBS, ולהוסיף PBS טרי במשך 5 דקות (0.15 מ"ל / טוב).
הערה: אם כל הבארות קבועות בו זמנית, לדגור עם PBS בטמפרטורת החדר. אם הבארות קבועות בנקודות זמן שונות, הוסף PBS לבארות הקבועות, ושמור את הצלחת באינקובטור ב 37 ° C למשך 5 דקות. לאחר מכן, להוסיף 0.4 מ"ל של PBS, ולשמור את הצלחת באינקובטור עד 1 שבוע.
9. חדירה וחסימה
- כאשר הוא מוכן להכתים, יש לשטוף את ה-PBS ולחדור עם 0.5% TritonX 100 ב-PBS (0.15 מ"ל/באר) למשך 8 דקות. פיפטה החוצה את TritonX 100, לשטוף עם PBS במשך 10 שניות (0.15 מ"ל / טוב), פיפטה החוצה, PBS, ולשטוף עם PBS במשך 5 דקות (0.15 מ"ל / טוב).
- חסום עם 5% BSA ללא IgG ב- PBS למשך 30-60 דקות (0.15 מ"ל / טוב).
10. צביעה
- פיפטה החוצה את BSA, ולהוסיף את תערובת הנוגדנים הראשונית מדוללת PBS (0.15 מ"ל / באר) (ראה טבלת החומרים; דילולים: anti-CD31 1:100, anti-FOSB 1:200, anti-GFP 1:1,000, anti-KI67 1:1,000, anti-MyHC 1:400, anti-MYOD 1:200, anti-MYOG 1:150, anti-PAX7 1:100, anti-PDGFRa 1:50) לדגירת לילה ב 4 ° C.
הערה: לאחר דגירה של נוגדנים, יש לאסוף את תערובת הנוגדנים, להוסיף נתרן אזיד ולשמור על טמפרטורה של 4°C או -20°C (בהתאם להוראות יצרן הנוגדנים) לשימוש חוזר עתידי. - פיפטה החוצה את תערובת הנוגדנים, לשטוף עם PBS במשך 10 s (0.15 מ"ל / טוב), פיפטה החוצה, PBS, ולשטוף עם PBS במשך 5 דקות (0.15 מ"ל / טוב).
- יש להוציא את PBS הכביסה, להוסיף את תערובת הנוגדנים המשנית (עז נגד עכבר Alexa Fluor 488, עז נגד ארנב Alexa Fluor 555, עז נגד חולדה Alexa Fluor 647, עז נגד עכבר Alexa Fluor 555, עז נגד עוף Alexa Fluor 488, כולם בשימוש בדילול של 1:500-1,000) וסמן גרעין (למשל, DAPI) מדולל PBS (0.15 מ"ל / באר) (ראה טבלת חומרים), ולדגור במשך שעה אחת בטמפרטורת החדר, מוגן מפני אור.
- פיפטה החוצה את תערובת הנוגדנים המשנית, לשטוף עם PBS במשך 10 שניות (0.15 מ"ל / טוב), פיפטה החוצה PBS, לשטוף עם PBS במשך 5 דקות (0.15 מ"ל / טוב), פיפטה החוצה, PBS, ולהרכיב.
הערה: אם משתמשים בצלחות בנות 8 בארות עם מפרידים נשלפים, יש לקלף את המפרידים לפני ההרכבה.
תוצאות
פרוטוקול זה מאפשר תרבית תאי שריר תוך שימור תאי הלוויין ורוב התאים מהנישה האנדוגנית שלהם. איור 2 מסכם את השלבים העיקריים של הפרוטוקול, בעוד שחלקים חיוניים של הדיסקציה והעיכול מוצגים באיור 1. מומלץ לבצע דיסקציה של שרירי הגפה האחורית (איור 1A-C...
Discussion
תפקוד שרירי השלד הבוגרים מבוסס על מערכת מתוזמרת היטב של אינטראקציות תאיות ואותות מולקולריים. כאן, מוצגת שיטה המאפשרת ללמוד פרמטרים אלה בסביבה ex vivo הדומה מאוד microenvironment פיזיולוגי.
מספר קבוצות דיווחו על שיטות במבחנה לתרבית תאים מיוגניים. שיטות אלה נועדו לבודד תאי לו...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
עבור איור 2 נעשה שימוש בתבניות מ-Servier Medical Art (https://smart.servier.com/). מעבדת FR נתמכת על ידי האגודה הצרפתית contre les Myopathies - AFM באמצעות TRANSLAMUSCLE (מענקים 19507 ו- 22946), Fondation pour la Recherche Médicale - FRM (EQU202003010217, ENV202004011730, ECO201806006793), Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73), ו- La Ligue Contre le Cancer (IP/SC-17130). למממנים הנ"ל לא היה כל תפקיד בעיצוב, באיסוף, בניתוח, בפרשנות או בדיווח של מחקר זה או בכתיבת כתב יד זה.
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| cell strainer 40 um | Dominique Dutscher | 352340 | |
| cell strainer 70 um | Dominique Dutscher | 352350 | |
| cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
References
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297 (2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817 (2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16 (2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149 (2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12 (2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17 (2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143 (2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved