Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cultivo masivo no fraccionado de músculo esquelético de ratón para recapitular la quiescencia de nicho y de células madre
* Estos autores han contribuido por igual
En este artículo
Resumen
El músculo esquelético comprende múltiples tipos de células, incluidas las células madre residentes, cada una con una contribución especial a la homeostasis y regeneración muscular. Aquí, se describe el cultivo 2D de células madre musculares y el nicho de células musculares en un entorno ex vivo que conserva muchas de las características fisiológicas, in vivo y ambientales.
Resumen
El músculo esquelético es el tejido más grande del cuerpo y realiza múltiples funciones, desde la locomoción hasta el control de la temperatura corporal. Su funcionalidad y recuperación de lesiones dependen de multitud de tipos celulares y de señales moleculares entre las células musculares centrales (miofibras, células madre musculares) y su nicho. La mayoría de los entornos experimentales no preservan este complejo microambiente fisiológico, y tampoco permiten el estudio ex vivo de las células madre musculares en quiescencia, un estado celular que es crucial para ellas. Aquí, se describe un protocolo para el cultivo ex vivo de células madre musculares con componentes celulares de su nicho. A través de la descomposición mecánica y enzimática de los músculos, se obtiene una mezcla de tipos celulares, que se pone en cultivo 2D. La inmunotinción muestra que en 1 semana, múltiples células de nicho están presentes en cultivo junto con miofibras y, lo que es más importante, células Pax7 positivas que muestran las características de las células madre musculares quiescentes. Estas propiedades únicas hacen de este protocolo una poderosa herramienta para la amplificación celular y la generación de células madre quiescentes que se pueden utilizar para abordar cuestiones fundamentales y traslacionales.
Introducción
El movimiento, la respiración, el metabolismo, la postura corporal y el mantenimiento de la temperatura corporal dependen del músculo esquelético, y las disfunciones en el músculo esquelético pueden, por lo tanto, causar patologías debilitantes (es decir, miopatías, distrofias musculares, etc.) 1. Dadas sus funciones esenciales y su abundancia, el músculo esquelético ha atraído la atención de laboratorios de investigación de todo el mundo que se esfuerzan por comprender los aspectos clave que apoyan la función muscular normal y pueden servir como objetivos terapéuticos. Además, el músculo esquelético es un modelo ampliamente utilizado para estudiar la regeneración y la función de las células madre, ya que el músculo sano puede autorrepararse completamente después de una lesión y degeneración completas, principalmente debido a sus células madre residentes2; Estas también se denominan células satélite y se localizan debajo de la lámina basal en la periferia de las fibras musculares3.
Las células centrales del músculo esquelético adulto son las miofibras (células multinucleares sincitiales largas) y las células satélite (células madre con potencial miogénico que están inactivas hasta que una lesión las activa). Estas últimas células son las células centrales de la regeneración muscular, y este proceso no puede ocurrir en su ausencia 4,5,6,7. En su microambiente inmediato, hay múltiples tipos de células y factores moleculares que les señalan. Este nicho se establece gradualmente a lo largo del desarrollo y hasta la edad adulta8. El músculo adulto contiene múltiples tipos de células (células endoteliales, pericitos, macrófagos, progenitores fibro-adipogénicos-FAPs, células T reguladoras, etc.) 9,10 y componentes de la matriz extracelular (lamininas, colágenos, fibronectina, fibrilinas, periostina, etc.) 11 que interactúan entre sí y con las células satélite en el contexto de la salud, la enfermedad y la regeneración.
Preservar este complejo nicho en entornos experimentales es fundamental pero desafiante. Igualmente difícil es mantener o volver a la quiescencia, un estado celular que es crítico para las células satélite9. Se han introducido varios métodos para abordar parcialmente estos desafíos, cada uno con sus ventajas y desventajas (detalladas en la sección de discusión). Aquí, se presenta un método que puede superar parcialmente estas dos barreras. Los músculos se cosechan inicialmente y luego se descomponen mecánica y enzimáticamente antes de que la mezcla celular heterogénea se ponga en cultivo. En el transcurso del cultivo, se detectan muchos tipos de células del nicho y se observan células satélite que han vuelto a la quiescencia. Como último paso del protocolo, se presentan los pasos de inmunofluorescencia que permiten la detección de cada tipo celular mediante el uso de marcadores universalmente aceptados.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los experimentos cumplieron con las regulaciones animales francesas y de la UE en el Institut Mondor de Recherche Biomédicale (INSERM U955), en particular la directiva 2010/63/UE. Los animales se mantuvieron en un ambiente controlado y enriquecido en las instalaciones de animales con números de certificación A94 028 379 y D94-028-028; Fueron manipulados solo por investigadores y cuidadores de animales autorizados, y fueron inspeccionados visualmente por el personal de alojamiento de animales en busca de signos de incomodidad durante su vida. Fueron sacrificados por luxación cervical antes de la disección. No se realizaron procedimientos intervencionistas durante la vida de los animales; por lo tanto, no era necesario obtener la aprobación para el procedimiento de un Comité de Ética y del Ministerio de Educación Superior, Investigación e Innovación francés. De hecho, no se requiere autorización ética para la eutanasia y la disección post mortem de acuerdo con la directiva 2010/63/UE. Los resultados presentados en este manuscrito son de la línea C57BL/6NRj de tipo salvaje (ver Tabla de Materiales) y de la línea transgénica Tg:Pax7-nGFP 12 (criada por nuestro equipo). El protocolo se aplicó a ratones machos y hembras de 8 a 12 semanas de edad.
1. Predigestión de preparación de reactivos y equipos
- Rocíe las herramientas de disección (tijeras rectas y curvas, fórceps, consulte la Tabla de materiales) con etanol al 70% y séquelas con papel. Cubra un plato de corcho con papel de aluminio y mantenga cerca placas de Petri de 10 cm (una por animal). Tenga papel y etanol al 70% al alcance.
NOTA: Al final de la disección, enjuague las herramientas de disección con agua, luego rocíelas con etanol al 70% y séquelas con papel. - Ajuste un baño de agua giratorio a 37 °C y prepare la mezcla de digestión (20 ml/animal) combinando DMEM con penicilina-estreptomicina al 1 %, colagenasa 0,5 U/ml, dispasa 3 U/ml (consulte la tabla de materiales) y BSA al 0,2 % en tubos de 50 ml.
- Pasar la mezcla de digestión a través de un filtro de 0,22 μm en una campana de cultivo celular.
NOTA: Se recomienda preparar la mezcla de digestión fresca cada vez.
2. Preparación de reactivos y equipos después de la digestión
- Después de la digestión, la mezcla puede congelarse o cultivarse. Para congelar, prepare 10% DMSO:90% suero fetal bovino (FBS), así como un juego de criotubos (1 mL de suspensión celular por 2 mL de criotubo). Para el cultivo, prepare un medio de cultivo (DMEM suplementado con penicilina-estreptomicina al 1%, 4 ng/ml de bFGF y FBS al 20%) y un juego de placas de 8 pocillos. Las placas deben recubrirse antes de enchapar las células (los detalles se proporcionan en el paso 7.1).
- Para la tinción, prepare paraformaldehído (PFA) al 4% en solución salina tamponada con fosfato (PBS) (0,15 ml/pocillo de la placa de 8 pocillos) y solución de bloqueo (albúmina sérica bovina libre de IgG al 5% [BSA] en PBS; 0,15 ml/pocillo de la placa de 8 pocillos).
PRECAUCIÓN: No respire el polvo de PFA; Prepáralo y manipulalo bajo una cubierta química.
3. Disección
- Rocíe el animal sacrificado con etanol al 70%. Haga una incisión horizontal (del lado izquierdo del cuerpo hacia el lado derecho) con unas tijeras grandes a la altura del abdomen y corte alrededor de la cintura. Retire la piel de las extremidades posteriores para revelar los músculos (Figura 1A).
- Coloque al animal en la placa de corcho cubierta con papel de aluminio y sujete con alfileres la extremidad delantera y trasera opuestas. Retire rápidamente todos los músculos de las extremidades posteriores (delanteros y traseros) en una placa de Petri de 10 cm colocada sobre hielo (Figura 1B, C). Tenga especial cuidado en eliminar el tejido adiposo de las áreas alrededor de los cuádriceps y los músculos posteriores. La fascia, los nervios y los tendones también se pueden extirpar en este punto si esto no compromete el tiempo total dedicado a la disección.
NOTA: Un tiempo óptimo de disección para ambas extremidades posteriores debe ser de alrededor de 15-20 min. Se aconseja que el tiempo de disección no supere los 30 min. - Agregue gotas de DMEM a los músculos de vez en cuando para mantenerlos húmedos, pero no demasiado, ya que esto dificultará el corte. Repita para la otra extremidad posterior. Una vez que todos los músculos de un animal estén en la placa de Petri (Figura 1D), píquelos finamente con unas tijeras durante 7-10 min para obtener un homogeneizado liso (Figura 1E).
NOTA: En este protocolo, se utiliza DMEM suplementado con L-glutamina, piruvato y 4,5 g/L de D-glucosa.
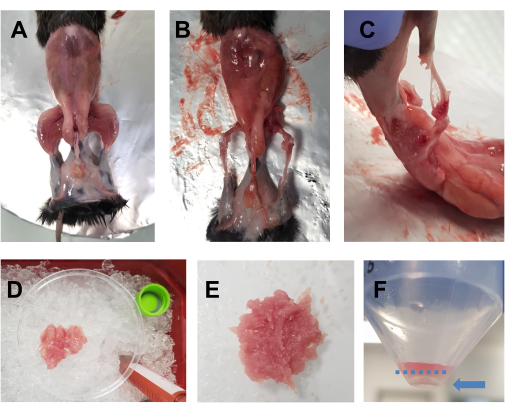
Figura 1: Preparación muscular previa al cultivo. (A) Se retira la piel para revelar los músculos de las extremidades posteriores, como se describe en el paso 3.1. (B,C) Todos los músculos de las extremidades posteriores se extraen (B) alrededor y (C) entre los huesos, como se describe en el paso 3.2. (D) Los músculos extraídos se colocan en una placa de Petri de 10 cm sobre hielo con gotas de DMEM para mantenerlos húmedos, como se describe en el paso 3.3. (E) Los músculos se cortan finamente con unas tijeras hasta obtener una pasta suave con la consistencia que se muestra en esta imagen. (F) Una imagen del gránulo después de la centrifugación final; La flecha azul resalta el perdigón, que está contra el tubo, debajo de la línea azul discontinua. Haga clic aquí para ver una versión más grande de esta figura.
4. Digestión
NOTA: Al final de la digestión, se necesita una centrífuga a 4 °C, un cubo de hielo, tres filtros celulares (100 mmm, 70 mmm, 40 mmm) y tres tubos de 50 ml (por animal) para la sección 5.
- Prepare y filtre la mezcla de digestión como se describe en el paso 1.2. Mantén la mezcla en hielo.
- Una vez que todos los músculos estén picados, coloque el homogeneizado en un tubo de 50 ml con 20 ml de mezcla de digestión. Envuelva los bordes de la tapa con una película flexible para evitar fugas y coloque el tubo en un baño de agua agitado a 37 °C a una velocidad baja a media (50 rpm).
- Después de 1 h a 37 °C, abra la tapa y mezcle pipeteando suavemente siete veces hacia arriba y hacia abajo con una pipeta de 10 ml para obtener una mezcla homogénea. Aplique una nueva película alrededor de la tapa y vuelva a colocarla en el baño de agua agitado. Después de 1 h, retire el tubo y cierre el baño.
NOTA: Para el cultivo, utilice este tiempo de incubación para cubrir las placas como se describe en el paso 7.1 antes de pasar a la sección 5.
5. Filtración
- Llene el tubo de digestión con DMEM frío (suplementado con penicilina-estreptomicina al 1%) hasta 50 ml. Mezclar invirtiendo el tubo tres veces. Mantenga el DMEM en un cubo de hielo para los siguientes pasos.
- Coloque un filtro de células de 100 μm en un tubo nuevo de 50 ml. Pase la mezcla digerida a través del colador de células al nuevo tubo. Centrifugar a 600 x g durante 5 min a 4 °C. Vierta el sobrenadante en un recipiente de desechos líquidos.
- Vuelva a suspender el gránulo en 1 ml de DMEM frío (suplementado con penicilina-estreptomicina al 1%). Llene el tubo hasta 50 ml con el mismo DMEM. NOTA: Si se omite la centrifugación, el siguiente gránulo será más difícil de identificar y mantener.
- Coloque un colador de células de 70 μm en un tubo nuevo de 50 ml. Pase la mezcla centrifugada/resuspendida a través del filtro celular hacia el nuevo tubo. Centrifugar a 80 x g durante 5 min a 4 °C.
NOTA: Este paso no es obligatorio, pero se recomienda para eliminar los restos de la celda. - Coloque un filtro de células de 40 μm en un tubo nuevo de 50 ml. Pase el sobrenadante a través del filtro de células hacia el nuevo tubo. Centrifugar a 600 x g durante 5 min a 4 °C, verter el sobrenadante en un recipiente de residuos líquidos y volver a suspender el pellet en FBS bajo la campana de cultivo. El gránulo es muy pequeño en este paso (Figura 1F).
NOTA: El filtrado a través del filtro de 40 μm elimina los residuos, lo que daría una señal inespecífica en la tinción posterior de los cultivos.
6. Congelación (opcional)
NOTA: La sección 6 es opcional. El protocolo se puede pausar después del filtrado, pero esto puede reducir la supervivencia celular y el éxito del cultivo.
- Agregue DMSO para obtener una relación 10% DMSO:90% FBS y transfiéralo a criotubos (1 mL de pellet resuspendido por 2 mL de criotubo).
- Coloque el criotubo a -80 °C en una caja de poliestireno durante la noche. Pasar a -150 °C al día siguiente para un almacenamiento a largo plazo.
NOTA: También es posible el almacenamiento a corto plazo a -80 °C. - Al iniciar el cultivo, descongele el criotubo rápidamente en un baño de agua a 37 °C hasta que la suspensión celular se haya descongelado. Mezclar con 4 ml de DMEM bajo la campana de cultivo. Centrifugar a 600 x g durante 5 min a 4 °C. Pipetear el sobrenadante y continuar como se describe en el paso 7.2.
7. Cultivo
NOTA: Se puede esperar que las suspensiones celulares congeladas o frescas llenen de 24 a 32 pocillos de tres a cuatro placas de 8 pocillos.
- Cubra las placas de 8 pocillos con la solución de recubrimiento, que debe descongelarse a 4 °C o con hielo (la solución de recubrimiento original normalmente se mantiene a -20 °C). Agregue 0,4 ml de solución de recubrimiento a un pocillo y pipetee de pocillo a pocillo. Después de transferir la solución de recubrimiento a través de todos los pocillos, se puede recolectar y volver a congelar para futuros cultivos. Mantenga las placas recubiertas a 37 °C durante 30 minutos antes de enchapar las células.
- Añadir DMEM (suplementado con penicilina-estreptomicina al 1%) suplementado con 4 ng/mL de bFGF (ver Tabla de Materiales) a la suspensión de células FBS para obtener una relación 20% FBS:80% DMEM.
NOTA: A pesar de que la adición de bFGF puede ser beneficiosa en cultivos primarios de mioblastos y en la producción de células de tipo satélite en cultivos a granel, su adición es opcional, ya que su omisión en cultivos a granel de ~7 días no compromete gravemente el rendimiento celular. - Placa de 0,4 ml de la suspensión por pocillo (a partir del paso 7.2) en las placas de 8 pocillos recubiertas.
NOTA: Calcular 30cm2 de cultivo por animal para preparados congelados y frescos. - Incubar los cultivos a 37 °C con 5% de CO2 durante un máximo de 10 días, cambiando el medio todos los días después de que el cultivo comience a cambiar a un color amarillento (generalmente 5-7 días).
NOTA: Para cuantificar las células en la fase S del ciclo celular13, añadir 10 μM de EdU 2 h antes de la fijación. Para capturar la primera fase S, añadir 10 μM de EdU del recubrimiento y fijar a 40 h de cultivo.
8. Fijación
NOTA: Las secciones 8-10 deben realizarse a temperatura ambiente a menos que se indique lo contrario.
- Pipetear el medio de cultivo y fijar las células con PFA al 4 % (0,15 ml/pocillo).
PRECAUCIÓN: Agregue PFA debajo de una cubierta química.
NOTA: Si todos los pocillos están fijos al mismo tiempo, incubar con PFA a temperatura ambiente durante 10 min. Si los pocillos se fijan en diferentes momentos, agregue PFA a los pocillos que se van a fijar y mantenga la placa en la incubadora a 37 °C durante 5 min. - Pipetear el PFA y añadir PBS durante 10 s (0,15 ml/pocillo). Pipetear el PBS y agregar PBS fresco durante 5 min (0,15 mL/pocillo).
NOTA: Si todos los pocillos están fijos al mismo tiempo, incubar con PBS a temperatura ambiente. Si los pocillos se fijan en diferentes momentos, agregue PBS a los pocillos fijos y mantenga la placa en la incubadora a 37 °C durante 5 min. Luego, agregue 0.4 ml de PBS y mantenga la placa en la incubadora hasta por 1 semana.
9. Permeabilización y bloqueo
- Cuando esté listo para teñir, pipetear el PBS y permeabilizar con TritonX 100 al 0,5 % en PBS (0,15 ml/pocillo) durante 8 min. Pipetear el TritonX 100, enjuagar con PBS durante 10 s (0,15 ml/pocillo), pipetear el PBS y lavar con PBS durante 5 min (0,15 ml/pocillo).
- Bloquear con BSA libre de IgG al 5% en PBS durante 30-60 min (0,15 mL/pocillo).
10. Tinción
- Pipetear el BSA y añadir la mezcla de anticuerpos primarios diluida en PBS (0,15 ml/pocillo) (ver la tabla de materiales; diluciones: anti-CD31 1:100, anti-FOSB 1:200, anti-GFP 1:1.000, anti-KI67 1:1.000, anti-MyHC 1:400, anti-MYOD 1:200, anti-MYOG 1:150, anti-PAX7 1:100, anti-PDGFRa 1:50) para la incubación nocturna a 4 °C.
NOTA: Después de la incubación de anticuerpos, recoja la mezcla de anticuerpos, agregue azida sódica y manténgala a 4 °C o -20 °C (según las instrucciones del fabricante del anticuerpo) para su futura reutilización. - Pipetear la mezcla de anticuerpos, enjuagar con PBS durante 10 s (0,15 ml/pocillo), pipetear el PBS y lavar con PBS durante 5 min (0,15 ml/pocillo).
- Pipetear el PBS de lavado, añadir la mezcla de anticuerpos secundarios (Alexa Fluor 488 anti-ratón de cabra, Alexa Fluor 555 anti-conejo de cabra, Alexa Fluor 647 anti-ratas de cabra, Alexa Fluor 555 anti-ratón de cabra, Alexa Fluor 488 anti-pollo de cabra, todos utilizados en diluciones de 1:500-1.000) y marcador de núcleo (por ejemplo, DAPI) diluido en PBS (0,15 mL/pocillo) (ver Tabla de Materiales), e incubar durante 1 h a temperatura ambiente, protegido de la luz.
- Pipetear la mezcla de anticuerpos secundarios, enjuagar con PBS durante 10 s (0,15 ml/pocillo), pipetear el PBS, lavar con PBS durante 5 min (0,15 ml/pocillo), pipetear el PBS y montar.
NOTA: Si se utilizan placas de 8 pocillos con separadores extraíbles, retire los separadores antes de montarlos.
Access restricted. Please log in or start a trial to view this content.
Resultados
Este protocolo permite el cultivo de células musculares preservando las células satélite y la mayoría de las células de su nicho endógeno. La Figura 2 resume los pasos principales del protocolo, mientras que las partes esenciales de la disección y la digestión se presentan en la Figura 1. Se recomienda la disección de la musculatura de las extremidades posteriores (Figura 1A-C), ya que este...
Access restricted. Please log in or start a trial to view this content.
Discusión
La función del músculo esquelético adulto está respaldada por un conjunto finamente orquestado de interacciones celulares y señales moleculares. Aquí, se presenta un método que permite el estudio de estos parámetros en un entorno ex vivo que se asemeja mucho al microambiente fisiológico.
Varios grupos han reportado métodos in vitro para cultivar células miogénicas. Estos métodos tenían como objetivo aislar células satélite para estudiar sus propiedades progeni...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Para la Figura 2 se utilizaron plantillas de Servier Medical Art (https://smart.servier.com/). El laboratorio FR cuenta con el apoyo de la Association Française contre les Miopathies - AFM via TRANSLAMUSCLE (subvenciones 19507 y 22946), la Fondation pour la Recherche Médicale - FRM (EQU202003010217, ENV202004011730, ECO201806006793), la Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73) y La Ligue Contre le Cancer (IP/SC-17130). Los financiadores mencionados anteriormente no tuvieron ningún papel en el diseño, la recopilación, el análisis, la interpretación o la presentación de informes de este estudio o la redacción de este manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
Referencias
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados