Method Article
胃低级别上皮内瘤变病理升级风险预测模型的建立与评价
* 这些作者具有相同的贡献
摘要
在这里,我们对既往内镜活检诊断为胃低级别上皮内瘤变的患者进行了系统评估,并通过内镜粘膜下剥离术 (ESD) 完全切除病灶获得病理诊断,分析可能增加病理升级风险的因素。
摘要
本研究旨在探讨胃低级别上皮内皮瘤变(LGIN)内镜手术后病理升级的危险因素,并建立和评估LGIN的风险预测模型。回顾性分析了 2020 年 11 月至 2022 年 6 月期间通过活检和内窥镜粘膜下剥离术 (ESD) 诊断为胃 LGIN 的 120 例患者。收集所有患者的性别、 年龄、 HP感染、病灶大小、病灶位置、形态、胃黏膜充血、结节状态、表面溃疡和糜烂、ME观察,根据活检和ESD术后病理诊断结果分为升级组和非升级组。采用logistic回归分析筛选ESD手术治疗后病理升级的独立危险因素,建立风险预测模型。120例胃LGIN患者中,49例出现术后病理升级;病理升级率为40.83%。其中,42例患者升级为高级别上皮内瘤变(HGIN),1例升级为晚期胃癌,6例升级为早期胃癌(EGC)。单因素分析显示,两组患者年龄、病灶大小、胃黏膜充血、表面溃疡、糜烂等差异有统计学意义(p < 0.05)。多因素Logistic回归分析显示,年龄≥60岁、焦距≥2 cm、胃黏膜淤血、表面溃疡和糜烂是胃LGIN患者术后病理恶化的独立危险因素。P = 1/[1 + e(26.515-0.161 x β1-0.357 x β2+0.039 x β3-0.269 x β4)] 的最终联合概率预测模型。年龄、病灶大小≥2 cm、胃黏膜充血、病灶表面溃疡和糜烂是胃LGIN患者术后病理升级的危险因素。本研究建立的基于危险因素的风险预测模型具有预测价值,可为胃LGIN患者的临床治疗提供科学参考。
引言
胃癌是最常见的恶性肿瘤之一,尤其是在东亚地区,发病率和死亡率都很高。它是中国最常见的癌症之一,新诊断和死亡约占全球总数的一半 1.它是中国人群发病和死亡的主要原因2.胃癌在肿瘤中死亡率最高,居世界第三位,其预后高度依赖于病变的分期1。晚期患者的 5 年生存率低于 30%,而早期患者的 5 年生存率通常在 90% 以上。因此,胃癌的早期诊断和治疗对于预防和控制疾病至关重要3.
Correa级联反应被广泛认为是胃癌发展的主要模式之一,表明胃癌的致癌过程逐渐从萎缩性胃炎发展为肠上皮化生、上皮内瘤变,最后发展为腺癌4。随着现代技术的应用和胃镜检查的日益普及,越来越多的胃黏膜癌前病变被检测到,包括放大内窥镜 (ME)、染色内窥镜和窄带成像 (NBI)5。
低级别上皮内瘤变(LGIN)是胃癌的癌前病变之一,与胃癌密切相关。然而,与活检结果相比,一些低级别上皮内瘤变患者在内镜黏膜下夹层 (ESD) 后表现出病理升级6。因此,在临床实践中,对于活检证实的LGIN患者的随访或治疗选择存在一些争议。本文探讨了胃LGIN患者ESD治疗后病理升级的危险因素,建立并评价了LGIN发生的风险预测模型,为胃LGIN患者的临床管理提供了更科学、更有价值的参考意见。
研究方案
本研究中描述的方案已由福建医科大学龙岩第一附属医院伦理委员会根据《赫尔辛基宣言》确立的伦理准则进行审查和批准。人类参与者的安全和福祉是我们最关心的问题,所有程序都旨在将潜在的风险和不适降至最低。所有收集的数据将被保密处理,并仅用于本研究的目的。受试者可以随时自由退出研究,他们参与或退出的决定不会影响他们与研究人员或机构的关系。
1. 一般信息
- 选择诊断为胃 LGIN 的患者。本回顾性分析纳入2020年11月至2022年6月在龙岩第一医院、邢台第三医院、甘肃省肿瘤医院经组织病理学检查诊断为胃LGIN并接受ESD治疗的120例患者。
2. 纳入和排除标准
- 纳入标准
- 包括通过组织病理学检查诊断为胃 LGIN 并在诊断后 3 个月内接受 ESD 治疗的患者。
- 确保所有活检和手术标本均根据世界卫生组织(WHO)消化系统肿瘤病理诊断标准7进行诊断,并在手术前后由两名病理学家审查所有病理切片。
- 完整的临床数据。
- 排除标准
- 排除最近接受过抗生素、质子泵抑制剂 (PPI)、铋制剂和抑酸剂治疗 幽门螺 杆菌 (HP) 感染的患者。
- 排除通过组织病理学检查诊断为胃高级别上皮内瘤变 (HGIN)、胃癌或其他转移性肿瘤的患者。
- 排除接受手术的患者。
- 排除接受放疗或化疗的患者。
- 排除临床数据不完整的患者。
3. 研究方法
- 内窥镜检查和手术
- 让所有通过组织病理学检查诊断为胃 LGIN 的患者接受常规白光内窥镜检查 (WLE)。
- 在进行内窥镜检查之前,请确保患者进行一些准备工作,包括禁食 6 小时以上。
注意:检查通常涉及喉咙局部麻醉,以尽量减少不适。 - 将内窥镜插入患者的口腔,并逐渐通过食道将其推进到胃中。在WLE下观察消化道内部,包括粘膜中血管的颜色、形状、质地和分布,寻找可能的病变。
- 根据观察结果采集组织样本或进行其他治疗操作。检查完成后,逐渐撤出内窥镜并结束检查。
- 在进行内窥镜检查之前,请确保患者进行一些准备工作,包括禁食 6 小时以上。
- 使用ME-NBI技术观察胃黏膜表面的微观结构,以进一步确定病变的程度。
注意:ME-NBI是一种形成模式,在WLE模式下观察近似粘膜后,通过内窥镜上的按钮进行切换。它可以观察传统内窥镜检查无法观察到的微血管 (MV) 和微观结构 (MS)。- 在 WLE 中发现可疑病灶后,从远处到近处,从正常到病灶中心放大。
- 通过ME-NBI检查,判断是否存在分界线(DL)、MV和MS各向异性、病灶表面的一些特殊征象,更好地观察胃肠道黏膜表面的微观结构,进而判断病灶的性质,可能是病灶。
- 接下来,用一次性粘膜切刀在患者病变边界外 3-5 毫米处做一个电凝标记,标记点之间的距离约为 2 毫米。
- 通过特殊的内窥镜注射针将制备的注射液(250mL生理盐水+3mg肾上腺素+2mL靛蓝)注射到粘膜下层。
注意:生理盐水主要用于保持粘膜下层湿润,并将粘膜层与肌肉层分开。肾上腺素收缩血管,减少出血。靛蓝胭脂红是一种染料,可帮助医生更好地可视化粘膜下层血管的分布。分配的成分包括 250 mL 生理盐水 + 3 mg 肾上腺素 + 2 mL 靛蓝胭脂。 - 病灶完全抬高后,用一次性粘膜切刀在距病灶标记点约 3 mm 处做一个环形切口,然后进行黏膜下夹层,直到病灶完全切除。
- 解剖后,仔细观察伤口并使用电凝钳进行电凝。如有必要,使用金属止血夹夹住伤口。
- 让所有通过组织病理学检查诊断为胃 LGIN 的患者接受常规白光内窥镜检查 (WLE)。
- 病理检查
- 完全切除后,使用抽吸或圈套取出组织样本。
- 固定并保存取出的组织样本,并在口腔和肛门两侧标记以进行病理检查和诊断。将样品在20-25°C下用10%福尔马林固定24-48小时。
注:病理描述包括病变的一般形态、体积和大小、边缘、组织学分类、浸润深度和胃粘膜病变的信息。
- 固定并保存取出的组织样本,并在口腔和肛门两侧标记以进行病理检查和诊断。将样品在20-25°C下用10%福尔马林固定24-48小时。
- 完全切除后,使用抽吸或圈套取出组织样本。
- HP检测方法
- 使用快速脲酶试验或 13C 呼气试验。
- 在快速脲酶试验中,在内窥镜检查下用活检钳取患者胃壁样本,并将其放入含有脲酶的试剂中。
- 检查胃壁中是否存在 幽门螺杆 菌。脲酶分解尿素产生氨,使试剂呈碱性并变红。观察试剂颜色的变化并确定是否存在 幽门螺杆 菌感染。
注意:13C 呼气测试是一种非侵入性、无痛且无副作用的测试,通过口服含有 13C 标记尿素的尿素并使用同位素比质谱仪检测患者呼出的呼吸中 13C 标记的二氧化碳的含量。如果胃中存在 幽门 螺杆菌,细菌会分解13C标记的尿素产生13C标记的二氧化碳,通过测量呼出气体中13C标记的二氧化碳的量,可以确定是否存在 幽门螺 杆菌感染。需要注意的是,在进行快速脲酶试验或 13C 呼气试验之前,患者必须停止质子泵抑制剂 (PPI) 至少 2 周,并停止抗菌药物、铋和某些具有抗菌特性的草药至少 4 周。这些药物会影响检测结果的准确性。在13C呼气试验期间,患者还必须禁食或避免进食至少2小时,以避免食物对检测结果的影响。
- 使用快速脲酶试验或 13C 呼气试验。
- 数据收集和分组
- 汇总患者的一般临床资料,包括性别、年龄、 幽门螺杆菌 (HP)感染、病灶大小、病灶位置、形态、胃黏膜充血、结节状态、表面溃疡和糜烂、ME观察。
- 根据所进行的评估,根据ESD后病理诊断是否升级,将研究中的所有患者分为升级组和非升级组。
注:升级组术后病理诊断为胃HGIN、早期胃癌(EGC)或晚期胃癌,而未升级组术后病理诊断为胃LGIN或炎症。
4. 统计方法
- 使用统计软件来组织和分析所有数据。以频率(百分比)统计方式分析分类数据,并使用卡方检验或费舍尔精确检验进行比较。
注:本研究使用了 SPSS 软件。 - 采用逻辑回归分析来识别诊断为胃 LGIN 的患者与 ESD 后病理升级相关的危险因素。小于 0.05 的 P 值表示存在统计显著差异。
结果
ESD后胃LGIN患者病理升级的发生率
本研究共纳入120例胃LGIN患者,其中49例(40.83%)在ESD后出现病理升级。其中,42例升级为HGIN,1例升级为晚期胃癌,6例升级为EGC。共有71例未经历病理升级,其中2例降级为炎症,69例仍为LGIN,病理降级率为1.67%。
胃LGIN患者ESD后病理升级的单因素分析
如 表1所示,胃LGIN患者术后病理升级组与非升级组在性别、HP感染、病灶位置、表面结节、ME层分界线(DL)、病灶形态、微观结构(MS)和微血管形态方面差异无统计学意义(p > 0.05)。然而,在年龄、病灶大小、胃黏膜充血以及表面溃疡和糜烂方面存在统计学差异(p < 0.05)。
胃LGIN患者ESD后病理升级的多因素logistic回归分析
单因素分析筛选出p<0.05的因素,包括年龄、病灶大小、胃黏膜充血、表面溃疡和糜烂等因素,作为自变量,胃LGIN患者ESD后病理升级作为logistic回归分析的因变量(表2)。 表3 显示,年龄≥60岁、病灶直径≥2 cm、胃黏膜充血、表面溃疡和糜烂是胃LGIN患者ESD后病理升级的独立危险因素。基于逻辑回归的预测公式,最终的联合概率预测模型为 P = 1 / [1 + e(26.515-0.161xβ1-0.357xβ2+0.039xβ3-0.269xβ4)]:P(y = 1/x) = 1/(1+e-(β0+β1x1+β2x2+β3x3+β4x4)),其中 y 表示二分因变量,x 表示自变量向量,β 表示回归系数,e 表示自然对数的底数。此外,技术术语缩写将在首次使用时定义。该公式表明,给定自变量 x,事件发生 y = 1 的概率为 P(y = 1/x)。当 β0 + β1 x 1 + β2 x 2 + β3 x 3 + β4 x 4 的总和增加时,P(y = 1/x) 的值也增加,表明事件发生 y = 1 的概率更高;相反,事件发生 y = 1 的概率较低。其中,β1为年龄回归系数,β2为病灶大小回归系数,β3为胃黏膜淤血回归系数,β4为表面溃疡糜烂回归系数。
案例介绍
代表性病例为一名50岁女性患者,体格检查时出现黏膜粗糙、胃角糜烂。内镜活检证实低级别上皮内瘤变 (LGIN)。使用放大内窥镜检查、窄带成像 (NBI) 和色素内窥镜检查的进一步研究表明,患者有发生高级别上皮内瘤变 (HGIN) 的风险。建议患者接受内镜黏膜下剥离(ESD)治疗,最终病理诊断为HGIN( 如图1所示)。
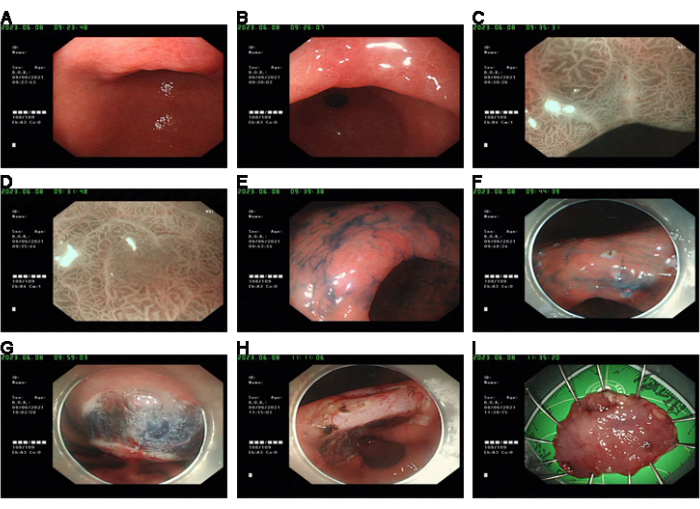
图1:案例介绍。 (A、B) 术前,WLE 显示胃黏膜粗糙伴糜烂。(C,D)在ME + NBI观察到的病变中观察到不规则的MV和MS。(E)靛蓝染色可以看到病变的轮廓。(F)在内窥镜下标记病灶。(G) 粘膜下水注射后剥离。(八)伤口止血治疗。(一)将固定标本送去进行病理检查。请点击这里查看此图的较大版本.
表1:ESD后病理升级的单因素分析(%)。请按此下载此表格。
表2:ESD后病理升级的多变量logistic回归分析变量分配表。请按此下载此表格。
表3:ESD后病理升级的多因素logistic回归分析。请按此下载此表格。
讨论
胃LGIN是一种常见的胃肠道疾病,随着患者人数的不断增加,该病的预防和治疗变得越来越重要。建立风险预测模型对于指导临床治疗和预防疾病发生至关重要8.胃LGIN的病理升级是指LGIN性质在一定时期内恶化,这可能导致LGIN转化为HGIN甚至更严重的情况。在临床实践中,病理升级的预测已成为医务人员关注的焦点。目前,已经研究了一些基于临床表现、影像学表现和生物标志物的预测模型,但这些模型存在指标复杂、长期消耗的缺点。因此,有必要开发一个简单有效的预测模型。根据目前国内共识建议,应积极采用ESD治疗具有病理升级高危因素的胃LGIN患者。然而,越来越多的研究表明,胃 LGIN 患者的活检病理结果与术后病理结果之间存在显着差异9。
研究显示,在观察的120例胃LGIN患者中,有49例在术后进行了病理升级,病理升级率为40.83%。与其他相关研究相比,这一比率相对较高。这些发现的可能原因包括低估了病理活检的结果。内窥镜医师资格的差异可能导致患者病情和活检部位评估的差异,导致表面或不充分的取样和部位偏差。结果的准确性也可能受到病理学家的认知能力和知识的影响。此外,活检的准确性可能会受到不同内窥镜技术的影响。例如,应用高清胃镜观察病变的微血管和微观结构形态,确定靶向活检最显眼的部位,可以大大提高活检的精确度。
本研究表明,胃LGIN患者年龄越大,术后病理升级的风险越高,这与国内其他研究结果相似10。因此,对于60岁以上的胃LGIN患者,应进行密切随访,如果患者有更多危险因素,建议及时手术。关于病灶大小,本研究表明,病灶大小≥2 cm是病理升级的独立危险因素,与其他研究结果基本一致11。胃LGIN患者手术治疗后可能影响病理升级发生的病灶大小临界值仍存在争议,需要临床研究寻找最合适的临界值。应使用大样本量方法进行进一步研究。结果显示,黏膜表面充血、溃疡、糜烂是胃LGIN患者术后病理升级的独立危险因素,与相关研究相似12。病变表面溃疡和糜烂更容易引起手术后病理升级,这可能是因为胃黏膜反复损伤会促进异型增生和肠上皮化生,从而增加胃癌的风险。
然而,这项研究遇到了一定的局限性。首先,作为一项回顾性研究,无法完全控制偏倚和其他混杂因素。今后应开展前瞻性研究,以验证结论,增强客观性和推理能力。其次,由于样本数量有限,无法将样本分离到验证集中,以便对模型进行外部验证。因此,必须从多个中心收集额外的患者数据,以增加样本数量并扩大观察到的变量范围。这将提高模型的预测效果和结果的可信度。此外,进行外部验证将增强模型的可靠性。
综上所述,本研究通过分析接受手术的胃LGIN患者病理升级的独立危险因素而生成的风险预测模型具有显著的预测价值,可为临床环境中的LGIN治疗提供有益的指导。
披露声明
作者声明他们没有利益冲突。
致谢
本研究由龙岩市科技计划项目资助(批准号2020LYF17029)。
材料
| Name | Company | Catalog Number | Comments |
| Disposable mucosal incision knife | Olympus (Japan) | KD-650Q | |
| Endoscopic image processing device | Olympus (Japan) | CV-290 | |
| Hemostasis Clips | MICRO-TECH(Nanjing) | ROCC-D-26-195 | |
| High-frequency hemostatic forceps | Olympus (Japan) | FD-410LR | |
| Indicarminum | MICRO-TECH(Nanjing) | MTN-DYZ-15 | |
| Injection Needles | MICRO-TECH(Nanjing) | IN02-25423230 | |
| Magnifying gastroscope | Olympus (Japan) | GIF-H290Z | |
| Orthodontic rubber band | 3M Unitek Corporation | 6.4 mm 3.5 oz | |
| Therapeutic gastroscopy | Olympus (Japan) | GIF-2TQ260M | |
| Transparent cap | Olympus (Japan) | D-201-11804 |
参考文献
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Migita, K., et al. Rnf126 as a marker of prognosis and proliferation of gastric cancer. Anticancer Res. 40 (3), 1367-1374 (2020).
- Zhang, H., Yang, X., Zhang, X., Huang, X. The significance of endoscopic kyoto classification of gastritis in the gastric cancer risk assessment: A systematic review and meta-analysis. Medicine. 102 (22), e33942 (2023).
- Cheng, H. C., et al. Evolution of the correa's cascade steps: A long-term endoscopic surveillance among non-ulcer dyspepsia and gastric ulcer after H. pylori eradication. J Formos Med Assoc. 122 (5), 400-410 (2023).
- Kim, B., Cho, S. J. Endoscopic screening and surveillance for gastric cancer. Gastrointest Endosc Clin N Am. 31 (3), 489-501 (2021).
- Choi, C. W., et al. The risk factors for discrepancy after endoscopic submucosal dissection of gastric category 3 lesion (low grade dysplasia). Dig Dis Sci. 59 (2), 421-427 (2014).
- Nagtegaal, I. D., et al. The 2019 who classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Zou, L., et al. Endoscopic characteristics in predicting prognosis of biopsy-diagnosed gastric low-grade intraepithelial neoplasia. Chin Med J (Engl). 135 (1), 26-35 (2022).
- Ryu, D. G., et al. Clinical outcomes of endoscopic submucosa dissection for high-grade dysplasia from endoscopic forceps biopsy. Gastric Cancer. 20 (4), 671-678 (2017).
- Xu, G., et al. Risk factors for under-diagnosis of gastric intraepithelial neoplasia and early gastric carcinoma in endoscopic forceps biopsy in comparison with endoscopic submucosal dissection in Chinese patients. Surg Endosc. 30 (7), 2716-2722 (2016).
- Kim, M. K., et al. Is lesion size an independent indication for endoscopic resection of biopsy-proven low-grade gastric dysplasia. Dig Dis Sci. 59 (2), 428-435 (2014).
- Zhao, G., et al. How commonly is the diagnosis of gastric low grade dysplasia upgraded following endoscopic resection? A meta-analysis. PLoS One. 10 (7), e0132699 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。