需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
低成本肌外肌电图电极的开发:简化的制造和测试工作流程
摘要
我们的目的是提供一份更新的、易于遵循的关于肌膜外肌电图电极制造和测试的指南。为此,我们提供了材料采购说明以及制造和测试过程的详细演练。
摘要
肌电图 (EMG) 是检测神经肌肉异常的有价值的诊断工具。植入式肌外膜电极通常用于临床前模型中测量 EMG 信号。尽管存在描述表扬电极制造原理的经典资源,但将电极理论转化为实践的说明性信息很少。为了解决这个问题,我们提供了一个更新的、易于遵循的指南,用于制造和测试低成本的肌外电极。
通过将两个铂铱箔折叠并插入预切的硅胶基座以形成接触表面来制造电极。接下来,将涂层不锈钢丝焊接到每个接触面上以形成电极引线。最后,使用有机硅混合物密封电极。进行了 离体 测试,将我们定制的电极与盐水浴中的行业标准电极进行比较,其中在所有波形中发现了高水平的信号一致性(正弦 [类内相关性 - ICC= 0.993]、方波 [ICC = 0.995]、三角形 [ICC = 0.958])和时间同步性(正弦 [r = 0.987]、方波 [r = 0.990]、三角形 [r= 0.931])。还通过电化学阻抗谱量化了低水平的电极阻抗。
还进行了 体内 性能评估,其中大鼠的股外侧肌用定制的电极进行手术器械检测,并在上坡和下坡行走期间获得信号。正如预期的那样,下坡行走期间的峰值 EMG 活动 (0.008 ± 0.005 mV) 明显低于上坡 (0.031 ± 0.180 mV,p = 0.005),支持该设备的有效性。植入后 14 天和 56 天 (分别为 0.01 ± 0.007 mV、0.012 ± 0.007 mV;p > 0.05)和无组织学炎症,也支持了该设备的可靠性和生物相容性。总的来说,我们为低成本落射电极的制造和测试提供了更新的工作流程。
引言
肌电图 (EMG) 是研究肌肉电活动的强大工具。肌电图记录在临床前动物模型中特别有用,以评估治疗神经肌肉功能障碍的干预措施的有效性。在这些模型中,植入式生物相容性电极通常用于评估运动神经元和肌肉纤维之间的神经生理学接口。这些植入式电极可以提供肌肉兴奋的局部测量,并且可以在配置、形状和材料方面有所不同,最佳设计最终取决于位置和预期用途。
尽管它们适用于在临床前模型中评估肌肉兴奋,但肌外电极的使用可能会受到成本的限制。因此,许多研究人员使用内部生产的定制附加肌电极。尽管有资源详细介绍了电极制造、测试和使用的基本考虑因素 1,2,但需要更新的指导指南,详细说明使用现代方法获取、制造和验证外延电极。以 Loeb 和 Gans3 以及其他电极理论基础工作为基础,我们提出了有关采购和制造低成本附加电极的现代说明,并在一系列离体和体内实验中测试了它们的性能。其目的是为科学界的其他人提供一个用户友好的指南,以采购、制造和测试内部低成本的动物用肌外膜电极,从而在临床前模型中更广泛地量化肌肉兴奋。
在该协议中,我们提供了在现代电生理学实验室中采购、制造和测试用于动物的附阴电极的指导指南。为制造选择的电极参数,例如形状、尺寸、接触表面积、电极间距离、引线长度等,都是根据我们的实验需求选择的,并且与市售的行业标准外延电极相当(参见 材料表)。我们鼓励其他团队修改这些参数以满足他们的需求,此外还选择与其用例相匹配的可靠行业标准电极。
为了让读者相对快速地了解电极性能,我们还提供了一个 离体 测试方案示例,可选择测量电极阻抗。此外,我们给出了 体内电极性能评估的示例。 离体 实验将定制电极与盐水浴中的行业标准电极进行了比较,以模拟稳定的生理条件。还通过电化学阻抗谱 (EIS) 离 体 评估阻抗。 体内实验 包括将定制电极手术植入 16 周龄雌性长埃文斯大鼠(HsdBlu:LE、Envigo)的股外侧肌 (VL) 肌肉中,以在已知引起高信号或低信号的条件下测量 EMG 信号(上坡、下坡行走)。为了评估定制电极的可靠性,在完全手术恢复后和牺牲前(分别为植入后 14 天和 56 天)在水平行走期间获取 EMG 信号。对仪器化的肌肉进行苏木精-伊红 (H&E) 染色,以评估定制电极的生物相容性。
Access restricted. Please log in or start a trial to view this content.
研究方案
体内程序是在密歇根大学机构动物护理和使用委员会(IACUC批准 #PRO00010765)的批准下进行的,并按照美国国立卫生研究院关于实验室动物护理和使用的指南进行。
1. 电极采购和制造
注意: 图 1 提供了所有关键制造步骤的高级摘要,并带有一个 QR 链接,该链接提供了额外的视觉说明。
- 直接从制造商处批量采购生物相容性电极材料进行制造。请参阅 材料表,其中包含所有电极组件和采购详细信息。
注意:确保硅胶基材、硅胶密封胶和铂铱接触箔具有生物相容性,以避免不良免疫反应并允许慢性植入。为了支持内部制造的经济优势,我们提供了与行业标准(材料表)相比的定制外延电极的详细成本分析。 - 准备切割和折叠夹具(补充文件 1、补充文件 2)。使用选定的 3D 打印软件设计切割和折叠夹具,以批量生产相同的附加电极。
- 设计切割夹具,确保硅胶基座的穿孔大小和间隔一致,以实现所有电极的接触表面积和电极间距离相等。
- 创建折叠夹具以折叠铂-铱接触表面并简化箔在硅胶底座中的放置。
注意:提供了 Gcode 文件;修改切割和折叠夹具的尺寸和规格以适应实验需要。
- 在硅胶底座上打孔。将硅胶底座放在切割夹具上并用胶带粘住。使用 X-acto 刀使用切割夹具中的导轨在硅胶上穿孔,以放置接触箔。
- 将箔片插入硅胶底座以形成接触面。使用折叠夹具将生物相容性、预切割的铂-铱接触箔 (1.25 mm x 5 mm) 折叠成 U 形。接下来,将折叠箔的臂引导到硅胶底座的穿孔槽中,以构建电极的接触表面。以这种方式,将所有 12 个箔片插入硅胶底座;在电极之间留出一根柱子,以确保适当的间距。
注意:这种配置将允许制造 6 个双极肌外电极;如果需要,编辑切割夹具可以扩展容量。 - 从切割夹具上取下硅胶底座。在接触面上放一条手术胶带,将箔片固定到位。接下来,从切割夹具上取下硅胶底座,翻转过来,露出 U 形箔的臂,然后将 U 形箔的一只臂与硅胶底座折叠齐平。
- 连接电极引线。将全氟烷氧基 (PFA) 涂层的不锈钢丝剪成所需长度,准备该钢丝。接下来,使用市售的打火机将不锈钢丝的一端剥去 ~ 1 厘米。将不锈钢丝的裸露端放在箔展开臂的内侧。使用微型 TIG 焊机(脉冲宽度 = 0,焊接能量 = 25)将不锈钢丝焊接到箔的臂上。
- 检查引线-箔界面。通过对不锈钢丝施加张力来测试线箔连接。如果连接有效,请将箔片的臂向下折叠,使其与硅胶底座齐平,然后撕下与硅胶片接壤的胶带。
注意: 应用代表指定用例中应用的张力的张力。 - 密封电极。为了获得更稀释的稠度,将 1 g 生物相容性液态硅胶与 0.75 mL 甲苯混合。使用 18 G 钝头注射器吸取混合物,并将其涂抹在每个电极的焊接侧以密封电极的背面。
注意:甲苯易燃,吞咽或进入气道可能致命,并引起皮肤刺激。在通风橱下工作,远离明火。 - 将批次分成单独的电极。在处理电极之前,让硅甲苯凝固 72 小时。接下来,用剪刀将硅胶底座剪成尺寸为 10 x 5 毫米的单个电极。
注意:电极尺寸将取决于切割夹具的尺寸和具体用例。在超声波浴中高压灭菌和/或清洁电极。
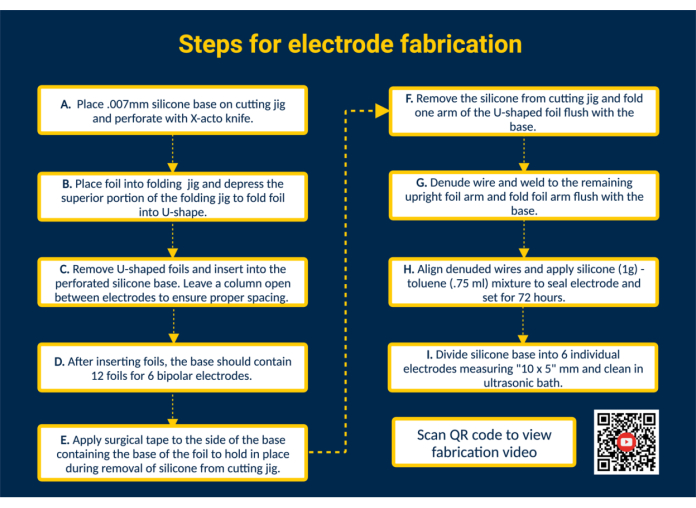
图 1.电极制造步骤。 (A) 穿孔硅胶底座。(B) 使用折叠夹具形成 U 形箔。(C) 将 U 形箔插入穿孔硅胶底座中。(D) 硅胶基座包含 12 个箔片,形成 6 个双极电极。(E) 在底座上贴上手术胶带,以便在从切割夹具中取出时固定箔片。(F) 从切割夹具上取下硅胶底座。(G) Denude 涂有 PFA 的不锈钢丝,并使用微型 TIG 焊机焊接到直立的铝箔臂上。(H) 对齐裸露的电线,涂上硅甲苯密封剂,然后凝固。(I) 将硅胶基座分成单独的电极,并在超声波浴中清洁。 请单击此处查看此图的较大版本。
2. 体外 测试
- 将电极连接到记录设备。将每个电极引线固定到电极接口板 (EIB) 上的通道。对选定的工业标准电极重复此步骤(使用相同的 EIB)以进行比较。通过磁性系留电缆系统将 EIB 连接到数据采集平台。
注意:行业标准电极可以是任何被认为可靠且适合实验需要的电极。 - 将 EIB 接地。将 PFA 涂层不锈钢的一端去掉,并点焊到接地源(例如,不锈钢螺钉)上。将接地引线针脚到指定的"接地"位置的同一电极接口板上。
- 设置盐水浴。在玻璃烧杯 (250 mL) 中加入 180 mL 生理盐水溶液(0.9% 无菌盐水溶液)4。将定制和行业标准的外延电极浸入盐水浴中,并将它们固定在稳定位置。接下来,将接地源浸入盐水浴中并固定其位置。最后,将两个刺激针电极浸入盐水浴中并固定,并将刺激电极连接到信号发生器。
- 使用信号生成器评估信号一致性和时间同步性。使用信号发生器通过刺激电极将选定电压和频率(0.1 V 和 5 Hz)的重复波形传送到盐水浴中(图 2)。提供各种波形(正弦波、方波和三角波),以比较定制失传电极之间相对于行业标准的记录信号。
- 以非正式和直观的方式实时评估性能,以评估电极之间信号的变化程度。执行类内相关性 (ICC) 和 Pearson 相关性,以分别评估信号一致性和时间同步性。
注:为了进行分析,以 4,000 Hz 的频率采集了 8,000 个样本,并使用高通和低通巴特沃斯滤波器(高通 = 75 Hz;低通 = 2 kHz)进行实时过滤。 - 测量电极阻抗。为了测量电极阻抗,使用 Richie 等人在下面描述的程序,用恒电位仪在 10 Hz-31 kHz5 的频率范围内收集定制电极(例如,10 个电极)上的 EIS。6. 有关测量双极电极阻抗的更多信息,请参见 Sarolic 等人7.
- 按照 Richie 等人的程序,将肌外电极 1 mm 浸入 1x 磷酸盐缓冲盐水 (PBS) 中。使用银-氯化银 (Ag|AgCl) 参比电极和不锈钢棒作为对电极来完成电路。
- 暂停 Ag|AgCl 参比电极和不锈钢棒在 1x PBS 中使用烧杯夹。将参比电极连接到正在使用的阻抗系统的参考电极,并连接到正在使用的阻抗系统的对电极输入。
- 使用电化学工作站运行 1 kHz 阻抗扫描。在单个正弦波形中设置为 0.01 Vrms 的 1 kHz 扫描频率。在扫描的前 5 秒内,将电化学工作站设置为 0 V 以稳定记录的信号。使用恒电位仪相关软件记录测量值。
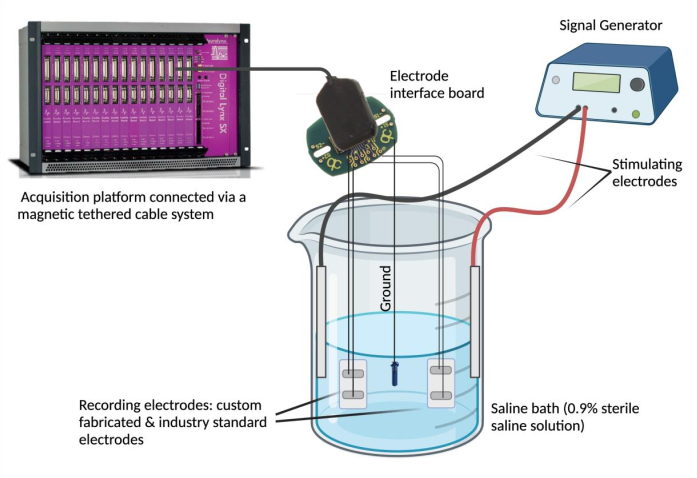
图 2: 离体 测试: 盐水浴包含定制电极、行业标准电极、两个刺激电极和一个接地源。通过将正弦波、方波和三角波从信号发生器输送到盐水浴中,并使用数据采集平台记录相应电极检测到的波形,评估信号一致性和时间同步性。注意:电化学阻抗谱图未图示。 请单击此处查看此图的较大版本。
3. 体内 测试
注意: 体内 测试程序描述了我们的实验用例。建议以与用户预期实验条件相匹配的方式在 体内 测试定制的表扬电极。
- 查看手术信息;使用以下资源为正在学习植入慢性神经记录电极过程的外科医生咨询信息 8,9。
注意:鉴于我们手稿的重点是电极制造和测试,这里我们只简要概述了我们实验室用于 体内 电极测试的手术技术。 - 选择要检测的大鼠(例如,16 周龄的雌性 Long Evans 大鼠)。让大鼠在跑步机适应前进行 1 周的实验室驯化。实验室驯化后,逐渐将大鼠以高达 16 m/min 的速度暴露在啮齿动物跑步机上。
- 准备 EIB,首先通过将每个电极引线固定到 EIB 上的通道,将定制的肌外膜电极连接到 EIB。要将 EIB 接地,请剥去涂有 PFA 的不锈钢丝的一端,然后点焊到选定的接地点(例如,不锈钢螺钉)。接下来,将接地引线固定到指定"接地"位置的同一 EIB。
注意:为了在仪器过程中保护电极,请用保护罩(例如封口膜)包裹电极。 - 在开始之前对所有手术工具和手术区域进行消毒。使用密封的无菌手术用品,并对所有非无菌包装的手术器械进行高压灭菌。使用手术单创建一个无菌手术区域。
- 使用含有 3-5% 异氟醚和 1 L/min 氧气的诱导室麻醉动物,并通过含有 2% 异氟醚和 500 mL 氧气的鼻锥保持,同时准备大鼠。到达麻醉手术平面后,通过捏脚趾进行评估,涂抹眼药膏,监测呼吸频率(70-110 次呼吸/分钟),并使用直肠探针评估核心温度。
- 接下来,用动物剪刀剃掉手术部位,并清除手术部位的碎屑。剃除手术区域后,使用洗必泰、异丙醇和聚维酮碘对手术部位进行消毒,从手术区域的中心到外部擦洗。适当和经批准使用镇痛药,并提供热量以维持核心体温 (37.5-38.5 °C)。准备后,将大鼠置于立体定向框架中并建立无菌区。
- 为了外科医生做好适当的手术准备,请使用肥皂和/或消毒剂(洗必泰)彻底洗手。穿戴适当的个人防护装备:口罩、无菌手套和一次性长袍/磨砂上衣。如果因任何原因违反无菌技术,请戴上新的无菌手套。
- 要对右侧 VL 进行器械检测,请使用手术刀在右后肢的前外侧部分做一个 3-5 厘米的切口,并使用钝性解剖来识别 VL 肌肉。
- 沿冠状缝合线做一个 1 cm 矢状面切口,露出颅骨。使用一对细镊子,从右后肢到颅底做一个皮下隧道。使用镊子抓住电极并将电极路由到 VL。
- 使用骨钻在颅骨上打一个孔(确保钻头规格与接地螺钉的规格相匹配)。固定接地螺钉并使用牙科水泥将 EIB 连接到颅骨上。
注意:可以使用少量过氧化氢来增加颅骨的孔隙率并增强牙科粘接剂的粘附性。 - 确定 VL 肌后,使用 4-0 不可吸收单丝植入与肌纤维对齐的定制肌外膜电极。使用伤口夹或缝合闭合切口。
- 关闭后,将动物从麻醉中取出,并单独饲养在干净、干燥的动物笼子中。让大鼠在加热垫上恢复,每 15 分钟监测一次大鼠的体温和呼吸频率,直到动物可以走动。通过在器械操作后的几天内使用经批准的镇痛药来治疗术后疼痛。
注意:大鼠需要单独饲养,直到完全恢复。 - 14 天后,进行 体内 电极测试,以评估定制的肌外电极捕获肌肉活动的生理变化的有效性。将装有仪器的大鼠放在啮齿动物跑步机上,随机将其暴露在上坡和下坡行走条件下,这些条件会引起 VL EMG 信号的增加或减少(16° 倾斜,16° 下降,16 米/分钟)。收集纵向数据(例如,检测后 14 天和 56 天)以确保长期可靠性。
注意:已选择 14 天和 56 天的评估,因为 14 天的时间可以完全手术恢复,而 56 天的评估时间超过了我们的实验时间表。我们鼓励其他人在使用前使用复制其实验时间表的时间框架来测试电极性能和可靠性。选择速度 (16m/min) 和步行条件 (16° 倾斜,16° 下降) 以匹配该模型中 VL 激励增加和减少的既定条件10. - 修改采集参数以适应实验需求。使用数据采集平台以 2,000 Hz 的速率捕获行走过程中的 EMG 信号,并与动作捕捉系统同步。
注意:如果使用不同的采集设备,请根据制造商的说明收集 EMG 和动作捕捉,以满足实验需求。 - 从每个步行条件中提取 25 秒的步态数据,并导出到自定义的 Python 脚本,以便进一步进行信号处理和分析。使用分箱宽度为 50 ms 的均方根算法进行基线调整(零)、校正和平滑。应用峰值检测算法来选择 RMS-EMG 峰值,用于后续数据分析。
注意:我们已经简要描述了预处理和分析 EMG 数据的方法,因为此步骤因编程语言和 EMG 采集软件和硬件而异。我们鼓励作者查阅以下资源以获取更多信息 3,11,12,13。
4. 生物相容性测试
- 纵向 EMG 收集结束后(或在选定的时间点),使用适当且经批准的方法对大鼠实施安乐死(例如,使用 CO2 窒息,然后进行双侧开胸术)。
- 安乐死后,通过在左右前外侧后肢上切开一个切口来提取双侧 VL 肌肉。在液氮中快速冷冻并储存在 -80 °C。
注意:在提取过程中,注意将电极保持在仪器化肌肉(例如,右侧 VL)上的位置。或者,标记子电极区域或仅从子电极区域提取肌肉。这不适用于对侧/对照肌。 - 使用低温恒温器从电极筋膜接口正下方的区域切割连续的肌肉横截面 (7 μm)。从对侧 VL 的肌肉腹部切下切片作为对照。有关冷冻切片的详细信息,请参见 Kumar 等人14。
- 用苏木精和伊红染色(H&E);有关骨骼肌横截面 H&E 染色的详细信息,请参见 Wang 等人15。
- 使用 20 倍放大倍率的光学显微镜检查染色切片(仪器和对照)。分析对样本来源不知情的组织学变化。使用以下病理特征评估组织健康状况:免疫细胞浸润、内部肌核积累、纤维化和肌膜碎裂。
5. 建议的统计分析
- 要评估定制的 epimyisal 电极与行业标准相比的性能,请将 离体 数据导入选定的统计包。将以下统计测试应用于从定制电极和行业标准电极收集的 离体 数据(例如,来自正弦波、三角波和方波的 8,000 个代表性样品)。将 alpha 水平先 验 设置为 p ≤ 0.05。
- 要测试电极之间的信号一致性水平,请使用类内相关性 (ICC) 和 Bland-Altman 图。根据单一评级 (k = 2)、绝对一致性、2 因子随机效应模型计算 ICC 估计值及其 95% 置信区间。
- 为了测试波形记录随时间变化的程度(也称为时间同步),请对使用定制和行业标准电极收集的值执行 Pearson 相关。
- 将选定的定制电极(例如 10 个电极)的两个接触面的平均电极阻抗(在 1 kHz 下测量)与行业标准电极的阻抗进行比较。
注意:电极阻抗值会因电极制造过程中使用的用例和材料而异。
- 要评估 体内 记录的质量,请将跑步机行走期间收集的数据导入到选定的统计包中。
- 为了在 体内 测试期间评估定制电极的有效性(大鼠的步态因上坡和下坡行走而受到扰动以诱导肌肉活动的生理变化),请执行 Welch 的 t 检验以比较上坡和下坡行走条件的平均峰值。
注意:鼓励读者进行额外的测试和分析(例如,信噪比 (SNR) 评估;为简洁起见,此处未介绍这些测试和分析16。 - 为了评估电极信号随时间变化的可靠性,通过配对 t 检验评估在一致条件下(植入后以 16 m/min 的间隔以 14 天和 56 天的间隔水平行走)收集的纵向数据。
- 为了在 体内 测试期间评估定制电极的有效性(大鼠的步态因上坡和下坡行走而受到扰动以诱导肌肉活动的生理变化),请执行 Welch 的 t 检验以比较上坡和下坡行走条件的平均峰值。
Access restricted. Please log in or start a trial to view this content.
结果
离体 性能
ICC 显示,定制电极和行业标准电极在所有波形(正弦 [ICC = 0.993]、方波 [ICC = 0.995]、三角形 [ICC = 0.958];p < .001)上具有高度一致性。Bland-Altman 图还揭示了电极之间的高度信号一致性。 图 3 总结了 Bland Altman 图和 Pearson 相关性,其中定制电极和行业标准电极之间存在很强的正相关关系。Pearson 相关性显示,在所有波形(?...
Access restricted. Please log in or start a trial to view this content.
讨论
我们的目标是简化 EMG 制造过程,更广泛地采用和实施 epimysial 电极设计,从而提高可及性,并推进神经肌肉研究。为此,我们提供了一个用户友好的指南,用于在内部采购、制造和测试低成本的失散电极。为了支持其他研究小组,我们还提供了补充 3D 打印模板,以促进为他们的研究工作生产内部外延电极。
考虑采用这些制造技术的研究人员读者应?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明,他们没有已知的竞争性经济利益或个人关系,这些利益或个人关系似乎可能会影响本文报告的工作。
致谢
这项工作得到了美国国家关节炎研究所和肌肉骨骼和皮肤病 Grant R01AR081235 (给 LK Lepley) 的支持。作者感谢以下个人为我们的生物相容性电极的制造和测试做出的贡献:Joel Pingel、Grant Gueller、Akhil Ramesh、Joe Letner、Jacky Tian 和 Ross Brancati。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
参考文献
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。