A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיתוח אלקטרודת אלקטרומיוגרפיה אפימיסיאלית בעלות נמוכה: זרימת עבודה פשוטה לייצור ובדיקה
In This Article
Summary
מטרתנו הייתה לספק מדריך מעודכן וקל למעקב על ייצור ובדיקה של אלקטרודות אלקטרומיוגרפיה אפימיסיאליות. לשם כך, אנו מספקים הוראות למיקור חומרים והדרכה מפורטת של תהליך הייצור והבדיקה.
Abstract
אלקטרומיוגרפיה (EMG) היא כלי אבחון רב ערך לאיתור הפרעות נוירומוסקולריות. אלקטרודות אפימיסיאליות מושתלות משמשות בדרך כלל למדידת אותות EMG במודלים פרה-קליניים. למרות שקיימים מקורות קלאסיים המתארים את עקרונות ייצור האלקטרודות האפימיסיאליות, קיימת דלילות של מידע להמחשה המתרגם את תורת האלקטרודות לפרקטיקה. כדי לתקן זאת, אנו מספקים מדריך מעודכן וקל למעקב על ייצור ובדיקה של אלקטרודה אפימיסיאלית בעלות נמוכה.
אלקטרודות נוצרו על ידי קיפול והחדרת שני רדידי פלטינה-אירידיום לתוך בסיס סיליקון חתוך מראש כדי ליצור את משטחי המגע. לאחר מכן, חוטי נירוסטה מצופים רותכו לכל משטח מגע כדי ליצור את מוליכי האלקטרודות. לבסוף, נעשה שימוש בתערובת סיליקון כדי לאטום את האלקטרודה. בדיקות Ex vivo נערכו כדי להשוות את האלקטרודה המותאמת אישית שלנו לאלקטרודה סטנדרטית בתעשייה באמבט מלוחים, שם נמצאו רמות גבוהות של הסכמת אות (סינוס [מתאם תוך-מעמדי - ICC= 0.993], ריבוע [ICC = 0.995], משולש [ICC = 0.958]), וסנכרון זמני (סינכרון זמני [r = 0.987], ריבוע [r = 0.990], משולש [r = 0.931]) בכל צורות הגל. רמות נמוכות של עכבת אלקטרודות כומתו גם באמצעות ספקטרוסקופיית עכבה אלקטרוכימית.
הערכת ביצועים in vivo נערכה גם כאשר שריר vastus lateralis של חולדה הותקן בניתוח עם אלקטרודה מותאמת אישית ואיתות נרכש במהלך הליכה בעלייה ובירידה. כצפוי, שיא פעילות EMG היה נמוך משמעותית במהלך הליכה בירידה (0.008 ± 0.005 mV) מאשר בעלייה (0.031 ± 0.180 mV, p = 0.005), מה שתומך בתוקפו של המכשיר. האמינות והתאימות הביולוגית של המכשיר נתמכו גם על ידי איתות עקבי במהלך הליכה ברמה לאחר 14 ימים ו -56 ימים לאחר ההשתלה (0.01 ± 0.007 mV, 0.012 ± 0.007 mV בהתאמה; p > 0.05) והיעדר דלקת היסטולוגית. יחד, אנו מספקים זרימת עבודה מעודכנת לייצור ובדיקה של אלקטרודות אפימיסיאליות בעלות נמוכה.
Introduction
אלקטרומיוגרפיה (EMG) היא כלי רב עוצמה לחקר הפעילות החשמלית של השריר. רישומי EMG יכולים להיות שימושיים במיוחד במודלים פרה-קליניים של בעלי חיים כדי להעריך את היעילות של התערבויות לטיפול בתפקוד עצבי-שרירי. במודלים אלה, אלקטרודות ביו-תואמות ביולוגיות מושתלות משמשות בדרך כלל להערכת הממשק הנוירופיזיולוגי בין נוירונים מוטוריים וסיבי שריר. אלקטרודות מושתלות אלה יכולות לספק מדידות מקומיות של עירור שרירים ויכולות להיות מגוונות מבחינת תצורתן, צורתן וחומרן, כאשר העיצוב האופטימלי מוכתב בסופו של דבר על ידי המיקום והשימוש המיועד.
למרות התאמתם להערכת עירור שרירים במודלים פרה-קליניים, השימוש באלקטרודות אפימיסיאליות יכול להיות מוגבל בעלות. כתוצאה מכך, חוקרים רבים משתמשים באלקטרודות אפימיסיאליות מפוברקות בהתאמה אישית המיוצרות בבית. למרות שקיימים משאבים המפרטים את השיקולים הבסיסיים של ייצור, בדיקה ושימוש באלקטרודות 1,2, יש צורך במדריך הדרכה מעודכן המפרט את המקור, הייצור והאימות של אלקטרודות אפימיסיאליות בשיטות מודרניות. בהתבסס על עבודות היסוד של Loeb ו- Gans3 ואחרים בתורת האלקטרודות, אנו מציגים הוראות מודרניות על מיקור וייצור של אלקטרודות אפימיסיאליות בעלות נמוכה ובודקים את ביצועיהן בסדרה של ניסויים ex vivo ו- in vivo. המטרה היא להציע מדריך ידידותי למשתמש עבור אחרים בקהילה המדעית כדי למקור, לייצר ולבדוק אלקטרודות אפימיסיאליות בעלות נמוכה לשימוש בבעלי חיים, המאפשר כימות רחב יותר של עירור שרירים במודלים פרה-קליניים.
בפרוטוקול זה, אנו מספקים מדריך הדרכה למקור, ייצור ובדיקה של אלקטרודות אפימיסיאליות לשימוש בבעלי חיים במעבדה המודרנית לאלקטרופיזיולוגיה. פרמטרים של אלקטרודות שנבחרו לייצור, כגון הצורה, המידות, שטח הפנים במגע, מרחק האינטראלקטרודה, אורך העופרת וכו', נבחרו כדי להתאים לצרכי הניסוי שלנו והיו דומים לאלקטרודה אפימיסיאלית בתקן מסחרי בתעשייה (ראה טבלת חומרים). אנו מעודדים קבוצות אחרות לשנות פרמטרים אלה כך שיתאימו לצרכיהן, בנוסף לבחירת אלקטרודה אמינה בתקן התעשייה התואמת את מקרה השימוש שלהן.
במאמץ לתת לקוראים תחושה מהירה יחסית של ביצועי אלקטרודות, אנו מספקים גם דוגמה לפרוטוקול בדיקת ex vivo עם אפשרות למדוד עכבת אלקטרודות. בנוסף, אנו נותנים הערכה לדוגמה של ביצועי אלקטרודות in vivo. ניסוי ex vivo השווה את האלקטרודה המיוצרת בהתאמה אישית לסטנדרט בתעשייה באמבט מלח כדי לחקות תנאים פיזיולוגיים יציבים. העכבה הוערכה גם ex vivo באמצעות ספקטרוסקופיית עכבה אלקטרוכימית (EIS). ניסוי in vivo כלל השתלה כירורגית של אלקטרודה מותאמת אישית בשריר vastus lateralis (VL) של נקבת חולדת לונג אוונס בת 16 שבועות (HsdBlu: LE, Envigo) כדי למדוד את אות ה- EMG בתנאים הידועים כמעוררים אות גבוה או נמוך (הליכה בעלייה, במורד). כדי להעריך את אמינות האלקטרודה המותאמת אישית, איתות EMG נרכש במהלך הליכה מפלסית לאחר התאוששות כירורגית מלאה ולפני הקרבה (14 יום ו-56 ימים לאחר ההשתלה, בהתאמה). צביעת Hematoxylin-eosin (H&E) בוצעה על השריר המכשור כדי להעריך את התאימות הביולוגית של האלקטרודה המותאמת אישית.
Access restricted. Please log in or start a trial to view this content.
Protocol
הליך in vivo נערך באישור הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מישיגן (אישור IACUC #PRO00010765) ובהתאם להנחיות המכונים הלאומיים לבריאות בנושא טיפול ושימוש בחיות מעבדה.
1. מיקור אלקטרודות וייצור
הערה: איור 1 מספק סיכום ברמה גבוהה של כל שלבי הייצור העיקריים עם קישור QR המספק הוראות חזותיות נוספות.
- מקור חומרי אלקטרודות תואמים ביולוגית ישירות מהיצרן בתפזורת לצורך ייצור. ראה את טבלת החומרים, המכילה את כל רכיבי האלקטרודות ופרטים על מקורות.
הערה: ודא שבסיס הסיליקון, חומר האיטום סיליקון ורדידי המגע פלטינה-אירידיום תואמים ביולוגית כדי למנוע תגובה חיסונית שלילית ולאפשר השתלה כרונית. כדי לתמוך ביתרונות הכלכליים של ייצור פנימי, אנו מציגים ניתוח עלויות מפורט של אלקטרודת אפימיסיאלית מפוברקת בהתאמה אישית בהשוואה לתקן התעשייה (טבלה של חומרים). - הכנת ג'יג חיתוך וקיפול (קובץ משלים 1, קובץ משלים 2). השתמש בתוכנות הדפסה תלת-ממדיות נבחרות כדי לתכנן ג'יגים לחיתוך וקיפול לייצור אצווה של אלקטרודות אפימיסיאליות זהות.
- תכנן את ג'יג החיתוך כדי להבטיח נקבים בגודל ובמרווח עקביים של בסיס הסיליקון לקבלת שטח פנים מגע שווה ומרחק אינטראלקטרודה על פני כל האלקטרודות.
- צרו את הג'יג המתקפל כדי לקפל את משטחי המגע פלטינה-אירידיום ולפשט את מיקום רדידי האלומיניום בבסיס הסיליקון.
הערה: קובצי Gcode מסופקים; שנה את המידות והמפרטים של ג'יג החיתוך והקיפול כך שיתאימו לצרכי הניסוי.
- מנקבים את בסיס הסיליקון. הניחו את בסיס הסיליקון על ג'יג החיתוך והדביקו אותו. מנקבים את הסיליקון באמצעות קווי העזר בג'יג החיתוך באמצעות סכין X-acto למיקום רדידי המגע.
- הכניסו את רדידי האלומיניום לבסיס הסיליקון ליצירת משטחי המגע. קפלו את רדידי המגע פלטינה-אירידיום התואמים ביולוגית וחתוכים מראש (1.25 מ"מ x 5 מ"מ) לצורת U באמצעות הג'יג המתקפל. לאחר מכן, הנחו את זרועות רדידי האלומיניום המקופלים לתוך החריצים המחוררים בבסיס הסיליקון כדי לבנות את משטחי המגע של האלקטרודה. באופן זה, הכנס את כל 12 רדידי הכסף לתוך בסיס הסיליקון; השאר עמודה אחת פתוחה בין האלקטרודות כדי להבטיח מרווח נכון.
הערה: תצורה זו תאפשר ייצור של 6 אלקטרודות אפימיסיאליות דו קוטביות; עריכת ג'יג החיתוך יכולה להרחיב את הקיבולת במידת הצורך. - מוציאים את בסיס הסיליקון מג'יג החיתוך. הניחו פיסת סרט כירורגי על משטחי המגע כדי להחזיק את נייר הכסף במקומו. לאחר מכן, הסירו את בסיס הסיליקון מג'יג החיתוך, הפכו כך שזרועות רדיד האלומיניום בצורת U יהיו חשופות, וקפלו זרוע אחת של רדיד הכסף בצורת U עם בסיס הסיליקון.
- חבר את מוליכי האלקטרודות. הכינו חוט נירוסטה מצופה פרפלואורואלקוקסי (PFA) על ידי חיתוכו לאורך הרצוי. לאחר מכן, דחו קצה אחד של חוט הנירוסטה ב~ 1 ס"מ באמצעות מצית זמין מסחרית. מקם את הקצה הדחוס של חוט הנירוסטה בחלק הפנימי של הזרוע הפתוחה של נייר הכסף. רתכו את חוט הנירוסטה לזרוע נייר הכסף באמצעות רתך Micro TIG (רוחב פולס = 0, אנרגיית ריתוך = 25).
- בדוק את ממשק העופרת-רדיד אלומיניום. בדוק את חיבור רדיד האלומיניום על-ידי הפעלת מתח על חוט הנירוסטה. אם החיבור מחזיק, קפלו את זרוע נייר הכסף כלפי מטה עם בסיס הסיליקון והסירו את סרט הדבק הגובל ביריעת הסיליקון.
הערה: החל מתח המייצג את המתח שהופעל במקרה השימוש שצוין. - אטמו את האלקטרודה. כדי להשיג עקביות דקה יותר, מערבבים 1 גרם של סיליקון נוזלי תואם ביולוגית עם 0.75 מ"ל של טולואן. ציירו את התערובת באמצעות מזרק 18 G קהה והניחו אותו על הצד המרותך של כל אלקטרודה כדי לאטום את גב האלקטרודות.
אזהרה: טולואן דליק, עלול להיות קטלני אם נבלע או נכנס לדרכי הנשימה וגורם לגירוי בעור. יש לעבוד מתחת למכסה האדים ולהתרחק מלהבות פתוחות. - הפרד את האצווה לאלקטרודות בודדות. הניחו לסיליקון-טולואן להתייצב למשך 72 שעות לפני הטיפול באלקטרודה. לאחר מכן, השתמש מספריים לחתוך את בסיס הסיליקון לתוך אלקטרודות בודדות עם גודל של 10 x 5 מ"מ.
הערה: גודל האלקטרודה יהיה תלוי במידות של ג'יג החיתוך ובמקרה השימוש הספציפי. אוטוקלאבה ו/או אלקטרודות נקיות באמבטיה אולטראסונית.
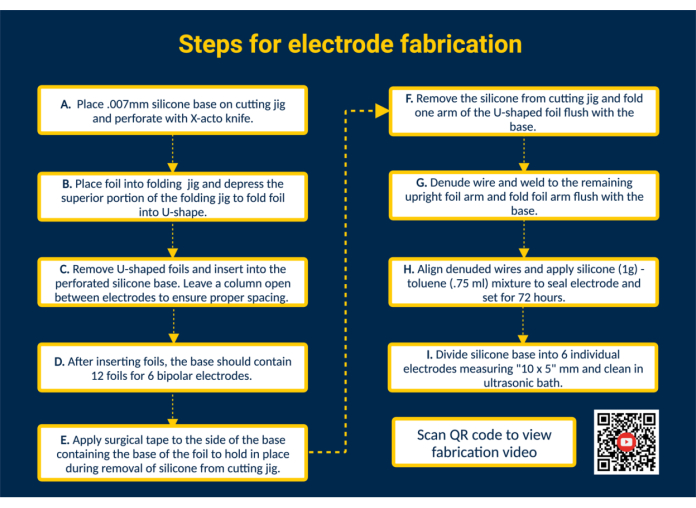
איור 1. שלבים לייצור אלקטרודות. (A) לנקב בסיס סיליקון. (B) צרו רדידי אלומיניום בצורת U באמצעות הג'יג המתקפל. (C) הכנס רדידי אלומיניום בצורת U לבסיס סיליקון מחורר. (D) בסיס סיליקון מכיל 12 רדידי אלומיניום ליצירת 6 אלקטרודות דו-קוטביות. (E) יש למרוח סרט כירורגי על הבסיס כדי לאבטח רדידי אלומיניום במהלך ההסרה מג'יג החיתוך. (F) הסירו את בסיס הסיליקון מג'יג החיתוך. (G) דנוד חוט נירוסטה מצופה PFA וריתוך לזרוע רדיד הכסף הזקופה באמצעות רתך Micro TIG. (H) יישרו חוטים צפופים, מרחו חומר איטום סיליקון-טולואן והניחו לקיבוע. (I) חלקו את בסיס הסיליקון לאלקטרודות נפרדות ונקו באמבטיה על-קולית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. בדיקת Ex vivo
- חבר אלקטרודות להתקן הקלטה. הצמד כל חוט עופרת אלקטרודה לתעלה בלוח ממשק אלקטרודות (EIB). חזור על שלב זה (באמצעות אותו EIB) עבור אלקטרודה שנבחרה בתקן התעשייה לצורך השוואה. חבר את ה-EIB לפלטפורמת איסוף נתונים באמצעות מערכת כבלים מגנטית קשורה.
הערה: האלקטרודה הסטנדרטית בתעשייה יכולה להיות כל אלקטרודה הנחשבת אמינה ומתאימה לצרכי ניסוי. - קרקע את EIB. יש לדחוק קצה אחד של פלדת אל-חלד מצופה PFA ולרתך נקודתית למקור הארקה (למשל, בורג נירוסטה). הצמד את חוט העופרת הארקה לאותו לוח ממשק אלקטרודות במצב "הארקה" המיועד.
- הגדר את אמבט המלח. מלאו זכוכית (250 מ"ל) בתמיסת מלח פיזיולוגית במינון 180 מ"ל (0.9% תמיסת מלח סטרילית)4. טבלו את האלקטרודות האפימיסיאליות המותאמות אישית והמקובלות בתעשייה באמבט המלח ואבטחו אותן במצב יציב. לאחר מכן, לטבול את מקור הארקה לתוך אמבט מלוחים ולהבטיח את מיקומו. לבסוף, השקיעו והצמידו שתי אלקטרודות מחט מעוררות באמבט המלח וחברו את האלקטרודות המעוררות למחולל האותות.
- השתמש במחולל אותות כדי להעריך הסכם אות וסינכרון זמני. השתמשו במחולל אותות כדי להעביר צורות גל חוזרות ונשנות במתח ובתדר נבחרים (0.1 וולט ו-5 הרץ) לתוך אמבט המלח דרך האלקטרודות המעוררות (איור 2). ספק צורות גל שונות (סינוס, ריבוע ומשולש) כדי להשוות אותות מוקלטים בין האלקטרודה האפימיסיאלית המותאמת אישית ביחס לתקן התעשייה.
- הערך את הביצועים באופן לא רשמי וחזותי בזמן אמת כדי להעריך את המידה שבה האותות בין אלקטרודות משתנים. בצע מתאמים תוך-מחלקתיים (ICCs) ומתאמי פירסון כדי להעריך את הסכם האותות ואת הסנכרון הזמני, בהתאמה.
הערה: לצורך הניתוח שלנו, 8,000 דגימות נרכשו ב-4,000 הרץ וסוננו בזמן אמת עם מסנן Butterworth במעבר גבוה ונמוך (מעבר גבוה = 75 הרץ; מעבר נמוך = 2 קילוהרץ). - מדידת עכבת אלקטרודות. כדי למדוד עכבת אלקטרודות, אסוף EIS על אלקטרודות מותאמות אישית (למשל, 10 אלקטרודות) על פני תדרים 10 הרץ-31 קילוהרץ5 עם פוטנציוסטט באמצעות ההליך המתואר להלן על ידי ריצ'י ואחרים.6. ראה Sarolic et al. למידע נוסף על מדידת עכבת אלקטרודות על אלקטרודות דו קוטביות7.
- בעקבות ההליך של ריצ'י ואחרים, לטבול אלקטרודה אפימיסיאלית 1 מ"מ לתוך 1x פוספט-buffered מלוחים (PBS). השתמש בכלוריד כסף-כסף (Ag|AgCl) אלקטרודת ייחוס ומוט נירוסטה כאלקטרודה נגדית להשלמת המעגל.
- השעיית האג |אלקטרודת ייחוס AgCl ומוט הנירוסטה ב- PBS 1x באמצעות מהדק. חבר את אלקטרודת הייחוס לייחוס של מערכת העכבה הנמצאת בשימוש וחבר לקלט האלקטרודה הנגדית של מערכת העכבה שבשימוש.
- השתמש בפוטנציוסטט כדי להפעיל סריקת עכבה של 1 kHz. הגדר לתדר סריקה של 1 kHz ב- 0.01 Vrms בצורת גל סינוס יחיד. במהלך 5 השניות הראשונות של הסריקה, הגדר את הפוטנציוסטט ל- 0 V כדי לייצב את האות המוקלט. השתמש בתוכנה המשויכת לפוטנציוסטט כדי להקליט את המדידות.
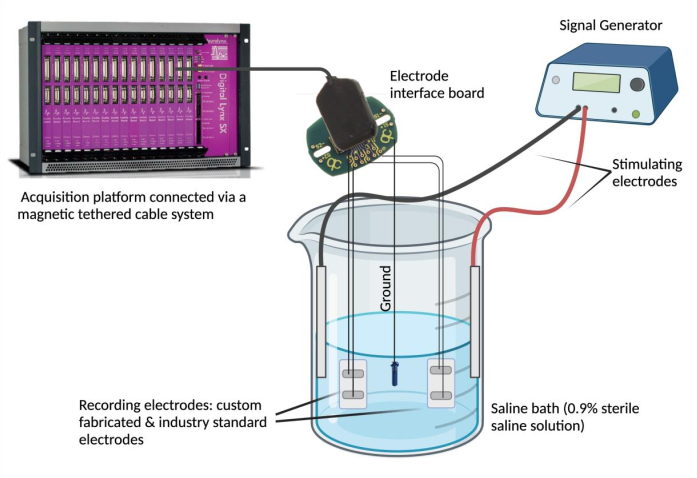
איור 2: בדיקת Ex vivo : אמבט מלח המכיל אלקטרודה מיוצרת בהתאמה אישית, אלקטרודות סטנדרטיות בתעשייה, שתי אלקטרודות מעוררות ומקור הארקה. הסכם אותות וסנכרון זמני הוערכו על ידי העברת גלים סינוגרפיים, מרובעים ומשולשים לתוך אמבט המלח ממחולל האותות והקלטת צורות הגל שזוהו על ידי האלקטרודות בהתאמה באמצעות פלטפורמת רכישת נתונים. הערה: ספקטרוסקופיית עכבה אלקטרוכימית אינה בתמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. בדיקות In vivo
הערה: הליך הבדיקה in vivo מתאר את מקרה השימוש הניסיוני שלנו. מומלץ שאלקטרודות אפימיסיאליות מותאמות אישית ייבדקו in vivo באופן התואם את תנאי הניסוי המיועדים של המשתמש.
- סקירת מידע כירורגי; עיין במידע עבור מנתחים הלומדים את התהליך של השתלת אלקטרודות רישום עצבי כרוני באמצעות המשאבים הבאים 8,9.
הערה: בהתחשב בכך שכתב היד שלנו מתמקד בייצור אלקטרודות ובדיקתן, כאן אנו מספקים רק סקירה קצרה של טכניקות כירורגיות המשמשות במעבדה שלנו לבדיקת אלקטרודות in vivo . - בחרו חולדה למכשיר (למשל, נקבת חולדה לונג אוונס בגיל 16 שבועות). בקשו מהחולדה לעבור תקופת התאקלמות מעבדה של שבוע לפני התאקלמות ההליכון. לאחר התאקלמות במעבדה, יש לחשוף את החולדה בהדרגה להליכון מכרסמים במהירויות הולכות וגדלות של עד 16 מ' לדקה.
- הכן את ה-EIB על-ידי הצמדת אלקטרודה אפימיסיאלית מותאמת אישית ל-EIB על-ידי הצמדת כל מוליך אלקטרודה לתעלה ב-EIB. כדי לקרקע את ה-EIB, יש לדחוס קצה אחד של חוט נירוסטה מצופה PFA ולרתך נקודתית להארקקה שנבחרה (למשל, בורג מפלדת אל-חלד). לאחר מכן, הצמד את חוט עופרת הקרקע לאותו EIB במצב "הקרקע" המיועד.
הערה: כדי להגן על האלקטרודה במהלך המכשור, עטוף אותה בכיסוי מגן (לדוגמה, פרפילם). - יש לחטא את כל כלי הניתוח וכן את אזור הניתוח לפני שמתחילים. השתמש בציוד כירורגי אטום, אספטי ואוטוקלאבי את כל כלי הניתוח שאינם באריזה סטרילית. יצירת שדה כירורגי סטרילי באמצעות שפשוף כירורגי.
- מרדימים את בעל החיים באמצעות תא אינדוקציה עם 3-5% איזופלורן וחמצן 1 ליטר/דקה ושומרים באמצעות חרוט אף עם 2% איזופלורן ו-500 מ"ל חמצן בזמן הכנת החולדה. לאחר ההגעה למישור הכירורגי של ההרדמה, מוערך באמצעות צביטת בוהן, יש למרוח משחת עיניים, לעקוב אחר קצב הנשימה (70-110 נשימות לדקה), ולהעריך את טמפרטורת הליבה באמצעות בדיקה רקטלית.
- לאחר מכן, לגלח את האתר הכירורגי עם קוצץ בעלי חיים ולהסיר פסולת מאתר הניתוח. לאחר גילוח אזור הניתוח, יש לחטא את אתר הניתוח באמצעות כלורהקסידין, איזופרופיל אלכוהול ופובידון-יוד על ידי קרצוף מהמרכז אל מחוץ לאזור הניתוח. לנהל משככי כאבים לפי הצורך ומאושר ולספק חום כדי לשמור על טמפרטורת הגוף הליבה (37.5-38.5 מעלות צלזיוס). לאחר ההכנה, מקמו את החולדה במסגרת סטריאוטקטית והקימו את השדה הסטרילי.
- להכנה כירורגית נכונה של המנתח, יש לשטוף היטב ידיים באמצעות סבון ו/או חומר חיטוי (כלורהקסידין). לבשו ציוד הגנה אישי: מסכה, כפפות סטריליות וחולצת קרצוף חד פעמית. לבשו כפפות סטריליות חדשות אם הטכניקה האספטית מופרת מכל סיבה שהיא.
- כדי להרכיב את שריר ה-VL הימני, השתמש באזמל כדי לבצע חתך של 3-5 ס"מ בחלק הקדמי של הגפה האחורית הימנית והשתמש בדיסקציה קהה כדי לזהות את שריר ה-VL.
- בצע חתך במישור הקשת בקוטר 1 ס"מ לאורך תפר העטרה וחשף את הגולגולת. באמצעות זוג דק של מלקחיים, לעשות תעלה subdermal מן הגפה האחורית הימנית לבסיס הגולגולת. השתמש במלקחיים כדי לתפוס את האלקטרודה ולנתב את האלקטרודה ל- VL.
- השתמש במקדח עצם כדי ליצור חור בקלבריה (ודא שמפרטי המקדחה תואמים לאלה של בורג הקרקע). אבטחו את בורג הארקה וחברו את ה-EIB לגולגולת באמצעות מלט דנטלי.
הערה: ניתן ליישם כמויות קטנות של מי חמצן כדי להגביר את נקבוביות הגולגולת ולשפר את ההיצמדות של מלט השיניים. - לאחר זיהוי שריר ה-VL, השתילו את האלקטרודה האפימיסיאלית המותאמת אישית שהושתלה בקו אחד עם סיבי השריר באמצעות מונופילמנט 4-0 שאינו נספג. סגור את החתך באמצעות קליפסים לפצע או על ידי תפירה.
- לאחר הסגירה, יש להוציא את בעל החיים מההרדמה ולשכן אותו בנפרד בכלוב חיות נקי ויבש. אפשרו לחולדה להתאושש על פד מחומם ועקבו אחר הטמפרטורה וקצב הנשימה של החולדה כל 15 דקות עד שהחיה תהיה אמבולטורית. טיפול בכאב לאחר ניתוח על ידי מתן משכך כאבים מאושר בימים שלאחר המכשור.
הערה: יש לשכן את החולדה בנפרד עד להחלמה מלאה. - לאחר תקופה של 14 יום, בצע בדיקת אלקטרודות in vivo כדי להעריך את תקפות האלקטרודה האפימיסיאלית המותאמת אישית כדי ללכוד שינויים פיזיולוגיים בפעילות השרירים. הניחו את החולדה המכשורית על הליכון מכרסמים וחשפו אותה באופן אקראי לתנאי הליכה בעלייה ובירידה הגורמים לעלייה או הפחתה באיתות VL EMG (שיפוע של 16°, ירידה של 16° ב-16 מטר לדקה). אסוף נתוני אורך (לדוגמה, 14 יום ו- 56 יום לאחר המכשור) כדי להבטיח אמינות לאורך זמן.
הערה: נבחרו הערכות של 14 ו-56 יום מכיוון שתקופה של 14 יום מאפשרת התאוששות כירורגית מלאה וזו של 56 ימים חורגת מציר הזמן הניסיוני שלנו. אנו מעודדים אחרים לבדוק את הביצועים והאמינות של האלקטרודות באמצעות מסגרת זמן המשחזרת את ציר הזמן של הניסוי לפני השימוש. מהירות (16 מ' לדקה) ותנאי הליכה (שיפוע של 16°, ירידה של 16 מעלות) נבחרו כדי להתאים לתנאים שנקבעו של עירור VL מוגבר ומופחת בדגםזה 10. - שנה את פרמטרי הרכישה כך שיתאימו לצרכי הניסוי. לכידת איתות EMG במהלך הליכה בקצב של 2,000 הרץ באמצעות פלטפורמת איסוף הנתונים וסנכרון עם מערכת לכידת תנועה.
הערה: אם אתה משתמש במכשיר רכישה אחר, אסוף EMG ולכידת תנועה בהתאם להוראות היצרן וכדי לענות על צרכי הניסוי. - חלץ 25 שניות של נתוני הליכה מכל תנאי הליכה וייצא לסקריפט Python מותאם אישית לעיבוד וניתוח אותות נוספים. כוונון בסיסי (אפס), תיקון והחלקה באמצעות אלגוריתם ריבוע ממוצע שורש עם רוחב סל של 50 אלפיות השנייה. החל אלגוריתם זיהוי שיאים כדי לבחור פסגות RMS-EMG לשימוש לניתוחי נתונים עוקבים.
הערה: תיארנו בקצרה שיטות לעיבוד וניתוח מראש של נתוני EMG, מכיוון ששלב זה משתנה במידה רבה עקב שפות תכנות ותוכנה וחומרה לרכישת EMG. אנו ממליצים למחברים לעיין במשאבים הבאים לקבלת מידע נוסף 3,11,12,13.
4. בדיקת תאימות ביולוגית
- לאחר סיום איסוף EMG אורכי (או בנקודת זמן נבחרת), יש להרדים את החולדה בשיטות מתאימות ומאושרות (למשל, חנק באמצעותCO2 ואחריו תורקוטומיה דו-צדדית).
- לאחר המתת חסד, לחלץ שרירי VL דו צדדיים על ידי יצירת חתך על הגפיים האחוריות הימנית והשמאלית. יש להקפיא בחנקן נוזלי ולאחסן בטמפרטורה של -80°C.
הערה: יש להקפיד לשמור על האלקטרודה במקומה על השריר המכשור (למשל, ה-VL הימני) במהלך החילוץ. לחלופין, סמנו את אזור תת-האלקטרודה או חלצו רק את השריר מאזור תת-האלקטרודה. זה לא חל על שריר הקונטרלטרלי/בקרה. - השתמש בקריוסטט כדי לחתוך חתכי שרירים סדרתיים (7 מיקרומטר) מהאזור ישירות מתחת לממשק האלקטרודה-פאשיאלי. לחתוך חלקים מבטן השריר של VL contralateral לשמש שליטה. ראה Kumar et al. לפרטים על cryosectioning14.
- כתם עם Hematoxylin ו Eosin (H&E); ראו Wang et al. לפרטים בנוגע לכתמי H&E על חתכי שרירי השלד15.
- בחנו את החלקים המוכתמים (מכשור ובקרה) באמצעות מיקרוסקופ אור בהגדלה של פי 20. לנתח שינויים היסטולוגיים עיוורים למקור הדגימות. להעריך את בריאות הרקמה המוערכת באמצעות התכונות הפתולוגיות הבאות: חדירת תאי מערכת החיסון, הצטברות מיו-גרעינית פנימית, פיברוגנזה ופיצול סרקולמה.
5. ניתוחים סטטיסטיים מוצעים
- כדי להעריך את הביצועים של אלקטרודת אפימייזל מותאמת אישית בהשוואה לתקן בתעשייה, ייבא את נתוני ex vivo לחבילה סטטיסטית שנבחרה. החל את הבדיקות הסטטיסטיות הבאות על נתוני ex vivo שנאספו מהאלקטרודות המותאמות אישית והסטנדרטיות בתעשייה (לדוגמה, 8,000 דגימות מייצגות מצורות הגל הסינוס, המשולש והריבוע). הגדר רמת אלפא מראש ב- p ≤ 0.05.
- כדי לבדוק את רמת הסכם האותות בין אלקטרודות, השתמש במתאמים תוך-מעמדיים (ICCs) ובחלקות בלנד-אלטמן. חשב אומדני ICC ואת מרווחי הסמך שלהם של 95% בהתבסס על מודל השפעות אקראיות דו-כיווניות בדירוג יחיד (k = 2), הסכמה מוחלטת, דו-כיוונית.
- כדי לבדוק את המידה שבה ההקלטה של צורות הגל השתנתה לאורך זמן, הידועה גם בשם סינכרון זמני, בצע מתאם פירסון על ערכים שנאספו עם אלקטרודות מותאמות אישית וסטנדרטיות בתעשייה.
- השווה את עכבת האלקטרודות הממוצעת עבור שני משטחי המגע (נמדדה ב- 1 kHz) מאלקטרודות נבחרות שנוצרו בהתאמה אישית (לדוגמה, 10 אלקטרודות) לעכבה של האלקטרודה הסטנדרטית בתעשייה.
הערה: ערכי עכבת האלקטרודות ישתנו בהתאם למקרה השימוש ולחומרים המשמשים במהלך ייצור האלקטרודות.
- כדי להעריך את האיכות של הקלטות in vivo , ייבאו את הנתונים שנאספו במהלך הליכון הליכה לחבילה סטטיסטית שנבחרה.
- כדי להעריך את תקפותה של האלקטרודה המותאמת אישית במהלך בדיקת in vivo (שבה ההליכה של החולדה הופרעה באמצעות הליכה בעלייה ובירידה כדי לגרום לשינויים פיזיולוגיים בפעילות השרירים), בצע את מבחן t של וולש כדי להשוות ערכי שיא ממוצעים עבור תנאי הליכה בעלייה ובירידה.
הערה: אנו מעודדים את הקוראים לבצע בדיקות וניתוחים נוספים (לדוגמה, הערכות יחס אות לרעש (SNR); ראה Delysys מושגי יסוד ברכישת אותות EMG) שאינם מוצגים כאן בקיצור16. - כדי להעריך את אמינות האיתות של האלקטרודה לאורך זמן, הערך את נתוני האורך שנאספו בתנאים עקביים (הליכה בגובה 16 מטר לדקה במרווחים של 14 ו-56 יום לאחר ההשתלה) באמצעות בדיקות t זוגיות.
- כדי להעריך את תקפותה של האלקטרודה המותאמת אישית במהלך בדיקת in vivo (שבה ההליכה של החולדה הופרעה באמצעות הליכה בעלייה ובירידה כדי לגרום לשינויים פיזיולוגיים בפעילות השרירים), בצע את מבחן t של וולש כדי להשוות ערכי שיא ממוצעים עבור תנאי הליכה בעלייה ובירידה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ביצועי Ex vivo
ICCs חשפו רמות גבוהות של הסכמה בין האלקטרודות המותאמות אישית לבין האלקטרודות הסטנדרטיות בתעשייה בכל צורות הגל (סינוס [ICC = 0.993], ריבוע [ICC = 0.995], משולש [ICC = 0.958]; p < .001). עלילות בלנד-אלטמן חשפו גם רמה גבוהה של הסכמת אותות בין אלקטרודות. חלקות בלנד אלטמן ו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
מטרתנו הייתה לייעל את תהליך ייצור האלקטרודות האלקטרומגנטיות, לאפשר אימוץ ויישום רחב יותר של עיצובי אלקטרודות אפימיסיאליות, ובכך לקדם נגישות ולקדם מחקר עצבי-שרירי. לשם כך, אנו מציגים מדריך ידידותי למשתמש למיקור, ייצור ובדיקה של אלקטרודות אפימיסיאליות בעלות נמוכה בתוך ה?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים ידועים או קשרים אישיים שיכלו להשפיע לכאורה על העבודה המדווחת במאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לדלקת פרקים ומחלות שרירים ושלד ומחלות עור R01AR081235 (ל L. K. Lepley). המחברים מודים לאנשים הבאים על תרומתם לייצור ולבדיקה של האלקטרודה התואמת ביולוגית שלנו: ג'ואל פינגל, גרנט גולר, אקהיל ראמש, ג'ו לטנר, ג'קי טיאן ורוס ברנקטי.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
References
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved