このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
低コストのエピミジオル筋電図電極の開発:製造と試験のための簡素化されたワークフロー
要約
私たちの目的は、エピミシス型筋電図電極の作製と試験に関する最新のわかりやすいガイドを提供することでした。そのために、材料調達の手順と、製造およびテストプロセスの詳細なウォークスルーを提供します。
要約
筋電図検査(EMG)は、神経筋の異常を検出するための貴重な診断ツールです。埋め込み型エピミシール電極は、前臨床モデルでEMG信号を測定するために一般的に使用されます。エピミシアル電極製造の原理を説明する古典的な資料は存在しますが、電極理論を実践に変換する説明的な情報はまばらです。これを改善するために、低コストのエピミジアル電極の製造とテストに関する最新のわかりやすいガイドを提供しています。
電極は、2つのプラチナイリジウム箔を折り畳み、事前にカットされたシリコーンベースに挿入して接触面を形成することによって作られました。次に、被覆されたステンレス鋼線を各接触面に溶接して電極リードを形成しました。最後に、電極をシールするためにシリコーン混合物を使用しました。 生理 食塩水浴中で、特注の電極を業界標準の電極と比較するためにEx vivo試験を実施しました。その結果、すべての波形で高レベルの信号一致(正弦波[クラス内相関 - ICC= 0.993]、二乗[ICC=0.995]、三角[ICC=0.958])、および時間同期性(正弦波[r = 0.987]、二乗[r = 0.990]、三角[r=0.931])が見られました。低レベルの電極インピーダンスも、電気化学インピーダンス分光法によって定量化されました。
また、ラットの外側広筋を特注電極で外科的に計装し、上り坂と下り坂の歩行中にシグナル伝達を獲得したin vivo 性能評価も実施しました。予想通り、下り坂の歩行時(0.008 ± 0.005 mV)は上り坂(0.031 ± 0.180 mV、p = 0.005)よりもピーク筋電図活動が有意に低く、このデバイスの有効性を裏付けています。このデバイスの信頼性と生体適合性は、移植後14日および56日での水平歩行時の一貫したシグナル伝達(それぞれ0.01 ± 0.007 mV、0.012 ± 0.007 mV、p > 0.05)および組織学的炎症がないことによっても支持されました。私たちは、低コストのエピミシアル電極の作製と試験のための最新のワークフローを提供しています。
概要
筋電図検査(EMG)は、筋肉の電気的活動を研究するための強力なツールです。EMG記録は、神経筋機能障害を治療するための介入の有効性を評価するために、前臨床動物モデルで特に役立ちます。これらのモデルでは、運動ニューロンと筋線維の間の神経生理学的界面を評価するために、埋め込み型生体適合性電極が一般的に使用されています。これらの埋め込み型電極は、筋肉の興奮を局所的に測定することができ、その構成、形状、および材料の点で多様であり、最適な設計は最終的に場所と使用目的によって決定されます。
前臨床モデルにおける筋興奮の評価に適しているにもかかわらず、エピミズム電極の使用はコストによって制限される可能性があります。その結果、多くの研究者は、自社で製造されたカスタムメイドのエピミシアル電極を使用しています。電極の製造、試験、および使用に関する基本的な考慮事項を詳述したリソースは存在しますが 1,2、最新の方法を使用したエピミシアル電極の調達、製造、および検証を詳述した最新の教育ガイドが必要です。Loeb と Gans3 などの電極理論の基礎研究に基づいて、低コストのエピミシアル電極の調達と製造に関する最新の指示を提示し、一連の ex vivo および in vivo 実験でその性能をテストします。その目的は、科学界の他の人々が動物用の低コストのエピミジア電極を社内で調達、製造、およびテストするためのユーザーフレンドリーなガイドを提供することであり、前臨床モデルにおける筋肉興奮のより広範な定量化を可能にすることです。
このプロトコルでは、現代の電気生理学研究室で動物が使用するエピミシアル電極の調達、製造、および試験に関する指導ガイドを提供します。形状、寸法、接触表面積、電極間距離、リード長など、製造用に選択された電極パラメータは、実験ニーズに合わせて選択され、市販の業界標準のエピミジアル電極と同等でした( 材料の表を参照)。他のグループには、これらのパラメータをニーズに合わせて変更するだけでなく、ユースケースに適した信頼性の高い業界標準の電極を選択することをお勧めします。
読者に電極性能を比較的迅速に理解していただくために、電極インピーダンスを測定するオプションを備えた ex vivo 試験プロトコルの例も提供しています。さらに、 in vivoでの電極性能の評価を例に挙げます。 ex vivo 実験では、カスタム作製の電極を生理食塩水浴で業界標準と比較し、安定した生理学的条件を模倣しました。インピーダンスは、電気化学インピーダンス分光法(EIS)を介して ex vivo でも評価されました。 in vivo 実験は、16週齢の雌Long Evansラット(HsdBlu:LE、Envigo)の外側広筋(VL)にカスタム作製の電極を外科的に移植して、高信号または低信号(上り坂、下り坂の歩行)を誘発することが知られている条件下でEMG信号を測定することで構成されました。カスタム作製電極の信頼性を評価するために、EMGシグナル伝達は、完全な外科的回復後および犠牲前(それぞれ移植後14日および56日)のレベルウォーキング中に取得されました。ヘマトキシリン-エオシン(H&E)染色を計装した筋肉に対して実施し、カスタム作製電極の生体適合性を評価しました。
Access restricted. Please log in or start a trial to view this content.
プロトコル
in vivo 手順は、ミシガン大学の Institutional Animal Care & Use Committee (IACUC 承認 #PRO00010765) の承認の下で、実験動物のケアと使用に関する国立衛生研究所のガイドラインに従って実施されました。
1. 電極の調達・製作
注: 図1 は、すべての主要な製造手順の概要と、追加の視覚的な指示を提供するQRリンクを示しています。
- 生体適合性電極材料は、製造のためにメーカーから直接バルクで調達します。すべての電極部品と調達の詳細が記載された 材料表を参照してください。
注:シリコーンベース、シリコーンシーラント、およびプラチナ-イリジウム接触箔が生体適合性であることを確認して、有害な免疫応答を回避し、慢性的な移植を可能にします。自社製造の経済的利点をサポートするために、カスタム作製されたエピミシアル電極の詳細なコスト分析を業界標準と比較します(材料の表)。 - シリコンベースに穴を開けます。シリコンベースをカッティング治具にのせてテープで留めます。コンタクト箔を配置するために、X-actoナイフを使用して切断治具のガイドを使用してシリコーンを穴を開けます。
- ホイルをシリコンベースに挿入して、接触面を形成します。生体適合性のあるプレカットされたプラチナ-イリジウムコンタクトフォイル(1.25 mm x 5 mm)を折りたたみ治具を使用してU字型に折ります。次に、折りたたまれたホイルのアームをシリコンベースの穴あきスロットに導き、電極の接触面を構築します。このようにして、12個のホイルすべてをシリコンベースに挿入します。電極間には1本のカラムを空けておき、適切な間隔を確保します。
注:この構成により、6つのバイポーラエピミシアル電極の製造が可能になります。カッティング治具を編集することで、必要に応じて容量を拡大することができます。 - カッティング治具からシリコンベースを取り外します。接触面にサージカルテープを貼って、ホイルを所定の位置に保持します。次に、カッティングジグからシリコンベースを取り外し、U字型ホイルのアームが露出するように裏返し、U字型ホイルの片方のアームをシリコンベースと同じ高さに折ります。
- 電極リード線を接続します。パーフルオロアルコキシ(PFA)被覆ステンレス鋼線を希望の長さに切断して作製します。次に、ステンレス製ワイヤーの一端を市販のライターで~1cm下げます。ステンレス鋼線のむき出しの端を、ホイルの広げたアームの内側に配置します。マイクロTIG溶接機を使用して、ステンレス鋼線をホイルのアームに溶接します(パルス幅= 0、溶接エネルギー= 25)。
- リードフォイルインターフェースを点検します。ステンレス鋼線に張力をかけて、ワイヤーとホイルの接続をテストします。接続が保持されている場合は、ホイルのアームをシリコンベースと同じ高さに折り、シリコンシートに隣接するテープをはがします。
注: 指定したユースケースで適用される張力を表す張力を適用します。 - 電極をシールします。より薄い粘稠度を得るには、1 gの生体適合性液体シリコーンと0.75 mLのトルエンを混合します。18 Gの鈍い先端のシリンジを使用して混合物を引き出し、各電極の溶接面に適用して電極の背面をシールします。
注意:トルエンは可燃性であり、飲み込んだり気道に入ったりすると致命的となる可能性があり、皮膚の炎症を引き起こす可能性があります。ドラフトの下で作業し、直火を避けてください。 - バッチを個々の電極に分けます。電極を取り扱う前に、シリコーントルエンを72時間設定してください。次に、はさみを使用して、シリコンベースを10 x 5mmのサイズの個々の電極に切断します。
注:電極サイズは、切断治具の寸法と特定のユースケースによって異なります。超音波浴で電極をオートクレーブおよび/または洗浄します。
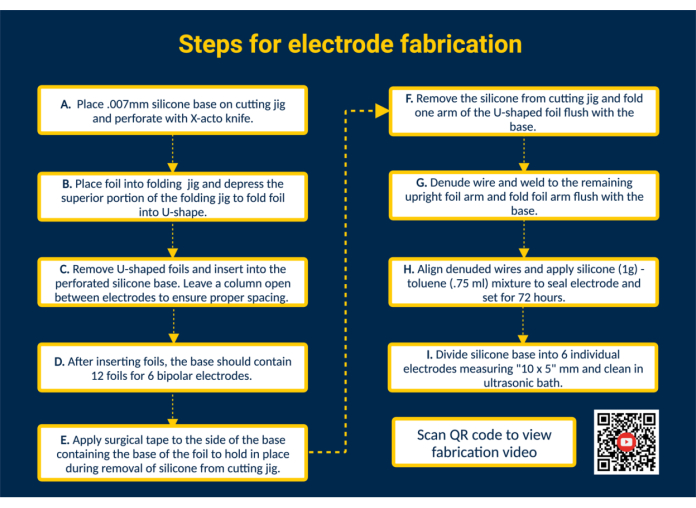
図 1.電極製造の手順。 (A)シリコンベースに穴を開けます。(B)折り畳み治具でU字箔を成形します。(C)U字型のホイルを穴あきシリコンベースに挿入します。(D)シリコーンベースには、6つのバイポーラ電極を形成するための12枚のホイルが含まれています。(E)カッティング治具から取り外す際に、ベースにサージカルテープを貼って箔を固定します。(F)カッティングジグからシリコンベースを取り外します。(G)Denude PFA被覆ステンレス鋼線をマイクロTIG溶接機を使用して直立ホイルアームに溶接します。(H)むき出しのワイヤーを位置合わせし、シリコーン-トルエンシーラントを塗布してセットします。(I)シリコーンベースを個々の電極に分割し、超音波浴で洗浄します。 この図の拡大版を表示するには、ここをクリックしてください。
2. ex vivo 試験
- 電極を記録装置に接続します。各電極リード線を電極インターフェースボード(EIB)のチャネルにピンで固定します。比較のために、選択した業界標準の電極について、この手順を(同じEIBを使用して)繰り返します。EIBを磁気テザリングケーブルシステムを介してデータ収集プラットフォームに接続します。
注:業界標準の電極は、信頼性が高く、実験的なニーズに適した任意の電極にすることができます。 - EIBを接地します。PFAコーティングされたステンレス鋼の一端をデヌードし、接地源(ステンレス鋼のネジなど)にスポット溶接します。アースリード線を同じ電極インターフェースボードの指定された「アース」位置にピンで固定します。
- 生理食塩水浴を設置します。ガラスビーカー(250 mL)に180 mLの生理食塩水(0.9%滅菌生理食塩水)を満たします4。カスタムメイドの業界標準のエピミシャル電極を生理食塩水浴に浸し、安定した位置に固定します。次に、接地源を生理食塩水浴に沈め、その位置を固定します。最後に、2つの刺激針電極を生理食塩水浴に浸して固定し、刺激電極を信号発生器に接続します。
- 信号発生器を使用して、信号の一致と時間的同期を評価します。信号発生器を使用して、選択した電圧と周波数(0.1Vおよび5Hz)で繰り返し波形を刺激電極を介して生理食塩水浴に送達します(図2)。さまざまな波形(正弦波、方形波、三角波)を提供して、カスタム作製のエピミジアル電極間で記録された信号を業界標準と比較して比較します。
- 性能を非公式かつ視覚的にリアルタイムで評価し、電極間の信号の変動の程度を評価します。クラス内相関 (ICC) とピアソン相関を実行して、シグナルの一致と時間的同期性をそれぞれ評価します。
注:分析の目的で、8,000のサンプルを4,000 Hzで取得し、ハイパスおよびローパスのバターワースフィルター(ハイパス= 75 Hz、ローパス= 2 kHz)でリアルタイムでフィルタリングしました。 - 電極インピーダンスを測定します。電極インピーダンスを測定するには、Richieらが以下に説明する手順を使用して、ポテンショスタットを使用して10Hz〜31kHz5の周波数でカスタム作製の電極(10個の電極など)にEISを収集します。6. バイポーラ電極の電極インピーダンスの測定に関する追加情報については、Sarolic et al.を参照してください7.
- Richieらの手順に従って、エピミシス電極1 mmを1xリン酸緩衝生理食塩水(PBS)に浸します。銀-塩化銀(Ag|AgCl)参照電極と対極としてのステンレス鋼棒で回路を完成させます。
- Agを一時停止|ビーカークランプを使用した1x PBSのAgCl参照電極とステンレス鋼ロッド。参照電極を使用するインピーダンスシステムの基準に接続し、使用するインピーダンスシステムの対電極入力に接続します。
- ポテンショスタットを使用して、1 kHzのインピーダンススキャンを実行します。スキャン周波数を1kHz、0.01Vrms、1つの正弦波に設定します。スキャンの最初の5秒間は、ポテンショスタットを0Vに設定して、記録された信号を安定させます。ポテンショスタット関連ソフトウェアを使用して、測定値を記録します。
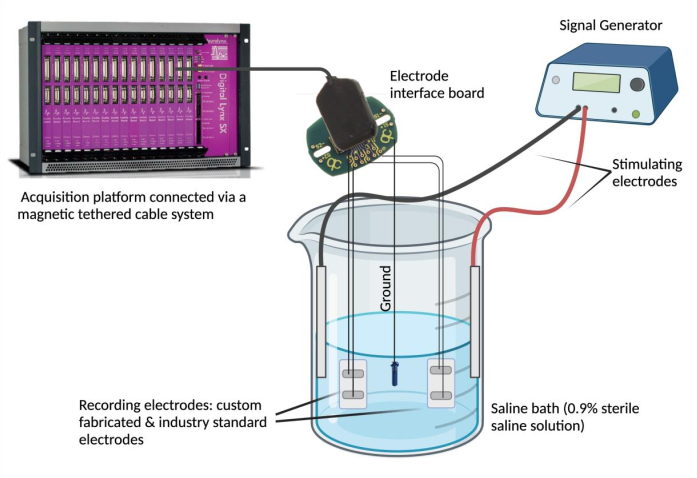
図2: 生体外 試験: 特注の電極、業界標準の電極、2つの刺激電極、および接地源を含む生理食塩水浴。信号の一致と時間的同期性は、信号発生器から正弦波、方形波、三角波を生理食塩水浴に送達し、データ収集プラットフォームを使用して各電極で検出された波形を記録することによって評価されました。注:電気化学インピーダンス分光法は図に写っていません。 この図の拡大版を表示するには、ここをクリックしてください。
3. 生体内 試験
注: in vivo 試験手順は、実験的な使用例を説明しています。カスタム作製のエピミジア電極は、ユーザーの意図した実験条件に一致する方法で in vivo で試験することをお勧めします。
- 手術情報を確認します。次のリソースを使用して慢性神経記録電極を埋め込むプロセスを学んでいる外科医向けの情報を参照してください8,9。
注:私たちの原稿の焦点が電極の製造と試験にあるため、ここでは、 in vivo 電極試験のために私たちの研究室で使用されている外科的技術の簡単な概要のみを提供します。 - 計装するラットを選択します(例:16週齢の雌のLong Evansラット)。ラットにトレッドミル順化の前に1週間の実験室順応を受けさせます。実験室で順応した後、ラットを徐々にげっ歯類のトレッドミルに最大16 m / minの速度でさらします。
- EIBを準備するには、まず、各電極リード線をEIBのチャネルに固定することにより、カスタムメイドのエピミジアル電極をEIBに取り付けます。EIBを接地するには、PFA被覆ステンレス鋼ワイヤの一端をデヌードし、選択した接地(ステンレス鋼ネジなど)にスポット溶接します。次に、アース導線を指定された「アース」位置の同じEIBに固定します。
注意: 計装中に電極を保護するために、電極を保護カバー(パラフィルムなど)で包みます。 - 開始する前に、すべての手術器具と手術部位を消毒してください。密封された無菌手術用品を使用し、滅菌包装されていないすべての手術器具をオートクレーブします。サージカルドレープを使用して無菌の手術野を作成します。
- 3-5%イソフルランと1L / min酸素を含む誘導チャンバーを使用して動物に麻酔をかけ、ラットを準備しながら2%イソフルランと500mL酸素を含むノーズコーンを介して維持します。麻酔の手術面に到達した後、つま先をつまんで評価し、眼軟膏を塗布し、呼吸数を監視し (70-110 呼吸/分)、直腸プローブを使用してコア温度を評価します。
- 次に、動物用クリッパーで手術部位を剃り、手術部位から破片を取り除きます。手術部位を剃ったら、クロルヘキシジン、イソプロピルアルコール、ポビドンヨードを使用して手術部位の中心から外側に向かってこすり洗いして手術部位を消毒します。必要に応じて鎮痛薬を投与し、承認されたことを確認し、深部体温(37.5-38.5°C)を維持するために熱を提供します。調製後、ラットを定位フレームに配置し、無菌フィールドを確立します。
- 外科医の適切な外科的準備のために、石鹸および/または消毒剤(クロルヘキシジン)を使用して手をよく洗ってください。適切なPPEを着用してください:マスク、滅菌手袋、使い捨てのガウン/スクラブトップ。何らかの理由で無菌技術に違反した場合は、新しい滅菌手袋を着用してください。
- 右VLを器具にするには、メスを使用して右後肢の前外側部分に3〜5 cmの切開を行い、鈍的解剖を使用してVL筋肉を特定します。
- 冠状縫合糸に沿って1cmの矢状面を切開し、頭蓋骨を露出させます。細い鉗子を使用して、右後肢から頭蓋骨の基部まで皮下トンネルを作ります。鉗子を使用して電極をつかみ、電極をVLに配線します。
- ボーンドリルを使用して、頭蓋骨に穴を開けます(ドリルの仕様がアーススクリューの仕様と一致していることを確認してください)。接地ネジを固定し、歯科用セメントを使用してEIBを頭蓋骨に取り付けます。
注:少量の過酸化水素を適用して、頭蓋骨の多孔性を高め、歯科用セメントの接着性を高めることができます。 - VL筋を特定したら、4-0非吸収性モノフィラメントを使用して、筋線維に沿って埋め込まれたカスタム作製のエピミズ電極を埋め込みます。傷口クリップを使用するか、縫合して切開部を閉じます。
- 閉鎖後、動物を麻酔から外し、清潔で乾燥した動物ケージに個別に収容します。ラットが加熱されたパッドで回復するのを待ち、動物が歩行できるようになるまで15分ごとにラットの体温と呼吸数を監視します。術後の痛みを治療するには、器具使用後数日間に承認された鎮痛薬を投与します。
注:ラットは完全に回復するまで個別に収容する必要があります。 - 14日間の期間後、 in vivo 電極試験を実施して、カスタム作製されたエピミズ電極の有効性を評価し、筋肉活動の生理学的変化を捕捉します。計装されたラットをげっ歯類のトレッドミルに置き、VL EMGシグナル伝達の増加または減少(16メートル/分で16°傾斜、16°低下)を引き出す上り坂と下り坂の歩行条件にランダムにさらします。縦断的なデータ(装置装着後14日や56日など)を収集し、長期にわたる信頼性を確保します。
注: 14 日間と 56 日間の評価は、14 日間の期間として選択されています 完全な外科的回復と 56 日間の期間は、実験タイムラインを超えています。私たちは、他のユーザーが使用前に実験タイムラインを再現する時間枠を使用して電極の性能と信頼性をテストすることをお勧めします。速度(16m/分)と歩行条件(傾斜16°、下降16°)は、このモデル10で確立されたVL励起の増減条件に一致するように選択されました。 - 実験のニーズに合わせて取得パラメータを変更します。データ収集プラットフォームを使用して、歩行中のEMG信号を2,000Hzの速度でキャプチャし、モーションキャプチャシステムと同期します。
注意: 別の取得デバイスを使用している場合は、製造元の指示に従って、実験のニーズを満たすためにEMGとモーションキャプチャを収集します。 - 各歩行条件から25秒の歩行データを抽出し、カスタマイズされたPythonスクリプトにエクスポートして、さらに信号処理と分析を行います。ベースライン調整 (ゼロ)、修正、および平滑化は、ビン幅が 50 ミリ秒の二乗平均平方根アルゴリズムを使用して行います。ピーク検出アルゴリズムを適用して、その後のデータ解析に利用するRMS-EMGピークを選択します。
注:EMGデータを前処理および分析する方法は、プログラミング言語とEMG取得ソフトウェアおよびハードウェアによって大きく異なるため、簡単に説明しました。著者は、追加情報3,11,12,13について次のリソースを参照することをお勧めします。
4. 生体適合性試験
- 縦断的EMG収集の終了後(または選択した時点で)、適切で承認された方法を使用してラットを安楽死させます(例:.、CO2 を使用した窒息とそれに続く両側開胸術)。
- 安楽死後、前外側の右肢と左後肢に切開を作成することにより、両側のVL筋肉を抽出します。液体窒素で急速凍結し、-80°Cで保存します。
注:抽出中は、電極を計装された筋肉(右VLなど)の所定の位置に保つように注意してください。あるいは、副電極領域に印を付けるか、副電極領域から筋肉のみを抽出します。これは、対側筋/制御筋には適用されません。 - クライオスタットを使用して、電極-筋膜界面の真下にある領域から連続した筋肉の断面積(7 μm)を切断します。対側VLの筋肉腹から切片を切り取り、コントロールとして機能します。クライオセクショニングの詳細については、Kumar et al.を参照してください14。
- ヘマトキシリンおよびエオシン(H&E)で染色します。骨格筋断面15のH&E染色に関する詳細は、Wang et al.を参照のこと。
- 染色された切片(計装および制御)を光学顕微鏡で20倍の倍率で調べます。サンプルの起源を知らなくても組織学的変化を解析します。次の病理学的特徴を使用して評価された組織の健康状態を評価します:免疫細胞の浸潤、内部筋核蓄積、線維形成、およびサルコレンマの断片化。
5. 推奨される統計分析
- カスタム作製した筋外電極の性能を業界標準と比較して評価するには、選択した統計パッケージに ex vivo データをインポートします。カスタム作製および業界標準の電極から収集した ex vivo データ(例えば、正弦波、三角波、および矩形波からの8,000の代表サンプル)に、以下の統計的検定を適用します。アルファ レベル を a アプリオリに p ≤ 0.05 に設定します。
- 電極間の信号一致のレベルをテストするには、クラス内相関 (ICC) と Bland-Altman プロットを使用します。ICC 推定値とその 95% 信頼区間を、単一評価 (k = 2)、絶対一致、2 因子変量効果モデルに基づいて計算します。
- 時間的同期とも呼ばれる、時間の経過に伴う共変波形の記録の程度をテストするには、カスタム作製の業界標準の電極で収集された値に対してピアソン相関を実行します。
- 選択したカスタム作製電極(10個の電極など)からの両方の接触面(1kHzで測定)の平均電極インピーダンスを、業界標準の電極のインピーダンスと比較します。
注:電極インピーダンスの値は、電極製造中に使用されるユースケースと材料によって異なります。
- in vivo 記録の品質を評価するには、トレッドミルでの歩行中に収集されたデータを選択した統計パッケージにインポートします。
- in vivo試験(ラットの歩行が上り坂と下り坂の歩行によって摂動され、筋肉活動の生理学的変化を誘発された)中にカスタム作製電極の有効性を評価するには、ウェルチのt検定を実行して、上り坂と下り坂の歩行条件の平均ピーク値を比較します。
注:読者は、ここで簡潔に説明されていない追加のテストと分析(信号対雑音比(SNR)評価など、EMG信号取得のDelysysの基本概念を参照)を実行することをお勧めします16。 - 電極のシグナル伝達の信頼性を経時的に評価するには、一貫した条件 (移植後 14 日間隔と 56 日間隔で 16 m/min で水平歩行) で収集された縦断的データを、対応のある t 検定によって評価します。
- in vivo試験(ラットの歩行が上り坂と下り坂の歩行によって摂動され、筋肉活動の生理学的変化を誘発された)中にカスタム作製電極の有効性を評価するには、ウェルチのt検定を実行して、上り坂と下り坂の歩行条件の平均ピーク値を比較します。
Access restricted. Please log in or start a trial to view this content.
結果
生体外 性能
ICCは、すべての波形(正弦[ICC = 0.993]、正方形[ICC = 0.995]、三角形[ICC = 0.958]、p<.001)にわたって、カスタム製造電極と業界標準電極との間に高いレベルの一致を示しました。Bland-Altmanプロットは、電極間の信号の一致度が高いことも明らかにしました。Bland AltmanプロットとPearson相関は、カスタム作製電極と業界標準の電極との間に強い?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
私たちの目的は、EMG製造プロセスを合理化し、エピミシャル電極設計の広範な採用と実装を可能にし、アクセシビリティを促進し、神経筋研究を前進させることでした。この目的のために、低コストのエピミサイアル電極を社内で調達、製造、およびテストするためのユーザーフレンドリーなガイドを提供します。また、他の研究グループを支援することを考え、彼...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、この論文で報告された研究に影響を与えたと思われる可能性のある既知の競合する金銭的利益や個人的な関係がないことを宣言します。
謝辞
この研究は、国立関節炎・筋骨格・皮膚疾患研究所の助成金R01AR081235(L.K.レプリー氏)の支援を受けた。著者は、生体適合性電極の製造と試験に貢献してくれたJoel Pingel氏、Grant Gueller氏、Akhil Ramesh氏、Joe Letner氏、Jacky Tian氏、Ross Brancati氏に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
参考文献
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved