Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung einer kostengünstigen epimysialen Elektromyographie-Elektrode: Ein vereinfachter Arbeitsablauf für Herstellung und Prüfung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Unser Ziel war es, einen aktualisierten, leicht verständlichen Leitfaden für die Herstellung und Prüfung von epimysialen Elektromyographie-Elektroden bereitzustellen. Zu diesem Zweck bieten wir Anweisungen für die Materialbeschaffung und eine detaillierte Anleitung zum Herstellungs- und Prüfprozess.
Zusammenfassung
Die Elektromyographie (EMG) ist ein wertvolles diagnostisches Instrument zur Erkennung neuromuskulärer Anomalien. Implantierbare epimysiale Elektroden werden häufig zur Messung von EMG-Signalen in präklinischen Modellen verwendet. Obwohl es klassische Ressourcen gibt, die die Prinzipien der epimysialen Elektrodenherstellung beschreiben, gibt es nur wenige anschauliche Informationen, die die Elektrodentheorie in die Praxis umsetzen. Um hier Abhilfe zu schaffen, stellen wir einen aktualisierten, leicht verständlichen Leitfaden zur Herstellung und Prüfung einer kostengünstigen Epimysialelektrode zur Verfügung.
Die Elektroden wurden hergestellt, indem zwei Platin-Iridium-Folien gefaltet und in eine vorgeschnittene Silikonbasis eingelegt wurden, um die Kontaktflächen zu bilden. Anschließend wurden an jede Kontaktfläche beschichtete Edelstahldrähte geschweißt, um die Elektrodenleitungen zu bilden. Zuletzt wurde eine Silikonmischung verwendet, um die Elektrode abzudichten. Ex-vivo-Tests wurden durchgeführt, um unsere kundenspezifische Elektrode mit einer Industriestandard-Elektrode in einem Salzbad zu vergleichen, wobei über alle Wellenformen hinweg ein hohes Maß an Signalübereinstimmung (Sinus [Intraklassenkorrelation - ICC= 0,993], Quadrat [ICC = 0,995], Dreieck [ICC = 0,958]) und zeitliche Synchronie (Sinus [r = 0,987], Quadrat [r = 0,990], Dreieck [r= 0,931]) festgestellt wurde. Niedrige Elektrodenimpedanzen wurden auch mittels elektrochemischer Impedanzspektroskopie quantifiziert.
Es wurde auch eine In-vivo-Leistungsbewertung durchgeführt, bei der der Musculus vastus lateralis einer Ratte chirurgisch mit der speziell angefertigten Elektrode instrumentiert und die Signalübertragung beim Auf- und Absteigen erfasst wurde. Wie erwartet war die maximale EMG-Aktivität beim Gehen bergab (0,008 ± 0,005 mV) signifikant niedriger als bergauf (0,031 ± 0,180 mV, p = 0,005), was die Validität des Geräts unterstützt. Die Zuverlässigkeit und Biokompatibilität des Geräts wurde auch durch eine konsistente Signalübertragung während des Gehens 14 Tage und 56 Tage nach der Implantation (0,01 ± 0,007 mV, 0,012 ± 0,007 mV; p > 0,05) und das Fehlen histologischer Entzündungen unterstützt. Gemeinsam bieten wir einen aktualisierten Workflow für die Herstellung und Prüfung kostengünstiger epimysieller Elektroden.
Einleitung
Die Elektromyographie (EMG) ist ein leistungsfähiges Instrument zur Untersuchung der elektrischen Aktivität von Muskeln. EMG-Aufzeichnungen können besonders in präklinischen Tiermodellen nützlich sein, um die Wirksamkeit von Interventionen zur Behandlung neuromuskulärer Dysfunktion zu beurteilen. In diesen Modellen werden häufig implantierbare biokompatible Elektroden verwendet, um die neurophysiologische Schnittstelle zwischen Motoneuronen und Muskelfasern zu beurteilen. Diese implantierbaren Elektroden können lokalisierte Messungen der Muskelerregung liefern und können in Bezug auf ihre Konfiguration, Form und ihr Material unterschiedlich sein, wobei das optimale Design letztendlich von der Position und dem Verwendungszweck abhängt.
Trotz ihrer Eignung für die Beurteilung der Muskelerregung in präklinischen Modellen kann der Einsatz von epimysialen Elektroden durch die Kosten begrenzt sein. Daher verwenden viele Forscher maßgeschneiderte Epimysienelektroden, die im eigenen Haus hergestellt werden. Obwohl Ressourcen vorhanden sind, in denen die grundlegenden Überlegungen zur Herstellung, Prüfungund Verwendung von Elektroden 1,2 detailliert beschrieben werden, besteht ein Bedarf an einem aktualisierten Anleitungsleitfaden, in dem die Beschaffung, Herstellung und Validierung von Epimysienelektroden unter Verwendung moderner Methoden detailliert beschrieben wird. Basierend auf den grundlegenden Arbeiten von Loeb und Gans3 und anderen in der Elektrodentheorie präsentieren wir moderne Anleitungen zur Beschaffung und Herstellung kostengünstiger epimysieller Elektroden und testen ihre Leistungsfähigkeit in einer Reihe von ex vivo und in vivo Experimenten. Ziel ist es, anderen in der wissenschaftlichen Gemeinschaft einen benutzerfreundlichen Leitfaden für die Beschaffung, Herstellung und Prüfung von kostengünstigen Epimysienelektroden für den Tiergebrauch zu bieten, der eine breitere Quantifizierung der Muskelerregung in präklinischen Modellen ermöglicht.
In diesem Protokoll stellen wir eine Anleitung für die Beschaffung, Herstellung und Prüfung von Epimysialelektroden für den Einsatz bei Tieren im modernen Elektrophysiologielabor zur Verfügung. Die für die Herstellung ausgewählten Elektrodenparameter wie Form, Abmessungen, Kontaktfläche, Zwischenelektrodenabstand, Leitungslänge usw. wurden entsprechend unseren experimentellen Anforderungen ausgewählt und waren vergleichbar mit einer kommerziell erhältlichen Epimysialelektrode nach Industriestandard (siehe Materialtabelle). Wir ermutigen andere Gruppen, diese Parameter an ihre Bedürfnisse anzupassen und eine zuverlässige Elektrode nach Industriestandard auszuwählen, die ihrem Anwendungsfall entspricht.
Um den Lesern einen relativ schnellen Eindruck von der Elektrodenleistung zu vermitteln, stellen wir auch ein Beispiel für ein Ex-vivo-Testprotokoll mit der Option zur Messung der Elektrodenimpedanz zur Verfügung. Zusätzlich geben wir ein Beispiel für eine Bewertung der Elektrodenleistung in vivo. Das Ex-vivo-Experiment verglich die speziell angefertigte Elektrode mit einem Industriestandard in einem Salzbad, um stabile physiologische Bedingungen nachzuahmen. Die Impedanz wurde auch ex vivo mittels elektrochemischer Impedanzspektroskopie (EIS) bestimmt. Das In-vivo-Experiment bestand aus der chirurgischen Implantation der maßgefertigten Elektrode in den Musculus vastus lateralis (VL) einer 16 Wochen alten weiblichen Long-Evans-Ratte (HsdBlu: LE, Envigo), um das EMG-Signal unter Bedingungen zu messen, von denen bekannt ist, dass sie ein hohes oder tiefes Signal auslösen (bergauf, bergab gehend). Um die Zuverlässigkeit der individuell angefertigten Elektrode zu beurteilen, wurde die EMG-Signalgebung während des waagerechten Gehens nach vollständiger chirurgischer Genesung und vor der Opferung (14 Tage bzw. 56 Tage nach der Implantation) erfasst. An dem instrumentierten Muskel wurde eine Hämatoxylin-Eosin (H&E)-Färbung durchgeführt, um die Biokompatibilität der individuell angefertigten Elektrode zu beurteilen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Das In-vivo-Verfahren wurde unter der Genehmigung des Institutional Animal Care & Use Committee an der University of Michigan (IACUC-Zulassung #PRO00010765) und in Übereinstimmung mit den Richtlinien der National Institutes of Health zur Pflege und Verwendung von Labortieren durchgeführt.
1. Beschaffung und Herstellung von Elektroden
HINWEIS: Abbildung 1 bietet eine allgemeine Zusammenfassung aller wichtigen Fertigungsschritte mit einem QR-Link, der zusätzliche visuelle Anweisungen enthält.
- Beschaffung biokompatibler Elektrodenmaterialien direkt vom Hersteller in loser Schüttung für die Herstellung. Weitere Informationen finden Sie in der Materialtabelle, die alle Elektrodenkomponenten und Details zur Beschaffung enthält.
HINWEIS: Stellen Sie sicher, dass die Silikonbasis, der Silikondichtstoff und die Platin-Iridium-Kontaktfolien biokompatibel sind, um eine unerwünschte Immunreaktion zu vermeiden und eine chronische Implantation zu ermöglichen. Um die wirtschaftlichen Vorteile der Eigenfertigung zu untermauern, stellen wir eine detaillierte Kostenanalyse der kundenspezifischen Epimysialelektrode im Vergleich zum Industriestandard vor (Table of Materials). - Schneiden und Falten vorbereiten (Ergänzungsdatei 1, Ergänzungsdatei 2). Verwenden Sie ausgewählte 3D-Drucksoftware, um Schneid- und Falzvorrichtungen für die Serienproduktion identischer epimysieller Elektroden zu konstruieren.
- Entwerfen Sie die Schneidlehre so, dass eine gleichmäßig große und gleichmäßige Perforation der Silikonbasis für eine gleichmäßige Kontaktfläche und einen gleichmäßigen Elektrodenabstand zwischen allen Elektroden gewährleistet ist.
- Erstellen Sie die Faltvorrichtung, um die Platin-Iridium-Kontaktflächen zu falten und das Platzieren der Folien in der Silikonbasis zu vereinfachen.
HINWEIS: Gcode-Dateien werden bereitgestellt. Ändern Sie die Abmessungen und Spezifikationen der Schneid- und Biegevorrichtung, um sie an die experimentellen Anforderungen anzupassen.
- Perforieren Sie die Silikonbasis. Lege die Silikonbasis auf die Schneidevorrichtung und klebe sie fest. Perforieren Sie das Silikon mit Hilfe der Führungen in der Schneidlehre mit einem X-acto-Messer zum Platzieren der Kontaktfolien.
- Führen Sie die Folien in die Silikonbasis ein, um die Kontaktflächen zu bilden. Falten Sie die biokompatiblen, vorgestanzten Platin-Iridium-Kontaktfolien (1,25 mm x 5 mm) mit der Faltlehre in eine U-Form. Führen Sie anschließend die Arme der gefalteten Folien in die perforierten Schlitze in der Silikonbasis, um die Kontaktflächen der Elektrode zu konstruieren. Führen Sie auf diese Weise alle 12 Folien in die Silikonbasis ein; Lassen Sie eine einzelne Säule zwischen den Elektroden offen, um den richtigen Abstand zu gewährleisten.
HINWEIS: Diese Konfiguration ermöglicht die Herstellung von 6 bipolaren epimysialen Elektroden; Durch die Bearbeitung der Schneidvorrichtung kann die Kapazität bei Bedarf erweitert werden. - Entfernen Sie die Silikonbasis von der Schneidevorrichtung. Legen Sie ein Stück chirurgisches Klebeband über die Kontaktflächen, um die Folien an Ort und Stelle zu halten. Entfernen Sie als Nächstes die Silikonbasis von der Schneidevorrichtung, drehen Sie sie um, so dass die Arme der U-förmigen Folie freiliegen, und falten Sie einen Arm der U-förmigen Folie bündig mit der Silikonbasis.
- Schließen Sie die Elektrodenkabel an. Bereiten Sie einen mit Perfluoralkoxy (PFA) beschichteten Edelstahldraht vor, indem Sie ihn auf die gewünschte Länge zuschneiden. Als nächstes entblößen Sie ein Ende des Edelstahldrahtes mit einem handelsüblichen Feuerzeug um ~ 1 cm. Positionieren Sie das entblößte Ende des Edelstahldrahtes auf der Innenseite des entfalteten Arms der Folie. Schweißen Sie den Edelstahldraht mit einem Micro-WIG-Schweißgerät (Impulsbreite = 0, Schweißenergie = 25) mit dem Arm der Folie zusammen.
- Überprüfen Sie die Blei-Folien-Schnittstelle. Testen Sie die Draht-Folien-Verbindung, indem Sie den Edelstahldraht unter Spannung halten. Wenn die Verbindung hält, klappen Sie den Arm der Folie bündig mit der Silikonbasis nach unten und entfernen Sie das Klebeband, das an die Silikonfolie grenzt.
HINWEIS: Wenden Sie eine Spannung an, die für die im angegebenen Anwendungsfall angewendete Spannung repräsentativ ist. - Versiegeln Sie die Elektrode. Um eine dünnere Konsistenz zu erreichen, mischen Sie 1 g biokompatibles Flüssigsilikon mit 0,75 mL Toluol. Ziehen Sie die Mischung mit einer 18-G-Spritze mit stumpfen Spitzen auf und tragen Sie sie auf die verschweißte Seite jeder Elektrode auf, um die Rückseite der Elektroden abzudichten.
ACHTUNG: Toluol ist brennbar, kann tödlich sein, wenn es verschluckt wird oder in die Atemwege gelangt und Hautreizungen verursacht. Arbeiten Sie unter dem Abzug und halten Sie ihn von offenen Flammen fern. - Trennen Sie die Charge in einzelne Elektroden. Lassen Sie das Silikon-Toluol 72 h einwirken, bevor Sie die Elektrode anfassen. Schneiden Sie anschließend mit einer Schere die Silikonbasis in einzelne Elektroden mit einer Größe von 10 x 5 mm.
HINWEIS: Die Elektrodengröße hängt von den Abmessungen der Schneidlehre und dem spezifischen Anwendungsfall ab. Autoklavieren und/oder reinigen Sie Elektroden in einem Ultraschallbad.
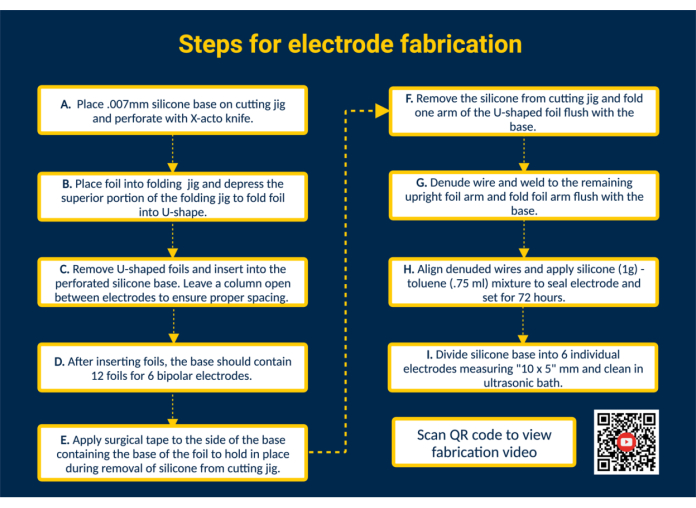
Abbildung 1. Schritte zur Elektrodenherstellung. (A) Perforierte Silikonbasis. (B) Mit der Faltlehre U-förmige Folien formen. (C) Legen Sie U-förmige Folien in die perforierte Silikonbasis ein. (D) Die Silikonbasis enthält 12 Folien zur Bildung von 6 bipolaren Elektroden. (E) Bringen Sie chirurgisches Klebeband auf der Basis an, um die Folien während der Entnahme aus der Schneidvorrichtung zu sichern. (F) Entfernen Sie die Silikonbasis von der Schneidvorrichtung. (G) Entblößen Sie PFA-beschichteten Edelstahldraht und schweißen Sie ihn mit einem Mikro-WIG-Schweißgerät an den aufrechten Folienarm. (H) Richten Sie die entblößten Drähte aus, tragen Sie Silikon-Toluol-Dichtmittel auf und lassen Sie es aushärten. (I) Teilen Sie die Silikonbasis in einzelne Elektroden auf und reinigen Sie sie in einem Ultraschallbad. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Ex-vivo-Tests
- Schließen Sie Elektroden an ein Aufzeichnungsgerät an. Stecken Sie jeden Elektrodenanschlussdraht in einen Kanal auf einer Elektrodenschnittstellenplatine (EIB). Wiederholen Sie diesen Schritt (mit demselben EIB) für eine ausgewählte Industriestandard-Elektrode zum Vergleich. Verbinden Sie die EIB über ein magnetisches Kabelsystem mit einer Datenerfassungsplattform.
HINWEIS: Die Industriestandard-Elektrode kann jede Elektrode sein, die als zuverlässig gilt und den experimentellen Anforderungen entspricht. - Die EIB erden. Entblößen Sie ein Ende eines PFA-beschichteten Edelstahls und schweißen Sie ihn an eine Erdungsquelle (z. B. eine Edelstahlschraube). Stecken Sie das Erdungskabel in der angegebenen "Masse"-Position an dieselbe Elektrodenschnittstellenplatine.
- Stellen Sie das Salzbad auf. Füllen Sie ein Becherglas (250 ml) mit 180 ml physiologischer Kochsalzlösung (0,9 % sterile Kochsalzlösung)4. Tauchen Sie die speziell angefertigten und branchenüblichen Epimysialelektroden in das Salzbad ein und befestigen Sie sie in einer stabilen Position. Tauchen Sie anschließend die Erdungsquelle in das Salzbad ein und sichern Sie ihre Position. Zum Schluss tauchen und befestigen Sie zwei Stimulationsnadelelektroden in das Salzbad und verbinden Sie die Stimulationselektroden mit dem Signalgenerator.
- Verwenden Sie einen Signalgenerator, um die Signalübereinstimmung und die zeitliche Synchronität zu beurteilen. Verwenden Sie einen Signalgenerator, um wiederholte Wellenformen mit einer ausgewählten Spannung und Frequenz (0,1 V und 5 Hz) über die Stimulationselektroden in das Salzbad abzugeben (Abbildung 2). Liefern Sie verschiedene Wellenformen (Sinus, Rechteck und Dreieck), um aufgezeichnete Signale zwischen der kundenspezifischen Epimysialelektrode im Vergleich zum Industriestandard zu vergleichen.
- Bewerten Sie die Leistung informell und visuell in Echtzeit, um zu beurteilen, inwieweit die Signale zwischen den Elektroden variieren. Durchführung von Intra-Class-Korrelationen (ICCs) und Pearson-Korrelationen, um die Signalübereinstimmung bzw. die zeitliche Synchronität zu bewerten.
HINWEIS: Für unsere Analyse wurden 8.000 Proben bei 4.000 Hz erfasst und in Echtzeit mit einem Hoch- und Tiefpass-Butterworth-Filter (Hochpass = 75 Hz; Tiefpass = 2 kHz) gefiltert. - Messen Sie die Elektrodenimpedanz. Um die Elektrodenimpedanz zu messen, sammeln Sie EIS an den kundenspezifisch angefertigten Elektroden (z. B. 10 Elektroden) über Frequenzen von 10 Hz-31 kHz5 mit einem Potentiostaten unter Verwendung des unten von Richie et al. beschriebenen Verfahrens.6. Siehe Sarolic et al. für zusätzliche Informationen zur Messung der Elektrodenimpedanz an bipolaren Elektroden7.
- Nach dem Verfahren von Richie et al. tauchen Sie die epimysiale Elektrode 1 mm in 1x phosphatgepufferte Kochsalzlösung (PBS) ein. Verwenden Sie ein Silber-Silberchlorid (Ag|AgCl) Referenzelektrode und einen Edelstahlstab als Gegenelektrode zur Vervollständigung des Stromkreises.
- Aussetzung der Ag|AgCl-Referenzelektrode und der Edelstahlstab in der 1x PBS mit einer Becherklemme. Verbinden Sie die Referenzelektrode mit der Referenz des verwendeten Impedanzsystems und verbinden Sie sie mit dem Gegenelektrodeneingang des verwendeten Impedanzsystems.
- Verwenden Sie einen Potentiostaten, um einen Impedanzscan von 1 kHz durchzuführen. Auf eine Scanfrequenz von 1 kHz bei 0,01 Vrms in einer einzelnen Sinuswellenform eingestellt. Stellen Sie während der ersten 5 Sekunden des Scans den Potentiostaten auf 0 V, um das aufgenommene Signal zu stabilisieren. Verwenden Sie die potentiostatzugehörige Software, um die Messungen aufzuzeichnen.
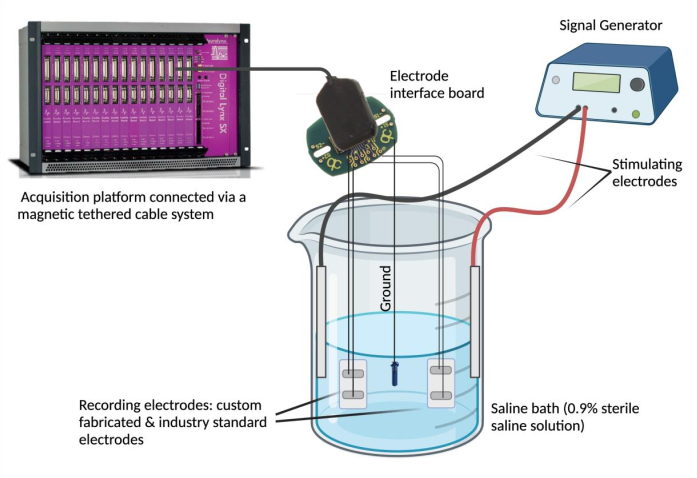
Abbildung 2: Ex-vivo-Test : Kochsalzbad mit der kundenspezifischen Elektrode, Industriestandard-Elektroden, zwei Stimulationselektroden und einer Erdungsquelle. Die Signalübereinstimmung und die zeitliche Synchronität wurden bewertet, indem Sinus-, Rechteck- und Dreieckswellen vom Signalgenerator in das Salzbad eingebracht und die von den jeweiligen Elektroden erfassten Wellenformen mit Hilfe einer Datenerfassungsplattform aufgezeichnet wurden. HINWEIS: Die elektrochemische Impedanzspektroskopie ist nicht abgebildet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. In-vivo-Tests
HINWEIS: Das in vivo Testverfahren beschreibt unseren experimentellen Anwendungsfall. Es wird empfohlen, kundenspezifische epimysiale Elektroden in vivo so zu testen, dass sie den vom Benutzer beabsichtigten Versuchsbedingungen entsprechen.
- Überprüfen Sie die chirurgischen Informationen; Konsultieren Sie Informationen für Chirurgen, die den Prozess der Implantation chronischer neuronaler Aufzeichnungselektroden mit den folgenden Ressourcen erlernen 8,9.
HINWEIS: Da der Schwerpunkt unseres Manuskripts auf der Elektrodenherstellung und -prüfung liegt, geben wir hier nur einen kurzen Überblick über die chirurgischen Techniken, die in unserem Labor für die In-vivo-Elektrodenprüfung verwendet werden. - Wählen Sie eine Ratte aus, die instrumentiert werden soll (z. B. eine weibliche Long-Evans-Ratte im Alter von 16 Wochen). Lassen Sie die Ratte vor der Akklimatisierung auf dem Laufband eine 1-wöchige Laborakklimatisierung durchlaufen. Setzen Sie die Ratte nach und nach einem Nagetierlaufband mit zunehmender Geschwindigkeit von bis zu 16 m/min einem Nagetierlaufband aus.
- Bereiten Sie die EIB vor, indem Sie zunächst eine speziell angefertigte epimysiale Elektrode an der EIB anbringen, indem Sie jedes Elektrodenkabel an einen Kanal an der EIB anheften. Um die EIB zu erden, entblößen Sie ein Ende eines PFA-beschichteten Edelstahldrahtes und schweißen Sie ihn an eine ausgewählte Erdung (z. B. Edelstahlschraube). Stecken Sie anschließend das Erdungskabel in der dafür vorgesehenen "Masse"-Position an dieselbe EIB.
HINWEIS: Um die Elektrode während der Instrumentierung zu schützen, wickeln Sie sie mit einer Schutzhülle (z. B. Parafilm) ein. - Desinfizieren Sie alle chirurgischen Instrumente sowie das Operationsgebiet, bevor Sie beginnen. Verwenden Sie versiegeltes, aseptisches OP-Material und autoklavieren Sie alle chirurgischen Instrumente, die sich nicht in einer sterilen Verpackung befinden. Erstellen Sie ein steriles Operationsfeld mit einem OP-Tuch.
- Betäuben Sie das Tier mit einer Induktionskammer mit 3-5 % Isofluran und 1 l/min Sauerstoff und halten Sie es über einen Nasenkonus mit 2 % Isofluran und 500 ml Sauerstoff aufrecht, während Sie die Ratte vorbereiten. Nach Erreichen der chirurgischen Ebene der Anästhesie, die durch Zehenkneifen beurteilt wird, tragen Sie Augensalbe auf, überwachen Sie die Atemfrequenz (70-110 Atemzüge/min) und bestimmen Sie die Kerntemperatur mit einer Rektumsonde.
- Rasieren Sie anschließend die Operationsstelle mit einer Tierschermaschine und entfernen Sie Ablagerungen von der Operationsstelle. Sobald der Operationsbereich rasiert ist, desinfizieren Sie die Operationsstelle mit Chlorhexidin, Isopropylalkohol und Povidon-Jod, indem Sie von der Mitte nach außen des Operationsbereichs schrubben. Verabreichen Sie Analgetika nach Bedarf und Zulassung und stellen Sie Wärme bereit, um die Körperkerntemperatur (37,5-38,5 °C) zu halten. Positionieren Sie die Ratte nach der Vorbereitung in einem stereotaktischen Rahmen und richten Sie das sterile Feld ein.
- Für eine ordnungsgemäße chirurgische Vorbereitung des Chirurgen waschen Sie sich gründlich die Hände mit Seife und/oder einem Desinfektionsmittel (Chlorhexidin). Ziehen Sie die richtige PSA an: Maske, sterile Handschuhe und ein Einwegkittel/Peeling-Oberteil. Ziehen Sie neue sterile Handschuhe an, wenn die aseptische Technik aus irgendeinem Grund verletzt wird.
- Um den rechten VL zu instrumentieren, verwenden Sie ein Skalpell, um einen 3-5 cm langen Schnitt am anterolateralen Teil der rechten Hintergliedmaße zu machen, und verwenden Sie eine stumpfe Dissektion, um den VL-Muskel zu identifizieren.
- Machen Sie einen 1 cm langen Schnitt in der sagittalen Ebene entlang der koronalen Naht und legen Sie den Schädel frei. Machen Sie mit einer dünnen Pinzette einen subdermalen Tunnel von der rechten Hintergliedmaße zur Schädelbasis. Greifen Sie mit der Pinzette die Elektrode und führen Sie die Elektrode zum VL.
- Verwenden Sie einen Knochenbohrer, um ein Loch in den Schädeldach zu bohren (stellen Sie sicher, dass die Bohrerspezifikationen mit denen der Schraubfundamente übereinstimmen). Befestigen Sie die Schraube und befestigen Sie die EIB mit Zahnzement am Schädel.
HINWEIS: Kleine Mengen Wasserstoffperoxid können aufgetragen werden, um die Porosität des Schädels zu erhöhen und die Haftung des Zahnzementes zu verbessern. - Nachdem Sie den VL-Muskel identifiziert haben, implantieren Sie die individuell angefertigte epimysiale Elektrode, die in Linie mit den Muskelfasern mit 4-0 nicht resorbierbarem Monofilament implantiert wird. Verschließen Sie den Schnitt mit Wundklammern oder durch Nähen.
- Nehmen Sie das Tier nach dem Verschluss aus der Narkose und bringen Sie es einzeln in einem sauberen, trockenen Tierkäfig unter. Lassen Sie die Ratte sich auf einem beheizten Pad erholen und überwachen Sie die Temperatur und Atemfrequenz der Ratte alle 15 Minuten, bis das Tier gehfähig ist. Behandeln Sie postoperative Schmerzen, indem Sie in den Tagen nach der Instrumentierung ein zugelassenes Analgetikum verabreichen.
HINWEIS: Die Ratte muss einzeln untergebracht werden, bis sie sich vollständig erholt hat. - Führen Sie nach einem Zeitraum von 14 Tagen einen In-vivo-Elektrodentest durch, um die Gültigkeit der individuell angefertigten epimysialen Elektrode zur Erfassung physiologischer Veränderungen der Muskelaktivität zu beurteilen. Setzen Sie die instrumentierte Ratte auf ein Nagetierlaufband und setzen Sie sie nach dem Zufallsprinzip bergauf und bergab aus, die eine Zunahme oder Verringerung der VL-EMG-Signalübertragung hervorrufen (16° Steigung, 16° Abfall bei 16 Metern/Minute). Sammeln Sie Längsschnittdaten (z. B. 14 Tage und 56 Tage nach der Instrumentierung), um die Zuverlässigkeit im Laufe der Zeit zu gewährleisten.
HINWEIS: Es wurden 14- und 56-Tage-Untersuchungen ausgewählt, da ein Zeitraum von 14 Tagen eine vollständige chirurgische Genesung ermöglicht und der Zeitraum von 56 Tagen unseren experimentellen Zeitplan überschreitet. Wir ermutigen andere, die Leistung und Zuverlässigkeit der Elektroden anhand eines Zeitrahmens zu testen, der ihren experimentellen Zeitplan vor der Verwendung repliziert. Die Geschwindigkeit (16 m/min) und die Gehbedingungen (16° Steigung, 16° Gefälle) wurden so ausgewählt, dass sie den in diesem Modell festgelegten Bedingungen erhöhter und verringerter VL-Anregung entsprachen10. - Ändern Sie die Erfassungsparameter, um sie an die experimentellen Anforderungen anzupassen. Erfassen Sie EMG-Signale während des Gehens mit einer Rate von 2.000 Hz mithilfe der Datenerfassungsplattform und synchronisieren Sie sie mit einem Motion-Capture-System.
HINWEIS: Wenn Sie ein anderes Erfassungsgerät verwenden, erfassen Sie EMG und Bewegungserfassung gemäß den Anweisungen des Herstellers und um experimentelle Anforderungen zu erfüllen. - Extrahieren Sie 25 s Gangdaten aus jeder Gehbedingung und exportieren Sie sie zur weiteren Signalverarbeitung und -analyse in ein benutzerdefiniertes Python-Skript. Anpassen der Grundlinie (Null), Entzerren und Glätten mit einem Algorithmus für das mittlere Quadrat mit einer Bin-Breite von 50 ms. Wenden Sie einen Peak-Detection-Algorithmus an, um RMS-EMG-Peaks auszuwählen, die für nachfolgende Datenanalysen verwendet werden sollen.
HINWEIS: Wir haben die Methoden zur Vorverarbeitung und Analyse von EMG-Daten kurz beschrieben, da dieser Schritt aufgrund von Programmiersprachen und EMG-Erfassungssoftware und -hardware stark variiert. Wir empfehlen den Autoren, die folgenden Ressourcen zu konsultieren, um zusätzliche Informationen zu erhalten: 3,11,12,13.
4. Prüfung der Biokompatibilität
- Nach Beendigung der longitudinalen EMG-Entnahmen (oder zu einem ausgewählten Zeitpunkt) euthanasieren Sie die Ratte mit geeigneten und zugelassenen Methoden (z. B. Erstickung mit CO2 gefolgt von einer bilateralen Thorakotomie).
- Nach der Euthanasie wird die beidseitige VL-Muskulatur entnommen, indem ein Schnitt an den anterolateralen rechten und linken Hintergliedmaßen angelegt wird. In flüssigem Stickstoff schockgefrieren und bei -80 °C lagern.
HINWEIS: Achten Sie darauf, dass die Elektrode während der Extraktion auf dem instrumentierten Muskel (z. B. dem rechten VL) in Position bleibt. Alternativ können Sie den Sub-Elektroden-Bereich markieren oder nur den Muskel aus dem Sub-Elektroden-Bereich extrahieren. Dies gilt nicht für den kontralateralen/Kontrollmuskel. - Mit einem Kryostaten schneiden Sie serielle Muskelquerschnitte (7 μm) aus dem Bereich direkt unter der Elektroden-Faszien-Grenzfläche. Schneiden Sie Abschnitte aus dem Muskelbauch des kontralateralen VL ab, um als Kontrolle zu dienen. Siehe Kumar et al. für Details zur Kryosektion14.
- Färbung mit Hämatoxylin & Eosin (H&E); siehe Wang et al. für Details zur H&E-Färbung an Skelettmuskelquerschnitten15.
- Untersuchen Sie die gefärbten Schnitte (instrumentiert und kontrolliert) mit einem Lichtmikroskop bei 20-facher Vergrößerung. Analysieren Sie histologische Veränderungen ohne Rücksicht auf die Herkunft der Proben. Beurteilen Sie die Gesundheit des Gewebes anhand der folgenden pathologischen Merkmale: Infiltration von Immunzellen, interne myonukleäre Akkumulation, Fibrogenese und Sarkolemma-Fragmentierung.
5. Vorgeschlagene statistische Analysen
- Um die Leistung der kundenspezifischen Epimyisalelektrode im Vergleich zum Industriestandard zu bewerten, importieren Sie die ex vivo-Daten in ein ausgewähltes Statistikpaket. Wenden Sie die folgenden statistischen Tests auf die Ex-vivo-Daten an, die von den kundenspezifischen und branchenüblichen Elektroden gesammelt wurden (z. B. 8.000 repräsentative Proben aus den Sinus-, Dreieck- und Rechteckwellenformen). Setzen Sie das Alpha-Level a priori auf p ≤ 0,05.
- Um den Grad der Signalübereinstimmung zwischen Elektroden zu testen, verwenden Sie Intraklassenkorrelationen (ICCs) und Bland-Altman-Diagramme. Berechnen Sie ICC-Schätzungen und ihre 95%-Konfidenzintervalle basierend auf einem Modell mit einfacher Bewertung (k = 2), absoluter Übereinstimmung und 2-Wege-Zufallseffekten.
- Um das Ausmaß zu testen, in dem die Aufzeichnung der Wellenformen im Laufe der Zeit kovariierte, auch bekannt als zeitliche Synchronie, führen Sie eine Pearson-Korrelation mit Werten durch, die mit den speziell angefertigten und branchenüblichen Elektroden erfasst wurden.
- Vergleichen Sie die mittlere Elektrodenimpedanz für beide Kontaktflächen (gemessen bei 1 kHz) von ausgewählten kundenspezifischen Elektroden (z. B. 10 Elektroden) mit der Impedanz der Industriestandardelektrode.
HINWEIS: Die Impedanzwerte der Elektrode variieren je nach Anwendungsfall und Materialien, die bei der Elektrodenherstellung verwendet werden.
- Um die Qualität der In-vivo-Aufzeichnungen zu beurteilen, importieren Sie die beim Gehen auf dem Laufband gesammelten Daten in ein ausgewähltes Statistikpaket.
- Um die Validität der maßgefertigten Elektrode während eines In-vivo-Tests zu beurteilen (bei denen der Gang der Ratte durch Bergauf- und Bergabgehen gestört wurde, um physiologische Veränderungen der Muskelaktivität zu induzieren), führen Sie den Welch-t-Test durch, um die mittleren Spitzenwerte für Bergauf- und Bergab-Gehbedingungen zu vergleichen.
HINWEIS: Den Lesern wird empfohlen, zusätzliche Tests und Analysen durchzuführen (z. B. Bewertungen des Signal-Rausch-Verhältnisses (SNR); siehe Delysys Fundamental Concepts in EMG Signal Acquisition), die hier der Kürzehalber nicht vorgestellt werden 16. - Um die Zuverlässigkeit der Signalübertragung der Elektrode im Laufe der Zeit zu beurteilen, werten Sie die Längsschnittdaten aus, die unter gleichbleibenden Bedingungen (ebenes Gehen bei 16 m/min in Intervallen von 14 und 56 Tage nach der Implantation) über gepaarte t-Tests gesammelt wurden.
- Um die Validität der maßgefertigten Elektrode während eines In-vivo-Tests zu beurteilen (bei denen der Gang der Ratte durch Bergauf- und Bergabgehen gestört wurde, um physiologische Veränderungen der Muskelaktivität zu induzieren), führen Sie den Welch-t-Test durch, um die mittleren Spitzenwerte für Bergauf- und Bergab-Gehbedingungen zu vergleichen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Ex-vivo-Leistung
Die ICCs zeigten eine hohe Übereinstimmung zwischen den kundenspezifischen und den Industriestandard-Elektroden über alle Wellenformen hinweg (Sinus [ICC = 0,993], Quadrat [ICC = 0,995], Dreieck [ICC = 0,958]; p < .001). Bland-Altman-Diagramme zeigten auch ein hohes Maß an Signalübereinstimmung zwischen den Elektroden. Bland-Altman-Diagramme und Pearson-Korrelationen sind in Abbildung 3 zusammengefasst, mit s...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Unser Ziel war es, den EMG-Herstellungsprozess zu rationalisieren, eine breitere Akzeptanz und Implementierung von epimysialen Elektrodendesigns zu ermöglichen, um so die Zugänglichkeit zu fördern und die neuromuskuläre Forschung voranzutreiben. Zu diesem Zweck stellen wir einen benutzerfreundlichen Leitfaden für die Beschaffung, Herstellung und Prüfung kostengünstiger Epimysialelektroden im eigenen Haus vor. In der Hoffnung, andere Forschungsgruppen unterstützen zu können, stel...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder persönlichen Beziehungen bekannt sind, die die in diesem Artikel berichtete Arbeit beeinflusst haben könnten.
Danksagungen
Diese Arbeit wurde vom National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant R01AR081235 (an L. K. Lepley) unterstützt. Die Autoren danken den folgenden Personen für ihren Beitrag zur Herstellung und Prüfung unserer biokompatiblen Elektrode: Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian und Ross Brancati.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Referenzen
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten