Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de un electrodo de electromiografía epimisial de bajo costo: un flujo de trabajo simplificado para la fabricación y las pruebas
* Estos autores han contribuido por igual
En este artículo
Resumen
Nuestro propósito era proporcionar una guía actualizada y fácil de seguir sobre la fabricación y las pruebas de electrodos de electromiografía epimisial. Con ese fin, proporcionamos instrucciones para el abastecimiento de materiales y un recorrido detallado del proceso de fabricación y prueba.
Resumen
La electromiografía (EMG) es una valiosa herramienta diagnóstica para detectar anomalías neuromusculares. Los electrodos epimisiales implantables se utilizan habitualmente para medir las señales de EMG en modelos preclínicos. Aunque existen recursos clásicos que describen los principios de la fabricación de electrodos epimisiales, existe una escasez de información ilustrativa que traslada la teoría de los electrodos a la práctica. Para remediar esto, proporcionamos una guía actualizada y fácil de seguir sobre cómo fabricar y probar un electrodo epimisial de bajo costo.
Los electrodos se fabricaron doblando e insertando dos láminas de platino-iridio en una base de silicona precortada para formar las superficies de contacto. A continuación, se soldaron alambres de acero inoxidable recubiertos a cada superficie de contacto para formar los cables de los electrodos. Por último, se utilizó una mezcla de silicona para sellar el electrodo. Se realizaron pruebas ex vivo para comparar nuestro electrodo fabricado a medida con un electrodo estándar de la industria en un baño salino, donde se encontraron altos niveles de concordancia de señal (seno [correlación intraclase - ICC= 0,993], cuadrado [ICC = 0,995], triángulo [ICC = 0,958]) y sincronía temporal (seno [r = 0,987], cuadrado [r = 0,990], triángulo [r = 0,931]) en todas las formas de onda. También se cuantificaron niveles bajos de impedancia del electrodo mediante espectroscopia de impedancia electroquímica.
También se llevó a cabo una evaluación del rendimiento in vivo en la que el músculo vasto lateral de una rata se instrumentó quirúrgicamente con el electrodo fabricado a medida y se adquirió la señalización durante la marcha cuesta arriba y cuesta abajo. Como se esperaba, la actividad máxima de EMG fue significativamente menor durante la caminata cuesta abajo (0,008 ± 0,005 mV) que cuesta arriba (0,031 ± 0,180 mV, p = 0,005), lo que respalda la validez del dispositivo. La fiabilidad y biocompatibilidad del dispositivo también fueron respaldadas por la señalización consistente durante la marcha nivelada a los 14 días y 56 días después de la implantación (0,01 ± 0,007 mV, 0,012 ± 0,007 mV respectivamente; p > 0,05) y la ausencia de inflamación histológica. En conjunto, proporcionamos un flujo de trabajo actualizado para la fabricación y prueba de electrodos epimisiales de bajo costo.
Introducción
La electromiografía (EMG) es una herramienta poderosa para estudiar la actividad eléctrica del músculo. Los registros EMG pueden ser especialmente útiles en modelos animales preclínicos para evaluar la efectividad de las intervenciones para tratar la disfunción neuromuscular. En estos modelos, los electrodos biocompatibles implantables se utilizan comúnmente para evaluar la interfaz neurofisiológica entre las neuronas motoras y las fibras musculares. Estos electrodos implantables pueden proporcionar mediciones localizadas de la excitación muscular y pueden ser diversos en términos de su configuración, forma y material, con el diseño óptimo dictado en última instancia por la ubicación y el uso previsto.
A pesar de su idoneidad para evaluar la excitación muscular en modelos preclínicos, el uso de electrodos epimisiales puede estar limitado por el costo. Como resultado, muchos investigadores utilizan electrodos epimisiales fabricados a medida que se producen internamente. Aunque existen recursos que detallan las consideraciones fundamentales de la fabricación, las pruebas y el uso de electrodos 1,2, existe la necesidad de una guía instructiva actualizada que detalle el abastecimiento, la fabricación y la validación de los electrodos epimisiales utilizando métodos modernos. Informados por los trabajos fundacionales de Loeb y Gans3 y otros en la teoría de electrodos, presentamos instrucciones modernas sobre el abastecimiento y la fabricación de electrodos epimisiales de bajo costo y probamos su rendimiento en una serie de experimentos ex vivo e in vivo. El objetivo es ofrecer una guía fácil de usar para que otros miembros de la comunidad científica obtengan, fabriquen y prueben electrodos epimisiales de bajo costo para uso animal, lo que permite una cuantificación más amplia de la excitación muscular en modelos preclínicos.
En este protocolo, proporcionamos una guía instructiva para el abastecimiento, la fabricación y las pruebas de electrodos epimisiales para uso animal en el laboratorio de electrofisiología moderno. Los parámetros del electrodo elegidos para la fabricación, como la forma, las dimensiones, el área de superficie de contacto, la distancia entre electrodos, la longitud del cable, etc., se seleccionaron para satisfacer nuestras necesidades experimentales y eran comparables a un electrodo epimisial estándar de la industria disponible comercialmente (consulte la Tabla de materiales). Alentamos a otros grupos a modificar estos parámetros para adaptarlos a sus necesidades, además de seleccionar un electrodo estándar de la industria confiable que coincida con su caso de uso.
En un esfuerzo por dar a los lectores una idea relativamente rápida del rendimiento del electrodo, también proporcionamos un ejemplo de un protocolo de prueba ex vivo con la opción de medir la impedancia del electrodo. Además, damos un ejemplo de evaluación del rendimiento de los electrodos in vivo. El experimento ex vivo comparó el electrodo fabricado a medida con un estándar de la industria en un baño salino para imitar condiciones fisiológicas estables. La impedancia también se evaluó ex vivo mediante espectroscopia de impedancia electroquímica (EIS). El experimento in vivo consistió en la implantación quirúrgica del electrodo fabricado a medida en el músculo vasto lateral (VL) de una rata Long Evans hembra de 16 semanas de edad (HsdBlu: LE, Envigo) para medir la señal EMG en condiciones conocidas por provocar una señal alta o baja (cuesta arriba, cuesta abajo, caminando cuesta abajo). Para evaluar la fiabilidad del electrodo fabricado a medida, la señalización EMG se adquirió durante la caminata nivelada después de la recuperación quirúrgica completa y antes del sacrificio (14 días y 56 días después de la implantación, respectivamente). Se llevó a cabo una tinción de hematoxilina-eosina (H&E) en el músculo instrumentado para evaluar la biocompatibilidad del electrodo fabricado a medida.
Protocolo
El procedimiento in vivo se llevó a cabo bajo la aprobación del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Michigan (#PRO00010765 de aprobación de IACUC) y de acuerdo con las directrices de los Institutos Nacionales de Salud sobre el cuidado y uso de animales de laboratorio.
1. Abastecimiento y fabricación de electrodos
NOTA: La Figura 1 proporciona un resumen de alto nivel de todos los pasos clave de fabricación con un enlace QR que proporciona instrucciones visuales adicionales.
- Obtenga materiales de electrodos biocompatibles directamente del fabricante a granel para su fabricación. Consulte la Tabla de materiales, que contiene todos los componentes del electrodo y detalles sobre el abastecimiento.
NOTA: Asegúrese de que la base de silicona, el sellador de silicona y las láminas de contacto de platino-iridio sean biocompatibles para evitar una respuesta inmunitaria adversa y permitir la implantación crónica. Para respaldar las ventajas económicas de la fabricación interna, presentamos un análisis detallado de costos del electrodo epimisial fabricado a medida en comparación con el estándar de la industria (Tabla de materiales). - Prepare la plantilla de corte y plegado (archivo complementario 1, archivo complementario 2). Utilice el software de impresión 3D seleccionado para diseñar plantillas de corte y plegado para la producción en serie de electrodos epimisiales idénticos.
- Diseñe la plantilla de corte para garantizar perforaciones de tamaño y espaciado uniformes de la base de silicona para un área de superficie de contacto y una distancia entre electrodos iguales en todos los electrodos.
- Cree la plantilla plegable para plegar las superficies de contacto de platino-iridio y simplificar la colocación de las láminas en la base de silicona.
NOTA: Se proporcionan archivos Gcode; Modifique las dimensiones y especificaciones de la plantilla de corte y plegado para adaptarla a las necesidades experimentales.
- Perfora la base de silicona. Coloque la base de silicona en la plantilla de corte y péguela con cinta adhesiva. Perfore la silicona con las guías de la plantilla de corte con un cuchillo X-acto para colocar las láminas de contacto.
- Inserte las láminas en la base de silicona para formar las superficies de contacto. Doble las láminas de contacto de platino-iridio precortadas biocompatibles (1,25 mm x 5 mm) en forma de U con la plantilla plegable. A continuación, guíe los brazos de las láminas dobladas hacia las ranuras perforadas de la base de silicona para construir las superficies de contacto del electrodo. De esta manera, inserte las 12 láminas en la base de silicona; Deje una sola columna abierta entre los electrodos para garantizar un espaciado adecuado.
NOTA: Esta configuración permitirá la fabricación de 6 electrodos epimisiales bipolares; La edición de la plantilla de corte puede ampliar la capacidad si es necesario. - Retire la base de silicona de la plantilla de corte. Coloque un trozo de cinta quirúrgica sobre las superficies de contacto para mantener las láminas en su lugar. A continuación, retire la base de silicona de la plantilla de corte, déle la vuelta para que los brazos de la lámina en forma de U queden expuestos y doble un brazo de la lámina en forma de U al ras de la base de silicona.
- Conecte los cables de los electrodos. Prepare un alambre de acero inoxidable recubierto de perfluoroalcoxi (PFA) cortándolo a la longitud deseada. A continuación, desnude un extremo del alambre de acero inoxidable ~ 1 cm con un encendedor disponible en el mercado. Coloque el extremo desnudado del alambre de acero inoxidable en el interior del brazo desplegado de la lámina. Suelde el alambre de acero inoxidable al brazo de la lámina con una soldadora Micro TIG (ancho de pulso = 0, energía de soldadura = 25).
- Inspeccione la interfaz de plomo-lámina. Pruebe la conexión de alambre aplicando tensión al alambre de acero inoxidable. Si la conexión se mantiene, doble el brazo de la lámina hacia abajo al ras de la base de silicona y retire la cinta que bordea la lámina de silicona.
NOTA: Aplique una tensión que sea representativa de la tensión aplicada en el caso de uso especificado. - Selle el electrodo. Para lograr una consistencia más fina, mezcle 1 g de silicona líquida biocompatible con 0,75 mL de tolueno. Extraiga la mezcla con una jeringa de punta roma de 18 G y aplíquela en el lado soldado de cada electrodo para sellar la parte posterior de los electrodos.
PRECAUCIÓN: El tolueno es inflamable, puede ser mortal si se ingiere o entra en las vías respiratorias y causa irritación de la piel. Trabaje debajo de la campana extractora y manténgalo alejado de llamas abiertas. - Separe el lote en electrodos individuales. Deje que el tolueno de silicona se asiente durante 72 h antes de manipular el electrodo. A continuación, utilice unas tijeras para cortar la base de silicona en electrodos individuales con un tamaño de 10 x 5 mm.
NOTA: El tamaño del electrodo dependerá de las dimensiones de la plantilla de corte y del caso de uso específico. Autoclave y/o electrodos limpios en un baño ultrasónico.
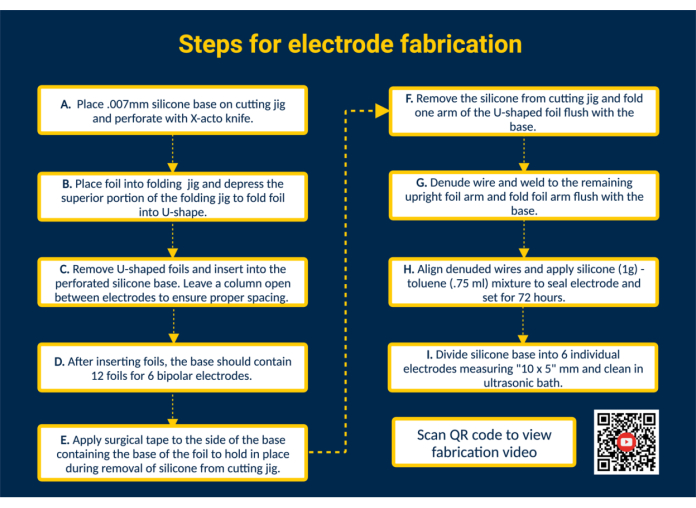
Figura 1. Pasos para la fabricación de electrodos. (A) Base de silicona perforada. (B) Forme láminas en forma de U con la plantilla plegable. (C) Inserte láminas en forma de U en la base de silicona perforada. (D) La base de silicona contiene 12 láminas para formar 6 electrodos bipolares. (E) Aplique cinta quirúrgica a la base para asegurar las láminas durante la extracción de la plantilla de corte. (F) Retire la base de silicona de la plantilla de corte. (G) Denude el alambre de acero inoxidable recubierto de PFA y suelde al brazo de lámina vertical con un soldador Micro TIG. (H) Alinee los alambres denudados, aplique sellador de silicona-tolueno y deje que se asiente. (I) Divida la base de silicona en electrodos individuales y límpiela en un baño ultrasónico. Haga clic aquí para ver una versión más grande de esta figura.
2. Ensayos ex vivo
- Conecte los electrodos a un dispositivo de registro. Fije cada cable conductor de electrodo a un canal en una placa de interfaz de electrodo (EIB). Repita este paso (usando el mismo EIB) para un electrodo estándar de la industria seleccionado para comparar. Conecte el EIB a una plataforma de adquisición de datos a través de un sistema de cable magnético anclado.
NOTA: El electrodo estándar de la industria puede ser cualquier electrodo que se considere confiable y que se adapte a las necesidades experimentales. - Poner a tierra el BEI. Desnudo un extremo de un acero inoxidable recubierto de PFA y suelde por puntos a una fuente de conexión a tierra (por ejemplo, un tornillo de acero inoxidable). Fije el cable conductor de tierra a la misma placa de interfaz de electrodo en la posición designada como "tierra".
- Prepara el baño de solución salina. Llene un vaso de precipitados (250 ml) con 180 ml de solución salina fisiológica (solución salina estéril al 0,9%)4. Sumerja los electrodos epimisiales fabricados a medida y estándar de la industria en el baño salino y asegúrelos en una posición estable. A continuación, sumerja la fuente de conexión a tierra en el baño de solución salina y asegure su posición. Por último, sumerja y coloque dos electrodos de aguja estimulante en el baño salino y conecte los electrodos estimulantes al generador de señales.
- Utilice un generador de señales para evaluar la concordancia de la señal y la sincronía temporal. Utilice un generador de señales para entregar formas de onda repetidas a un voltaje y frecuencia seleccionados (0,1 V y 5 Hz) en el baño salino a través de los electrodos estimulantes (Figura 2). Entregue varias formas de onda (sinusoidal, cuadrada y triangular) para comparar las señales registradas entre el electrodo epimisial fabricado a medida en relación con el estándar de la industria.
- Evalúe el rendimiento de manera informal y visual en tiempo real para evaluar el grado en que varían las señales entre electrodos. Realice correlaciones intraclase (ICC) y correlaciones de Pearson para evaluar la concordancia de la señal y la sincronía temporal, respectivamente.
NOTA: Para los fines de nuestro análisis, se adquirieron 8.000 muestras a 4.000 Hz y se filtraron en tiempo real con un filtro Butterworth de paso alto y bajo (paso alto = 75 Hz; paso bajo = 2 kHz). - Mida la impedancia del electrodo. Para medir la impedancia del electrodo, recopile EIS en los electrodos fabricados a medida (por ejemplo, 10 electrodos) en frecuencias de 10 Hz-31 kHz5 con un potenciostato utilizando el procedimiento descrito a continuación por Richie et al.6. Consulte Sarolic et al. para obtener información adicional sobre la medición de la impedancia del electrodo en electrodos bipolares7.
- Siguiendo el procedimiento de Richie et al., sumerja el electrodo epimisial 1 mm en 1x solución salina tamponada con fosfato (PBS). Utilice un cloruro de plata-plata (Ag|AgCl) y una varilla de acero inoxidable como contraelectrodo para completar el circuito.
- Suspender el Ag|Electrodo de referencia AgCl y la varilla de acero inoxidable en el 1x PBS mediante una pinza de precipitado. Conecte el electrodo de referencia a la referencia del sistema de impedancia que se está utilizando y conéctelo a la entrada del contraelectrodo del sistema de impedancia que se está utilizando.
- Utilice un potenciostato para ejecutar un escaneo de impedancia de 1 kHz. Ajustado a una frecuencia de escaneo de 1 kHz a 0,01 Vrms en una sola forma de onda sinusoidal. Durante los primeros 5 segundos de la exploración, ajuste el potenciostato a 0 V para estabilizar la señal grabada. Utilice el software asociado al potenciostato para registrar las mediciones.
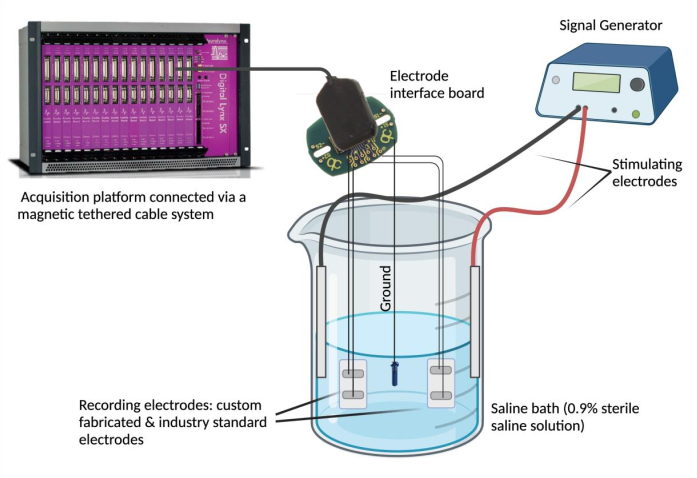
Figura 2: Prueba ex vivo: baño de solución salina que contiene el electrodo fabricado a medida, electrodos estándar de la industria, dos electrodos estimulantes y una fuente de tierra. La concordancia de la señal y la sincronía temporal se evaluaron mediante la entrega de ondas sinusoidales, cuadradas y triangulares al baño salino desde el generador de señales y el registro de las formas de onda detectadas por los respectivos electrodos utilizando una plataforma de adquisición de datos. NOTA: La espectroscopia de impedancia electroquímica no se muestra en la imagen. Haga clic aquí para ver una versión más grande de esta figura.
3. Ensayos in vivo
NOTA: El procedimiento de prueba in vivo describe nuestro caso de uso experimental. Se recomienda que los electrodos epimisiales fabricados a medida se prueben in vivo de una manera que coincida con las condiciones experimentales previstas por el usuario.
- Revisar la información quirúrgica; Consulte información para cirujanos que están aprendiendo el proceso de implantación de electrodos de registro neural crónico utilizando los siguientes recursos 8,9.
NOTA: Dado que nuestro manuscrito se centra en la fabricación y las pruebas de electrodos, aquí solo proporcionamos una breve descripción de las técnicas quirúrgicas utilizadas en nuestro laboratorio para las pruebas de electrodos in vivo . - Seleccione una rata para instrumentarla (por ejemplo, una rata Long Evans hembra a las 16 semanas de edad). Haga que la rata se someta a un período de 1 semana de aclimatación en el laboratorio antes de la aclimatación en la cinta de correr. Después de la aclimatación en el laboratorio, exponga gradualmente a la rata a una cinta de correr para roedores a velocidades crecientes de hasta 16 m/min.
- Prepare el BEI conectando primero un electrodo epimisial fabricado a medida al BEI fijando cada cable de electrodo a un canal en el BEI. Para conectar a tierra el EIB, desnude un extremo de un alambre de acero inoxidable recubierto de PFA y suelde por puntos a una conexión a tierra seleccionada (por ejemplo, tornillo de acero inoxidable). A continuación, fije el cable conductor de tierra al mismo EIB en la posición designada como "tierra".
NOTA: Para proteger el electrodo durante la instrumentación, envuélvalo con una cubierta protectora (por ejemplo, parafilm). - Desinfecte todas las herramientas quirúrgicas, así como el área quirúrgica antes de comenzar. Utilice suministros quirúrgicos sellados y asépticos y autoclave todos los instrumentos quirúrgicos que no estén en envases estériles. Cree un campo quirúrgico estéril con un paño quirúrgico.
- Anestesiar al animal mediante una cámara de inducción con 3-5% de isoflurano y 1 L/min de oxígeno y mantener a través de un cono nasal con 2% de isoflurano y 500 mL de oxígeno mientras se prepara a la rata. Después de alcanzar el plano quirúrgico de la anestesia, se evaluó mediante un pellizco en los dedos de los pies, se aplique ungüento para los ojos, se controle la frecuencia respiratoria (70-110 respiraciones/min) y se evalúe la temperatura central con una sonda rectal.
- A continuación, afeite el sitio quirúrgico con tijeras para animales y elimine los desechos del sitio quirúrgico. Una vez afeitada la zona quirúrgica, desinfecte el sitio quirúrgico con clorhexidina, alcohol isopropílico y povidona yodada frotando desde el centro hasta el exterior de la zona quirúrgica. Administrar analgésicos según corresponda y estar aprobado y proporcionar calor para mantener la temperatura corporal central (37,5-38,5 °C). Después de la preparación, coloque a la rata en un marco estereotáctico y establezca el campo estéril.
- Para una adecuada preparación quirúrgica del cirujano, lávese bien las manos con jabón y/o un desinfectante (clorhexidina). Use el EPP adecuado: mascarilla, guantes estériles y una bata/blusa desechable. Use guantes estériles nuevos si se viola la técnica aséptica por cualquier motivo.
- Para instrumentar la VL derecha, use un bisturí para hacer una incisión de 3-5 cm en la porción anterolateral de la extremidad posterior derecha y use una disección roma para identificar el músculo VL.
- Realice una incisión de 1 cm en el plano sagital a lo largo de la sutura coronal y exponga el cráneo. Con un par de pinzas delgadas, haz un túnel subdérmico desde la extremidad posterior derecha hasta la base del cráneo. Use las pinzas para agarrar el electrodo y dirigirlo al VL.
- Use un taladro para huesos para crear un agujero en la calvaria (asegúrese de que las especificaciones del taladro coincidan con las del tornillo de tierra). Asegure el tornillo de tierra y fije el EIB al cráneo con cemento dental.
NOTA: Se pueden aplicar pequeñas cantidades de peróxido de hidrógeno para aumentar la porosidad del cráneo y mejorar la adherencia del cemento dental. - Una vez identificado el músculo VL, implante el electrodo epimisial fabricado a medida implantado en línea con las fibras musculares utilizando un monofilamento no absorbible 4-0. Cierre la incisión con pinzas para heridas o suturando.
- Después del cierre, retire al animal de la anestesia y colóquelo individualmente en una jaula limpia y seca. Permita que la rata se recupere en una almohadilla térmica y controle la temperatura y la frecuencia respiratoria de la rata cada 15 minutos hasta que el animal esté ambulatorio. Tratar el dolor postquirúrgico mediante la administración de un analgésico aprobado en los días posteriores a la instrumentación.
NOTA: la rata debe ser alojada individualmente hasta que se recupere por completo. - Después de un período de 14 días, realice una prueba de electrodos in vivo para evaluar la validez del electrodo epimisial fabricado a medida para capturar las alteraciones fisiológicas en la actividad muscular. Coloque a la rata instrumentada en una cinta de correr para roedores y expóngala aleatoriamente a condiciones de caminata cuesta arriba y cuesta abajo que provoquen un aumento o disminución en la señalización de VL EMG (16° de inclinación, 16° de descenso a 16 metros/minuto). Recopile datos longitudinales (por ejemplo, 14 días y 56 días después de la instrumentación) para garantizar la fiabilidad a lo largo del tiempo.
NOTA: Se han seleccionado evaluaciones de 14 y 56 días ya que un período de 14 días permite una recuperación quirúrgica completa y el de 56 días supera nuestro cronograma experimental. Alentamos a otros a probar el rendimiento y la confiabilidad de los electrodos utilizando un marco de tiempo que replique su línea de tiempo experimental antes de su uso. La velocidad (16 m/min) y las condiciones de marcha (16° de inclinación, 16° de descenso) se seleccionaron para que coincidieran con las condiciones establecidas de aumento y disminución de la excitación de VL en este modelo10. - Modificar los parámetros de adquisición para adaptarlos a las necesidades experimentales. Capture la señalización EMG durante la marcha a una velocidad de 2.000 Hz utilizando la plataforma de adquisición de datos y sincronícela con un sistema de captura de movimiento.
NOTA: Si utiliza un dispositivo de adquisición diferente, recoja EMG y captura de movimiento de acuerdo con las instrucciones del fabricante y para satisfacer las necesidades experimentales. - Extraiga 25 s de datos de marcha de cada condición de marcha y expórtelos a un script de Python personalizado para su posterior procesamiento y análisis de señales. Ajuste de línea de base (cero), rectifique y suavize mediante un algoritmo de cuadrático medio con un ancho de intervalo de 50 ms. Aplique un algoritmo de detección de picos para seleccionar picos RMS-EMG y utilizarlos para análisis de datos posteriores.
NOTA: Hemos descrito brevemente los métodos para preprocesar y analizar los datos de EMG, ya que este paso varía mucho debido a los lenguajes de programación y al software y hardware de adquisición de EMG. Recomendamos a los autores que consulten los siguientes recursos para obtener información adicional: 3,11,12,13.
4. Pruebas de biocompatibilidad
- Una vez finalizadas las recolecciones longitudinales de EMG (o en un momento seleccionado), se sacrificará a la rata utilizando métodos apropiados y aprobados (p. ej., asfixia con CO2 seguida de toracotomía bilateral).
- Después de la eutanasia, extraiga los músculos VL bilaterales creando una incisión en las extremidades posteriores anterolateral derecha e izquierda. Congele rápidamente en nitrógeno líquido y almacene a -80 °C.
NOTA: Tenga cuidado de mantener el electrodo en posición en el músculo instrumentado (por ejemplo, el VL derecho) durante la extracción. Alternativamente, marque la región del subelectrodo o extraiga solo el músculo de la región del subelectrodo. Esto no se aplica al músculo contralateral/de control. - Utilice un criostato para cortar secciones transversales de músculo en serie (7 μm) de la región directamente debajo de la interfaz electrodo-fascial. Corte secciones del vientre muscular de la VL contralateral para que sirvan como control. Ver Kumar et al. para más detalles sobre la criosección14.
- Tinción con hematoxilina y eosina (H&E); véase Wang et al. para más detalles sobre la tinción de H&E en secciones transversales del músculo esquelético15.
- Examine las secciones teñidas (instrumentadas y de control) con un microscopio óptico con un aumento de 20x. Analizar los cambios histológicos ciegos al origen de las muestras. Evaluar la salud de los tejidos evaluada utilizando las siguientes características patológicas: infiltración de células inmunitarias, acumulación mionuclear interna, fibrogénesis y fragmentación del sarcolema.
5. Análisis estadísticos sugeridos
- Para evaluar el rendimiento del electrodo epimyisal fabricado a medida en comparación con el estándar de la industria, importe los datos ex vivo a un paquete estadístico seleccionado. Aplique las siguientes pruebas estadísticas a los datos ex vivo recopilados de los electrodos fabricados a medida y estándar de la industria (por ejemplo, 8,000 muestras representativas de las formas de onda sinusoidal, triangular y cuadrada). Establezca el nivel de alfa a priori en p ≤ 0.05.
- Para probar el nivel de concordancia de la señal entre los electrodos, utilice correlaciones intraclase (ICC) y gráficos de Bland-Altman. Calcule las estimaciones de la ICC y sus intervalos de confianza del 95% sobre la base de un modelo de efectos aleatorios de una sola calificación (k = 2), de acuerdo absoluto y de 2 vías.
- Para probar el grado en que el registro de las formas de onda covarió a lo largo del tiempo, también conocido como sincronía temporal, realice la correlación de Pearson en los valores recopilados con los electrodos fabricados a medida y estándar de la industria.
- Compare la impedancia media del electrodo para ambas superficies de contacto (medida a 1 kHz) de electrodos seleccionados fabricados a medida (por ejemplo, 10 electrodos) con la impedancia del electrodo estándar de la industria.
NOTA: Los valores de impedancia del electrodo variarán según el caso de uso y los materiales utilizados durante la fabricación del electrodo.
- Para evaluar la calidad de los registros in vivo , importe los datos recopilados durante la caminata en cinta a un paquete estadístico seleccionado.
- Para evaluar la validez del electrodo fabricado a medida durante las pruebas in vivo (en las que se perturbó la marcha de la rata al caminar cuesta arriba y cuesta abajo para inducir alteraciones fisiológicas en la actividad muscular), se realizó la prueba t de Welch para comparar los valores máximos medios para las condiciones de marcha cuesta arriba y cuesta abajo.
NOTA: Se recomienda a los lectores que realicen pruebas y análisis adicionales (por ejemplo, evaluaciones de la relación señal-ruido (SNR); consulte Delysys Fundamental Concepts in EMG Signal Acquisition) que no se presentan aquí por brevedad16. - Para evaluar la fiabilidad de la señalización del electrodo a lo largo del tiempo, evalúe los datos longitudinales recopilados en condiciones consistentes (caminata a nivel a 16 m/min a intervalos de 14 y 56 días después de la implantación) mediante pruebas t pareadas.
- Para evaluar la validez del electrodo fabricado a medida durante las pruebas in vivo (en las que se perturbó la marcha de la rata al caminar cuesta arriba y cuesta abajo para inducir alteraciones fisiológicas en la actividad muscular), se realizó la prueba t de Welch para comparar los valores máximos medios para las condiciones de marcha cuesta arriba y cuesta abajo.
Resultados
Rendimiento ex vivo
Los ICC revelaron altos niveles de concordancia entre los electrodos fabricados a medida y los estándar de la industria en todas las formas de onda (seno [ICC = 0,993], cuadrado [ICC = 0,995], triángulo [ICC = 0,958]; p < 0,001). Los diagramas de Bland-Altman también revelaron un alto grado de concordancia de señal entre los electrodos. Los diagramas de Altman insípidos y las correlaciones de Pearson se resumen en la
Discusión
Nuestro objetivo era agilizar el proceso de fabricación de EMG, permitiendo una adopción e implementación más amplias de los diseños de electrodos epimisiales, promoviendo así la accesibilidad y avanzando en la investigación neuromuscular. Con este fin, presentamos una guía fácil de usar para obtener, fabricar y probar electrodos epimisiales de bajo costo internamente. Con la esperanza de apoyar a otros grupos de investigación, también proporcionamos plantillas de impresión 3...
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contrapuestas que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel Grant R01AR081235 (a L. K. Lepley). Los autores agradecen a las siguientes personas por su contribución a la fabricación y prueba de nuestro electrodo biocompatible: Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian y Ross Brancati.
Materiales
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Referencias
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), 794-799 (2014).
- Loeb, G. E., Gans, C. . Electromyography for Experimentalists. , (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009 (2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099 (2021).
- Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. Impedance measurement of bipolar stimulation electrodes immersed in medium. , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586 (2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345 (2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793 (2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279 (2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010 (2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. . Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694 (2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Koch, K. P., Leinenbach, C., Stieglitz, T. Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33 (2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados