需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用肺动脉束带法的右侧心脏重塑和心律失常大鼠模型
摘要
右心衰竭 (RHF) 的特征是右侧心脏扩张和肥大,导致心室和心房功能障碍。与 RHF 相关的心肺疾病伴随着心律失常的风险增加。本文描述了肺动脉束带诱导的 RHF 与增强的室性和房性心律失常发生相关的标准化模型。
摘要
包括慢性阻塞性肺病或肺动脉高压 (PAH) 在内的临床状况可导致慢性右心室压力超负荷和进行性右心衰竭 (RHF)。RHF 可通过与影响 RV 和右心房 (RA) 的异常心肌功能相关的右侧心脏肥大和扩张来识别。我们最近证明,严重的 RHF 伴随着心房炎症、心房纤维化和心房颤动 (AF) 的风险增加,这是最常见的心律失常 (CA) 类型。最近的研究表明,RV 和 RA 炎症在 CA 的心律失常发生中起重要作用,包括 AF。然而,炎症对 RHF 中 CA 和 AF 发展的影响描述甚少。
需要 RHF 的实验模型来更好地了解右侧心肌炎症与 CA 之间的关联。野百合碱 (MCT) 诱导的肺动脉高压 (PH) 大鼠模型已建立起诱发 RHF 的模型。然而,MCT 会引发严重的肺毒性和肺部炎症。因此,MCT 诱导的 RHF 无助于区分随后的心肌炎症是源自 RHF 本身还是受伤肺分泌的循环炎症信号。
在本文中,使用一种涉及肺动脉干束带 (PAB) 的机械方法来引发右侧心律失常的发生。PAB 包括对肺动脉干进行 3 周的永久缝合。这种方法会增加右侧压力超负荷。在 PAB 后第 21 天,缝合导致 RV 和 RA 肥大、扩张和发炎。PAB 诱导的 RHF 还伴有室性和房性心律失常的易感性,包括 AF。
引言
右心衰竭 (RHF) 的特征是右心室 (RV) 和心房 (RA) 肥大和扩张,由于肺动脉 (PA) 收缩导致慢性 RV 压力超负荷,导致右侧心脏功能障碍1。因此,引起 PA 狭窄的情况可能导致 RHF 1,2,3,4 的风险增加。临床数据显示,RHF 是 PA 高血压 (PAH) 患者住院的主要原因 (56%)2。临床研究表明,无论 PAH 的病因如何,包括血栓栓塞性肺动脉高压 (PH) 和特发性 PAH,患者经常受到 RHF 的影响,并且患心律失常的几率要高 20%,包括室上性快速性心律失常和心房颤动 (AF)2,5,6。
为了更好地了解 PAH 和 RHF 之间的关联,动物研究,包括单剂量野百合碱 (MCT) 的模型,已被用于诱发严重的肺部炎症和 RHF 7,8。我们最近观察到 MCT 诱导的 RHF 与 RA 炎症和 AF9 相关。然而,由于 MCT 诱导的肺部炎症和循环细胞因子的重要性,很难描述 MCT 诱导的 RA 炎症是否仅是 RHF 的结果9。因此,需要一种新的 RHF 诱导的心律失常模型来研究 RA 炎症状态。
PA 躯干带 (PAB) 实验模型已用于各种动物物种,以模拟阻塞性 PA 疾病并研究影响心脏右侧的相关病理性心脏重塑10。在各种模拟 RV 超负荷10、11、12、13、14、15、16 的研究中,PAB 已被报道为诱导右侧 RV 功能障碍和失败的有效方法。从技术上讲,PAB 是在 PA 躯干上放置永久缝合线,引起 PA 躯干直径的机械减小10。PAB 会给 RV10 带来更大的压力过载。首先,作为对 RV 后负荷突然增加的补偿性适应,RV 腔扩张,导致慢性 RV 肥大10,13。右心室扩张和肥大影响三尖瓣,三尖瓣渗漏13.更准确地说,右心室的明显扩张与高 RV 后负荷相结合,具有拉伸位于 RV 和 RA 之间的三尖瓣环的效果13,17。由于瓣膜的不完全闭塞,在收缩期间从 RV 射出的一部分血液将流向 RA 腔17。三尖瓣渗漏可以通过超声心动图观察到,称为三尖瓣反流17。然后,RA 接受不适当的高血压,导致 RA 扩张和肥大增加13。慢性 RV 和 RA 重塑伴有局部心肌炎症反应,导致 RV 和 RA 纤维化和功能丧失 9,13。心脏纤维化的特征是低电压区的发展,这些低压区的收缩性较低,更容易引发与心律失常发展有关的传导阻滞和折返回路,包括心室颤动和 AF18,19。
本文的独创性在于利用 PAB 诱导的右侧心脏重塑的标准化方法来激发和研究 PAB 后 3 周内心律失常的诱发性。这种手术方法的主要优点是:i) 直接控制 PA 干直径的减小,以及 ii) 避免肺部炎症,专注于 RHF 诱导的心肌炎症,以研究心律失常,包括 AF。
此处描述的方法包括精确的显微外科手术以创建 PAB、评估增加的 RV 后负荷、超声心动图观察 PAB 诱导的心肌结构和功能重塑,以及评估心律失常(包括 AF)易感性的电生理学研究。
研究方案
以下描述的所有程序均已获得蒙特利尔心脏研究所伦理委员会的批准(方案编号:2021-2938-2021-47-01 和 2024-3412-2024-48-01),并严格遵循加拿大动物护理委员会 (CCAC) 指南。使用 6-8 周龄的雄性 Wistar 大鼠 (225-275 g) 进行手术。所有动物都被安置在蒙特利尔心脏研究所的动物护理设施中,可以免费获得水和食物。
1. 术前准备
- 手术前使用高压饱和蒸汽高压灭菌器对所有手术器械和材料进行消毒,温度在 121 °C 和 134 °C 之间,在 15-30 psi 下灭菌 30-40 分钟,然后干燥循环 25 分钟。
- 准备手术所需的所有药物体积。使用多模式镇痛方法,包括在手术前 30 分钟皮下注射丁丙诺啡 (0.05 mg/kg) 和酮洛芬 (5 mg/kg),并在术后 6 小时(丁丙诺啡)和 24 小时重复(丁丙诺啡和酮洛芬)。此外,在切口部位进行局部镇痛(利多卡因 5 mg/mL)。
- 手术前进行基线经胸超声心动图检查(参见步骤 6.1-6.13 中经胸超声心动图的详细程序)以确定 PA 直径并选择合适的规格针头,该针头将用作导线,以在 PAB 期间产生预期的 60% 的 PA 直径减少。
注:在本文中,使用了 225-275 g 的雄性 Wistar 大鼠,并且使用 19 G 针头是适当的,以产生 60% 的 PA 直径减小。 - 准备一根 19 G 针头(或步骤 1.3 中确定的适当口径)用作导线(见下文:步骤 4.18 和 4.19)以获得最佳的 PA 躯干收缩,引发大鼠心脏的严重重塑。使用镊子将 19 G 弯曲至 90-110°(图 1A)。
注意:弯曲 19 G 有助于 i) 在 PA 躯干附近定位,以及 ii) 在手术过程中应用结扎。19 G 用作导线,围绕该引线安装缝合线以将 PA 的直径减小到 1.0 毫米(体重 60-225 g 的大鼠减少 275%),这会导致显着的 RV 压力超负荷,导致 3 周内严重的 RV 重塑。
2. 麻醉诱导和动物准备
注意:对 6-8 周龄的雄性 Wistar 大鼠 (225-275 g) 进行分析。在以下程序的所有步骤中使用加热垫,将动物的体温保持在 37 °C 左右。 使用直肠探针监测体温。
- 用连续吸入 3% 异氟醚和 100% 氧气 2-3 L/min 麻醉动物。
- 涂抹眼部润滑凝胶以保护角膜免受干燥。
- 使用脚趾捏反射验证麻醉水平。
3. 插管
注意:插管按照前面描述的20.
- 将动物以仰卧位转移到倾斜的插管站。使用一圈线抓住大鼠的上门牙,将身体保持在 45° 的悬吊位置,以获得更好的喉咙可视化。
- 将柔性光源对准颈部表面,以透射透射光穿过咽咽声门区域。
- 使用棉签伸展舌头,并用弯曲的称重刮刀作为压舌板将其稳定在上颌骨上。
- 观察气管和声带。
- 使用 16 G 血管导管进行插管。将导管用作气管插管,并将斜头针头变钝以用作导引器。
- 将安装在导引器(斜尖针)上的气管插管(16 G 血管导管)推进到气管中,定位后取下导引器(图 1B)。
- 通过观察正常的呼吸模式(体重为 80 克的大鼠约为 225 次呼吸/分钟,体重为 70 克的大鼠约为 275 次呼吸/分钟)和金属刮刀表面是否存在雾气(或小镜子)来确认管子的正确位置当放置在插管轮毂的法兰上时。
- 正确插管后,通过恒温加热垫仰卧将动物快速转移到手术站。
- 根据大鼠的体重调整呼吸机的潮气量和潮气速率。225-275 g 左右的大鼠使用呼吸机接受 2.0-2.5 mL 的潮气量和 70-80 次呼吸/分钟。
- 将气管插管连接到呼吸机以启动机械通气。将呼吸机的流出尖端放入水缸中。每次呼吸后从流出处冒出的气泡表明插管成功。
- 一旦建立稳定的呼吸,用手术胶带固定气管插管,并沿尾部固定直肠探头以监测体温。
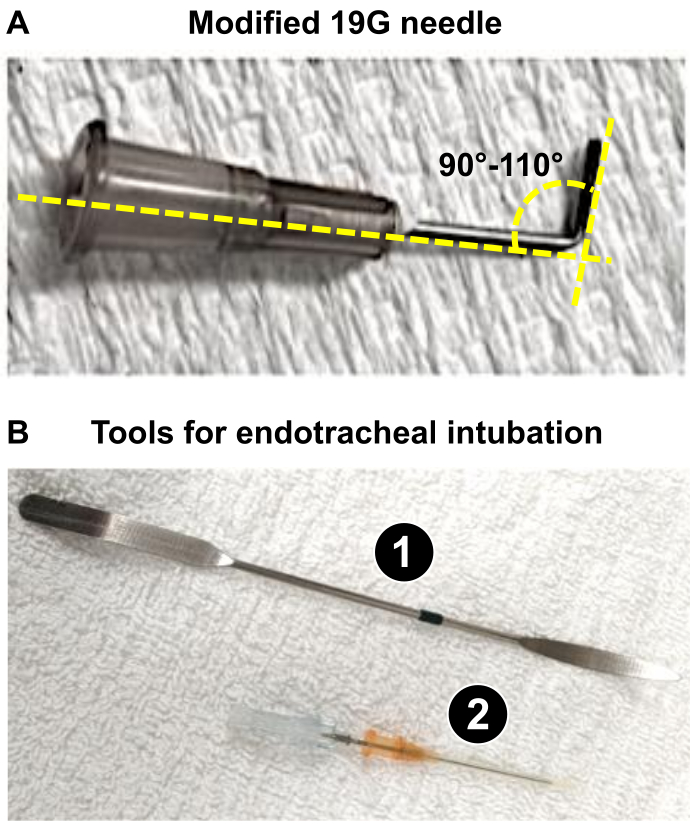
图 1:准备 PAB 显微外科手术所需的关键器械。 (A) 使用 19 G 改良针作为导线,在 PAB 后获得直径为 1 mm 的 PA 躯干。(B) 大鼠使用的气管内工具或成功插管。 1. 刮刀用作麻醉大鼠的压舌器,以暴露气管。 2. 16G 导管在钝化其触针尖端后充当气管插管。 请单击此处查看此图的较大版本。
4. PAB 手术(图 2)
注意:所有程序必须按照严格的无菌手术技术进行。
- 用剪刀和脱毛霜剃掉胸部的左侧,然后用 2% 的洗必泰准备皮肤,然后用 70% 的酒精磨砂膏(重复 3 次)。
- 用医用胶带将前肢固定在张开位置,注意不要过度伸展四肢,以免影响呼吸。
- 将右后肢稍微向下拉,并沿着尾巴固定。
- 伸展并内收左后肢并将其固定在动物的右侧,以产生轻微的右侧位置,露出胸部的左侧。
- 在此步骤中,在手术的剩余部分使用无菌手套。
- 将无菌覆盖在动物身上,并在胸部左侧做一个 2-3 厘米的皮肤切口,从剑突上方约 2 厘米处开始,对角线朝向大鼠左前肢的底部。
- 在皮肤下,随后将胸肌(胸小肌和胸大肌)分开,并使用圆头剪刀通过钝器解剖将它们移到一边。使用磁性牵开器固定肌肉,以便正确观察位于下方的肋骨。
- 从水瓶中取出流出管(连接到呼吸机),使肺部充气(参见步骤 3.10)。从水中移除流出管会降低进入肺部的压力,从而产生肺叶的去充气。
- 使用弯曲的解剖钳进行左侧开胸手术。在位于第 3 和第 4 肋之间的肌肉锁骨中线刺穿一个小孔。
- 将弯曲的镊子引入开口,沿着两根肋骨之间的肌肉左内壁滑动,稍微抬起左胸壁,避免在切割肌肉时接触肺部。
- 使用引入的镊子作为导向,用虹膜剪刀在大约 1 厘米的肋骨上纵向切开。保持左胸壁抬起并小心作剪刀,以免损伤正下方的左肺叶。
- 使用圆头剪刀将肋间切口扩大到动物左侧 1-2 厘米处。
- 将牵开器重新定位在肋骨下方,以保持伤口开放。
- 观察胸腺的下部和肺左叶的一部分。
- 考虑到这些器官占据了很大的空间,在这个水平上将胸腺和肺推到一边。用镊子钝器解剖分开胸腺叶,并使用湿纱布将肺固定在左侧。然后,暴露心脏的上部、左心房 (LA) 以及肺干和主动脉弓。
- 小心地钝化该区域覆盖心脏的心包薄层,以及任何附着的脂肪组织,以帮助找到主动脉和肺干仍然相连的部分。尽量减少心包解剖,避免接触胸膜。
- 将弯曲的镊子插入 LA 附件和肺干之间的空间,在血管可见部分的中间,以到达血管的另一侧(图 2A)。
注意:避免在离心脏主动脉根部太近的地方工作,以防止血管破裂和出血的风险。 - 通过颅骨结膜观察镊子的尖端到肺干。使用第二把镊子解剖尖端,然后小心地刺穿膜以形成一个小开口。然后将位于肺干下方的弯曲镊子稍微打开,以抓住 5-0 的丝线。缩回镊子,将线从肺干的一侧带到另一侧(图 2B、C)。
- 进行肺干收缩。首先,在靠近动脉的地方练习 5-0 Silk 的松散双结。将 19 G 针沿血管和线下方插入。在取下 19 G 之前,拧紧第一个结并用第二个简单结固定它(图 2D)。
注意:快速小心地工作,以尽量减少肺干完全阻塞的持续时间。 - 进行最后一次简单打结,在距离结约 0.5-1 厘米处剪下剩余的 5-0 丝线(图 2D)。
- 重新定位胸腔叶并移除胸部牵开器。
- 通过捏住呼吸机的流出物 2 秒来重新给肺部充气。
- 通过使用合成可吸收的 5-0 缝合线进行十字绣图案来闭合肋骨。
- 在伤口区域滴几滴 0.9% 生理盐水,然后按压胸壁的每一侧,以去除气泡并重新建立胸部负压。
- 重新定位胸肌,用无菌纱布擦去剩余的盐水。
- 使用注射器在伤口表面和周围区域涂抹利多卡因的飞溅块。
- 使用合成可吸收的 5-0 缝合线和针以连续的皮下模式闭合皮肤。
注意:假大鼠接受相同的程序,没有步骤 4.18 和 4.19。
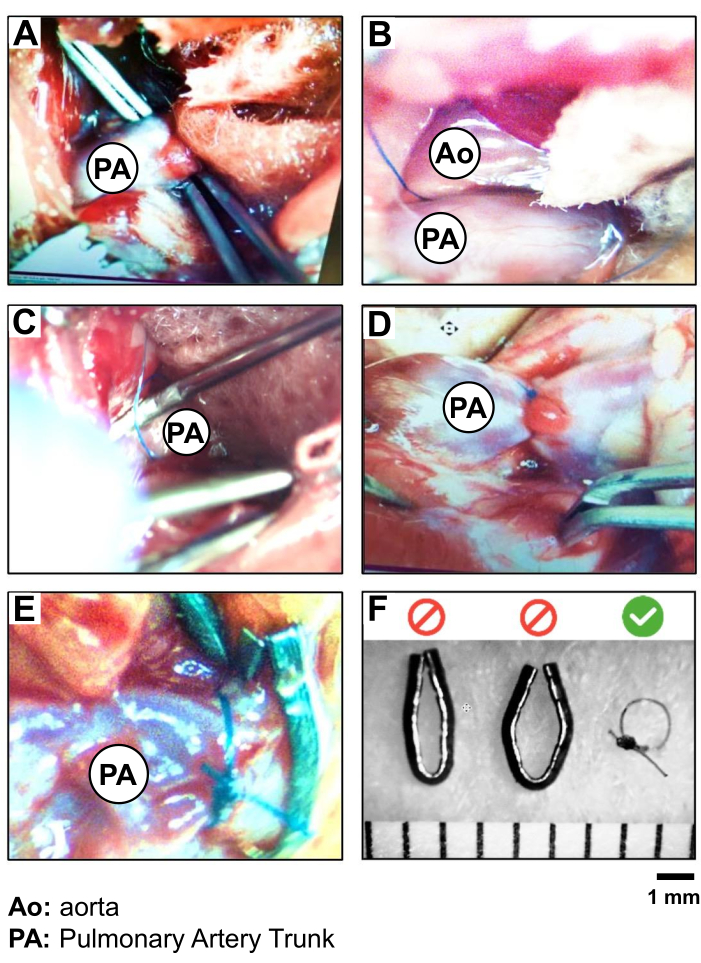
图 2:PAB 程序和 5.0 丝缝合线与金属夹的验证。 PA 躯干逐步分离和结扎的照片,显示 (A) PA 躯干的暴露和隔离,(B) 缝合线(5.0 丝)围绕 PA 躯干的位置,(C) PA (PAB) 的结扎(使用 19 G 针作为引线);(D) PAB 后心脏运动以及 PA 根和 RV 超负荷的验证;(E) 用丝缝合与金属夹进行的 PAB 的比较;(F) 验证 PAB 丝缝合线的选择,以在 PA 躯干周围产生 1 毫米的更可重复的直径。 请单击此处查看此图的较大版本。
5. 术后恢复
- 去除异氟醚,同时保持大鼠处于仅氧气流动的机械通气下。将老鼠转向右侧或腹侧以促进呼吸。
- 将 0.9% 盐水皮下注射到颈背区域以促进液体恢复(计算为 10 mL/kg/h 的麻醉)。
- 确认自主呼吸后,顺利取出气管插管。
- 观察大鼠何时开始自行移动,并将动物从加热垫转移到新的无菌笼子进行恢复。 随意提供水和湿食物。
- 在术后期间(4-6 小时),将笼子放在加热垫(笼子的一半)上,以帮助维持体温并密切监测动物。
- 及时处理任何疼痛、呼吸困难或异常行为的迹象。
- 在术后护理中,手术后 6 小时,注射第二剂 0.05 mg/kg 丁丙诺啡。第二天,手术后 24 小时,注射第三剂 0.05 mg/kg 丁丙诺啡和第二剂 5 mg/kg 酮洛芬。
- 监测大鼠,直到它们完全恢复健康。
6. 经胸超声心动图
注:本文显示了手术后第 21 天获得的数据,当时大鼠接受了经胸超声心动图检查。然而,根据研究目标和研究设计的要求,研究人员可以定义 PAB 前后经胸超声心动图的其他时间点。
- 手术前进行基线经胸超声心动图检查,以确定 PA 直径并选择合适的规格针头作为导线,以在 PAB 期间产生预期的 60% 的 PA 直径减少。
注意:在本研究中,使用了 225-275 g 的雄性 Wistar 大鼠,并且使用 19 G 针头是适当的,以产生 60% 的 PA 直径减小。 - 用连续吸入异氟醚(3% 和 2 L/min O2)对大鼠进行称重和麻醉。
- 使用 12S 扇形/多元素探头 (4.5-11.5 MHz) 和图像采集系统对每只动物进行经胸超声心动图检查。
- 通过将 12S 探头定位在主动脉瓣的水平,在二维 (2D) 胸骨旁短轴视图中使用颜色映射。单击回声机上的彩色多普勒按钮,以可视化穿过肺干中肺动脉束带 (PAB) 区域的血流模式。
- 通过在 2D 胸骨旁短轴视图中彩色映射引导下穿过 PAB 来执行连续波多普勒 (CW),以记录穿过 PAB 区域的血流的特性,包括峰值速度 (cm/s) 和平均压力梯度 (mmHg)。为了获得多普勒曲线,请在肺动脉条带水平调整样品体积。
- 通过将 2S 探头定位在心脏心尖水平来应用 12D 根尖 4 腔视图,以展示手术后 RA 和 RV 的扩大,并确定心脏收缩末期 (RAD) 的 RA 水平尺寸,以毫米 (mm) 表示。
- 在 2D 根尖 4 腔视图中应用颜色映射,通过在回声机上采集电影循环来揭示由 PAB 引起的三尖瓣反流。
- 通过穿过三尖瓣环和 RV 侧壁的交界处,在根尖 4 腔视图中进行 M 型 超声心动图,以研究以 mm 表示的三尖瓣环平面收缩偏移 (TAPSE)。
- 在三尖瓣环和 RV 侧壁交界处的顶端 4 腔视图中使用 组织多普勒成像 (TDI) 来测量以厘米/秒 (cm/s) 表示的 RV 侧壁收缩收缩力 (Sr),以评估 RV 收缩性能。
- 在根尖 4 腔视图中使用脉冲波多普勒记录舒张期经三尖瓣血流 (TTF),以研究 RV 舒张特性,包括早期充盈 (E) 波、心房充盈 (A) 波的峰值速度以及 TTF 中 E/A 的比率。
- 在主动脉瓣水平的胸骨旁长轴视图中进行 M 型 超声心动图检查,以测量心脏舒张末期的 RV 流出道(RVOT,以毫米表示)和心脏收缩期末期的左心房尺寸(LAD,以毫米表示)。
- 在肌水平的胸骨旁短轴视图中进行 2D M 型 超声心动图,以评估收缩末期和舒张期的 LV 尺寸(LVD 和 LVDd);和 LV 舒张末期前壁厚度 (LVAWd),均以毫米表示。
- 在胸骨旁短轴视图中执行 2D M 模式,以确定 LV 缩短分数 (LVFS,以百分比表示) 和 LV 射血分数 (LVEF,以百分比表示)。
7. 电生理学研究(图 3)
- 体内 超声心 动图后将大鼠维持在麻醉状态以进行 体内 经食管电生理研究 (EPS)。
- 将心电图电极插入大鼠的皮肤下(1 个靠近左前肢,1 个靠近右后肢,1 个靠近左后肢)。
- 轻轻地将极间距离为 4 mm 的 5F 四极导管引入食道(图 3A)。
- 通过精确确定 P 波(代表表面心电图上的心房收缩)何时与经食管导管心电图获得的 P 波匹配,调整靠近 RA 的经食管导管位置(图 3A、B)。
- 确定每只动物的刺激阈值。此阈值是刺激器直接影响心率的最小电压。
- 通过应用相当于阈值电压 4 倍的电压突发来评估 AF 脆弱性,该协议遵循 3 组 12 次刺激脉冲的协议,每次在 50 Hz 下持续 3 秒,然后休息 2 秒(1 分钟/组)。在每组之间,大鼠有 1 分钟的休息期9 、 13 、 21 。
- 识别并量化每次爆发后心动过速的发生,包括 AF 或心房扑动。
注意:AF 定义为不规则和超快速的心房搏动 (>800 bpm)。心房扑动被定义为规则但快速的心房心律,与 P 波缺失或在规则连续的 R-R 间期之间存在多个 P 波的规则模式相关。仅考虑持续时间超过 1 s 的心律失常发作。 - 如果窦性心律在两次连续刺激之间的休息期内没有自行恢复,请停止下一组刺激,避免中断正在进行的 AF 或心房扑动发作。
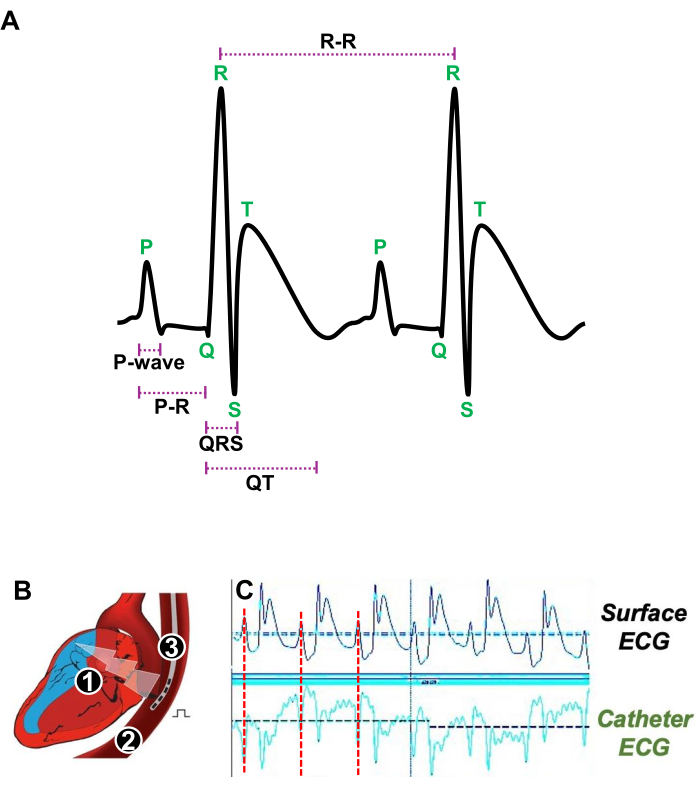
图 3:静息时心跳和用于 体内 电生理研究的经食管导管的适当位置的图示。 (A) 静息时两个连续心跳的代表性心电图,显示 P 波、PR 间期、QRS 复合波、QT 间期和 R-R 间期。(B) 心脏 (1) 和食道 (2) 的纵切图,其中引入四极导管 (3) 以刺激和获得心房心电图。(C) 当来自表面心电图(上迹线)的心房信号(红线)与导管心电图的心房信号(下迹线)重合时,显示经食管导管首选位置的代表性心电图信号。 请单击此处查看此图的较大版本。
8. 心电图分析
注意:心电图记录和刺激是使用心电图采集软件进行的。使用心电图分析软件进行分析(图 3A)。
- 测量与心房收缩相对应的 P 波持续时间,以毫秒 (ms) 表示。
- 确定对应于通过房室结 (AV) 的电传导持续时间的 PR 间期(以毫秒表示)。
- 报告对应于心室除极的 QRS 波群的持续时间(以毫秒表示)。
- 评估反映心室除极和复极化总持续时间的 QT 间期(以毫秒表示)。
- 量化 RR 间期(以毫秒表示),表示两个连续心跳之间的持续时间并确定心率。
9. 组织学分析
- 在 PAB 后第 21 天,在异氟醚麻醉 (5%,2 L/min O2) 下放血对大鼠实施安乐死。
- 分离 RA 和 LA 以分析与 RHF 和心律失常相关或无关的心房组织学重塑。
- 对新鲜切除的心脏进行横切,距心尖 5 mm,以评估与 RHF 和心律失常相关或无关的心室重塑。
- 将心肌样本固定在福尔马林中,并用 Masson 三色溶液22 对组织学载玻片进行染色,以量化 PAB 后 D21 的心室壁厚度和扩张以及心房纤维化。
10. 统计分析
- 通过 Shapiro-Wilk 检验评估分布的正态性。使用 Student 的 t 检验比较正态分布的数据。
- 如果数据是非参数分布,则执行 Mann-Whitney 检验。使用 Fisher 精确检验分析 AF 诱导性等分类变量。
- 将结果表示为平均值±标准误差与平均值 (S.E.M.) 之比。考虑双尾 P 值为 0.05 时<统计显著性差异。
结果
目视确认手术期间 PA 躯干的适当结扎
在 PAB 手术期间,缝合线位置良好的迹象是血压立即升高,并在与 RV 交界处迅速扩张 RV 和 PA 干根部。缝合线不得移动,以确保 3 周内持续和永久的压力超负荷。在这项研究中,使用 5-0 Silk 被验证为比金属夹更稳定(图 2E,F)。如果特定研究设计需要,5-0 Silk 还允许移除缝合线。
讨论
PAB 的成功性能是该协议最关键的部分。正确区分主动脉和 PA 干很重要。必须仔细进行 PA 的隔离,以避免在手术过程中撕裂、出血和死亡。必须迅速在 19G 导联周围进行缝合,然后立即移除导联,以避免由于导联的存在而导致 PA "完全阻塞"太长。
根据调查的要求,我们确定 5-0 Silk 比金属夹更稳定来执行 PAB10,13
披露声明
作者没有什么可披露的。
致谢
作者感谢 Colombe Roy、YanFen Shi、Sandra Query 和 Josiane Deslandes 对经胸超声心动图的技术性能,并感谢 Nathalie L'Heureux 在 PAB 方法标准化期间提供的初步技术援助。我们感谢蒙特利尔心脏研究所动物护理机构的成员。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
参考文献
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。