JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
폐동맥 밴딩을 이용한 우측 심장 리모델링 및 부정맥의 쥐 모델
요약
우심부전(RHF)은 우측 심장 확장과 비대가 특징이며, 심실 및 심방 기능 부전을 유발합니다. RHF와 관련된 심폐 질환은 심장 부정맥의 위험 증가를 동반합니다. 이 논문은 향상된 심실 및 심방 부정맥 형성과 관련된 폐동맥 밴딩 유도 RHF의 표준화된 모델을 설명합니다.
초록
만성 폐쇄성 폐질환 또는 폐동맥 고혈압(PAH)을 포함한 임상 상태는 만성 우심실 압력 과부하 및 진행성 우심부전(RHF)으로 이어질 수 있습니다. RHF는 RV와 우심방(RA)에 영향을 미치는 비정상적인 심근 기능과 관련된 우측 심장 비대 및 확장으로 확인할 수 있습니다. 우리는 최근에 중증 RHF가 심방 염증, 심방 섬유증 및 가장 흔한 유형의 심장 부정맥(CA)인 심방세동(AF)의 위험 증가를 동반한다는 것을 입증했습니다. 최근 연구에 따르면 RV 및 RA 염증은 AF를 포함한 CA의 부정맥 형성에 중요한 역할을 합니다. 그러나 RHF에서 CA 및 AF 발병에 대한 염증의 영향은 잘 설명되지 않았습니다.
RHF의 실험 모델은 우측 심근 염증과 CA 사이의 연관성을 더 잘 이해하는 데 필요합니다. 모노크로탈린(MCT)에 의한 폐고혈압(PH)의 랫트 모델은 RHF를 유발하는 것으로 잘 알려져 있습니다. 그러나 MCT는 심각한 폐독성과 폐 염증을 유발합니다. 따라서 MCT에 의한 RHF는 후속 심근 염증이 RHF 자체에서 비롯된 것인지 아니면 손상된 폐에서 분비되는 순환 염증 신호에서 비롯된 것인지 구별하는 데 도움이 되지 않습니다.
이 기사에서는 우측 심장 부정맥 형성을 유발하기 위해 폐동맥 몸통 밴딩(PAB)과 관련된 기계적 방법을 사용했습니다. PAB는 3주 동안 폐동맥 줄기를 영구적으로 봉합하는 것으로 구성됩니다. 이러한 접근 방식은 우측 압력 과부하를 증가시킵니다. PAB 후 D21에서 봉합사는 비대, 확장 및 염증성 RV 및 RA를 초래합니다. PAB에 의한 RHF는 또한 심방세동을 포함한 심실 및 심방 부정맥에 대한 취약성을 동반합니다.
서문
우심부전(RHF)은 우심실(RV) 및 심방(RA) 비대 및 확장을 특징으로 하며, 폐동맥(PA)의 수축으로 인한 만성 RV 압력 과부하에 대응하여 우측 심장 오작동을 유발합니다1. 따라서 PA의 협착을 유발하는 조건은 RHF 1,2,3,4의 위험 증가의 원인이 될 수 있습니다. 임상 데이터에 따르면 RHF는 PA 고혈압(PAH) 환자의 입원의 주요 원인(56%)입니다2. 임상 연구에 따르면 혈전색전성 폐고혈압(PH) 및 특발성 PAH를 포함한 PAH의 원인과 무관하게 환자는 종종 RHF의 영향을 받으며 상심실 빈맥 및 심방세동(AF)을 포함한 심장 부정맥 발병에 20% 더 취약합니다2,5,6.
PAH와 RHF 간의 연관성을 더 잘 이해하기 위해 모노크로탈린(MCT)의 단일 용량 모델을 포함한 동물 연구를 사용하여 심각한 폐 염증과 RHF 7,8을 유발했습니다. 우리는 최근에 MCT에 의한 RHF가 RA 염증 및 AF9와 관련이 있음을 관찰했습니다. 그러나 MCT에 의한 폐 염증과 순환 사이토카인의 중요성으로 인해 MCT에 의한 RA 염증이 RHF의 결과인지는 설명하기 어려웠다9. 따라서 RA 염증 상태를 연구하기 위해 RHF 유발 심장 부정맥의 새로운 모델이 필요했습니다.
PA 몸통 밴딩(PAB) 실험 모델은 폐쇄성 PA 질환을 모방하고 심장의 오른쪽에 영향을 미치는 관련 병리학적 심장 리모델링을 연구하기 위해 다양한 동물 종에서 사용되어 왔습니다10. PAB는 RV 과부하를 모방한 다양한 연구에서 올바른 RV 기능 장애 및 실패를 유도하는 효과적인 방법으로 보고되었습니다 10,11,12,13,14,15,16. 기술적으로 PAB는 PA 트렁크에 영구 봉합사를 배치하여 PA 트렁크 직경10을 기계적으로 줄이는 것입니다. PAB는 RV10에 증가된 압력 과부하를 생성합니다. 첫째, RV 후부하의 갑작스러운 증가에 대한 보상으로 RV 캐비티가 확장되어 만성 RV 비대가 발생합니다10,13. RV 확장과 비대는 삼첨판 판막에 영향을 미쳐 누출이 발생한다13. 보다 정확하게는, 높은 RV 후부하와 결합된 RV의 뚜렷한 팽창은 RV와 RA13,17 사이에 위치한 삼첨판 고리를 늘리는 효과가 있습니다. 판막의 불완전한 폐색으로 인해, 수축기 동안 RV에서 배출된 혈액의 일부는 RA 구멍17로 향하게 됩니다. 삼첨판 판막의 누출은 심장초음파를 통해 관찰할 수 있으며, 이를 삼첨판 역류(tricuspid regurgitation)라고 합니다17. 그런 다음 RA는 부적절하게 고혈압을 받아 RA 확장 및 비대 증가에 기여합니다13. 만성 RV 및 RA 리모델링은 국소 심근 염증 반응을 동반하여 RV 및 RA 섬유증과 기능 상실을 유발합니다 9,13. 심장 섬유증은 심실세동 및 AF18,19를 포함한 심장 부정맥의 발병과 관련된 전도 차단 및 재진입 회로를 유발하기 쉽고 수축성이 적고 유발에 더 취약한 저전압 영역의 발달을 특징으로 합니다.
이 논문의 독창성은 PAB 유도 우측 심장 리모델링의 표준화된 방법을 활용하여 PAB 후 3주 동안 심장 부정맥 유도를 유발하고 연구하는 데 있습니다. 이 수술 접근법의 주요 장점은 i) PA 몸통 직경의 감소를 직접 제어하고 ii) 심방세동을 포함한 심장 부정맥을 연구하기 위해 RHF 유발 심근 염증에 초점을 맞추기 위해 폐 염증을 피할 수 있다는 것입니다.
여기에 설명된 접근 방식에는 PAB를 생성하기 위한 정밀한 미세 수술 절차, 증가된 RV 후부하 평가, PAB에 의한 심근 구조 및 기능 리모델링을 관찰하기 위한 심장 초음파, 심방세동을 포함한 심장 부정맥에 대한 취약성을 평가하기 위한 전기 생리학적 연구가 포함됩니다.
프로토콜
아래에 설명된 모든 절차는 몬트리올 심장 연구소 윤리 위원회(프로토콜 번호: 2021-2938-2021-47-01 및 2024-3412-2024-48-01)의 승인을 받았으며 캐나다 동물 보호 위원회(CCAC) 지침을 엄격하게 따랐습니다. 6-8주 된 수컷 Wistar 쥐(225-275g)를 절차에 사용했습니다. 모든 동물은 몬트리올 심장 연구소(Montreal Heart Institute)의 동물 보호 시설에 수용되었으며 물과 음식을 무료로 이용할 수 있었습니다.
1. 수술 전 준비
- 121°C에서 134°C 사이의 온도에서 15-30psi에서 30-40분 동안 고압 포화 증기의 오토클레이브를 사용하여 수술 전에 모든 수술 기구 및 재료를 멸균한 다음 25분의 건조 주기를 거칩니다.
- 수술에 필요한 모든 양의 약물을 준비합니다. 부프레노르핀(0.05mg/kg)과 케토프로펜(5mg/kg)을 수술 30분 전에 피하 주사하고 수술 후 6시간(부프레노르핀) 및 수술 후 24시간(부프레노르핀 및 케토프로펜)에 반복하는 복합 진통제 접근법을 사용합니다. 또한 절개 부위에 국소 진통제(리도카인 5mg/mL)를 실시합니다.
- 수술 전에 기준선 경흉부 심초음파를 수행하여(6.1-6.13단계의 경흉부 심초음파에 대한 자세한 절차 참조) PA 직경을 결정하고 PAB 동안 PA 직경의 예상 60% 감소를 생성하기 위한 리드로 사용할 적절한 게이지 바늘을 선택합니다.
참고 :이 논문에서는 225-275g의 수컷 Wistar 쥐를 사용했으며 19G 바늘을 사용하여 PA 직경을 60 % 감소시키는 것이 적절했습니다. - 최적의 PA 몸통 수축을 얻기 위해 리드(아래 참조: 4.18 및 4.19 단계)로 사용할 19G 바늘(또는 1.3단계에서 결정된 적절한 구경)을 준비하여 쥐 심장의 심각한 개조를 유발합니다. 집게를 사용하여 19G를 90-110°로 구부립니다(그림 1A).
참고: 19G를 구부리면 i) PA 트렁크 근처의 위치를 쉽게 잡을 수 있고 ii) 시술 중 결찰을 적용할 수 있습니다. 19G는 PA의 직경을 1.0mm(225-275g 무게의 쥐의 경우 60% 감소)로 줄이기 위해 봉합사가 설치되는 리드로 사용되며, 이는 3주 만에 심각한 RV 리모델링을 담당하는 상당한 RV 압력 과부하를 유발합니다.
2. 마취 및 동물 제제의 유도
참고: 분석은 6-8주 된 수컷 Wistar 쥐(225-275g)에 대해 수행되었습니다. 다음 절차의 모든 단계에서 발열 패드를 사용하여 동물의 체온을 약 37°C로 유지하십시오. 직장 프로브를 사용하여 체온을 모니터링합니다.
- 이소플루란 3% 및 100% 산소 2-3L/min을 지속적으로 흡입하여 동물을 마취합니다.
- 각막이 건조되지 않도록 보호하기 위해 눈 윤활 젤을 바르십시오.
- 발가락 핀치 반사를 사용하여 마취 수준을 확인합니다.
3. 삽관
참고: 삽관은 앞서 설명한 바와 같이 수행하였다20.
- 동물을 누운 자세로 경사진 삽관실로 옮깁니다. 목구멍을 더 잘 시각화하기 위해 실을 사용하여 윗니로 쥐를 잡고 몸을 45°로 매달린 자세로 유지합니다.
- 유연한 광원을 목 표면으로 향하게 하여 인두 피글로틱 영역을 통해 투과비춥니다.
- 면봉을 사용하여 혀를 확장하고 혀 억제기로 구부러진 계량 주걱을 사용하여 상악골에 혀를 고정합니다.
- 기관과 성대를 시각화합니다.
- 16G 혈관테터를 사용하여 삽관을 수행합니다. 카테터를 기관 튜브로 사용하고 비스듬한 팁 바늘을 무디게 하여 주입기로 사용합니다.
- 도입기(비스듬한 끝 바늘)에 장착된 기관내관(16G 혈관테터)을 기관으로 전진시키고 위치가 지정되면 도입기를 제거합니다(그림 1B).
- 정상적인 호흡 패턴(체중이 225g인 쥐의 경우 약 80회, 체중이 275g인 쥐의 경우 약 70회/분)을 관찰하고 캐뉼라 허브의 플랜지에 놓았을 때 금속 주걱(또는 작은 거울) 표면에 안개가 있는지 관찰하여 튜브의 올바른 위치를 확인합니다.
- 올바르게 삽관이 완료되면 동물을 항상열 발열 패드 위에 누운 상태로 수술 스테이션으로 빠르게 옮깁니다.
- 쥐의 체중에 따라 인공호흡기의 일회 호흡량과 속도를 조정하십시오. 약 225-275g의 쥐는 인공 호흡기로 2.0-2.5 mL의 일회 호흡량과 70-80 회 호흡을받습니다.
- 기관내관을 인공호흡기에 연결하여 기계적 환기를 시작합니다. 인공호흡기의 유출 팁을 물통에 넣습니다. 호흡을 할 때마다 배출구에서 나오는 기포는 성공적인 삽관을 나타냅니다.
- 호흡이 안정되면 수술용 테이프로 기관내관을 고정하고 꼬리를 따라 직장 프로브를 고정하여 체온을 모니터링합니다.
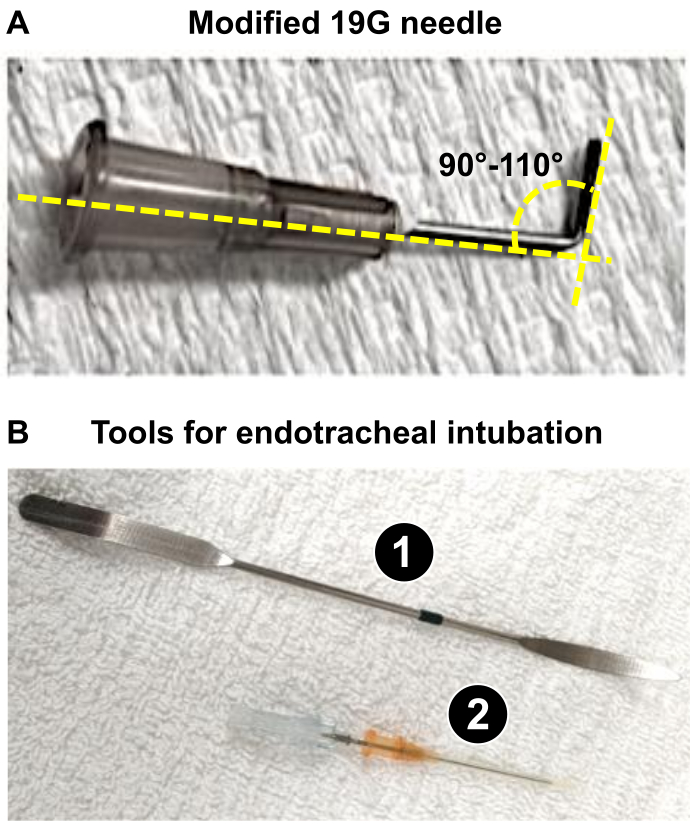
그림 1: PAB의 미세수술 절차 준비에 필요한 주요 기구. (A) PAB 후 PA 몸통의 1mm 직경을 얻기 위해 리드로 사용되는 변형된 19G 바늘. (B) 쥐의 기관 내 도구 사용 또는 성공적인 삽관. 1. 주걱은 기관을 노출시키기 위해 마취된 쥐의 혀 억제제로 사용됩니다. 2. 16G 카테터는 스타일러스 끝을 무디게 한 후 기관내 튜브 역할을 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. PAB 수술(그림 2)
참고: 모든 절차는 엄격한 무균 수술 기술에 따라 수행되어야 합니다.
- 클리퍼와 제모 크림을 사용하여 흉부의 왼쪽을 면도하고 2% 클로르헥시딘을 바르고 70% 알코올 스크럽(3회 반복)으로 피부를 정돈합니다.
- 의료용 테이프로 앞다리를 열린 자세로 고정하고 호흡에 영향을 주지 않도록 팔다리를 과도하게 뻗지 않도록 주의하십시오.
- 오른쪽 뒷다리를 약간 아래로 당겨 꼬리를 따라 고정합니다.
- 왼쪽 뒷다리를 뻗어 내전하고 동물의 오른쪽에 고정하여 가슴의 왼쪽을 노출시키는 약간의 오른쪽 측면 위치를 생성합니다.
- 이 단계에서 수술의 나머지 부분에는 멸균 장갑을 사용하십시오.
- 동물 위에 멸균 드레이프를 놓고 흉부 왼쪽에 2-3cm의 피부를 절개하여 xiphoid 돌기에서 약 2cm 위에서 시작하여 쥐의 왼쪽 앞다리 기저부를 향해 대각선 방향으로 절개합니다.
- 피부 아래에서 가슴 근육(Pectoralis minor 및 major)을 분리하고 둥근 끝 가위를 사용하여 뭉툭하게 해부하여 옆으로 이동합니다. 자기 견인기를 사용하여 근육을 고정하면 아래에 있는 흉곽을 적절하게 시각화할 수 있습니다.
- 물통에서 유출 튜브(인공호흡기에 연결됨)를 제거하여 폐의 공기를 빼냅니다(3.10단계 참조). 물에서 유출 튜브를 제거하면 폐로 들어가는 압력이 낮아져 엽의 팽창이 줄어듭니다.
- 구부러진 절개 겸자로 왼쪽 개흉술을 수행합니다. 3번째 와 4번째 갈비뼈 사이에 위치한 근육의 쇄골 중간 라인에 작은 구멍을 뚫습니다.
- 구부러진 겸자를 개구부에 삽입하고 두 갈비뼈 사이의 근육의 왼쪽 내벽을 따라 밀어 왼쪽 흉벽을 약간 들어 올리고 근육을 절단하는 동안 폐를 만지지 않도록 합니다.
- 도입한 겸자를 가이드로 하여 홍채 가위로 약 1cm의 갈비뼈까지 세로로 절개합니다. 왼쪽 흉벽을 들어 올린 상태를 유지하고 바로 아래에 있는 왼쪽 폐엽이 손상되지 않도록 가위를 조심스럽게 조작합니다.
- 둥근 팁 가위를 사용하여 늑간 절개를 동물의 왼쪽으로 1-2cm 확장하십시오.
- 상처가 열린 상태를 유지하기 위해 갈비뼈 아래에 견인기를 재배치합니다.
- 흉선의 아래쪽 부분과 폐의 왼쪽 엽 부분을 관찰하십시오.
- 이 수준에서 흉선과 폐를 옆으로 밀어내고, 이 기관들이 차지하는 중요한 공간을 감안할 때 말이다. 집게로 둔기 절개를 사용하여 흉선엽을 분리하고 젖은 거즈를 사용하여 폐를 왼쪽으로 잡습니다. 그런 다음 심장의 상부, 좌심방(LA), 폐줄기, 대동맥궁을 노출시킵니다.
- 대동맥과 폐간이 아직 붙어 있는 부분을 찾는 데 도움이 되도록 이 부위의 심장을 덮고 있는 얇은 심낭 층과 부착된 지방 조직을 조심스럽게 둔하게 절부합니다. 심낭을 최소한으로 절개하고 흉막을 만지지 마십시오.
- LA 부속물과 폐동 줄기 사이의 공간, 혈관의 보이는 부분 중앙에서 구부러진 집게를 닫힌 위치에 삽입하여 혈관의 다른 쪽에 도달합니다(그림 2A).
주의: 혈관 파열 및 출혈의 위험을 방지하기 위해 심장의 대동맥근에 너무 가깝게 작업하지 마십시오. - 겸자의 끝이 결막막을 통해 두개골로 폐간으로 가는 것을 시각화합니다. 두 번째 집게를 사용하여 팁을 절개하고 멤브레인을 조심스럽게 뚫어 작은 구멍을 만듭니다. 그런 다음 폐 줄기 아래에 위치한 구부러진 집게를 약간 열어 5-0 실크 실을 잡습니다. 집게를 집어넣어 실을 폐동맥 줄기의 한쪽에서 다른 쪽으로 가져옵니다(그림 2B, C).
- 폐 줄기의 수축을 수행합니다. 먼저 동맥에 가까운 5-0 실크의 느슨한 이중 매듭을 연습합니다. 19G 바늘을 용기를 따라 실 아래에 삽입합니다. 이 첫 번째 매듭을 조이고 19G를 제거하기 전에 두 번째 간단한 매듭으로 고정합니다(그림 2D).
주의 : 폐간이 완전히 막히는 기간을 최소화하기 위해 빠르고 조심스럽게 작업하십시오. - 마지막으로 간단한 매듭을 짓고 나머지 5-0 실크 실을 매듭에서 약 0.5-1cm 떨어진 곳으로 자릅니다(그림 2D).
- 흉선엽의 위치를 조정하고 흉부 견인기를 제거합니다.
- 2초 동안 인공호흡기의 유출을 꼬집어 폐를 다시 팽창시킵니다.
- 합성 흡수성 5-0 봉합사로 십자수 패턴을 수행하여 흉곽을 닫습니다.
- 상처 부위에 0.9% 식염수를 몇 방울 떨어뜨리고 흉벽의 양쪽을 압박하여 기포를 제거하고 흉부 음압을 다시 설정합니다.
- 가슴 근육의 위치를 조정하고 멸균 거즈로 남아 있는 식염수를 닦아냅니다.
- 주사기를 사용하여 상처 표면과 주변 부위에 리도카인 스플래시 블록을 바릅니다.
- 합성 흡수성 5-0 봉합사를 바늘로 연속 피하 패턴으로 피부를 닫습니다.
참고: 가짜 쥐는 4.18 및 4.19 단계 없이 동일한 절차를 받습니다.
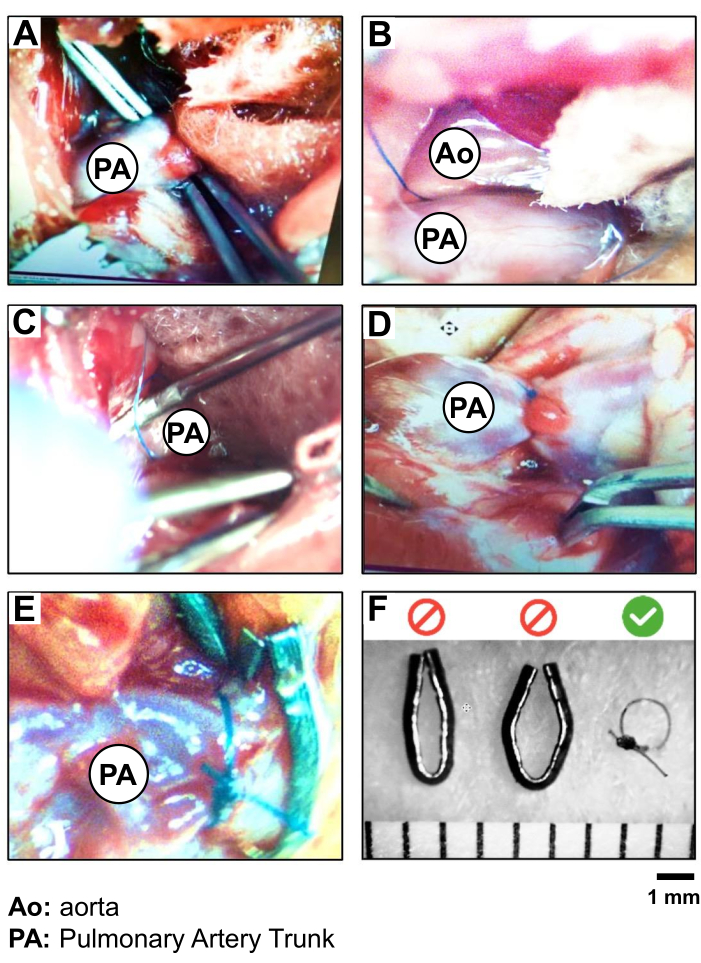
그림 2: 5.0 실크 봉합사와 금속 클립의 PAB 절차 및 검증. (A) PA 트렁크의 노출 및 절연, (B) PA 트렁크 주변의 봉합사(5.0 실크)의 위치, (C) PA(PAB)의 결찰(19G 바늘을 리드로 사용)을 보여주는 PA 트렁크의 단계별 절연 및 결찰 사진; (D) PAB 후 심장 움직임 및 PA-root 및 RV 과부하의 검증; (E) 실크 봉합사와 금속 클립으로 수행된 PAB의 비교; (F) PA 트렁크 주위에 1mm의 더 재현성 있는 직경을 생성하기 위해 PAB에 대한 실크 봉합사 선택의 검증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 수술 후 회복
- 산소 흐름만으로 기계적 환기 상태에서 쥐를 유지하면서 이소플루란을 제거합니다. 쥐를 오른쪽이나 배쪽으로 돌려 호흡을 용이하게 합니다.
- 체액 회복을 촉진하기 위해 0.9%의 식염수를 등쪽 목 부위에 피하주사합니다(10mL/kg/h의 마취로 계산).
- 자율호흡이 확인되면 기관내관을 부드럽게 제거합니다.
- 쥐가 스스로 움직이기 시작하는 시점을 관찰하고 회복을 위해 가열 패드에서 동물을 새로운 멸균 케이지로 옮깁니다. 물과 습식 사료를 자유롭게 제공하십시오.
- 수술 후 기간(4-6시간) 동안 케이지를 가열 패드(케이지의 절반) 위에 놓아 체온을 유지하고 동물을 면밀히 모니터링합니다.
- 통증, 호흡 곤란 또는 비정상적인 행동의 징후가 있으면 즉시 관리하십시오.
- 수술 후 관리에서는 수술 후 6시간 후에 0.05mg/kg 부프레노르핀을 두 번째 용량으로 주사합니다. 다음 날, 수술 후 24시간 이내에 0.05mg/kg 부프레노르핀의 세 번째 용량과 5mg/kg 케토프로펜의 두 번째 용량을 주사합니다.
- 쥐의 체력이 완전히 회복될 때까지 관찰한다.
6. 경흉부 심초음파(Transthoracic echocardiography)
참고: 이 논문은 쥐가 경흉부 심장초음파를 받은 수술 후 21일째에 얻은 데이터를 보여줍니다. 그러나 연구 목적과 연구 설계의 요구 사항에 따라 연구자는 PAB 경흉부 심장초음파에 대한 다른 시점을 정의할 수 있습니다.
- PA 직경을 결정하고 PAB 중 PA 직경의 예상 60% 감소를 생성하기 위해 리드로 사용되는 적절한 게이지 바늘을 선택하기 위해 수술 전에 기준선 경흉부 심장초음파를 수행합니다.
참고 :이 연구에서는 225-275g의 수컷 Wistar 쥐가 사용되었으며 19G 바늘을 사용하여 PA 직경을 60 % 감소시키는 것이 적절했습니다. - 지속적으로 흡입되는 이소플루란(3% 및 2L/minO2)으로 쥐의 무게를 측정하고 마취합니다.
- 12S 섹터/다중 요소 프로브(4.5-11.5MHz) 및 이미지 획득 시스템을 사용하여 각 동물에 대해 경흉부 심장초음파를 수행합니다.
- 2차원(2D) 흉골 주위 단축 보기에서 12S 프로브를 대동맥 판막 수준에 배치하여 색상 매핑을 사용합니다. 에코 머신의 컬러 도플러 버튼을 클릭하여 폐줄기의 폐동맥 밴딩(PAB) 영역을 가로지르는 혈류 패턴을 시각화합니다.
- 2D parasternal short-axis view에서 컬러 매핑에 의해 안내되는 PAB를 교차하여 연속파 도플러(CW)를 수행하여 최고 속도(cm/s) 및 평균 압력 구배(mmHg)를 포함하여 PAB 영역을 가로지르는 혈류의 특성을 기록합니다. 도플러 곡선을 얻으려면 폐동맥 밴딩 수준에서 샘플 부피를 조정하십시오.
- 12S 프로브를 심장 정점 높이에 배치하여 2D 정점 4-챔버 뷰를 적용하여 수술 후 RA 및 RV의 확대를 입증하고 밀리미터(mm)로 표시되는 말단 심장 수축기(RAD)의 RA 수평 치수를 결정합니다.
- 2D 정점 4-챔버 보기에서 컬러 매핑을 적용하면 에코 머신에서 cine-loops를 획득하여 PAB로 인한 삼첨판 역류를 나타낼 수 있습니다.
- mm로 표시되는 삼첨판 고리면 수축기 편위(TAPSE)를 연구하기 위해 삼첨판 고리와 RV 측벽의 결합을 교차하여 정점 4-챔버 보기에서 M-Mode 심초음파 검사를 수행합니다.
- RV 수축기 성능을 평가하기 위해 초당 센티미터(cm/s)로 표시되는 RV 측벽 수축기(Sr)를 측정하기 위해 삼첨판 고리와 RV 측벽의 결합 수준에서 정점 4-챔버 보기에서 TDI(Tissue Doppler Imaging )를 사용합니다.
- 정점 4-챔버 보기에서 펄스파 도플러를 사용하여 이완기 트랜스 삼첨판류(TTF)를 기록하여 조기 충전(E)파의 최고 속도, 심방 충전(A) 파의 최고 속도 및 TTF의 E/A 비율을 포함한 RV 이완기 특성을 연구합니다.
- 대동맥 판막 수준에서 흉골 주위 장축 보기에서 M-Mode 심초음파를 수행하여 심장 이완기 끝의 RV 유출로(RVOT, 밀리미터로 표시)와 심장 수축기 끝의 좌심방 치수(LAD, 밀리미터로 표시)를 측정합니다.
- 유두근 수준에서 흉골 주위 단축 보기에서 2D M-Mode 심장 초음파를 수행하여 수축기 말기 및 이완기(LVD 및 LVDd)에서 LV 치수를 평가합니다. 및 확장기 말단에서 LV 전벽 두께(LVAWd)는 모두 밀리미터로 표시됩니다.
- 단축 parasternal view에서 2D M 모드를 수행하여 LV 분획 단축(LVFS, 퍼센트로 표시) 및 LV 박출률(LVEF, 퍼센트로 표시)을 측정합니다.
7. 전기생리학적 연구(그림 3)
- 생체 내 경식도 전기생리학적 연구(EPS)를 위해 생체 내 심장 초음파 검사 후 마취 상태에서 쥐를 유지합니다.
- 쥐의 피부 아래에 ECG 전극을 삽입합니다(1개는 왼쪽 앞다리 근처, 1개는 오른쪽 뒷다리 근처, 1개는 왼쪽 뒷다리 근처).
- 극간 거리가 5mm인 4F-사중극 카테터를 식도에 부드럽게 삽입합니다(그림 3A).
- 표면 ECG에서 심방 수축을 나타내는 P파가 경식도 카테터의 ECG에서 얻은 P파와 일치하는 시점을 정확하게 결정하여 RA에 가까운 경식도 카테터 위치를 조정합니다(그림 3A, B).
- 각 동물에 대한 자극 역치를 결정합니다. 이 임계값은 자극기가 심박수에 직접적인 영향을 미치는 최소 전압입니다.
- 임계값 전압의 4배에 해당하는 전압 버스트를 12개의 자극 버스트로 구성된 3세트(각각 50Hz에서 3초 동안 지속)한 후 2초의 휴식(1분/세트)으로 구성된 프로토콜에 따라 AF 취약성을 평가합니다. 각 세트 사이에 쥐는 1분의 휴식 시간을 가졌습니다 9,13,21.
- 각 파열 후 AF 또는 심방 조동을 포함한 심장 빈맥의 발생을 식별하고 정량화합니다.
참고: AF는 불규칙하고 초고속 심방 박동(>800bpm)으로 정의됩니다. 심방 조동은 P 파의 부재 또는 규칙적으로 연속적인 R-R 간격 사이에 여러 P 파의 규칙적인 패턴의 존재와 관련된 규칙적이지만 빠른 심방 리듬으로 정의됩니다. 1초 이상 지속되는 부정맥 에피소드만 고려됩니다. - 두 번의 연속적인 자극 사이의 휴지 기간 내에 부비동 리듬이 자체적으로 회복되지 않는 경우 다음 일련의 자극을 중지하여 진행 중인 심방세동 또는 심방 조동 에피소드를 중단하지 마십시오.
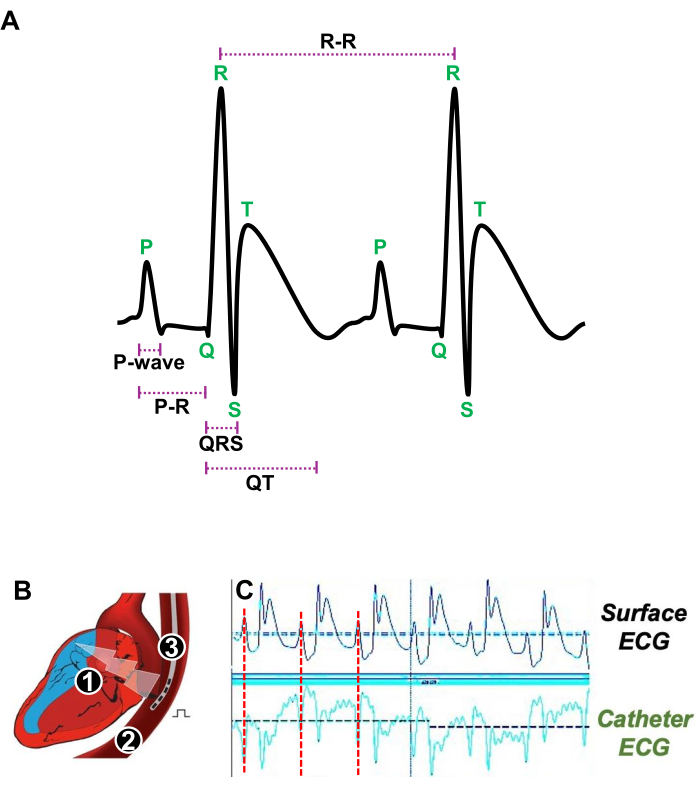
그림 3: 휴식 시 심장 박동과 생체 내 전기생리학적 연구를 위한 경식도 카테터의 적절한 위치에 대한 그림. (A) 휴지 시 두 개의 연속적인 심장 박동의 대표 ECG는 P파, PR 간격, QRS 복합체, QT 간격 및 R-R 간격을 보여줍니다. (B) 심방심전도를 자극하고 획득하기 위해 사극 카테터(3)를 삽입하는 심장(1)과 식도(2)의 세로 부분의 개략도. (C) 표면 ECG(위쪽 트레이스)의 심방 신호(빨간색 선)가 카테터 ECG(아래쪽 트레이스)의 심방 신호와 일치할 때 경식도 카테터의 선호되는 위치를 보여주는 대표적인 ECG 신호. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. ECG 분석
참고: ECG 기록 및 자극은 ECG 수집 소프트웨어를 사용하여 수행되었습니다. 분석은 ECG 분석 소프트웨어를 사용하여 수행되었습니다(그림 3A).
- 밀리초(ms)로 표현된 심방 수축에 해당하는 P파 지속 시간을 측정합니다.
- 방실(AV) 노드를 통한 전기 전도 기간에 해당하는 PR 간격(밀리초 단위로 표시)을 결정합니다.
- 심실 탈분극에 해당하는 QRS 복합체의 지속 시간(밀리초 단위로 표시)을 보고합니다.
- 심실 탈분극 및 재분극의 총 기간을 반영하는 QT 간격(밀리초 단위로 표시)을 평가했습니다.
- 두 개의 연속적인 심장 박동 사이의 지속 시간을 나타내고 심박수를 결정하는 RR 간격(밀리초 단위로 표시)을 정량화합니다.
9. 조직학적 분석
- PAB 후 21일째에 이소플루란 마취(5%, 2 L/min O2)하에서 박출로 쥐를 안락사시킨다.
- RA와 LA를 분리하여 RHF 및 심장 부정맥과 관련이 있거나 없는 심방 조직학적 리모델링을 분석합니다.
- 정점에서 5mm 떨어진 곳에서 갓 절제된 심장의 횡단면을 수행하여 RHF 및 심장 부정맥과 관련이 있는지 여부를 평가합니다.
- 심근 샘플을 포르말린으로 고정하고 Masson의 트리크롬 용액22 로 조직학적 슬라이드를 염색하여 PAB 후 D21에서 심실 벽 두께와 확장 및 심방 섬유증을 정량화합니다.
10. 통계 분석
- Shapiro-Wilk 검정으로 분포의 정규성을 평가합니다. 스튜던트 t-검정을 사용하여 정규 분포 데이터를 비교합니다.
- 데이터가 비모수 분포인 경우 Mann-Whitney 검정을 수행합니다. Fisher의 정확 검정을 사용하여 AF 유도성과 같은 범주형 변수를 분석합니다.
- 결과를 평균에 대한 표준 오차 ± 평균(S.E.M.)으로 표현합니다. 양측 P 값이 0.05< 통계적으로 유의한 차이를 고려합니다.
결과
수술 중 PA 몸통의 적절한 결찰에 대한 육안 확인
PAB 절차 중 봉합사의 양호한 위치 지정의 표시는 혈압의 즉각적인 상승과 RV와의 접합부에서 RV와 PA 트렁크의 뿌리의 즉각적인 확장입니다. 3주 동안 지속적이고 영구적인 압력 과부하를 보장하기 위해 봉합사가 움직이지 않아야 합니다. 이 연구에서는 5-0 실크의 사용이 금속 클립보다 더 안정적인 것으로 검...
토론
PAB의 성공적인 수행은 이 프로토콜에서 가장 중요한 부분입니다. 대동맥과 PA 몸통을 적절하게 구별하는 것이 중요합니다. PA의 격리는 시술 중 찢어짐, 출혈 및 사망을 방지하기 위해 세심하게 수행되어야 합니다. 19G 리드 주위에 봉합사를 도포하려면 신속하게 수행해야 하며, 리드의 존재로 인해 PA가 너무 오래 '완전히 막히는' 것을 방지하기 위해 리드를 즉시 제거해야 ...
공개
저자는 공개할 내용이 없습니다.
감사의 말
저자들은 경흉부 심초음파의 기술적 성과에 대해 Colombe Roy, YanFen Shi, Sandra Querry 및 Josiane Deslandes와 PAB 방법의 표준화 과정에서 예비 기술 지원을 제공한 Nathalie L'Heureux에게 감사를 표합니다. 몬트리올 심장 연구소(Montreal Heart Institute)의 동물 보호 시설 회원들에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
참고문헌
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유