Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель правостороннего ремоделирования сердца и аритмии на крысах с использованием бандажирования легочной артерии
В этой статье
Резюме
Правосторонняя сердечная недостаточность (ЗСН) характеризуется правосторонней дилатацией сердца и гипертрофией, приводящей к желудочковой и предсердной недостаточности. Сердечно-легочные заболевания, связанные с РГЛ, сопровождаются повышенным риском развития сердечной аритмии. В данной статье описана стандартизированная модель индуцированной бандажированием легочной артерии РГЛ, связанной с усилением желудочкового и предсердного аритмогенеза.
Аннотация
Клинические состояния, включая хроническую обструктивную болезнь легких или легочную артериальную гипертензию (ЛАГ), могут привести к хронической перегрузке правого желудочка и прогрессирующей правосторонней сердечной недостаточности (РГЛ). РГЛ может быть идентифицирована по правосторонней гипертрофии сердца и дилатации, связанной с аномальной функцией миокарда, затрагивающей ПЖ и правое предсердие (РА). Недавно мы продемонстрировали, что тяжелая форма РГЛ сопровождается повышенным риском воспаления предсердий, фиброза предсердий и фибрилляции предсердий (ФП), наиболее распространенного типа сердечной аритмии (КА). Недавние исследования показали, что воспаление ПЖ и РА играет важную роль в аритмогенезе КА, включая ФП. Однако влияние воспаления на развитие КА и ФП при РГЛ описано слабо.
Экспериментальные модели РГЛ необходимы для лучшего понимания связи между правосторонним воспалением миокарда и КА. Хорошо известно, что модель легочной гипертензии (ЛГ), индуцированной монокроталином (МСТ), провоцирует РЗН на крысах. Тем не менее, MCT вызывает тяжелую пневмотоксичность и воспаление легких. Следовательно, MCT-индуцированный RHF не помогает различить, происходит ли последующее воспаление миокарда от RHF как такового или от циркулирующих воспалительных сигналов, секретируемых поврежденным легким.
В данной статье был использован механический метод с использованием бандажирования ствола легочной артерии (PAB) для провоцирования правостороннего аритмогенеза сердца. PAB заключается в выполнении постоянного шва ствола легочной артерии в течение 3 недель. Такой подход создает повышенную перегрузку по давлению в правой части. При D21 после PAB наложение шва приводит к гипертрофированию, расширению и воспалению ПЖ и РА. ПАБ-индуцированная РГЛ также сопровождается уязвимостью к желудочковым и предсердным аритмиям, включая ФП.
Введение
Правосторонняя сердечная недостаточность (ПСН) характеризуется гипертрофией и расширением правых желудочков (ПЖ) и предсердий (РА), что приводит к правосторонней сердечной недостаточности в ответ на хроническую перегрузку давлением ПЖ из-за сужения легочных артерий (ПА)1. Следовательно, условия, провоцирующие сужение ПА, могут быть ответственны за повышенный риск RHF 1,2,3,4. Клинические данные показали, что РГЛ является основной причиной госпитализации (56%) у пациентов с артериальной гипертензией (ЛАГ)2. Клинические исследования показали, что независимо от причины ЛАГ, включая тромбоэмболическую легочную гипертензию (ЛГ) и идиопатическую ЛАГ, пациенты часто страдают РГЛ и на 20% более восприимчивы к развитию сердечных аритмий, включая наджелудочковые тахиаритмии и фибрилляцию предсердий (ФП)2,5,6.
Чтобы лучше понять связь между ЛАГ и РГЛ, были использованы исследования на животных, в том числе модель однократной дозы монокроталина (МСТ), чтобы спровоцировать тяжелое воспаление легких и РГЛ 7,8. Недавно мы заметили, что MCT-индуцированная RHF была связана с воспалением РА и ФП9. Тем не менее, из-за важности MCT-индуцированного воспаления легких и циркулирующих цитокинов, было трудно описать, является ли MCT-индуцированное воспаление РА следствием только RHF9. Следовательно, для изучения воспалительного статуса РА потребовалась новая модель RHF-индуцированной сердечной аритмии.
Экспериментальная модель бандажирования туловища PA (PAB) использовалась у различных видов животных для имитации обструктивных заболеваний PA и изучения связанного с ними патологического ремоделирования сердца, поражающего правую сторону сердца10. Сообщалось о том, что PAB является эффективным методом индуцирования дисфункции и неудачи правой ПЖ в различных исследованиях, имитирующих перегрузку ПЖ 10,11,12,13,14,15,16. Технически ПАБ представляет собой наложение постоянного шва на ствол ПА, провоцирующий механическое уменьшение диаметра ствола ПА10. PAB создает повышенное давление перегрузки для RV10. Во-первых, в качестве компенсаторной адаптации к резкому увеличению постнагрузки ПЖ, полость ПЖ расширяется, что приводит к хронической гипертрофии ПЖ10,13. Дилатация и гипертрофия ПЖ влияют на трехстворчатые клапаны, которые становятся негерметичными13. Точнее, выраженная дилатация ПЖ в сочетании с высокой постнагрузкой ПЖ приводит к растяжению кольца трикуспидального клапана, расположенного между ПЖ и ПЖ13,17. Из-за неполной окклюзии клапана часть крови, выбрасываемой из ПЖ во время систолы, будет направлена в сторону полостиРА 17. Утечка трикуспидального клапана может наблюдаться с помощью эхокардиографии и называется трикуспидальной регургитацией17. Затем РА получает неадекватно высокое кровяное давление, что способствует увеличению дилатации РА и гипертрофии13. Хроническое ремоделирование ПЖ и РА сопровождается местными воспалительными реакциями миокарда, приводящими к фиброзу ПЖ и РА и потере функции 9,13. Сердечный фиброз характеризуется развитием зон низкого напряжения, которые являются менее сократительными и более восприимчивыми к провоцированию блокады проводимости и обратному входу в цепи, участвующие в развитии сердечных аритмий, включая фибрилляцию желудочков и ФП18,19.
Оригинальность данной работы заключается в использовании стандартизированного метода ПАБ-индуцированного правостороннего ремоделирования сердца для провоцирования и изучения индуцируемости сердечных аритмий через 3 недели после ПАБ. Основными преимуществами данного хирургического подхода являются: i) прямой контроль над уменьшением диаметра ствола PA и ii) избежание воспаления легких с целью сосредоточения внимания на RHF-индуцированном воспалении миокарда для изучения сердечных аритмий, включая ФП.
Описанный здесь подход включает в себя точную микрохирургическую процедуру для создания PAB, оценку повышенной постнагрузки RV, эхокардиографию для наблюдения за PAB-индуцированным структурным и функциональным ремоделированием миокарда, а также электрофизиологическое исследование для оценки уязвимости к сердечным аритмиям, включая ФП.
протокол
Все описанные ниже процедуры были одобрены комитетом по этике Монреальского института сердца (номера протоколов: 2021-2938-2021-47-01 и 2024-3412-2024-48-01) и строго соответствовали рекомендациям Канадского совета по уходу за животными (CCAC). Для проведения процедур использовались самцы крыс линии Вистар (225-275 г) в возрасте 6-8 недель. Все животные были размещены в учреждении по уходу за животными Монреальского института сердца, со свободным доступом к воде и пище.
1. Предоперационная подготовка
- Стерилизуйте все хирургические инструменты и материалы перед операцией с помощью автоклава насыщенного пара под высоким давлением при температуре от 121 °C до 134 °C при давлении 15-30 фунтов на квадратный дюйм в течение 30-40 минут с последующим циклом сушки в течение 25 минут.
- Подготовьте все объемы препаратов, необходимых для проведения операции. Используйте мультимодальный анальгетический подход, включающий бупренорфин (0,05 мг/кг) и кетопрофен (5 мг/кг), вводимые подкожно за 30 минут до операции и повторяющиеся через 6 ч (бупренорфин) и через 24 ч после операции (бупренорфин и кетопрофен). Кроме того, проводят местную анальгезию в месте разреза (лидокаин 5 мг/мл).
- Перед операцией проведите базовую трансторакальную эхокардиографию (см. подробную процедуру трансторакальной эхокардиографии в шагах 6.1-6.13.), чтобы определить диаметр PA и выбрать подходящую измерительную иглу, которая будет использоваться в качестве проводника для получения ожидаемого снижения диаметра PAB на 60%.
ПРИМЕЧАНИЕ: В данной работе использовались самцы крыс Wistar весом 225-275 г, и использование иглы 19 G было целесообразным для получения такого 60% уменьшения диаметра PA. - Подготовьте иглу 19 G (или соответствующего калибра, как определено в шаге 1.3), которая будет использоваться в качестве проводника (см. ниже: шаги 4.18 и 4.19), чтобы получить оптимальное сужение ствола ПА, провоцирующее серьезное ремоделирование сердца крысы. С помощью щипцов согните 19 G на 90-110° (рисунок 1A).
ПРИМЕЧАНИЕ: Изгиб 19 G облегчает: i) расположение рядом с туловищем PA и ii) наложение лигирования во время процедуры. 19 G используется в качестве провода, вокруг которого будет установлен шов для уменьшения диаметра ПА до 1,0 мм (снижение на 60 % для крыс весом 225-275 г), что вызывает значительную перегрузку давлением ПЖ, ответственную за тяжелое ремоделирование ПЖ за 3 недели.
2. Индукция анестезии и подготовка животных
Примечание: Анализы проводились на самцах крыс линии Вистар (225-275 г) в возрасте 6-8 недель. Используйте грелку во время всех этапов следующих процедур, чтобы поддерживать температуру тела животного около 37 °C. Наложите ректальный зонд для контроля температуры тела.
- Обезболивают животное непрерывно вдыхаемым изофлураном 3% и 100% кислородом 2-3 л/мин.
- Нанесите смазывающий гель для глаз, чтобы защитить роговицу от высыхания.
- Проверьте уровень анестезии с помощью зажимного рефлекса на пальце ноги.
3. Интубация
ПРИМЕЧАНИЕ: Интубация была выполнена в соответствии с описанием ранее20.
- Переведите животное на наклонную станцию интубации в лежачем положении на спине. Держите крысу за верхние резцы с помощью петли из нити, чтобы удерживать тело в подвешенном положении под углом 45° для получения лучшей визуализации горла.
- Направьте гибкий источник света на поверхность горлышка, чтобы он просвечивал через глоточную область.
- Вытяните язык с помощью ватной палочки и стабилизируйте его на верхней челюсти изогнутым весовым шпателем в качестве депрессора языка.
- Визуализируйте трахею и голосовые связки.
- Используйте ангиокатетер 16 G для проведения интубации. Используйте катетер в качестве трахеальной трубки и притупите иглу со скошенным концом, чтобы использовать ее в качестве проводника.
- Введите эндотрахеальную трубку (ангиокатетер 16 G), установленную на интродьюсере (игле со скошенным концом) в трахею, и после установки извлеките проводник (Рисунок 1B).
- Подтвердите правильное положение трубки, наблюдая за нормальным ритмом дыхания (около 80 вдохов/мин для крыс весом 225 г и около 70 вдохов/мин для крыс весом 275 г) и наличием тумана на поверхности металлического шпателя (или маленького зеркала) при размещении на фланце ступицы канюли.
- После правильной интубации быстро переведите животное на хирургическую станцию лежа на гомеотермической грелке.
- Отрегулируйте дыхательный объем и скорость работы аппарата ИВЛ в соответствии с массой тела крысы. Крысы в возрасте около 225-275 г получают дыхательный объем 2,0-2,5 мл и 70-80 вдохов/мин с помощью аппарата искусственной вентиляции легких.
- Подключите эндотрахеальную трубку к аппарату искусственной вентиляции легких, чтобы начать искусственную вентиляцию легких. Поместите выпускной наконечник вентилятора в водяной цилиндр. Пузырьки воздуха, выходящие из оттока после каждого вдоха, свидетельствуют об успешной интубации.
- Как только установится устойчивое дыхание, закрепите эндотрахеальную трубку хирургической лентой и зафиксируйте ректальный зонд вдоль хвоста для контроля температуры тела.
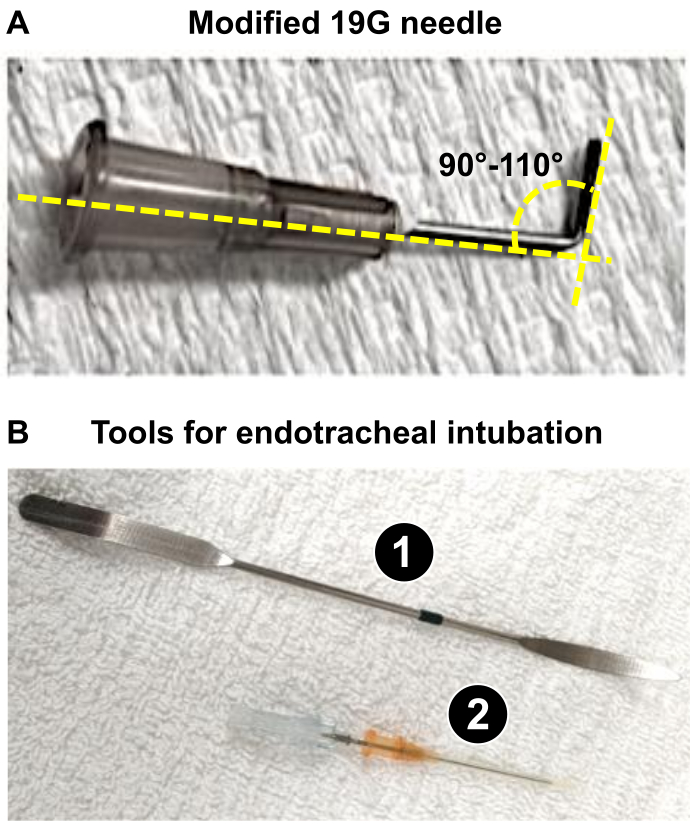
Рисунок 1: Основные инструменты, необходимые для подготовки микрохирургической процедуры PAB. (A) Модифицированная игла 19 G, используемая в качестве отведения, для получения диаметра ствола PAB диаметром 1 мм после PAB. (Б) Использование эндотрахеальных инструментов или успешная интубация крыс. 1. Шпатель используется в качестве депрессора языка у крыс под наркозом для обнажения трахеи. 2. Катетер 16G действует как эндотрахеальная трубка после притупления кончика его стилуса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Хирургия PAB (Рисунок 2)
ПРИМЕЧАНИЕ: Все процедуры должны выполняться в соответствии со строгими методами асептической хирургии.
- Побрейте левую сторону грудной клетки с помощью машинки для стрижки и крема для депиляции и подготовьте кожу с помощью аппликаций 2% хлоргексидина с последующим нанесением 70% спиртовых скрабов (повторите три раза).
- Иммобилизуйте передние конечности в открытом положении медицинской лентой, стараясь не перенапрягать конечности, чтобы не нарушить дыхание.
- Правую заднюю конечность потяните немного вниз и зафиксируйте ее вдоль хвоста.
- Вытяните и приведите левую заднюю конечность и прикрепите ее к правой стороне животного, чтобы создать небольшое правое боковое положение, обнажая левую сторону грудной клетки.
- Используйте стерильные перчатки на этом этапе для оставшейся части операции.
- Наложите на животное стерильную простыню и сделайте разрез кожи длиной 2-3 см с левой стороны грудной клетки, начиная примерно на 2 см выше мечевидного отростка и ориентированный по диагонали к основанию левой передней конечности крысы.
- Под кожей разделите впоследствии грудные мышцы (малую и большую) и отодвиньте их в сторону путем тупого рассечения с помощью ножниц с круглым кончиком. Используйте магнитные втягивающие устройства для удержания мышц, чтобы обеспечить правильную визуализацию грудной клетки, расположенной под ними.
- Раздуйте легкие, сняв отводящую трубку (подключенную к аппарату искусственной вентиляции легких) из водяного баллона (см. шаг 3.10). Удаление выпускной трубки из воды снижает давление в легких, что приводит к раздуванию долей.
- Выполните левостороннюю торакотомию с помощью изогнутых рассекающих щипцов. Проткните небольшое отверстие в среднеключичной линии мышцы, расположенной между3-м и4-м ребрами.
- Введите изогнутые щипцы в отверстие и проведите им вдоль левой внутренней стенки мышцы между двумя ребрами, чтобы немного приподнять левую грудную стенку и избежать касания легких при разрезании мышцы.
- Используйте введенные щипцы в качестве ориентира и сделайте разрез продольно к ребрам примерно на 1 см с помощью ножниц по радужной оболочке. Держите левую грудную стенку приподнятой и осторожно манипулируйте ножницами, чтобы не повредить доли левого легкого непосредственно под ней.
- Разверните межреберный разрез на 1-2 см слева от животного с помощью ножниц с круглым концом.
- Переместите ретракторы под ребра, чтобы рана оставалась открытой.
- Осмотрите нижнюю часть тимуса и часть левой доли легкого.
- Отодвиньте вилочковую железу и легкие на этом уровне, учитывая значительное пространство, занимаемое этими органами. Отделите доли тимуса с помощью тупого рассечения щипцами и удерживайте легкое с левой стороны с помощью влажной марли. Затем обнажите верхнюю часть сердца, левое предсердие (ЛП), а также легочный ствол и дугу аорты.
- Осторожно рассеките тонкий слой перикарда, покрывающего сердце в этой области, вместе с любой прикрепленной жировой тканью, чтобы помочь найти часть, где аорта и легочный ствол все еще прикреплены. Минимально рассекайте перикард и избегайте прикосновения к плевральной мембране.
- Вставьте изогнутые щипцы в закрытом положении в пространство между придатком LA и легочным стволом, в середине видимой части сосуда, чтобы добраться до другой стороны сосуда (рис. 2A).
ВНИМАНИЕ: Избегайте работы слишком близко к корню аорты сердца, чтобы предотвратить риск разрыва сосуда и кровоизлияния. - Визуализируйте кончик щипцов через соединительную оболочку краниально к легочному стволу. С помощью вторых щипцов рассеките кончик и осторожно проткните мембрану, чтобы создать небольшое отверстие. Затем изогнутые щипцы, расположенные под легочным стволом, слегка приоткрываются, чтобы захватить шелковую нить 5-0. Втяните щипцы, чтобы провести нить с одной стороны на другую легочного ствола (рисунок 2В, В).
- Выполняют сужение легочного ствола. Во-первых, потренируйтесь в свободном двойном узле 5-0 Silk рядом с артерией. Введите иглу 19 G вдоль сосуда и под нитку. Затяните этот первый узел и зафиксируйте его вторым простым узлом, прежде чем снять 19 G (Рисунок 2D).
ВНИМАНИЕ: Работайте быстро и осторожно, чтобы свести к минимуму продолжительность полной обструкции легочного ствола. - Заведите последний простой узел и обрежьте оставшуюся шелковую нить 5-0 примерно в 0,5-1 см от узла (Рисунок 2D).
- Переместите доли тимуса и удалите ретракторы грудной клетки.
- Повторно накачайте легкие, отщипнув отток аппарата ИВЛ на 2 с.
- Закройте грудную клетку, выполнив схему вышивки крестом с синтетической рассасывающейся нитью 5-0.
- Нанесите несколько капель 0,9% физиологического раствора на область раны и сожмите каждую сторону грудной стенки, чтобы удалить пузырьки воздуха и восстановить отрицательное давление в грудной клетке.
- Переместите грудные мышцы и сотрите оставшийся физиологический раствор стерильной марлей.
- С помощью шприца нанесите блок лидокаина на поверхность и вокруг раны.
- Закройте кожу с помощью синтетической рассасывающейся нити 5-0 с иглой в непрерывном подкожном узоре.
Примечание: Фиктивные крысы получают ту же процедуру без шагов 4.18 и 4.19.
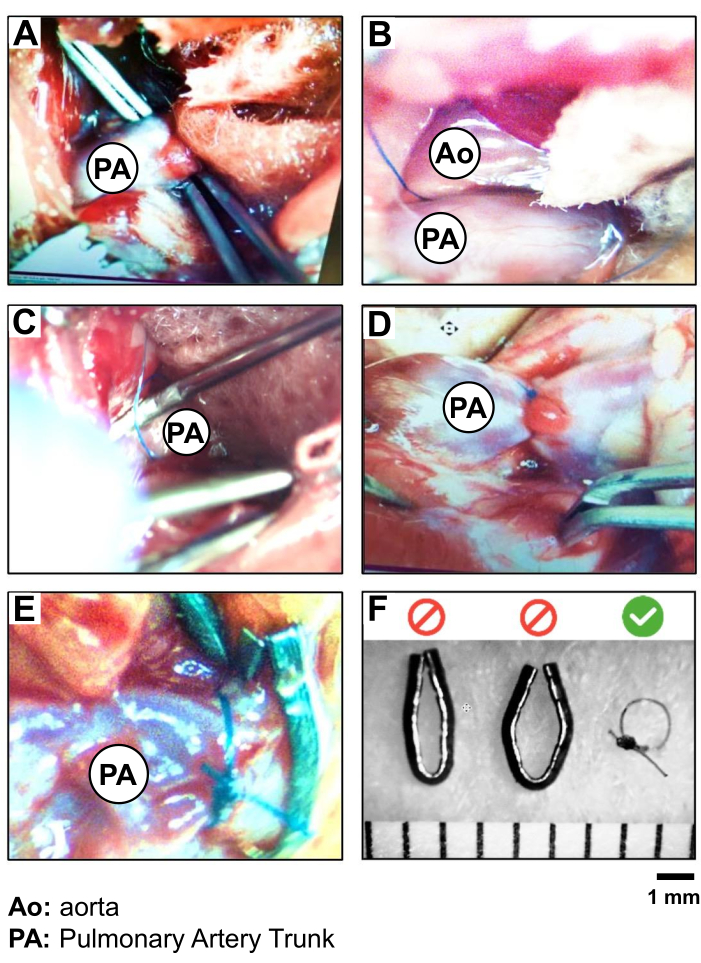
Иллюстрация 2: Процедура PAB и валидация шелкового шовного материала 5.0 по сравнению с металлическими зажимами. Фотосъемка поэтапной изоляции и лигирования ствола ПА, показывающая: (А) экспозицию и изоляцию ствола ПА, (Б) наложение шва (шелк 5,0) вокруг ствола ПА, (В) лигирование ПА (ПАБ) (с использованием иглы 19 G в качестве провода); (D) проверка движения сердца и перегрузки PA-корня и ПЖ после PAB; (E) сравнение PAB, выполненного с помощью шелкового шва, с металлическим зажимом; и (F) валидация выбора шелкового шовного материала для PAB для создания более воспроизводимого диаметра 1 мм вокруг ствола PAB. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Послеоперационное восстановление
- Удаляйте изофлуран, поддерживая крысу на искусственной вентиляции легких только с подачей кислорода. Переверните крысу на правый бок или на брюшной лад, чтобы облегчить дыхание.
- Введите объем 0,9% физиологического раствора подкожно в дорсальную область шеи для ускорения восстановления жидкости (в расчете на 10 мл/кг/ч анестезии).
- Как только автономное дыхание подтвердится, плавно удалите эндотрахеальную трубку.
- Понаблюдайте, когда крыса начнет двигаться самостоятельно, и переложите животное с грелки в новую стерильную клетку для восстановления. Обеспечьте водой и влажным кормом в неограниченном количестве.
- В послеоперационный период (4-6 ч) поместите клетку на грелку (половину клетки), чтобы поддерживать температуру тела, и внимательно следите за животным.
- Своевременно устраняйте любые признаки боли, затрудненного дыхания или ненормального поведения.
- В послеоперационном уходе, через 6 ч после операции, введите вторую дозу 0,05 мг/кг бупренорфина. На следующий день, через 24 ч после операции, введите третью дозу 0,05 мг/кг бупренорфина и вторую дозу 5 мг/кг кетопрофена.
- Следите за крысами до полного восстановления их здоровья.
6. Трансторакальная эхокардиография
ПРИМЕЧАНИЕ: В данной статье представлены данные, полученные на 21-й день после операции, когда крысам была проведена трансторакальная эхокардиография. Однако, в зависимости от целей исследования и требований к дизайну исследования, исследователи могут определить другие временные точки для трансторакальной эхокардиографии до и после PAB.
- Перед операцией проведите базовую трансторакальную эхокардиографию для определения диаметра PA и выбора подходящей измерительной иглы, используемой в качестве отведения, для ожидаемого снижения диаметра PAB на 60%.
ПРИМЕЧАНИЕ: В этом исследовании использовались самцы крыс Wistar весом 225-275 г, и использование иглы 19 г было целесообразным для получения такого 60% уменьшения диаметра PA. - Взвесьте и обезболите крыс непрерывно вдыхаемым изофлураном (3% и 2 л/мин О2).
- Проведите трансторакальную эхокардиографию на каждом животном с использованием секторного/многоэлементного зонда 12S (4,5-11,5 МГц) и системы получения изображений.
- Используйте цветовое отображение в двумерном (2D) парастернальном виде по короткой оси, расположив зонд 12S на уровне аортального клапана. Нажмите кнопку «Цветной допплер» на эхоаппарате, чтобы визуализировать характер кровотока, пересекающего область бандажирования легочной артерии (PAB) в легочном стволе.
- Выполняйте непрерывную волновую допплерографию (CW) путем пересечения PAB с помощью цветового картирования в двухмерном парастернальном виде короткой оси, чтобы записать свойства кровотока, проходящего через область PAB, включая пиковую скорость (см/с) и средний градиент давления (мм рт.ст.). Для получения допплеровских кривых отрегулируйте объем образца на уровне бандажирования легочной артерии.
- Примените 2D апикальный 4-камерный обзор, расположив зонд 12S на уровне верхушки сердца, чтобы продемонстрировать увеличение РА и ПЖ после операции и определить горизонтальный размер РА в конце сердечной систолы (РАД), выраженный в миллиметрах (мм).
- Применение цветовой карты в 2D апикальном 4-камерном виде для выявления трикуспидальной регургитации из-за PAB путем получения кинопетель на эхо-аппарате.
- Выполнить эхокардиографию в М-режиме в апикальном 4-камерном зрении путем пересечения соединения трикуспидального кольца и латеральной стенки ПЖ для изучения систолической экскурсии на плоскости трикуспидального кольца (TAPSE), выраженной в мм.
- Используйте тканевую допплеровскую визуализацию (TDI) в апикальной 4-камерной проекции на уровне соединения трикуспидального кольца и латеральной стенки ПЖ для измерения систолической сократимости (Sr) боковой стенки ПЖ, выраженной в сантиметрах в секунду (см/с), для оценки систолической производительности ПЖ.
- Регистрация диастолического транстрикуспидального потока (TTF) с помощью импульсно-волнового допплера в апикальном 4-камерном виде для изучения диастолических свойств ПЖ, включая пиковую скорость в ранней волне наполнения (E), волне наполнения предсердий (A) и отношение E/A в TTF.
- Выполните эхокардиографию в режиме М в парастернальной проекции по длинной оси на уровне аортального клапана для измерения выходного тракта ПЖ в конце сердечной диастолы (RVOT, выраженный в миллиметрах) и размера левого предсердия в конце сердечной систолы (ПМЖ, выраженный в миллиметрах).
- Выполнение эхокардиографии 2D M-Mode в парастернальной проекции по короткой оси на уровне папиллярных мышц для оценки размеров ЛЖ на конечных участках систолы и диастолы (LVD и LVDd); и толщина передней стенки ЛЖ в конце диастолы (LVAWd), выраженные в миллиметрах.
- Выполните 2D M-режим в парастернальном виде по короткой оси, чтобы определить дробное укорачивание LV (LVFS, выраженное в процентах) и фракцию выброса LV (LVEF, выраженное в процентах).
7. Электрофизиологическое исследование (Рисунок 3)
- Поддерживайте крыс под анестезией после эхокардиографии in vivo для чреспищеводного электрофизиологического исследования (ЭПС) in vivo .
- Вставьте электроды ЭКГ под кожу крыс (1 рядом с левой передней конечностью, 1 рядом с правой задней конечностью и 1 рядом с левой задней конечностью).
- Аккуратно введите в пищевод 4F-квадриполярный катетер с межполюсным расстоянием 5 мм (рисунок 3A).
- Отрегулируйте положение чреспищеводного катетера рядом с РА, точно определив, когда зубец P, представляющий сокращения предсердий на поверхностной ЭКГ, совпадает с зубцом P, полученным с помощью ЭКГ чреспищеводного катетера (рис. 3A, B).
- Определите порог стимуляции для каждого животного. Этот порог представляет собой минимальное напряжение, при котором стимулятор напрямую влияет на частоту сердечных сокращений.
- Оцените уязвимость ФП путем применения импульса напряжения, эквивалентного 4-кратному пороговому напряжению, следуя протоколу из 3 наборов по 12 импульсов стимуляции, каждый из которых длится 3 с при частоте 50 Гц, с последующим 2 с отдыха (1 мин/сет). Между каждым подходом у крыс был 1-минутный период отдыха 9,13,21.
- Выявляйте и количественно оценивайте после каждого всплеска возникновение сердечных тахиаритмий, включая ФП или трепетание предсердий.
ПРИМЕЧАНИЕ: ФП определяется как нерегулярное и сверхбыстрое сердцебиение (>800 уд/мин). Трепетание предсердий определяется как регулярный, но быстрый ритм предсердий, связанный с отсутствием зубца P или наличием регулярного паттерна множественных зубцов P между регулярно последовательными интервалами R-R. Учитываются только аритмические эпизоды продолжительностью более 1 с. - Избегайте прерывания текущих эпизодов ФП или трепетания предсердий, прекратив следующий набор стимуляций, если синусовый ритм не восстанавливается самостоятельно в течение периода покоя между двумя последовательными стимуляциями.
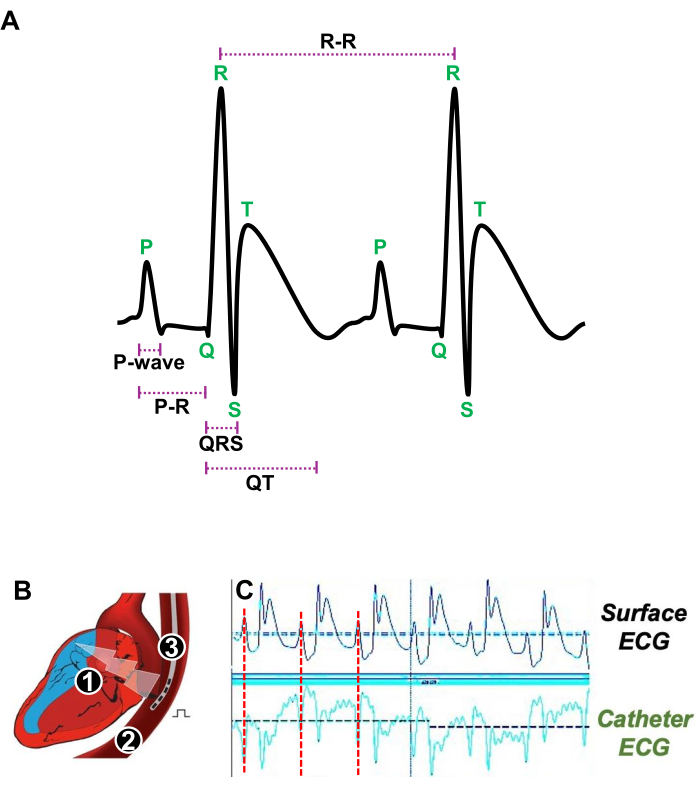
Рисунок 3: Иллюстрация сердечных сокращений в состоянии покоя и соответствующего положения чреспищеводного катетера для электрофизиологического исследования in vivo . (A) Репрезентативная ЭКГ двух последовательных сердечных сокращений в состоянии покоя с показом P-зубца, интервала PR, комплекса QRS, интервала QT и интервала R-R. (В) Схема продольного разреза сердца (1) и пищевода (2), в который вводится квадрипольный катетер (3) для стимуляции и получения ЭКГ предсердий. (C) Репрезентативные сигналы ЭКГ, показывающие предпочтительное положение чреспищеводного катетера, когда предсердный сигнал (красная линия) от поверхностной ЭКГ (верхние следы) совпадает с предсердным сигналом катетерной ЭКГ (нижние следы). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
8. Анализ ЭКГ
ПРИМЕЧАНИЕ: Запись и стимуляция ЭКГ проводились с использованием программного обеспечения для сбора ЭКГ. Анализы проводились с использованием программного обеспечения для анализа ЭКГ (рис. 3A).
- Измерьте продолжительность зубца P, соответствующего сокращению предсердий, выраженную в миллисекундах (мс).
- Определить интервал PR (выраженный в миллисекундах), соответствующий длительности электрической проводимости через атриовентрикулярный (АВ) узел.
- Сообщают о длительности комплекса QRS (выраженной в миллисекундах), соответствующей деполяризации желудочков.
- Оценивали интервал QT (выраженный в миллисекундах), отражающий общую продолжительность деполяризации и реполяризации желудочков.
- Количественно оцените интервал RR (выраженный в миллисекундах), указывающий на продолжительность между двумя последовательными сердечными сокращениями и определяющий частоту сердечных сокращений.
9. Гистологические анализы
- Усыпляют крыс методом обескровливания под анестезией изофлураном (5%, 2 л/мин О2) на 21 день после ПАБ.
- Изолируйте РА и ЛП для анализа гистологического ремоделирования предсердий, ассоциированного или не связанного с РГЛ и сердечными аритмиями.
- Выполните поперечный срез свежеиссеченных сердец, расположенный на расстоянии 5 мм от верхушки, чтобы оценить ремоделирование желудочков, связанное или не связанное с РГЛ и сердечными аритмиями.
- Зафиксировать образцы миокарда в формалине и окрашивать гистологические стекла трихромным раствором22 Массона для количественной оценки толщины стенки желудочка и дилатации, а также фиброза предсердий при D21 после PAB.
10. Статистический анализ
- Оцените нормальность распределений по критерию Шапиро-Уилка. Сравните нормально распределенные данные с помощью t-критерия Стьюдента.
- Если данные имеют непараметрическое распределение, выполните тест Манна-Уитни. Анализируйте категориальные переменные, такие как индуцируемость AF, с помощью точного теста Фишера.
- Выразите результаты в виде среднего ± стандартной погрешности к среднему значению (S.E.M.). Учитывайте различия, статистически значимые при двустороннем значении P < 0,05.
Результаты
Визуальное подтверждение соответствующей перевязки ствола ПА во время операции
Во время процедуры PAB признаком правильного расположения шва является немедленное повышение артериального давления и быстрое расширение RV и корня PA-ствола в месте соединения ...
Обсуждение
Успешная работа PAB является наиболее важной частью этого протокола. Важно правильно различать аорту и ствол ПА. Изоляция ПА должна быть выполнена тщательно, чтобы избежать разрыва, кровотечения и смерти во время процедуры. Наложение шва вокруг отведения 19G должно быть...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы выражают благодарность Коломбу Рою, ЯнФен Ши, Сандре Куэрри и Джозиан Десландес за технические характеристики трансторакальной эхокардиографии и Натали Л'Эро за предварительную техническую помощь во время стандартизации метода PAB. Мы благодарны сотрудникам учреждения по уходу за животными Монреальского института сердца.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
Ссылки
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены