Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle de rat de remodelage cardiaque du côté droit et d’arythmie à l’aide d’un cerclage de l’artère pulmonaire
Dans cet article
Résumé
L’insuffisance cardiaque droite (RHF) se caractérise par une dilatation et une hypertrophie cardiaques du côté droit, entraînant un dysfonctionnement ventriculaire et auriculaire. Les affections cardiopulmonaires associées à la FRH s’accompagnent d’un risque accru d’arythmies cardiaques. Cet article décrit un modèle standardisé de RHF induite par le cerclage de l’artère pulmonaire associé à une arythmogenèse ventriculaire et auriculaire améliorée.
Résumé
Les affections cliniques, y compris la bronchopneumopathie chronique obstructive ou l’hypertension artérielle pulmonaire (HTAP), peuvent entraîner une surcharge chronique de la pression du ventricule droit et une insuffisance cardiaque droite progressive (FHR). La RHF peut être identifiée par une hypertrophie cardiaque du côté droit et une dilatation associée à une fonction myocardique anormale affectant le VD et l’oreillette droite (PR). Nous avons récemment démontré qu’une FRH sévère s’accompagne d’un risque accru d’inflammation auriculaire, de fibrose auriculaire et de fibrillation auriculaire (FA), le type le plus courant d’arythmie cardiaque (AC). Des études récentes ont montré que l’inflammation du rotavirus et de la polyarthrite rhumatoïde joue un rôle important dans l’arythmogenèse de l’AC, y compris la FA. Cependant, l’impact de l’inflammation dans le développement de l’AC et de la FA dans la RHF est mal décrit.
Des modèles expérimentaux de RHF sont nécessaires pour mieux comprendre l’association entre l’inflammation du myocarde du côté droit et l’AC. Le modèle chez le rat de l’hypertension pulmonaire (HTP) induite par la monocrotaline (TCM) est bien établi pour provoquer la FHR. Cependant, la TCM déclenche une pneumotoxicité sévère et une inflammation pulmonaire. Par conséquent, la RHF induite par le TCM n’aide pas à distinguer si l’inflammation myocardique ultérieure provient de la RHF en soi ou des signaux inflammatoires circulants sécrétés par le poumon lésé.
Dans cet article, une méthode mécanique impliquant l’anneau du tronc de l’artère pulmonaire (PAB) a été utilisée pour provoquer l’arythmogenèse cardiaque droite. Le PAB consiste à réaliser une suture permanente du tronc de l’artère pulmonaire pendant 3 semaines. Une telle approche génère une surcharge de pression accrue du côté droit. À J21 post-PAB, la suture entraîne une hypertrophie, une dilatation et une inflammation du VD et de la PR. La RHF induite par le PAB s’accompagne également d’une vulnérabilité aux arythmies ventriculaires et auriculaires, y compris la FA.
Introduction
L’insuffisance cardiaque droite (RHF) est caractérisée par une hypertrophie et une dilatation du ventricule droit (VD) et auriculaire (PR), entraînant un dysfonctionnement cardiaque du côté droit en réponse à une surcharge chronique de la pression du VD due à la constriction des artères pulmonaires (PA)1. Par conséquent, les conditions provoquant le rétrécissement de l’AP peuvent être responsables d’un risque accru de RHF 1,2,3,4. Les données cliniques ont révélé que la RHF est la principale cause d’hospitalisation (56 %) chez les patients atteints d’hypertension artérielle (HTAP)2. Des études cliniques ont montré que, quelle que soit la cause de l’HTAP, y compris l’hypertension pulmonaire (HTP) thromboembolique et l’HTAP idiopathique, les patients sont souvent touchés par la FHR et sont 20 % plus susceptibles de développer des arythmies cardiaques, y compris les tachyarythmies supraventriculaires et la fibrillation auriculaire (FA)2,5,6.
Pour mieux comprendre l’association entre l’HTAP et la RHF, des études animales, y compris le modèle d’une dose unique de monocrotaline (MCT), ont été utilisées pour provoquer une inflammation pulmonaire sévère et une RHF 7,8. Nous avons récemment observé que la RHF induite par le TCM était associée à l’inflammation de la PR et àla FA 9. Cependant, en raison de l’importance de l’inflammation pulmonaire induite par les TCM et des cytokines circulantes, il était difficile de décrire si l’inflammation des PR induite par les TCM est une conséquence de la FRH seulement9. Par conséquent, un nouveau modèle d’arythmie cardiaque induite par la FRH était nécessaire pour étudier l’état inflammatoire de la PR.
Le modèle expérimental de bande tronciale PA (PAB) a été utilisé chez diverses espèces animales pour imiter les maladies obstructives de l’AP et pour étudier le remodelage cardiaque pathologique associé affectant le côté droit du cœur10. La PAB a été signalée comme une méthode efficace pour induire un dysfonctionnement et un échec du VD droit dans diverses études imitant la surcharge du VD 10,11,12,13,14,15,16. Techniquement, la PAB est la mise en place d’une suture permanente sur le tronc PA, provoquant une réduction mécanique du diamètre10 du tronc PA. Le PAB génère une surcharge de pression accrue vers le RV10. Tout d’abord, en tant qu’adaptation compensatoire à l’augmentation soudaine de la postcharge du rotavirus, la cavité du rotavirus est dilatée, ce qui entraîne une hypertrophie chronique du rotavirus10,13. La dilatation et l’hypertrophie du VD affectent les valves tricuspides, qui deviennent perméables13. Plus précisément, la dilatation prononcée du RV combinée à une forte postcharge du RV a pour effet d’étirer l’anneau de la valve tricuspide situé entre le RV et le RA13,17. En raison de l’occlusion incomplète de la valve, une partie du sang éjecté du VD pendant la systole sera dirigée vers la cavité PR17. La fuite de la valve tricuspide peut être observée par échocardiographie et est appelée régurgitation tricuspide17. Ensuite, le PR reçoit une pression artérielle élevée inappropriée, ce qui contribue à une dilatation et à une hypertrophie accrues de la PR13. Le remodelage chronique du VD et de la PR s’accompagne de réactions inflammatoires myocardiques locales conduisant à une fibrose du VD et de la PR et à une perte de fonction 9,13. La fibrose cardiaque se caractérise par le développement de zones de basse tension moins contractiles et plus susceptibles de provoquer un blocage de conduction et des circuits de rentrée impliqués dans le développement d’arythmies cardiaques, notamment la fibrillation ventriculaire et la FA18,19.
L’originalité de cet article réside dans l’utilisation d’une méthode standardisée de remodelage cardiaque droit induit par la PAB pour provoquer et étudier l’inducibilité des arythmies cardiaques dans les 3 semaines suivant la PAB. Les principaux avantages de cette approche chirurgicale sont : i) le contrôle direct de la réduction du diamètre du tronc PA et ii) l’évitement de l’inflammation pulmonaire pour se concentrer sur l’inflammation myocardique induite par la FRH pour étudier les arythmies cardiaques, y compris la FA.
L’approche décrite ici implique une procédure microchirurgicale précise pour créer le PAB, une évaluation de l’augmentation de la postcharge VD, une échocardiographie pour observer le remodelage structurel et fonctionnel du myocarde induit par le PAB, et une étude électrophysiologique pour évaluer la vulnérabilité aux arythmies cardiaques, y compris la FA.
Protocole
Toutes les procédures décrites ci-dessous ont été approuvées par le comité d’éthique de l’Institut de Cardiologie de Montréal (numéros de protocole : 2021-2938-2021-47-01 et 2024-3412-2024-48-01) et ont strictement suivi les lignes directrices du Conseil canadien de protection des animaux (CCPA). Des rats Wistar mâles (225-275 g) âgés de 6 à 8 semaines ont été utilisés pour les procédures. Tous les animaux ont été hébergés dans le centre de soins animaliers de l’Institut de Cardiologie de Montréal, avec un accès gratuit à l’eau et à la nourriture.
1. Préparation préopératoire
- Stérilisez tous les instruments et matériaux chirurgicaux avant l’intervention chirurgicale à l’aide d’un autoclave de vapeur saturée à haute pression à des températures comprises entre 121 °C et 134 °C sous 15-30 psi pendant 30 à 40 min, suivi d’un cycle de séchage de 25 min.
- Préparez tous les volumes de médicaments nécessaires à la chirurgie. Utiliser une approche analgésique multimodale impliquant de la buprénorphine (0,05 mg/kg) et du kétoprofène (5 mg/kg) injectés par voie sous-cutanée 30 min avant l’intervention et répétés à 6 h (buprénorphine) et 24 h après l’intervention (buprénorphine et kétoprofène). De plus, effectuez une analgésie locale au site d’incision (lidocaïne 5 mg/mL).
- Effectuez une échocardiographie transthoracique de base avant la chirurgie (voir la procédure détaillée pour l’échocardiographie transthoracique aux étapes 6.1 à 6.13) afin de déterminer le diamètre de l’AP et de sélectionner l’aiguille de calibre appropriée qui sera utilisée comme sonde pour générer la réduction attendue de 60 % du diamètre de l’AP pendant l’APB.
REMARQUE : Dans cet article, des rats Wistar mâles de 225 à 275 g ont été utilisés, et l’utilisation d’une aiguille de 19 G était appropriée pour générer une réduction de 60 % du diamètre de l’AP. - Préparez une aiguille de 19 G (ou du calibre approprié tel que déterminé à l’étape 1.3) qui sera utilisée comme sonde (voir ci-dessous : étapes 4.18 et 4.19) pour obtenir une constriction optimale du tronc de l’AP, provoquant un remodelage sévère du cœur du rat. À l’aide d’une pince, pliez le 19 G à 90-110° (Figure 1A).
REMARQUE : La flexion du 19 G facilite i) le positionnement près du tronc PA et ii) l’application de la ligature pendant la procédure. Le 19 G est utilisé comme une sonde autour de laquelle la suture sera installée pour réduire le diamètre du PA à 1,0 mm (réduction de 60 % pour les rats pesant 225-275 g), ce qui induit une surcharge de pression importante du VD responsable d’un remodelage sévère du VD en 3 semaines.
2. Induction de l’anesthésie et préparation des animaux
REMARQUE : Les analyses ont été effectuées sur des rats Wistar mâles (225-275 g) âgés de 6 à 8 semaines. Utilisez un coussin chauffant pendant toutes les étapes des procédures suivantes pour maintenir la température corporelle de l’animal autour de 37 °C. Appliquez une sonde rectale pour surveiller la température corporelle.
- Anesthésier l’animal avec de l’isoflurane à 3 % et de l’oxygène à 100 % à 2-3 L/min.
- Appliquez un gel lubrifiant pour les yeux pour protéger la cornée de la dessiccation.
- Vérifiez le niveau d’anesthésie à l’aide du réflexe de pincement de l’orteil.
3. L’intubation
REMARQUE : L’intubation a été effectuée comme décrit précédemment20.
- Transférez l’animal vers une station d’intubation inclinée en position couchée. Tenez le rat par les incisives supérieures à l’aide d’une boucle de fil pour maintenir le corps en position suspendue à 45° afin d’obtenir une meilleure visualisation de la gorge.
- Dirigez une source lumineuse flexible vers la surface du cou pour transilluminer à travers la région pharyngoépiglottique.
- Étendez la langue à l’aide d’un coton-tige et stabilisez-la sur le maxillaire à l’aide d’une spatule pesée incurvée comme abaisse-langue.
- Visualisez la trachée et les cordes vocales.
- Utilisez un angiocathéter de 16 G pour effectuer l’intubation. Utilisez le cathéter comme tube trachéal et émoussez l’aiguille à pointe biseautée pour l’utiliser comme introducteur.
- Avancez la sonde endotrachéale (angiocathéter 16 G) montée sur l’introducteur (aiguille à pointe biseautée) dans la trachée et, une fois positionnée, retirez l’introducteur (Figure 1B).
- Confirmez la position correcte du tube en observant un schéma respiratoire normal (environ 80 respirations/min pour les rats pesant 225 g et environ 70 respirations/min pour les rats pesant 275 g) et la présence de brouillard à la surface de la spatule métallique (ou du petit miroir) lorsqu’elle est placée sur le rebord du moyeu de la canule.
- Une fois correctement intubé, transférez rapidement l’animal au poste chirurgical en décubitus dorsal sur un coussin chauffant homéothermique.
- Ajustez le volume courant et le débit du ventilateur en fonction du poids corporel du rat. Les rats d’environ 225 à 275 g reçoivent un volume courant de 2,0 à 2,5 ml et 70 à 80 respirations par minute avec le ventilateur.
- Connectez la sonde endotrachéale au ventilateur pour initier la ventilation mécanique. Placez l’embout de sortie du ventilateur dans un cylindre d’eau. Les bulles d’air qui sortent de l’écoulement après chaque respiration indiquent une intubation réussie.
- Une fois la respiration régulière établie, fixez le tube endotrachéal avec du ruban chirurgical et fixez la sonde rectale le long de la queue pour surveiller la température corporelle.
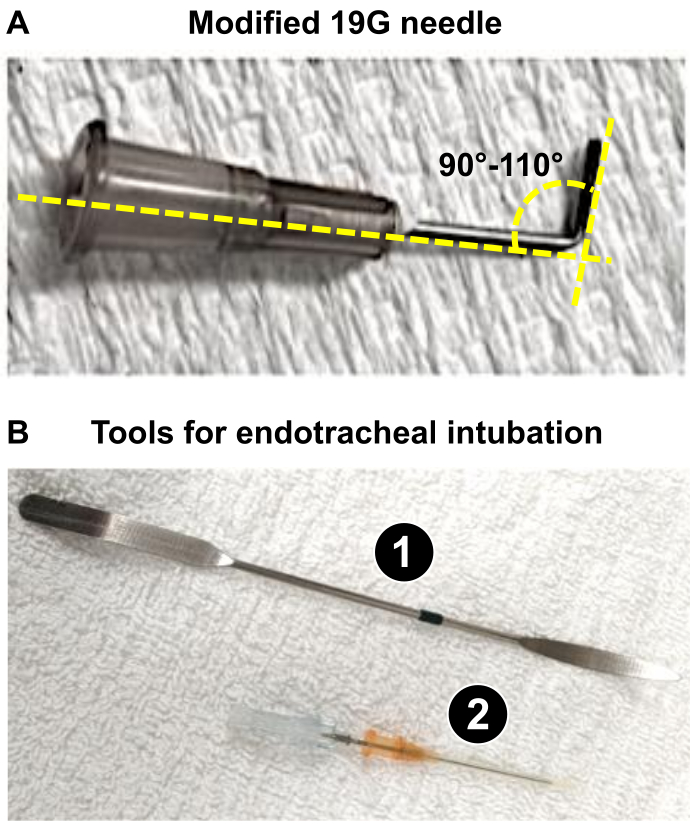
Figure 1 : Principaux instruments nécessaires à la préparation de l’intervention microchirurgicale de la PAB. (A) Aiguille 19 G modifiée utilisée comme sonde pour obtenir un diamètre de 1 mm du tronc de l’AP après PAB. (B) Outils endotrachéaux utilisés ou intubation réussie de rats. 1. La spatule est utilisée comme abaisse-langue sur les rats anesthésiés pour exposer la trachée. 2. Le cathéter 16G agit comme un tube endotrachéal après avoir émoussé la pointe de son stylet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Chirurgie de la PAB (Figure 2)
REMARQUE : Toutes les procédures doivent être effectuées selon des techniques de chirurgie aseptique strictes.
- Rasez le côté gauche du thorax à l’aide d’une tondeuse et d’une crème dépilatoire et préparez la peau avec des applications de chlorhexidine à 2 % suivies de gommages à 70 % d’alcool (répétés trois fois).
- Immobilisez les membres antérieurs en position ouverte avec du ruban adhésif médical, en prenant soin de ne pas trop étendre les membres pour éviter d’affecter la respiration.
- Tirez légèrement la patte arrière droite vers le bas et fixez-la le long de la queue.
- Étendez et adduisez le membre postérieur gauche et fixez-le sur le côté droit de l’animal pour générer une légère position latérale droite, exposant le côté gauche de la poitrine.
- Utilisez des gants stériles à cette étape pour le reste de la chirurgie.
- Placez un champ stérile sur l’animal et faites une incision cutanée de 2 à 3 cm sur le côté gauche du thorax, en commençant à environ 2 cm au-dessus de l’apophyse xiphoïde et en l’orientant en diagonale vers la base du membre antérieur gauche du rat.
- Sous la peau, séparez ensuite les muscles pectoraux (pectoraux petits et majeurs) et écartez-les par dissection émoussée à l’aide de ciseaux à bout rond. Utilisez des écarteurs magnétiques pour maintenir les muscles, afin de permettre une bonne visualisation de la cage thoracique située en dessous.
- Dégonflez les poumons en retirant le tube de sortie (relié au ventilateur) du cylindre d’eau (voir étape 3.10). Le retrait du tube d’écoulement de l’eau abaisse la pression dans les poumons, ce qui génère le dégonflage des lobes.
- Effectuez une thoracotomie du côté gauche avec une pince de dissection incurvée. Percez un petit trou dans la ligne médiane claviculaire du muscle situé entre la 3e et la4e côte.
- Introduisez la pince incurvée dans l’ouverture et faites-la glisser le long de la paroi intérieure gauche du muscle entre les deux côtes pour soulever légèrement la paroi thoracique gauche et éviter de toucher les poumons tout en coupant le muscle.
- Utilisez la pince introduite comme guide et faites une incision longitudinale aux côtes sur environ 1 cm avec des ciseaux à oris. Maintenez la paroi thoracique gauche soulevée et manipulez les ciseaux avec précaution pour éviter d’endommager les lobes pulmonaires gauches directement en dessous.
- Élargissez l’incision intercostale à 1-2 cm à gauche de l’animal à l’aide de ciseaux à bout rond.
- Repositionnez les écarteurs sous les côtes pour garder la plaie ouverte.
- Observez la partie inférieure du thymus et une partie du lobe gauche du poumon.
- Écartez le thymus et les poumons à ce niveau, compte tenu de l’espace important occupé par ces organes. Séparez les lobes du thymus à l’aide d’une dissection émoussée à l’aide d’une pince et tenez le poumon du côté gauche à l’aide de gaze humide. Ensuite, exposez la partie supérieure du cœur, l’oreillette gauche (LA) ainsi que le tronc pulmonaire et l’arc aortique.
- Disséquez soigneusement la fine couche de péricarde qui recouvre le cœur dans cette zone, ainsi que tout tissu adipeux attaché, pour aider à localiser la partie où l’aorte et le tronc pulmonaire sont encore attachés. Disséquez le péricarde de manière minimale et évitez de toucher la membrane pleurale.
- Insérez la pince incurvée en position fermée dans l’espace entre l’appendice AL et le tronc pulmonaire, au milieu de la partie visible du vaisseau, pour atteindre l’autre côté du vaisseau (figure 2A).
ATTENTION : Évitez de travailler trop près de la racine aortique du cœur pour éviter le risque de rupture des vaisseaux et d’hémorragie. - Visualisez l’extrémité de la pince à travers la membrane conjonctive crânienne jusqu’au tronc pulmonaire. Utilisez la deuxième pince pour disséquer sur la pointe et percez soigneusement la membrane pour créer une petite ouverture. La pince incurvée positionnée sous le tronc pulmonaire est ensuite légèrement ouverte afin d’attraper un fil de soie 5-0. Rétractez la pince pour amener le fil d’un côté à l’autre du tronc pulmonaire (Figure 2B, C).
- Effectuer la constriction du tronc pulmonaire. Tout d’abord, pratiquez un double nœud lâche de la soie 5-0 près de l’artère. Insérez l’aiguille 19 G le long du récipient et sous le fil. Serrez ce premier nœud et fixez-le avec un deuxième nœud simple avant de retirer le 19 G (Figure 2D).
ATTENTION : Travaillez rapidement et soigneusement pour minimiser la durée de l’obstruction complète du tronc pulmonaire. - Effectuez un dernier nœud simple et coupez le fil de soie 5-0 restant à environ 0,5-1 cm du nœud (Figure 2D).
- Repositionnez les lobes du thymus et retirez les écarteurs thoraciques.
- Regonflez les poumons en pinçant l’écoulement du ventilateur pendant 2 s.
- Fermez la cage thoracique en effectuant un motif de point de croix avec un fil de suture synthétique résorbable 5-0.
- Appliquez quelques gouttes de solution saline à 0,9 % sur la zone de la plaie et comprimez chaque côté de la paroi thoracique pour éliminer les bulles d’air et rétablir la pression thoracique négative.
- Repositionnez les muscles pectoraux et essuyez le reste de solution saline avec une gaze stérile.
- À l’aide d’une seringue, appliquez un bloc d’éclaboussures de lidocaïne sur la surface et la zone environnante de la plaie.
- Fermez la peau à l’aide d’un fil de suture synthétique résorbable 5-0 avec une aiguille selon un motif sous-cuticulaire continu.
REMARQUE : Les rats fictifs reçoivent la même procédure sans les étapes 4.18 et 4.19.
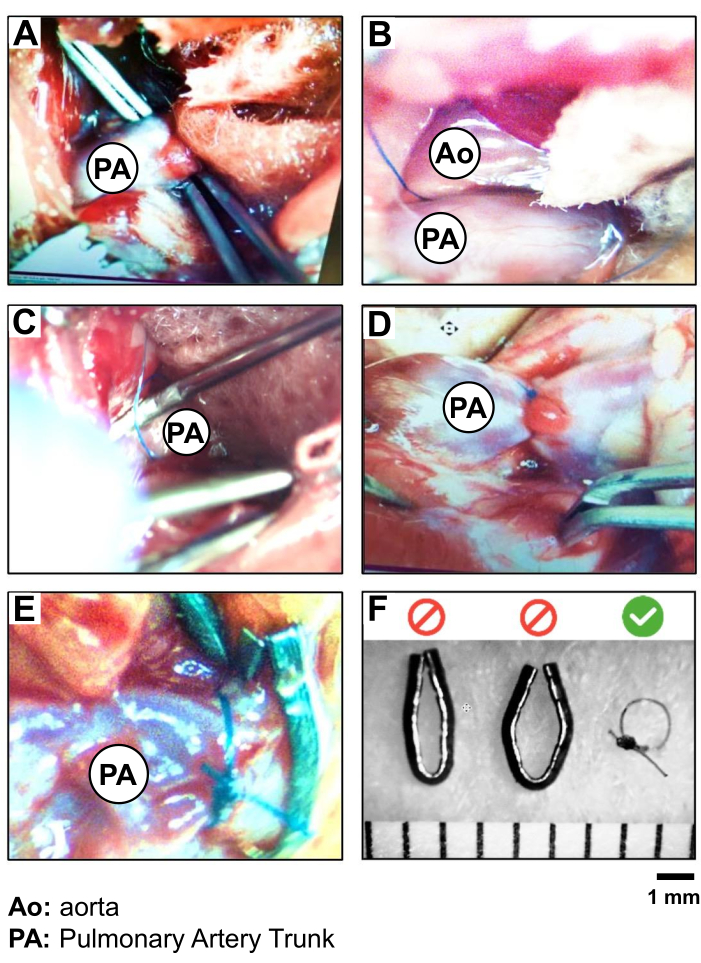
Figure 2 : Procédure PAB et validation de la suture en soie 5.0 par rapport aux clips métalliques. Photographie de l’isolement et de la ligature étape par étape du tronc de l’AP, montrant (A) l’exposition et l’isolement du tronc de l’AP, (B) le positionnement de la suture (soie 5.0) autour du tronc de l’AP, (C) la ligature de l’AP (PAB) (à l’aide d’une aiguille de 19 G comme sonde) ; (D) la vérification du mouvement cardiaque et de la surcharge de la racine PA et du VD après PAB ; (E) une comparaison de la PAB réalisée avec une suture en soie par rapport à une pince métallique ; et (F) la validation du choix de la suture en soie pour le PAB afin de créer un diamètre plus reproductible de 1 mm autour du tronc du PA. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Récupération postopératoire
- Retirer l’isoflurane tout en maintenant le rat sous ventilation mécanique avec débit d’oxygène seulement. Tournez le rat sur son côté droit ou ventral pour faciliter la respiration.
- Injecter un volume de solution saline à 0,9 % par voie sous-cutanée dans la région dorsale du cou pour favoriser la récupération des fluides (calculée comme 10 mL/kg/h d’anesthésie).
- Une fois la respiration autonome confirmée, retirez doucement le tube endotrachéal.
- Observez quand le rat commence à se déplacer tout seul et transférez l’animal du coussin chauffant dans une nouvelle cage stérile pour la récupération. Fournir de l’eau et de la nourriture humide à volonté.
- Pendant la période postopératoire (4 à 6 h), placez la cage sur un coussin chauffant (la moitié de la cage) pour aider à maintenir la température corporelle et surveiller de près l’animal.
- Gérez rapidement tout signe de douleur, de difficulté respiratoire ou de comportement anormal.
- En soins postopératoires, 6 h après l’intervention, injecter une deuxième dose de 0,05 mg/kg de buprénorphine. Le lendemain, 24 h après l’opération, injecter une troisième dose de 0,05 mg/kg de buprénorphine et une deuxième dose de 5 mg/kg de kétoprofène.
- Surveillez les rats jusqu’à ce qu’ils se rétablissent complètement.
6. Échocardiographie transthoracique
REMARQUE : Cet article présente des données obtenues le 21e jour après l’opération, lorsque les rats ont été soumis à une échocardiographie transthoracique. Cependant, en fonction des objectifs de recherche et des exigences de la conception de l’étude, les chercheurs peuvent définir d’autres points temporels pour l’échocardiographie transthoracique pré et post-PAB.
- Effectuer une échocardiographie transthoracique de base avant la chirurgie afin de déterminer le diamètre de l’AP et de sélectionner l’aiguille de calibre appropriée utilisée comme sonde pour générer la réduction attendue de 60 % du diamètre de l’AP pendant la PAB.
REMARQUE : Dans cette étude, des rats Wistar mâles de 225 à 275 g ont été utilisés et l’utilisation d’une aiguille de 19 g était appropriée pour générer une réduction de 60 % du diamètre de l’AP. - Peser et anesthésier les rats avec de l’isoflurane inhalé en continu (3 % et 2 L/minO2).
- Réaliser une échocardiographie transthoracique sur chaque animal à l’aide d’une sonde sectorielle/multi-éléments 12S (4,5-11,5 MHz) et d’un système d’acquisition d’images.
- Utilisez la cartographie des couleurs dans une vue parasternale bidimensionnelle (2D) à court axe en positionnant la sonde 12S au niveau de la valve aortique. Cliquez sur le bouton Doppler couleur de l’échographe pour visualiser le schéma du flux sanguin traversant la zone de l’anneau de l’artère pulmonaire (PAB) dans le tronc pulmonaire.
- Effectuez un Doppler à ondes continues (CW) en traversant le PAB guidé par une cartographie des couleurs dans la vue parasternale 2D à axe court pour enregistrer les propriétés du flux sanguin traversant la zone PAB, y compris la vitesse de pointe (cm/s) et le gradient de pression moyen (mmHg). Pour obtenir les courbes Doppler, ajustez le volume de l’échantillon au niveau de l’anneau de l’artère pulmonaire.
- Appliquez une vue apicale 2D à 4 chambres en positionnant la sonde 12S au niveau de l’apex du cœur pour démontrer l’élargissement de la PR et du VD suite à la chirurgie et déterminez la dimension horizontale de la PR à l’extrémité de la systole cardiaque (RADs) exprimée en millimètres (mm).
- Appliquez le mappage des couleurs en vue apicale 2D à 4 chambres pour révéler la régurgitation tricuspide due à la PAB en acquérant des boucles cinétiques sur la machine d’écho.
- Réaliser une échocardiographie en mode M en vue apicale à 4 chambres en croisant la conjonction de l’anneau tricuspide et de la paroi latérale du VD pour étudier l’excursion systolique du plan de l’anneau tricuspide (TAPSE) exprimée en mm.
- Utilisez l’imagerie Doppler tissulaire (TDI) dans la vue apicale à 4 chambres au niveau de la conjonction de l’anneau tricuspide et de la paroi latérale du VD pour la mesure de la contractilité systolique (Sr) de la paroi latérale du VD exprimée en centimètres par seconde (cm/s) afin d’évaluer les performances systoliques du VD.
- Enregistrez l’écoulement trans-tricuspide diastolique (TTF) à l’aide d’un Doppler à ondes pulsées dans la vue apicale à 4 chambres pour étudier les propriétés diastoliques du RV, y compris la vitesse de pointe dans l’onde de remplissage précoce (E), l’onde de remplissage auriculaire (A) et le rapport E/A dans le TTF.
- Réaliser une échocardiographie en mode M dans la vue parasternale grand axe au niveau de la valve aortique pour mesurer la voie d’éjection du VD à la fin de la diastole cardiaque (RVOT, exprimée en millimètres) et la dimension de l’oreillette gauche à l’extrémité de la systole cardiaque (DAL, exprimée en millimètres).
- Effectuer une échocardiographie 2D en mode M en vue parasternale à court axe au niveau des muscles papillaires pour évaluer les dimensions VG en fin de systole et en diastole (LVDs et LVDd) ; et l’épaisseur de la paroi antérieure du VG à la fin de la diastole (LVAWd), toutes exprimées en millimètres.
- Effectuez le mode M 2D en vue parasternale à court axe pour déterminer le raccourcissement fractionnel du VG (LVFS, exprimé en pourcentage) et la fraction d’éjection du VG (LVEF, exprimée en pourcentage).
7. Étude électrophysiologique (Figure 3)
- Maintenir les rats sous anesthésie après échocardiographie in vivo pour une étude électrophysiologique transœsophagienne (EPS) in vivo .
- Insérez les électrodes ECG sous la peau des rats (1 près du membre antérieur gauche, 1 près du membre postérieur droit et 1 près du membre postérieur gauche).
- Introduisez doucement un cathéter quadripolaire 4F avec une distance interpolaire de 5 mm dans l’œsophage (Figure 3A).
- Ajustez la position du cathéter transœsophagien près de l’AR en déterminant précisément quand l’onde P, qui représente les contractions auriculaires sur l’ECG de surface, correspond à l’onde P obtenue avec l’ECG du cathéter transœsophagien (Figure 3A, B).
- Déterminez le seuil de stimulation pour chaque animal. Ce seuil est la tension minimale à laquelle le stimulateur influence directement la fréquence cardiaque.
- Évaluez la vulnérabilité de l’AF en appliquant une rafale de tension équivalente à 4 fois la tension de seuil en suivant un protocole de 3 séries de 12 rafales de stimulation, chacune d’une durée de 3 s à 50 Hz, suivie de 2 s de repos (1 min/série). Entre chaque série, les rats ont eu une période de repos de 1 minute 9,13,21.
- Identifier et quantifier, après chaque rafale, l’apparition de tachyarythmies cardiaques, y compris la FA ou le flutter auriculaire.
REMARQUE : La mise au point automatique est définie comme des battements auriculaires irréguliers et ultrarapides (>800 bpm). Le flutter auriculaire est défini comme un rythme auriculaire régulier mais rapide associé à une absence de l’onde P ou à la présence d’un modèle régulier de plusieurs ondes P entre des intervalles R-R régulièrement consécutifs. Seuls les épisodes arythmiques d’une durée supérieure à 1 s sont pris en compte. - Évitez d’interrompre les épisodes continus de FA ou de flutter auriculaire en arrêtant la prochaine série de stimulations si le rythme sinusal n’est pas récupéré de lui-même pendant la période de repos entre deux stimulations consécutives.
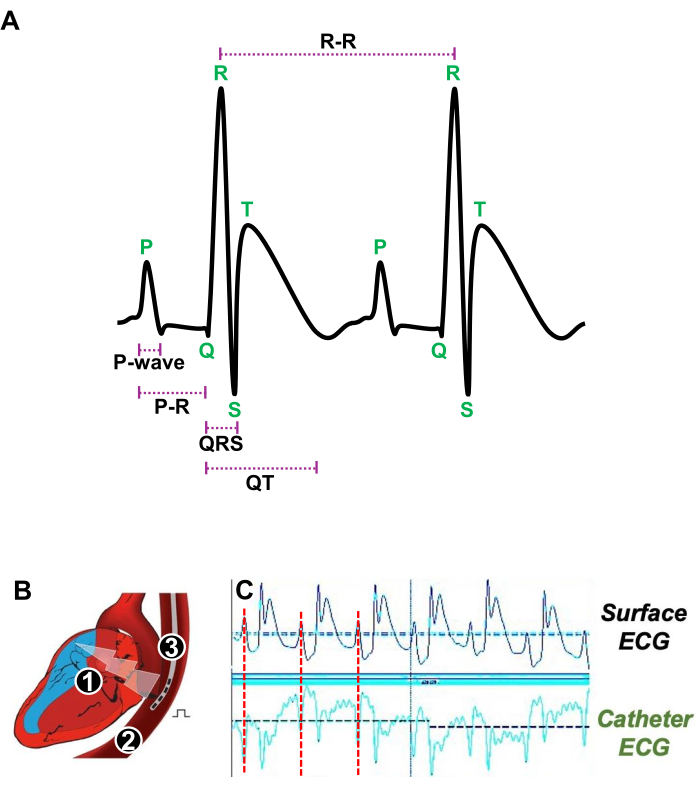
Figure 3 : Illustration des battements cardiaques au repos et de la position appropriée d’un cathéter transœsophagien pour une étude électrophysiologique in vivo. (A) ECG représentatif de deux battements cardiaques consécutifs au repos montrant l’onde P, l’intervalle PR, le complexe QRS, l’intervalle QT et l’intervalle R-R. (B) Schéma d’une coupe longitudinale du cœur (1) et de l’œsophage (2) dans laquelle un cathéter quadripolaire (3) est introduit pour stimuler et acquérir l’ECG auriculaire. (C) Signaux ECG représentatifs montrant la position préférée du cathéter transœsophagien lorsque le signal auriculaire (ligne rouge) de l’ECG de surface (traces supérieures) coïncide avec le signal auriculaire de l’ECG du cathéter (traces inférieures). Veuillez cliquer ici pour voir une version agrandie de cette figure.
8. Analyse ECG
REMARQUE : Les enregistrements et les stimulations ECG ont été effectués à l’aide d’un logiciel d’acquisition ECG. Les analyses ont été effectuées à l’aide d’un logiciel d’analyse ECG (Figure 3A).
- Mesurez la durée de l’onde P correspondant à la contraction auriculaire exprimée en millisecondes (ms).
- Déterminez l’intervalle PR (exprimé en millisecondes) correspondant à la durée de la conduction électrique à travers le nœud auriculo-ventriculaire (AV).
- Rapporter la durée du complexe QRS (exprimée en millisecondes) correspondant à la dépolarisation ventriculaire.
- Évaluation de l’intervalle QT (exprimé en millisecondes) reflétant la durée totale de la dépolarisation et de la repolarisation ventriculaires.
- Quantifiez l’intervalle RR (exprimé en millisecondes) en indiquant la durée entre deux battements cardiaques consécutifs et en déterminant la fréquence cardiaque.
9. Analyses histologiques
- Euthanasier les rats par exsanguination sous anesthésie à l’isoflurane (5 %, 2 L/minO2) le 21e jour après la PAB.
- Isoler l’AR et l’AL pour analyser le remodelage histologique auriculaire associé ou non à la FRH et aux arythmies cardiaques.
- Réaliser une coupe transversale des cœurs fraîchement excisés, à 5 mm de l’apex, afin d’évaluer le remodelage ventriculaire associé ou non à la RHF et aux arythmies cardiaques.
- Fixer les échantillons myocardiques dans du formol et colorer les lames histologiques avec la solution trichrome de Masson22 pour quantifier l’épaisseur et la dilatation de la paroi ventriculaire et la fibrose auriculaire à J21 post-PAB.
10. Analyses statistiques
- Évaluer la normalité des distributions par le test de Shapiro-Wilk. Comparez les données normalement distribuées à l’aide du test t de Student.
- Si les données sont de distribution non paramétrique, effectuez un test de Mann-Whitney. Analysez des variables catégorielles telles que l’inductibilité de la FA à l’aide du test exact de Fisher.
- Exprimer les résultats sous forme de moyenne ±'erreur-type par rapport à la moyenne (S.E.M.). Considérez les différences statistiquement significatives à des valeurs P bilatérales < 0,05.
Résultats
Confirmation visuelle de la ligature appropriée du tronc de l’AP pendant l’opération
Au cours de la procédure PAB, une indication d’un bon positionnement de la suture est une augmentation immédiate de la pression artérielle et une dilatation rapide du RV et de la racine du tronc PA à la jonction avec le RV. La suture ne doit pas bouger pour assurer une surcharge de pression constante et permanente pendant 3 semaines. Dans cette étude, l’utilisation d’...
Discussion
Le bon fonctionnement du PAB est la partie la plus cruciale de ce protocole. Il est important de bien distinguer l’aorte et le tronc AP. L’isolement de l’AP doit être effectué méticuleusement pour éviter les déchirures, les saignements et la mort pendant la procédure. L’application de la suture autour de la sonde 19G doit être effectuée rapidement et suivie d’un retrait immédiat de la sonde, afin d’éviter une « obstruction complète » trop longue de l’AP en rais...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Colombe Roy, YanFen Shi, Sandra Querry et Josiane Deslandes pour la performance technique de l’échocardiographie transthoracique et Nathalie L’Heureux pour l’assistance technique préliminaire lors de la normalisation de la méthode PAB. Nous sommes reconnaissants envers les membres de la structure de soins aux animaux de l’Institut de Cardiologie de Montréal.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
Références
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon