需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过计算机断层扫描图像融合增强人工耳蜗中的电极位置评估
摘要
该协议展示了一种为人工耳蜗接受者融合术前和术后计算机断层扫描图像的方法。该方法可以提高插入深度和电极阵列触点中心频率的测量精度。此外,这种方法在基于解剖学的拟合中具有潜在的应用,这是人工耳蜗领域的一个新兴领域。
摘要
本研究旨在确定融合术前和术后计算机断层扫描 (CT) 图像是否有助于评估人工耳蜗 (CI) 接受者的电极放置和中心频率 (CF)。次要目标是比较测量耳蜗参数的自动融合与手动方法。该研究包括 20 只带有 CI 的耳朵,这些耳朵接受了术前和术后 CT 扫描。人工耳蜗参数的手动测量最初取自术后 CT 图像,然后使用融合的术前和术后 CT 图像与耳科软件 (OTOPLAN) 进行自动检测。使用两种方法计算每个电极触点的角度插入深度 (AID) 和 CF,并评估误差差异。分析显示两种方法在耳蜗宽度 (B 值) 和耳蜗导管长度 (CDL) 方面存在显著差异;然而,这些差异没有临床意义。此外,耳蜗直径 (A 值) 无统计学意义差异。A 值的平均差异为 0.04 mm,B 值的平均差异为 0.21 mm,CDL 的平均差异为 0.73 mm。AID 和 CF 的比较显示,除 5 号电极外,所有电极触点的手动和自动熔合方法之间无显著差异。根据这项研究,融合术前和术后 CT 图像可用于确定 CI 受体的电极位置。自动融合图像可以在减少人为干扰的情况下测量耳蜗参数、AID 和 CF。因此,此方法可以作为创建基于解剖结构的拟合的另一个基础。
引言
人工耳蜗 (CI) 手术是一种针对重度至极重度感音神经性听力损失患者的变革性治疗方法,可显著改善听觉功能和生活质量1。CI 手术成功的一个关键因素是将电极阵列准确放置在正确的耳蜗室内,特别是鼓膜间隙,因为最佳电极定位始终与卓越的听力结果相关2。因此,仔细的术前计划和耳蜗解剖结构评估对于确保电极阵列位置正确至关重要。确保电极阵列完全插入鼓膜间隙内对于最大限度地提高患者益处和实现最佳临床结果至关重要3。
术前估计 CI 电极阵列的插入深度角被认为对于有效的手术计划很重要。这种估计在很大程度上依赖于从术前计算机断层扫描 (CT) 扫描中获得关键耳蜗参数的准确测量值,例如耳蜗导管长度 (CDL)4。当电极长度已知时,这些测量可以对 CI 手术期间的人工耳蜗覆盖率和角度插入深度进行基本预测。CDL 的主要预测因子是 A 值,定义为圆窗与基底转弯最远点之间的距离。先前的研究强调了术前成像和计划在指导手术决策和优化 CI 接受者的结果方面的关键作用5。
术前 CT 成像是许多 CI 诊所在手术前评估内耳解剖结构和耳蜗参数的标准做法。术前 CT 提供清晰、无伪影的图像,支持有效规划和优化手术程序6。然而,单独的术前 CT 分析在准确预测沿 CI 电极阵列的电极触点的实际角度插入深度 (AID) 和中心频率 (CF) 方面存在局限性。因此,术后成像仍然是必要的,以确认电极阵列的位置,评估任何移位或易位,并确定每个触点的真实 AID7。
术后成像可确认电极放置的准确性,并有助于根据每位患者独特的人工耳蜗解剖结构创建个性化的拟合图。这些拟合图对于通过确保精确刺激听觉神经纤维来优化听觉表现至关重要。最近的研究表明,与标准或临床拟合图相比,个性化拟合图或基于解剖学的拟合 (ABF) 可以提高在安静和嘈杂环境中的语音理解 8,9,10,11,12,13。此外,当他们的电极阵列对耳蜗的顶端区域进行充分刺激时,接受者往往更喜欢 ABF 图8。频率与位置不匹配是指基于电极触点在耳蜗内的物理位置的 CF 与默认设置4 之间的差异。Mertens 等人报告说,频率与位置不匹配的影响会随着设备使用时间的延长而降低14。其他研究表明,减少 CI 接受者与 ABF 的频率到位置不匹配可以增强嘈杂环境中的语音感知,而不会影响在安静环境中的理解11,13。
各种成像方式,包括 X 射线15,16、锥形束 CT17 和磁共振成像 (MRI) 18,19,已被用于评估 CI 受者。然而,CT 成像仍然是首选方法,因为它具有高空间分辨率和捕获详细耳蜗解剖结构的能力。CT 成像可以精确评估内耳结构,例如鼓膜和前庭鳞,有助于准确放置电极。
尽管 CT 成像有很多好处,但某些挑战仍然存在,尤其是对于低分辨率的术后扫描。金属电极接触会产生图像伪影,使 AID 和 CF 等关键参数的准确测量变得复杂。最近的研究表明,与标准扫描相比,融合术前和术后 CT 扫描可以提高图像清晰度,通过提供术前和术后图像的补充信息来实现更准确的评估并改善电极位置20。
目前,术后 CT 图像分析通常涉及使用软件工具进行手动测量,这需要大量培训,耗时,并且可能容易出现变异和错误,从而限制了其效率和更广泛的适用性。关于从融合图像进行自动测量以解决这些限制并提供可靠的电极接触 AID 测量的潜力的文献有限。本研究旨在评估术前和术后 CT 图像的融合是否可以有效评估 CI 受者的人工耳蜗特征和电极位置。它进一步研究了图像融合如何推进基于解剖学的拟合 (ABF) 并提高角度插入深度 (AID) 和中心频率 (CF) 的测量精度。
研究方案
这项研究获得了主要机构审查委员会 (E-21-5737) 的批准,并按照赫尔辛基宣言中概述的道德原则进行。从我们三级 CI 中心的病历中回顾性收集数据。由于数据分析的匿名性,不需要知情同意。该研究包括来自不同年龄组患者的 20 只耳朵。
纳入标准如下: 2020 年至 2023 年间接受 CI 的内耳解剖结构正常的患者,接受了术前和术后 CT 扫描,并植入了来自同一制造商的 CI 设备,与所使用的手术计划软件兼容。颞骨 CT 扫描是我们中心人工耳蜗患者术前评估的一部分,而术后 CT 扫描仅在医学上需要时进行,以尽量减少辐射暴露。排除标准包括接受过翻修手术或患有耳蜗骨化、耳蜗耳硬化或涉及耳囊的颞骨骨折的 CI 患者。材料和软件的详细信息在 材料表中提供。
1. 上传和测量耳蜗参数
注意:本研究中采用的测量方案包括一系列连续步骤,旨在评估术前和术后 CT 图像融合技术在评估 CI 受体中电极位置的有效性(图 1)。
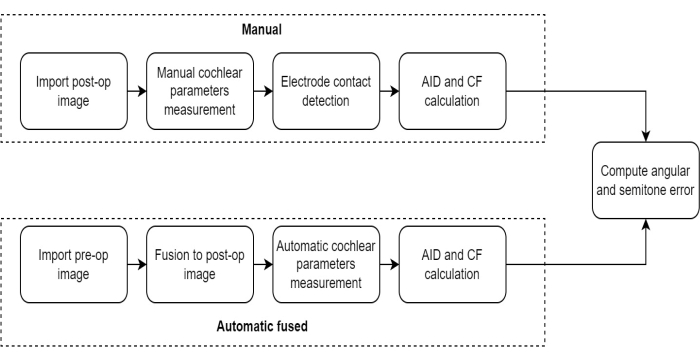
图 1:测量协议比较。 该图说明了与手动方法相比,使用自动融合方法测量耳蜗参数的方案。 请单击此处查看此图的较大版本。
- 按软件数据管理模块中的导入按钮上传术后和术前 CT 图像,然后选择 DICOM 文件。
- 手动定义 modiolus 中心、圆窗和耳蜗指标,包括 3D Ear-Cochlea 模块4 中的 A 值(耳蜗直径)、B 值(耳蜗宽度)和 H 值(耳蜗高度)(图 2)。
- 使用 A 和 B 值计算耳蜗管长度 (CDL),将 Alexiades 方法应用于椭圆近似 (ECA)2,4。
注意:Canfarotta 等人描述了术后分析的详细步骤21。这些测量为 CDL 估计提供了解剖标志。
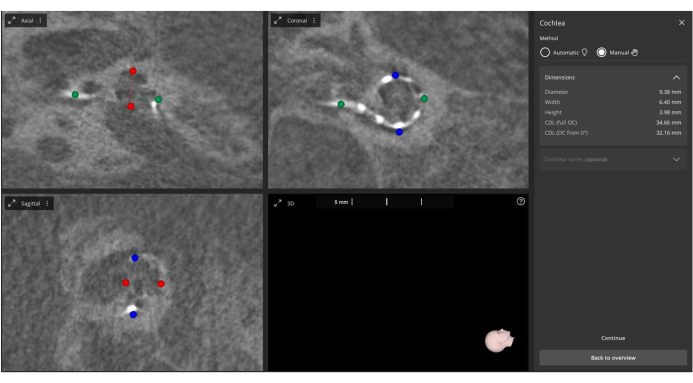
图 2:手动测量术后 A、B 和 H 值。 将术后图像导入软件中,并手动测量 A 值(标记为绿色)、B 值(标记为蓝色)和 H 值(标记为红色)。 请单击此处查看此图的较大版本。
2. 电极触点识别和 AID/CF 计算
- 打开 Implant Assessment 模块。该软件将自动识别术后 CT 图像上的 12 个电极接触点。
- 如有必要,在确认其位置之前,请手动调整检测到的接触点。
- 允许软件使用这些点以及预定义的耳蜗指标,以自动计算每个触点的角度插入深度(基于 Escude 等人 22)和特征频率(基于 Greenwood 等人 23)(参见 图 3)。
注意:这种手动方法被认为是测量 AID 和 CF 的标准方法,在本研究中称为“手动”。
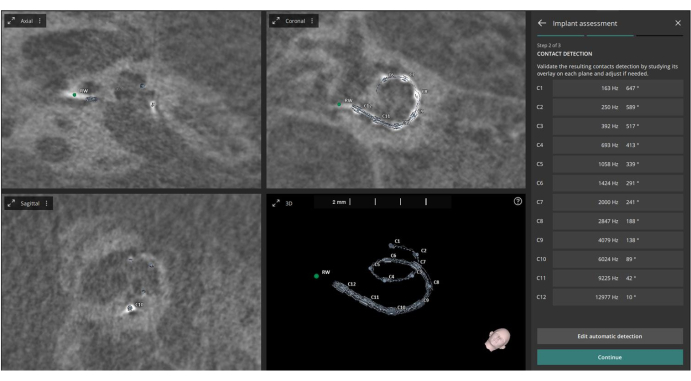
图 3:电极触点的识别。 该图显示了从术后 CT 图像中识别出 12 个电极触点。 请单击此处查看此图的较大版本。
3. 图像融合
- 按用户界面中的 添加 图标,将术前 CT 图像导入 Image Fusion 面板。
- 允许软件使用自动融合功能(应用互信息算法)自动开始将术前 CT 图像与预先上传的术后 CT 图像配准。
- 如果需要对融合进行手动调整,请访问术前图像菜单中的 手动对齐 功能。这种融合过程增强了可视化,并允许对人工耳蜗解剖结构和电极放置进行更全面的评估,同时减少伪影。融合旨在改善可视化以更好地评估(见 图 4)。
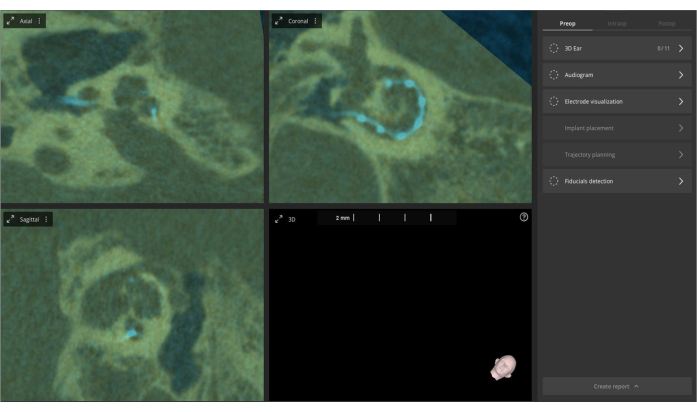
图 4:术前和术后 CT 图像的融合。 术前 CT 图像导入软件并与术后 CT 图像融合。叠加层以橄榄色显示,电极以亮蓝色突出显示。 请单击此处查看此图的较大版本。
4. 术前图像自动测量耳蜗参数
- 在 3D - 耳蜗模块中重新测量新导入的术前图像上的人工耳蜗参数。
- 在模块菜单中选择 Automatic 选项以执行自动耳蜗参数测量。此功能仅适用于没有植入电极的术前图像,因为不存在金属伪影。
- 使用自动算法以 3D 形式重建内耳解剖结构。3D 模型将作为 Abari 等人 24 描述的自动耳蜗参数测量的基础。
注意:3D 重建有助于精确测量耳蜗参数(见 图 5)。
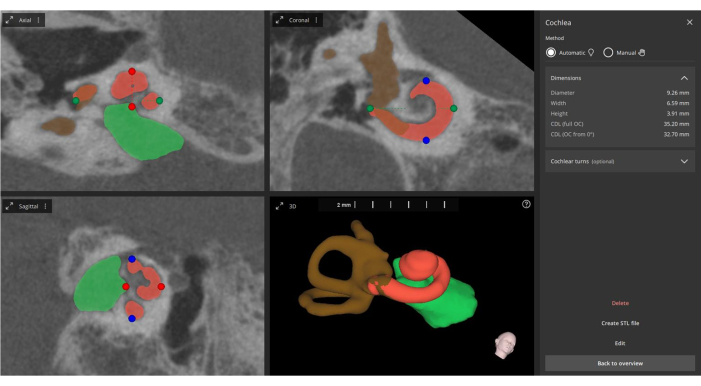
图 5:耳蜗参数的自动测量。 根据融合图像,软件会自动测量主要耳蜗参数(由绿点、蓝点和红点表示),执行 3D 重建(橙色的耳蜗、绿色的耳道和棕色的半规管),并更新有关电极触点的信息。 请单击此处查看此图的较大版本。
5. 使用新的人工耳蜗参数更新电极接触点
- 确认从术前图像中获得的新耳蜗管长度 (CDL) 测量值。
- 允许从术后图像中先前识别的电极接触点自动更新新的人工耳蜗参数信息,从而定义“自动融合”方法。
- 根据角度插入深度 (AID) 和特征频率 (CF) 的融合图像(术前和术后)进行计算,这对于确认电极阵列放置、人工耳蜗覆盖率和构建基于解剖学的拟合 (ABF) 图非常重要(见 图 5)。
注意:AID 和 CF 对于在人工耳蜗 (CI) 实践中确认电极定位和人工耳蜗覆盖率至关重要(见 图 6)。
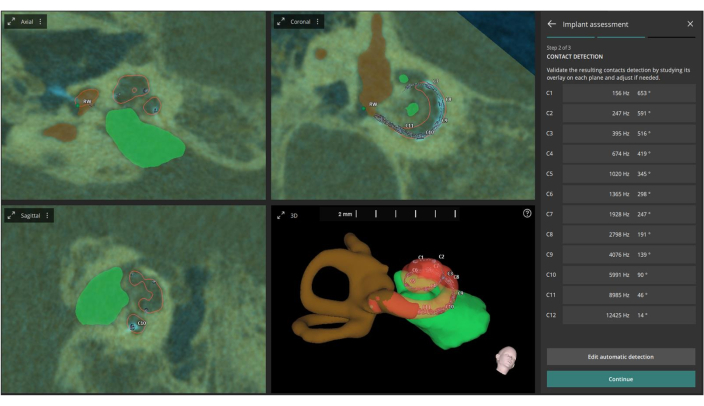
图 6:AID 和 CF 的自动定义。 该图描述了根据熔合图像自动定义每个电极触点的 AID(声阻抗分布)和 CF(中心频率)。 请单击此处查看此图的较大版本。
6. 计算平均角度误差和频率误差
- 计算每个电极接触的手动和自动融合方法之间的平均角度误差。
- 计算每种方法(手动和自动融合)之间每个电极触点的频率误差(以半音为单位)。
- 使用这些计算可提供两种方法之间差异和准确性的定量指标。请注意,半音是西方音乐中常用的最小音程25.
7. 统计分析
- 将术后 CT 成像中手动计算的人工耳蜗参数、插入角度深度 (AID) 和特征频率 (CF),以及来自每个电极接触的术前和术后 CT 图像融合技术自动融合的计算数据,输入统计分析软件(R 软件)。
- 对定量变量的描述性统计量使用均值和标准差,同时对分类变量应用计数和百分比。
- 根据使用 Shapiro-Wilk 检验检验的正态性假设,使用成对 Bonferroni 调整的配对 t 检验 或 Wilcoxon 有符号秩检验,对手动测量的 AID 和频率与自动融合的测量进行比较分析。
注意:假设所有比较都具有临床相关的标准化效应量 (Cohen's d)26。假设具有统计显著性的 P 值小于 0.05。
结果
这项研究包括来自 CI 受者的 20 只耳朵,其中 11 只植入物在左侧,9 只在右侧。参与者的平均年龄为 13.3 岁,其中 55% 为女性,45% 为男性。 表 1 介绍了用于测量耳蜗参数的手动与自动融合方法的比较分析,揭示了某些测量的统计学显着差异。具体来说,手动测量显示,与自动熔合测量相比,B 值和耳蜗导管长度 (CDL) 显著更高(分别为 6.9 mm ± 0.4 mm 和 36.3 mm ...
讨论
本研究的结果揭示了手动和自动融合方法对大多数耳蜗参数和频率的可比测量。虽然手动测量显示某些参数(例如 B 值和 CDL)的值略高,但总体上未观察到临床显着差异。这种差异可能归因于术后 CT 中的伪影,这可能会影响测量准确性。此外,本研究通过专门评估 AID27 建立在先前研究的基础上,为基于聚变的评估的一致性提供了有价值的见解。
披露声明
Yassin Abdelsamad 和 Tahir Sharif 在 MED-EL 工作,仅担任科学职务。作者对本手稿中描述的产品没有经济利益,也没有其他可披露的内容。
致谢
作者要感谢 Nikola Ivanovic 博士审查该方案和 Rahma Sweedy 进行统计分析。
材料
| Name | Company | Catalog Number | Comments |
| CI devices | MED-EL, Innsbruck, Austria | ||
| OTOPLAN software | CASCINATION, MED-EL, Innsbruck, Austria | version 4 (3.0.0) | Otology Planning Software |
| R software | R Foundation for Statistical Computing, Vienna, Austria | version 4.2.2 | Language and Environment for Statistical Computing |
参考文献
- Dazert, S., Thomas, J. P., Loth, A., Zahnert, T., Stover, T. Cochlear Implantation. Dtsch Arztebl Int. 117 (41), 690-700 (2020).
- Jwair, S., Versnel, H., Stokroos, R. J., Thomeer, H. The effect of the surgical approach and cochlear implant electrode on the structural integrity of the cochlea in human temporal bones. Sci Rep. 12 (1), 17068 (2022).
- O'Connell, B. P., Hunter, J. B., Wanna, G. B. The importance of electrode location in cochlear implantation. Laryngoscope Investig Otolaryngol. 1 (6), 169-174 (2016).
- Aljazeeri, I., et al. Anatomy-based frequency allocation in cochlear implantation: The importance of cochlear coverage. Laryngoscope. 132 (11), 2224-2231 (2021).
- Oh, J., et al. Cochlear duct length and cochlear distance on pre-operative CT: imaging markers for estimating insertion depth angle of cochlear implant electrode. Eur Radiol. 31 (3), 1260-1267 (2021).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Farnsworth, P. J., et al. Improved cochlear implant electrode localization using coregistration of pre-and post-operative CT. J Neuroimaging. 33 (3), 387-392 (2023).
- Kurz, A., Herrmann, D., Hagen, R., Rak, K. Using anatomy-based fitting to reduce frequency-to-place mismatch in experienced bilateral cochlear implant users: A promising concept. J Pers Med. 13 (7), 1109 (2023).
- Dillon, M. T., et al. Influence of the frequency-to-place function on recognition with place-based cochlear implant maps. The Laryngoscope. 133 (12), 3540-3547 (2023).
- Dillon, M. T., O'Connell, B. P., Canfarotta, M. W., Buss, E., Hopfinger, J. Effect of place-based versus default mapping procedures on masked speech recognition: Simulations of cochlear implant alone and electric-acoustic stimulation. Am J Audiology. 31 (2), 322-337 (2022).
- Creff, G., et al. Comparison of tonotopic and default frequency fitting for speech understanding in noise in new cochlear implantees: A prospective, randomized, double-blind, cross-over study. Ear Hearing. 45 (1), 35-52 (2024).
- Lassaletta, L., Calvino, M., Sanchez-Cuadrado, I., Gavilán, J. Does it make any sense to fit cochlear implants according to the anatomy-based fitting? Our experience with the first series of patients. Front Audiol Otol. 1, (2023).
- Kurz, A., Müller-Graff, F. -. T., Hagen, R., Rak, K. One click is not enough: Anatomy-based fitting in experienced cochlear implant users. Otol Neurotol. 43 (10), 1176-1180 (2022).
- Mertens, G., Van de Heyning, P., Vanderveken, O., Topsakal, V., Van Rompaey, V. The smaller the frequency-to-place mismatch the better the hearing outcomes in cochlear implant recipients. Eur Arch Otorhinolaryngol. 279 (4), 1875-1883 (2022).
- Liu, G. S., Cooperman, S. P., Neves, C. A., Blevins, N. H. Estimation of cochlear implant insertion depth using 2D-3D registration of post-operative X-ray and pre-operative CT images. Otol Neurotol. 45 (3), e156-e161 (2024).
- Alahmadi, A., et al. Advancing cochlear implant programming: X-ray guided anatomy-based fitting. Otol Neurotol. 45 (2), 107-113 (2024).
- Helal, R. A., et al. Cone-beam CT versus Multidetector CT in post-operative cochlear implant imaging: Evaluation of image quality and radiation dose. AJNR Am J Neuroradiol. 42 (2), 362-367 (2021).
- George-Jones, N. A., Tolisano, A. M., Kutz, J. W., Isaacson, B., Hunter, J. B. Comparing cochlear duct lengths between CT and MR images using an otological surgical planning software. Otol Neurotol. 41 (9), e1118-e1121 (2020).
- Swarup, A., et al. Comparing accuracy of cochlear measurements on magnetic resonance imaging and computed tomography: A step towards radiation-free cochlear implantation. J Otol. 18 (4), 208-213 (2023).
- Benson, J. C., Nassiri, A. M., Saoji, A. A., Carlson, M. L., Lane, J. I. Co-registration of pre- and post-operative images after cochlear implantation: A proposed technique to improve cochlear visualization and localization of cochlear electrodes. Neuroradiol J. 36 (2), 194-197 (2023).
- Canfarotta, M. W., Dillon, M. T., Buss, E., Pillsbury, H. C., Brown, K. D., O'Connell, B. P. Validating a new tablet-based tool in the determination of cochlear implant angular insertion depth. Otol Neurotol. 40 (8), 1006-1010 (2019).
- Escudé, B., et al. The size of the cochlea and predictions of insertion depth angles for cochlear implant electrodes. Audiol Neurotol. 11 (SUPPL. 1), 27-33 (2006).
- Greenwood, D. D. A cochlear frequency-position function for several species-29 years later. J Acoust Soc Am. 87 (6), 2592-2605 (1990).
- Abari, J., Heuninck, E., Topsakal, V. Entirely robotic cochlear implant surgery. Am J Otolaryngol. 45 (5), 104360 (2024).
- Bell, A., Jedrzejczak, W. W. The 1.06 frequency ratio in the cochlea: Evidence and outlook for a natural musical semitone. Peer J. 5, e4192 (2017).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Mertens, G., Van Rompaey, V., Van de Heyning, P., Gorris, E., Topsakal, V. Prediction of the cochlear implant electrode insertion depth: Clinical applicability of two analytical cochlear models. Sci Rep. 10 (1), 3340 (2020).
- Paouris, D., Kunzo, S., Goljerova, I. Validation of automatic cochlear measurements using OTOPLAN(R) software. J Pers Med. 13 (5), 805 (2023).
- IbraheemAl-Dhamari Rania Helal, T. A. S. W., Paulus, D. Automatic cochlear multimodal 3D image segmentation and analysis using atlas-model-based method. Cochlear Implants Int. 25 (1), 46-58 (2024).
- Rivas, A., et al. Automatic cochlear duct length estimation for selection of cochlear implant electrode arrays. Otol Neurotol. 38 (3), 339-346 (2017).
- Breitsprecher, T., et al. CT imaging-based approaches to cochlear duct length estimation human temporal bone study. Eur Radiol. 32 (2), 1014-1023 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。