Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verbesserung der Beurteilung der Elektrodenposition bei Cochlea-Implantaten durch Computertomographie-Bildfusion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll demonstriert eine Methode zur Verschmelzung von präoperativen und postoperativen Computertomographie-Bildern von Cochlea-Implantat-Trägern. Der Ansatz kann die Messgenauigkeit der Einführtiefe und der Mittenfrequenz von Elektrodenarray-Kontakten verbessern. Darüber hinaus bietet diese Methode potenzielle Anwendungen in der anatomiebasierten Anpassung, einem aufstrebenden Bereich im Bereich der Cochlea-Implantate.
Zusammenfassung
Ziel dieser Studie war es, festzustellen, ob die Verschmelzung von prä- und postoperativen Computertomographie-Bildern (CT) bei der Beurteilung der Elektrodenplatzierung und der Zentrumsfrequenz (CF) bei Trägern von Cochlea-Implantaten (CI) hilfreich sein kann. Ein sekundäres Ziel war es, die automatische Fusion mit manuellen Methoden zur Messung von Cochlea-Parametern zu vergleichen. Die Studie umfasste zwanzig Ohren mit CIs, die sowohl prä- als auch postoperativen CT-Scans unterzogen wurden. Die Cochlea-Parameter wurden zunächst manuell anhand der postoperativen CT-Bilder gemessen, gefolgt von der automatischen Erkennung anhand von fusionierten prä- und postoperativen CT-Bildern mit einer otologischen Software (OTOPLAN). Die Einführwinkeltiefe (AID) und die CF jedes Elektrodenkontakts wurden mit beiden Methoden berechnet und Fehlerunterschiede bewertet. Die Analyse zeigte signifikante Unterschiede zwischen den beiden Methoden für die Cochlea-Breite (B-Wert) und die Länge des Cochlea-Gangs (CDL); Diese Unterschiede waren jedoch klinisch nicht signifikant. Darüber hinaus gab es keinen statistisch signifikanten Unterschied im Cochlea-Durchmesser (A-Wert). Die mittleren Differenzen betrugen 0,04 mm für den A-Wert, 0,21 mm für den B-Wert und 0,73 mm für den CDL. Der Vergleich von AID und CF ergab nicht signifikante Unterschiede zwischen manuellen und automatischen Fusionsmethoden bei allen Elektrodenkontakten, mit Ausnahme von Elektrode Nummer fünf. Laut dieser Studie kann die Fusion von prä- und postoperativen CT-Bildern verwendet werden, um die Elektrodenpositionen bei CI-Empfängern zu bestimmen. Automatisch fusionierte Bilder können Cochlea-Parameter, AID und CF mit reduzierter menschlicher Beeinträchtigung messen. Daher kann diese Methode als eine weitere Grundlage für die Erstellung einer anatomisch basierten Anpassung dienen.
Einleitung
Die Cochlea-Implantat-Operation (CI) ist eine transformative Behandlung für Menschen mit schwerem bis hochgradigem Schallempfindungsschwerhörigkeitsverlust, die eine erhebliche Verbesserung der Hörfunktion und der Lebensqualität bietet1. Ein kritischer Faktor für den Erfolg der CI-Operation ist die genaue Platzierung des Elektrodenarrays im richtigen Cochlea-Kompartiment, insbesondere in der Scala tympani, da eine optimale Elektrodenpositionierung durchweg mit besseren Hörergebnissen verbunden ist2. Daher ist eine sorgfältige präoperative Planung und Beurteilung der Cochlea-Anatomie unerlässlich, um sicherzustellen, dass das Elektrodenarray richtig positioniert ist. Die Sicherstellung, dass das Elektrodenarray vollständig in die Scala tympani eingesetzt wird, ist entscheidend für die Maximierung des Patientennutzens und das Erreichen optimaler klinischer Ergebnisse3.
Die präoperative Abschätzung des Einführtiefenwinkels von CI-Elektrodenarrays wird als wichtig für eine effektive chirurgische Planung angesehen. Diese Schätzung beruht in hohem Maße auf der Gewinnung präziser Messungen wichtiger Cochlea-Parameter, wie z. B. der Länge des Cochlea-Gangs (CDL), aus präoperativen Computertomographie-Scans (CT)4. Diese Messungen ermöglichen wesentliche Vorhersagen über die Cochlea-Abdeckung und die Winkeleinstichtiefe während der CI-Chirurgie, wenn die Elektrodenlänge bekannt ist. Ein wichtiger Prädiktor für CDL ist der A-Wert, der als Abstand zwischen dem runden Fenster und dem am weitesten entfernten Punkt auf der basalen Windung definiert ist. Frühere Studien haben die entscheidende Rolle der präoperativen Bildgebung und Planung bei chirurgischen Entscheidungen und der Optimierung der Ergebnisse für CI-Empfängerhervorgehoben 5.
Die präoperative CT-Bildgebung ist in vielen CI-Kliniken Standard, um die Anatomie des Innenohrs und die Cochlea-Parameter vor der Operation zu beurteilen. Die präoperative CT liefert klare, artefaktfreie Bilder, die eine effektive Planung unterstützen und chirurgische Eingriffe optimieren6. Die präoperative CT-Analyse allein hat jedoch Einschränkungen bei der genauen Vorhersage der tatsächlichen Winkeleinstichtiefe (AID) und Mittenfrequenz (CF) von Elektrodenkontakten entlang des CI-Elektrodenarrays. Folglich ist nach wie vor eine postoperative Bildgebung erforderlich, um die Positionierung des Elektrodenarrays zu bestätigen, eine Verschiebung oder Translokation zu beurteilen und die tatsächliche AID jedes Kontaktszu bestimmen 7.
Die postoperative Bildgebung bestätigt die Genauigkeit der Elektrodenplatzierung und hilft bei der Erstellung individueller Anpassungskarten, die auf die individuelle Cochlea-Anatomie jedes Patienten zugeschnitten sind. Diese Anpassungskarten sind für die Optimierung der Hörleistung unerlässlich, indem sie eine präzise Stimulation der Hörnervenfasern gewährleisten. Jüngste Studien haben gezeigt, dass individualisierte Anpassungskarten oder anatomiebasierte Anpassungskarten (ABF) das Sprachverständnis sowohl in ruhigen als auch in lauten Umgebungen im Vergleich zu Standard- oder klinischen Anpassungskarten verbessern 8,9,10,11,12,13. Darüber hinaus neigen die Empfänger dazu, ABF-Maps zu bevorzugen, wenn ihr Elektrodenarray eine angemessene Stimulation der apikalen Region der Cochlea erreicht8. Die Frequenz-Ort-Diskrepanz ist die Diskrepanz zwischen dem CF von Elektrodenkontakten basierend auf ihrer physischen Position in der Cochlea und den Standardeinstellungen4. Mertens et al. berichteten, dass die Auswirkungen der Diskrepanz zwischen Frequenz und Ort mit längerer Gerätenutzung abnehmen14. Andere Studien haben gezeigt, dass die Verringerung der Diskrepanz zwischen Frequenz und Ort mit ABF bei CI-Empfängern die Sprachwahrnehmung in lauten Umgebungen verbessert, ohne das Verständnis in ruhigen Umgebungen zu beeinträchtigen11,13.
Verschiedene bildgebende Verfahren, darunter Röntgen15,16, Kegelstrahl-CT17 und Magnetresonanztomographie (MRT)18,19, wurden zur Beurteilung von CI-Empfängern verwendet. Die CT-Bildgebung bleibt jedoch aufgrund ihrer hohen räumlichen Auflösung und der Möglichkeit, eine detaillierte Cochlea-Anatomie zu erfassen, die bevorzugte Methode. Die CT-Bildgebung ermöglicht eine präzise Beurteilung von Innenohrstrukturen, wie z. B. der Scala tympani und der Scala vestibuli, und ermöglicht so eine genaue Elektrodenplatzierung.
Trotz der vielen Vorteile der CT-Bildgebung bestehen nach wie vor gewisse Herausforderungen, insbesondere bei postoperativen Scans mit geringer Auflösung. Metallische Elektrodenkontakte können Bildartefakte erzeugen, die benachbarte Strukturen verdecken und die genaue Messung kritischer Parameter wie AID und CF erschweren. Jüngste Studien haben gezeigt, dass die Verschmelzung von prä- und postoperativen CT-Scans die Bildschärfe im Vergleich zu Standardscans verbessert, genauere Bewertungen ermöglicht und die Elektrodenposition verbessert, indem ergänzende Informationen sowohl aus prä- als auch aus postoperativen Bildern bereitgestelltwerden 20.
Derzeit beinhaltet die postoperative CT-Bildanalyse häufig manuelle Messungen mit Softwaretools, die eine umfangreiche Schulung erfordern, zeitintensiv sind und anfällig für Variabilität und Fehler sein können, was ihre Effizienz und breitere Anwendbarkeit einschränkt. Es gibt nur begrenzte Literatur über das Potenzial automatisierter Messungen aus fusionierten Bildern, um diese Einschränkungen zu überwinden und zuverlässige Messungen von AID für Elektrodenkontakte zu ermöglichen. Ziel dieser Forschung ist es, zu evaluieren, ob die Fusion von prä- und postoperativen CT-Bildern die Cochlea-Eigenschaften und die Elektrodenplatzierung bei CI-Empfängern effektiv beurteilen kann. Darüber hinaus wird untersucht, wie die Bildfusion die anatomiebasierte Anpassung (ABF) verbessern und die Messgenauigkeit sowohl für die Winkeleinstichtiefe (AID) als auch für die Mittenfrequenz (CF) verbessern könnte.
Protokoll
Diese Studie wurde vom Principal Institutional Review Board (E-21-5737) genehmigt und nach den in der Deklaration von Helsinki dargelegten ethischen Grundsätzen durchgeführt. Die Daten wurden retrospektiv aus Krankenakten in unserem tertiären CI-Zentrum gesammelt. Aufgrund des anonymisierten Charakters der Datenanalyse war eine Einwilligungserklärung nach Aufklärung nicht erforderlich. Die Studie umfasste 20 Ohren von Patienten aus verschiedenen Altersgruppen.
Die Einschlusskriterien waren wie folgt: Patienten mit normaler Innenohranatomie, die zwischen 2020 und 2023 eine CI erhielten, wurden sowohl prä- als auch postoperativ CT-Scans unterzogen und erhielten CI-Geräte desselben Herstellers, die mit der verwendeten Operationsplanungssoftware kompatibel waren. CT-Scans des Schläfenknochens werden routinemäßig als Teil der präoperativen Beurteilung von Cochlea-Implantat-Patienten in unserem Zentrum durchgeführt, während postoperative CT-Scans nur dann durchgeführt werden, wenn dies medizinisch notwendig ist, um die Strahlenbelastung zu minimieren. Zu den Ausschlusskriterien gehörten CI-Patienten, die sich einer Revisionsoperation unterzogen hatten oder eine Cochlea-Ossifikation, Cochlea-Otosklerose oder Schläfenknochenfrakturen mit Beteiligung der otischen Kapsel hatten. Einzelheiten zu den Geräten und der Software finden Sie in der Materialtabelle.
1. Hochladen und Messen von Cochlea-Parametern
HINWEIS: Das in dieser Studie verwendete Messprotokoll umfasste eine Reihe von aufeinanderfolgenden Schritten, um die Wirksamkeit der prä- und postoperativen CT-Bildfusionstechnik bei der Beurteilung der Elektrodenposition bei CI-Empfängern zu bewerten (Abbildung 1).
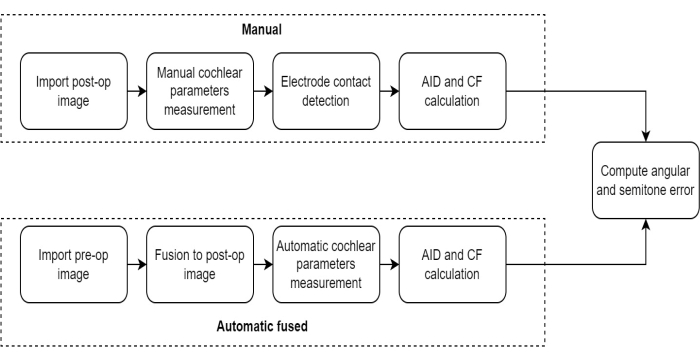
Abbildung 1: Vergleich des Messprotokolls. Diese Abbildung veranschaulicht das Protokoll für die Messung von Cochlea-Parametern mit der Methode der automatischen Fusion im Vergleich zur manuellen Methode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Klicken Sie auf die Schaltfläche Importieren im Datenverwaltungsmodul der Software, um die postoperativen und präoperativen CT-Bilder hochzuladen, und wählen Sie die DICOM-Dateien aus.
- Definieren Sie manuell die Metrik für den Mittelpunkt des Modolus, das runde Fenster und die Cochlea-Metriken, einschließlich des A-Werts (Cochlea-Durchmesser), des B-Werts (Cochlea-Breite) und des H-Werts (Cochlea-Höhe) im 3D-Ohr-Cochlea-Modul4 (Abbildung 2).
- Berechnen Sie die Länge des Cochlea-Gangs (CDL) anhand der A- und B-Werte und wenden Sie die Alexiades-Methode auf die elliptisch-zirkuläre Approximation (ECA) an2,4.
HINWEIS: Die detaillierten Schritte der postoperativen Analyse werden von Canfarotta et al.21 beschrieben. Diese Messungen liefern anatomische Orientierungspunkte für die CDL-Schätzung.
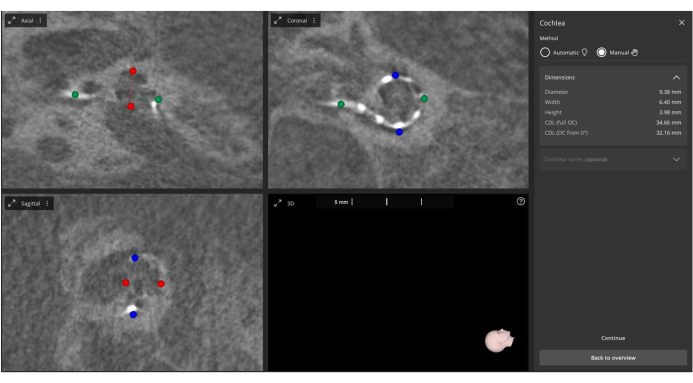
Abbildung 2: Manuelle Messung der postoperativen A-, B- und H-Werte. Postoperative Bilder werden in die Software importiert und der A-Wert (grün markiert), der B-Wert (blau markiert) und der H-Wert (rot markiert) werden manuell gemessen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Identifizierung des Elektrodenkontakts und Berechnung von AID/CF
- Öffnen Sie das Modul Implantatbewertung . Die Software identifiziert automatisch die zwölf Elektrodenkontaktpunkte auf den postoperativen CT-Bildern.
- Passen Sie die erkannten Kontaktpunkte bei Bedarf manuell an, bevor Sie ihre Positionen bestätigen.
- Erlauben Sie der Software, diese Punkte zusammen mit den vordefinierten Cochlea-Metriken zu verwenden, um automatisch die Winkeleinstichtiefe (basierend auf Escude et al.22) und die charakteristische Frequenz (basierend auf Greenwood et al.23) für jeden Kontakt zu berechnen (siehe Abbildung 3).
HINWEIS: Dieser manuelle Ansatz gilt als Standardmethode zur Messung von AID und CF und wird in dieser Studie als "manuell" bezeichnet.
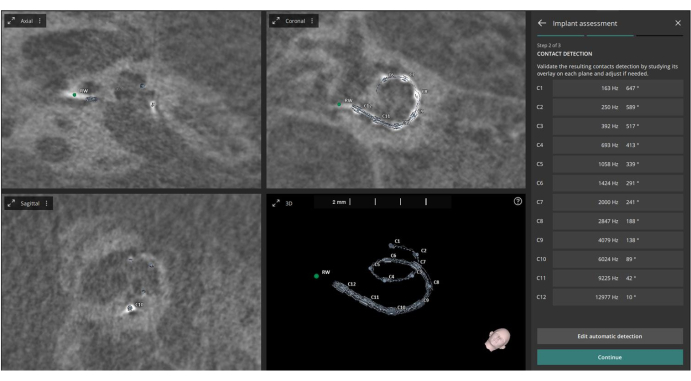
Abbildung 3: Identifizierung von Elektrodenkontakten. Diese Abbildung zeigt die Identifizierung der zwölf Elektrodenkontakte aus den postoperativen CT-Bildern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Bildfusion
- Klicken Sie auf das Symbol "Hinzufügen " in der Benutzeroberfläche, um die präoperativen CT-Bilder in das Image Fusion-Bedienfeld zu importieren.
- Lassen Sie die Software automatisch mit der Registrierung der präoperativen CT-Bilder mit den vorab hochgeladenen postoperativen CT-Bildern beginnen, indem Sie die automatische Fusionsfunktion verwenden, die einen gegenseitigen Informationsalgorithmus anwendet.
- Greifen Sie auf die Funktion "Manuelle Ausrichtung" im präoperativen Bildmenü zu, wenn manuelle Anpassungen an der Fusion erforderlich sind. Dieser Fusionsprozess verbessert die Visualisierung und ermöglicht eine umfassendere Beurteilung der Cochlea-Anatomie und der Elektrodenplatzierung mit weniger Artefakten. Ziel der Fusion ist es, die Visualisierung für eine bessere Auswertung zu verbessern (siehe Abbildung 4).
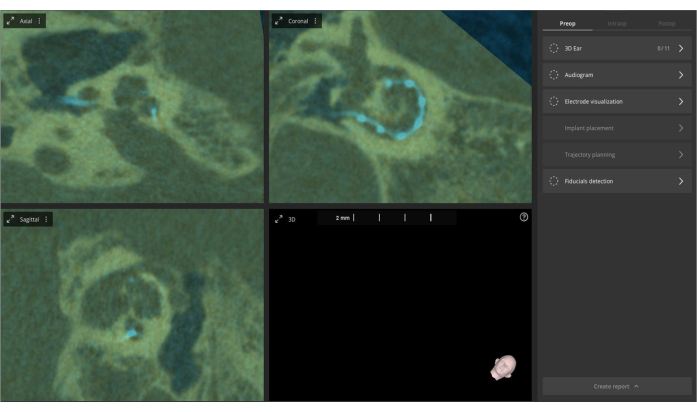
Abbildung 4: Fusion von prä- und postoperativen CT-Bildern. Präoperative CT-Bilder werden in die Software importiert und mit postoperativen CT-Bildern fusioniert. Das Overlay wird in olivfarbener Farbe angezeigt, wobei die Elektroden hellblau hervorgehoben sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Automatische Messung der Cochlea-Parameter auf dem präoperativen Bild
- Messen Sie die Cochlea-Parameter auf dem neu importierten präoperativen Bild im Modul 3D - Cochlea erneut.
- Wählen Sie im Modulmenü die Option Automatisch , um automatische Messungen der Cochlea-Parameter durchzuführen. Diese Funktion ist nur für präoperative Bilder ohne Implantatelektroden verfügbar, da keine Metallartefakte vorhanden sind.
- Verwenden Sie den automatischen Algorithmus, um die Anatomie des Innenohrs in 3D zu rekonstruieren. Das 3D-Modell dient als Grundlage für die automatischen Messungen der Cochlea-Parameter, wie sie von Abari et al.24 beschrieben werden.
HINWEIS: Die 3D-Rekonstruktion hilft bei der präzisen Messung der Cochlea-Parameter (siehe Abbildung 5).
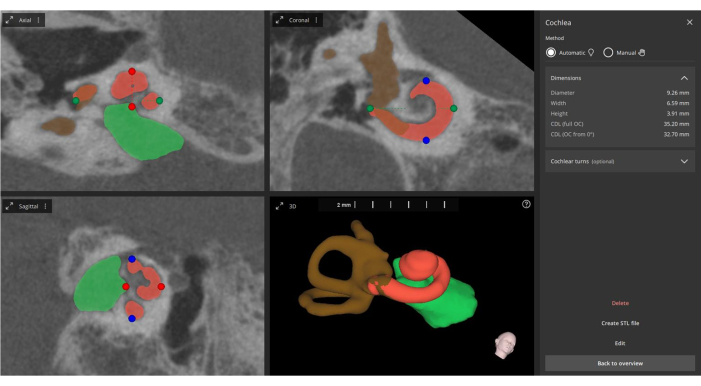
Abbildung 5: Automatisierte Messung der Cochlea-Parameter. Anhand der fusionierten Bilder misst die Software automatisch die wichtigsten Cochlea-Parameter (gekennzeichnet durch grüne, blaue und rote Punkte), führt eine 3D-Rekonstruktion durch (Cochlea in orange, interner Gehörgang in grün und Bogengänge in braun) und aktualisiert die Informationen zu den Elektrodenkontakten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Aktualisierung der Elektrodenkontaktpunkte mit neuen Cochlea-Parametern
- Bestätigen Sie die neuen Messungen der Länge des Cochlea-Ductus (CDL), die aus den präoperativen Bildern erhalten wurden.
- Lassen Sie zu, dass die zuvor identifizierten Elektrodenkontaktpunkte aus den postoperativen Bildern automatisch mit den neuen Cochlea-Parameterinformationen aktualisiert werden, wodurch der Ansatz der "automatischen Fusion" definiert wird.
- Führen Sie Berechnungen auf der Grundlage der fusionierten Bilder (präoperativ und postoperativ) für die Winkeleinführtiefe (AID) und die charakteristische Frequenz (CF) durch, die für die Bestätigung der Platzierung des Elektrodenarrays, der Cochlea-Abdeckung und die Erstellung der ANATOMY-Based Fitting (ABF)-Karte wichtig sind (siehe Abbildung 5).
HINWEIS: AID und CF sind entscheidend für die Bestätigung der Elektrodenpositionierung und der Cochlea-Abdeckung in der Praxis für Cochlea-Implantate (CI) (siehe Abbildung 6).
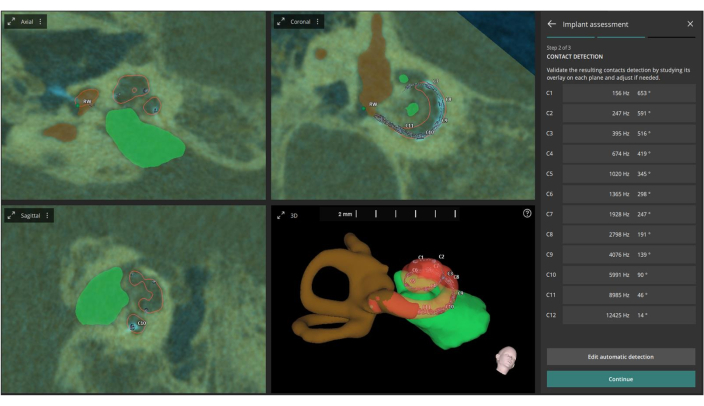
Abbildung 6: Automatische Definition von AID und CF. Diese Abbildung zeigt die automatische Definition von AID (Acoustic Impedance Distribution) und CF (Center Frequency) für jeden einzelnen Elektrodenkontakt auf Basis der fusionierten Bilder. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Berechnung des mittleren Winkelfehlers und des Häufigkeitsfehlers
- Berechnen Sie den mittleren Winkelfehler zwischen der manuellen und der automatischen Fusionsmethode für jeden Elektrodenkontakt.
- Berechnen Sie den Frequenzfehler in Halbtönen zwischen beiden Methoden (manuelle und automatische Fusion) für jeden Elektrodenkontakt.
- Verwenden Sie diese Berechnungen, um quantitative Indikatoren für die Differenz und Genauigkeit zwischen den beiden Methoden bereitzustellen. Beachten Sie, dass Halbtöne die kleinsten musikalischen Intervalle sind, die in der westlichen Musik üblich sind25.
7. Statistische Auswertung
- Geben Sie die manuell berechneten Cochlea-Parameter, die Winkeleinstichtiefe (AID) und die charakteristische Frequenz (CF) aus der postoperativen CT-Bildgebung zusammen mit den automatisch fusionierten berechneten Daten aus der prä- und postoperativen CT-Bildfusionstechnik für jeden Elektrodenkontakt in die statistische Analysesoftware (R-Software) ein.
- Verwenden Sie Mittelwerte und Standardabweichungen für die deskriptive Statistik quantitativer Variablen, während Sie Zählungen und Prozentsätze für kategoriale Variablen anwenden.
- Führen Sie eine vergleichende Analyse zwischen der manuell gemessenen AID und den Frequenzen und den automatisch fusionierten Messungen mit einem paarweise Bonferroni-adjustierten gepaarten t-Test oder einem Wilcoxon-Rangtest mit Vorzeichen durch, abhängig von der Normalannahme, die mit dem Shapiro-Wilk-Test getestet wurde.
HINWEIS: Gehen Sie davon aus, dass alle Vergleiche klinisch relevante standardisierte Effektstärken haben (Cohens d)26. Betrachten Sie einen statistisch signifikanten P-Wert als kleiner als 0,05.
Ergebnisse
Diese Studie umfasste 20 Ohren von CI-Empfängern, mit 11 Implantaten auf der linken Seite und neun auf der rechten Seite. Das Durchschnittsalter der Teilnehmer betrug 13,3 Jahre, wobei 55 % weiblich und 45 % männlich waren. Tabelle 1 zeigt eine vergleichende Analyse von manuellen und automatischen Fusionsmethoden zur Messung von Cochlea-Parametern, die statistisch signifikante Unterschiede bei bestimmten Messungen aufzeigt. Insbesondere zeigten manuelle Messungen einen...
Diskussion
Die Ergebnisse der vorliegenden Studie zeigten vergleichbare Messungen zwischen manuellen und automatischen Fusionsmethoden für die meisten Cochlea-Parameter und -Frequenzen. Während manuelle Messungen bei bestimmten Parametern, wie z.B. dem B-Wert und der CDL, geringfügig höhere Werte aufwiesen, konnten insgesamt keine klinisch signifikanten Unterschiede beobachtet werden. Diese Diskrepanz könnte auf Artefakte in der postoperativen CT zurückzuführen sein, die die Messgenauigkeit ...
Offenlegungen
Yassin Abdelsamad und Tahir Sharif arbeiten für MED-EL ausschließlich in wissenschaftlichen Funktionen. Die Autoren haben keine finanziellen Interessen an den in diesem Manuskript beschriebenen Produkten und haben auch sonst nichts offenzulegen.
Danksagungen
Die Autoren danken Dr. Nikola Ivanovic für die Überprüfung des Protokolls und Rahma Sweedy für die statistische Analyse.
Materialien
| Name | Company | Catalog Number | Comments |
| CI devices | MED-EL, Innsbruck, Austria | ||
| OTOPLAN software | CASCINATION, MED-EL, Innsbruck, Austria | version 4 (3.0.0) | Otology Planning Software |
| R software | R Foundation for Statistical Computing, Vienna, Austria | version 4.2.2 | Language and Environment for Statistical Computing |
Referenzen
- Dazert, S., Thomas, J. P., Loth, A., Zahnert, T., Stover, T. Cochlear Implantation. Dtsch Arztebl Int. 117 (41), 690-700 (2020).
- Jwair, S., Versnel, H., Stokroos, R. J., Thomeer, H. The effect of the surgical approach and cochlear implant electrode on the structural integrity of the cochlea in human temporal bones. Sci Rep. 12 (1), 17068 (2022).
- O'Connell, B. P., Hunter, J. B., Wanna, G. B. The importance of electrode location in cochlear implantation. Laryngoscope Investig Otolaryngol. 1 (6), 169-174 (2016).
- Aljazeeri, I., et al. Anatomy-based frequency allocation in cochlear implantation: The importance of cochlear coverage. Laryngoscope. 132 (11), 2224-2231 (2021).
- Oh, J., et al. Cochlear duct length and cochlear distance on pre-operative CT: imaging markers for estimating insertion depth angle of cochlear implant electrode. Eur Radiol. 31 (3), 1260-1267 (2021).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Farnsworth, P. J., et al. Improved cochlear implant electrode localization using coregistration of pre-and post-operative CT. J Neuroimaging. 33 (3), 387-392 (2023).
- Kurz, A., Herrmann, D., Hagen, R., Rak, K. Using anatomy-based fitting to reduce frequency-to-place mismatch in experienced bilateral cochlear implant users: A promising concept. J Pers Med. 13 (7), 1109 (2023).
- Dillon, M. T., et al. Influence of the frequency-to-place function on recognition with place-based cochlear implant maps. The Laryngoscope. 133 (12), 3540-3547 (2023).
- Dillon, M. T., O'Connell, B. P., Canfarotta, M. W., Buss, E., Hopfinger, J. Effect of place-based versus default mapping procedures on masked speech recognition: Simulations of cochlear implant alone and electric-acoustic stimulation. Am J Audiology. 31 (2), 322-337 (2022).
- Creff, G., et al. Comparison of tonotopic and default frequency fitting for speech understanding in noise in new cochlear implantees: A prospective, randomized, double-blind, cross-over study. Ear Hearing. 45 (1), 35-52 (2024).
- Lassaletta, L., Calvino, M., Sanchez-Cuadrado, I., Gavilán, J. Does it make any sense to fit cochlear implants according to the anatomy-based fitting? Our experience with the first series of patients. Front Audiol Otol. 1, (2023).
- Kurz, A., Müller-Graff, F. -. T., Hagen, R., Rak, K. One click is not enough: Anatomy-based fitting in experienced cochlear implant users. Otol Neurotol. 43 (10), 1176-1180 (2022).
- Mertens, G., Van de Heyning, P., Vanderveken, O., Topsakal, V., Van Rompaey, V. The smaller the frequency-to-place mismatch the better the hearing outcomes in cochlear implant recipients. Eur Arch Otorhinolaryngol. 279 (4), 1875-1883 (2022).
- Liu, G. S., Cooperman, S. P., Neves, C. A., Blevins, N. H. Estimation of cochlear implant insertion depth using 2D-3D registration of post-operative X-ray and pre-operative CT images. Otol Neurotol. 45 (3), e156-e161 (2024).
- Alahmadi, A., et al. Advancing cochlear implant programming: X-ray guided anatomy-based fitting. Otol Neurotol. 45 (2), 107-113 (2024).
- Helal, R. A., et al. Cone-beam CT versus Multidetector CT in post-operative cochlear implant imaging: Evaluation of image quality and radiation dose. AJNR Am J Neuroradiol. 42 (2), 362-367 (2021).
- George-Jones, N. A., Tolisano, A. M., Kutz, J. W., Isaacson, B., Hunter, J. B. Comparing cochlear duct lengths between CT and MR images using an otological surgical planning software. Otol Neurotol. 41 (9), e1118-e1121 (2020).
- Swarup, A., et al. Comparing accuracy of cochlear measurements on magnetic resonance imaging and computed tomography: A step towards radiation-free cochlear implantation. J Otol. 18 (4), 208-213 (2023).
- Benson, J. C., Nassiri, A. M., Saoji, A. A., Carlson, M. L., Lane, J. I. Co-registration of pre- and post-operative images after cochlear implantation: A proposed technique to improve cochlear visualization and localization of cochlear electrodes. Neuroradiol J. 36 (2), 194-197 (2023).
- Canfarotta, M. W., Dillon, M. T., Buss, E., Pillsbury, H. C., Brown, K. D., O'Connell, B. P. Validating a new tablet-based tool in the determination of cochlear implant angular insertion depth. Otol Neurotol. 40 (8), 1006-1010 (2019).
- Escudé, B., et al. The size of the cochlea and predictions of insertion depth angles for cochlear implant electrodes. Audiol Neurotol. 11 (SUPPL. 1), 27-33 (2006).
- Greenwood, D. D. A cochlear frequency-position function for several species-29 years later. J Acoust Soc Am. 87 (6), 2592-2605 (1990).
- Abari, J., Heuninck, E., Topsakal, V. Entirely robotic cochlear implant surgery. Am J Otolaryngol. 45 (5), 104360 (2024).
- Bell, A., Jedrzejczak, W. W. The 1.06 frequency ratio in the cochlea: Evidence and outlook for a natural musical semitone. Peer J. 5, e4192 (2017).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Mertens, G., Van Rompaey, V., Van de Heyning, P., Gorris, E., Topsakal, V. Prediction of the cochlear implant electrode insertion depth: Clinical applicability of two analytical cochlear models. Sci Rep. 10 (1), 3340 (2020).
- Paouris, D., Kunzo, S., Goljerova, I. Validation of automatic cochlear measurements using OTOPLAN(R) software. J Pers Med. 13 (5), 805 (2023).
- IbraheemAl-Dhamari Rania Helal, T. A. S. W., Paulus, D. Automatic cochlear multimodal 3D image segmentation and analysis using atlas-model-based method. Cochlear Implants Int. 25 (1), 46-58 (2024).
- Rivas, A., et al. Automatic cochlear duct length estimation for selection of cochlear implant electrode arrays. Otol Neurotol. 38 (3), 339-346 (2017).
- Breitsprecher, T., et al. CT imaging-based approaches to cochlear duct length estimation human temporal bone study. Eur Radiol. 32 (2), 1014-1023 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten