Method Article
用三电极、两室生物电化学系统表征乳酸菌介导的细胞外电子转移
摘要
在这里,我们提出了一种使用三电极、两室生物电化学系统表征乳酸菌中介导的细胞外电子转移 (EET) 的方案。我们用 植物乳植杆菌 和氧化还原介质 1,4-二羟基-2-萘甲酸说明了这种方法,并提供了用于评估介导的 EET 的电化学技术的全面描述。
摘要
许多细菌进行细胞外电子转移 (EET),从而将电子从细胞转移到细胞外末端电子受体。该电子受体可以是电极,电子可以通过氧化还原活性介质分子间接递送。在这里,我们提出了一种方案,用于使用生物电化学系统研究 植物乳植杆菌(一种广泛用于食品工业的益生菌乳酸菌)中介导的 EET。我们详细介绍了如何组装三电极、双腔室生物电化学系统,并提供了在可溶性介质存在下使用计时安培法和循环伏安法技术表征 EET 的指导。我们使用来自 1,4-二羟基-2-萘甲酸 (DHNA) 介导的 植物乳杆菌 EET 实验的代表性数据来证明数据分析和解释。该协议中描述的技术可以为电发酵和生物电催化开辟新的机会。这种电化学技术最近在 植物乳杆菌 中的应用表明,代谢通量加速产生发酵终产物,这是食品发酵中的关键风味成分。因此,该系统有可能进一步发展,以改变食品生产中的风味或生产有价值的化学品。
引言
生物电化学系统将微生物与电极连接,允许研究细胞外电子转移 (EET) 机制,并为生物电催化提供可再生的方法 1,2,3。自然执行 EET 的微生物称为外电原,它将代谢衍生的电子转移到细胞外末端电子受体,例如铁(氢)氧化物和电极1。EET 通路首先在 Geobacter 和 Shewanella 物种 4,5 中被表征,此后在许多细菌中被鉴定出来。这些外电原在多种微生物电化学技术中发挥着核心作用,例如从废物流中产生电能、固定 CO2 以及通过电合成生产有价值的化学品 1,6,7,8,9,10,11,12。
一种这样的外电原是植物乳植杆菌,一种革兰氏阳性乳酸菌13。植物乳杆菌是一种游牧的益生菌,存在于广泛的环境中,包括人类和其他脊椎动物的肠道,以及多种类型的食物,如肉类、谷物、蔬菜和发酵食品和饮料 14,15,16,17。它的基因组编码一种灵活的异源发酵代谢,从而能够在这些不同的环境中成功适应。它得到了充分的研究,广泛用于食品和健康行业,并被美国食品和药物管理局普遍认为是安全的18,19。因此,L. plantarum 有可能成为基于 EET 的技术的有用平台。
最近对植物乳杆菌的研究确定了一种多基因纵子,该纵子编码最初以单核细胞增生李斯特菌为特征的复杂 EET 通路 13,20。在植物乳杆菌中,当提供醌 1,4-二羟基-2-萘甲酸 (DHNA) 作为电子介质时,从该纵子合成的蛋白质在生物电化学系统 (BES) 中促进 EET13。该通路中的第一个必需蛋白是膜结合的 NADH-醌氧化还原酶 (Ndh2),它氧化 NADH 并降低 DHNA。DHNA 要么直接将电子输送到电极,要么通过辅助蛋白 PplA 间接输送(图 1)13,21,22。最近的研究表明,植物乳杆菌也可能使用其他结构上与 DHNA 相似的醌作为电子介质;然而,植物乳杆菌不能产生 DHNA 或这些替代醌,因此介质必须外源性存在于环境中才能发生 EET 13,22,23。
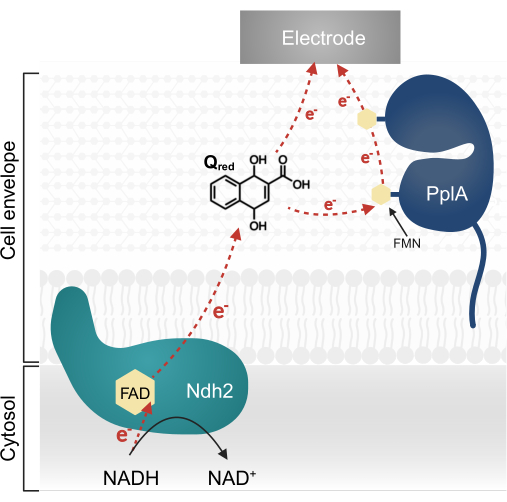
图 1: 植物乳植杆菌 EET 中的电子流。 Ndh2 将电子从 NADH 传递到醌 DHNA。电子穿梭到电极以产生电流,直接通过还原醌或通过间接通过辅助蛋白 PplA。缩写:FAD = 黄素腺嘌呤二核苷酸;FMN = 黄素单核苷酸;EET = 细胞外电子转移;NADH = 还原烟酰胺腺嘌呤二核苷酸;Ndh2 = NADH-醌氧化还原酶;DHNA = 1,4-二羟基-2-萘甲酸;PplA = 磷脂酶 A。 请点击此处查看此图的较大版本。
在本文中,我们提供了一个全面的方案,用于使用基于 BES 的方法来表征 DHNA 介导的 植物乳杆菌中的 EET。三电极、双腔系统将细菌限制在工作电极上,从而可以精确控制施加到细菌上的电位,同时防止工作电极和对电极之间的串扰。我们提出了一个为期 5 天的综合方案,其中包括实验前准备、BES 组装、使用计时安培法 (CA) 和循环伏安法 (CV) 的 EET 分析,以及实验后样品分析。该协议可用于解开 EET 途径的机制并构建电发酵和电催化系统。
研究方案
注:双腔 BES 组件在以下协议中称为"反应器"。
1. 培养基制备
- 准备植物 乳杆菌 培养基。
- 按照说明准备商业 MRS (de Man Rogosa Sharpe) 培养基,并按照表 1 中的说明准备 mMRS 培养基24。将 mMRS 的 pH 值调节至 6.5。通过使两种介质通过 0.22 μm 过滤器对两种介质进行过滤灭菌,并将两者储存在 4 °C 直至使用。
- 如表 2 所述,用甘露醇 (mCDM)13,25 制备化学成分明确的培养基,并将 pH 值调节至 6.5。准备足够的培养基,用 110 mL 培养基填充每个反应器的阳极室。通过 0.22 μm 过滤器对 mCDM 进行过滤灭菌。
注意:mCDM 应在预期使用当天新鲜制备。组分溶液可以提前准备。通过 0.22 μm 过滤器对所有组分溶液进行过滤灭菌,并在 4 °C 下储存。制备 Wolfe's 维生素时,消毒前将 pH 值调节至 11,并在黑暗中存放或用箔纸包裹。制备 Wolfe 矿物质时,加入次氮基三乙酸 (NTA) 后将 pH 值调节至 8。然后,添加剩余的组分,消毒,避光或用箔纸包裹。
- 准备 1x PBS 并高压灭菌。储存在 4 °C 以用于本协议。
- 按照说明准备商业 M9 培养基(表 3)并高压灭菌。准备足够的培养基,用 110 mL 填充每个反应器的阴极室。在室温下储存。
2. 第 1 天:BES 反应器组装和初始 植物乳杆菌 培养
注:参考 图 2 了解 BES 反应器的示意图和详细说明协议中指示的组装件的图表。
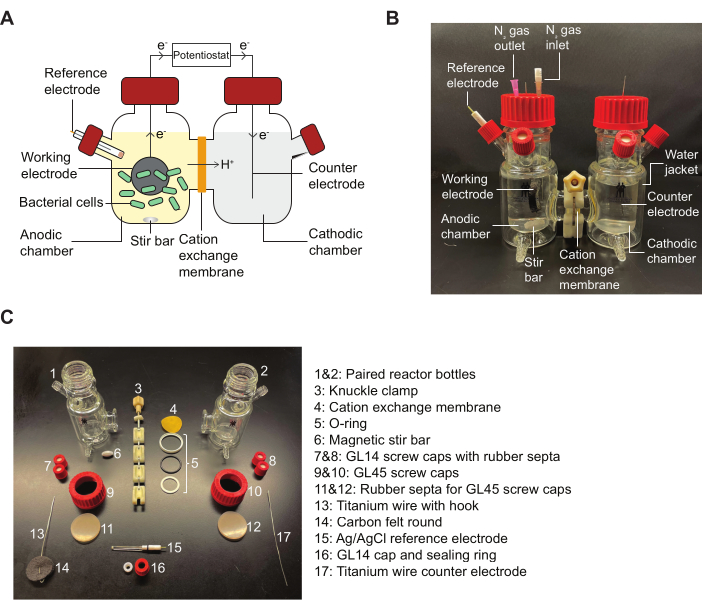
图 2:BES 组件和组装图。 (A) 双室 BES 反应器示意图。阳极室中的细菌(绿色)在醌介质存在下将电子转移到工作电极(黑色圆圈)。电子通过电路流向阴极室,允许电基恒电位仪在阳极和阴极之间进行电流测量。(B) 描绘完全组装的 BES 反应器的图像,包括阳极室中的 N2 入口和出口针。(C) 描绘拆卸反应器所有部分的图像。缩写:BES = 生物电化学系统。 请单击此处查看此图的较大版本。
- 组装和消毒反应器。
- 准备工作电极和对电极。用氧化铝砂纸打磨工作电极和对电极的预切直径为 1.0 毫米的钛丝,直到均匀有光泽。使用钳子,将每根工作电极丝的一端弯曲成一个小钩子。将 16 厘米2 的碳毡圆滑到每根工作电极丝上,将金属丝编织进出碳毡圆一次,然后将圆环拉到金属丝上,直到固定在钩子上。用金属丝刺穿橡胶隔膜并将其拉过几厘米,将工作电极和对电极固定到 GL45 帽中。
- 要组装成对的反应器,首先组装 O 形圈,然后将预先浸泡在水中的预切割阳离子交换膜放入组装好的 O 形圈中。将带有膜的 O 形圈放在两个成对的反应器瓶的大底部开口之间。用指节夹将反应器对瓶和 O 形圈固定在膜上,用手拧紧。将磁力搅拌棒放入每个阳极室中,然后用装有橡胶隔垫的 GL14 瓶盖关闭每个瓶子顶部的所有小开口。
注意: 不要将转向节夹或任何盖子拧得过紧,因为这会导致瓶子出现裂缝或破损。 - 用 110 mL 去离子 (DI) 水填充每个反应器瓶,然后用合适的电极安装 GL45 盖住每个瓶。轻轻按下毛毡圆片的顶部,插入装有碳毡圆形工作电极的瓶盖,使圆片保持在钩子上。
注意:新鲜的碳毡具有疏水性,在初始组件中排斥反应器中的水。高压灭菌将使碳毡变得适合实验的亲水性。 - 收集装有硅胶密封圈的 GL14 电极帽。
- 高压灭菌前轻轻松开所有 GL45 盖。高压灭菌充水反应器和电极帽进行灭菌。高压灭菌后,让反应器冷却至室温。
- 培养 物 L. plantarum NCIMB8826.在无菌条件下,从甘油原液的顶部刮下一些细菌,然后接种到 3 mL 商业 MRS 培养基中。将培养物在 37 °C 下培养过夜,不要摇晃。
注意: 植物乳杆菌 不使用氧作为末端电子受体;因此,没有必要通过摇动26 来给介质充氧。但是,如果使用其他微生物,培养条件会有所不同。
3. 第 2 天:准备参比电极,准备用于实验开始的反应器,以及 植物乳杆菌 传代培养
- 准备 Ag/AgCl 参比电极。
注:这些步骤描述了 材料表中所示的 Ag/AgCl 参比电极的制备。如果使用不同的参比电极,用户应遵循制造商的说明。- 拆卸 Ag/AgCl 参比电极并打磨电线。轻轻地将电极从玻璃外壳中拉出,然后轻弹玻璃外壳以清空旧的 KCl 溶液。用氧化铝砂纸轻轻打磨电极丝,直到均匀有光泽,以去除氧化材料。
- 将所有打磨过的参比电极丝收集在一个带有小搅拌棒的小烧杯中,并用 100% 漂白剂填充烧杯,直到电线完全浸没。让电线在搅拌平台上漂白 30 分钟,直到电极变成深灰色,从而对电线进行氯化。漂白后,用去离子水彻底冲洗电极丝。
- 要重新组装参比电极,请使用注射器将 3 M 氯化银饱和的 KCl 溶液完全填充玻璃外壳,轻轻敲击侧面以去除任何气泡。使用相同的注射器,用 KCl 溶液填充电极丝帽,然后将电极丝插入外壳。将玻璃外壳的底部靠在工作台上的纸巾上,将电极插入玻璃外壳,然后用力按下盖子以关闭电极。将参比电极储存在浅装有 KCl 溶液的烧杯中,直到需要,然后对所有剩余的参比电极重复此作。
- 使用数字万用表测量自制 Ag/AgCl 参比电极的电压。
- 将 Ag/AgCl 参比电极(与标准氢电极 SHE 相比估计为 197 mV)的末端浅浸入装有 3 M KCl 的烧杯中。将万用表牢固地连接到市售的饱和甘汞电极(SCE,241 mV 与 SHE),该电极也浸没在相同的 KCl 电解液中。
- 测量每个参比电极和 SCE 之间的电位差。确认参比电极与 SCE 相差 44 ± 10 mV。拆卸并重新组装超出此范围的任何参比电极。
- 用封口膜密封瓶盖与玻璃外壳相接的接缝。
- 准备反应器进行实验。
- 在无菌生物安全柜中,将反应器中高压灭菌的水与适当的培养基交换。倒出高压灭菌的水。用 110 mL 高压灭菌的 M9 培养基填充阴极室。用 110 mL 新鲜制备的 mCDM 填充阳极室。
- 安装参比电极。从每个阳极室中取出一个 GL14 帽,并用高压灭菌的电极帽(带有硅胶密封圈的 GL14 帽)替换。用 70% 乙醇喷洒参比电极进行消毒,然后将一个参比电极穿过电极帽放入每个阳极室中。
注意:确保参比电极不直接接触碳毡圆。 - 从生物安全柜中取出反应器之前,请拧紧所有盖子和夹具,使其用手拧紧,以避免泄漏。
- 将反应器连接到水泵系统。将每个反应器放在适当的搅拌棒平台上。用橡胶管将每个反应器的水套龙头连接到下一个反应器,将末端反应器连接到水泵的流入和流出管。
注意:确保所有连接紧密且无泄漏,必要时使用扎带固定管道。 - 将泵注满水,加入 4-6 滴水调节剂。打开泵系统并将温度设置为 30 °C。启动泵并观察流经所有反应器水套的水流,确保任何连接处没有泄漏。
- 打开搅拌平台,将其设置为以 220 RPM 的速度连续搅拌。
- 将反应器连接到氮气喷射气体管线。将空气过滤器连接到 4 英寸、22 G 针头上,然后将针头穿过反应器阳极室的顶部隔膜插入介质中,作为氮气入口。将另一根 1 英寸的 18 G 针插入阳极室的顶部隔膜,作为氮气出口。将氮气源的气体管线连接到空气过滤器,然后打开阀门,让气体轻轻地冒泡通过反应器。确保氮气气泡在整个实验过程中持续通过所有阳极室,以保持厌氧条件。
注意: 确保入口针远离碳毡圆。气泡流不应与碳毡或参比电极接触。 - 将生物反应器连接到电化学工作站导线上。将电化学工作站的工作电极、对电极和参比电极鳄鱼夹引线连接到相应的电极。
注意: 使用万用表检查电线/集流器与电极之间的电阻,以确保正确的电气连接并最大限度地减少潜在的测量误差。
- 输入预运行的恒电位仪参数。
注意:下面给出了关键技术设置。有关每种技术的软件设置的扩展列表,请参见 表 4 。- 打开电化学工作站并初始化计算机上的 EC-lab 软件。通过单击左上角面板 Devices 下的 potentiottat 符号按钮,将 potentiostat 连接到计算机。连接后,设备名称将在下面的文本框中显示一个绿色圆圈。
- 通过单击 Edit(编辑 )选项卡,然后选择 synchronize(同步),将连接到生物反应器的所有通道同步到一个组中。单击相应的 频道编号框 | 确定。
- 通过单击左侧 Parameters Settings 面板中的 + 按钮,将技术开路电压 (OCV) 添加到电化学工作站。在蓝色设置框中;将其设置为针对参考电极 (RE) 测量工作电极电位 (EWE),每 36 秒以间隔 dt 记录时间,总共 3 小时。
- 接下来,将循环伏安法 (CV) 技术添加到电化学工作站中。将 EWE 的初始电位设置为 0 V 的 Ei 与 RE,扫描速率为 2 mV/s。扫描到 0.4 V 的顶点电位 (E1) 与 RE 反转为 -0.7 V 的顶点电位 (E2) 与 RE。重复扫描,总共扫描两次。
注:在微生物电化学系统中,与金属材料或无机分子相比,微生物接种和生物膜形成诱导高容量。在循环伏安法扫描过程中,电位会发生变化,充电电流充当背景。为了实现高信噪比,需要较低的扫描速率,但这会增加扫描的持续时间。由于我们扫描两个周期,覆盖 1.1 V 的宽电化学窗口,因此 2 mV/s 的扫描速率导致半周期需要长达 9.1 分钟。因此,两个周期总共需要 36.4 分钟。进一步降低扫描速率将非常耗时。 - 添加技术 chronoamperometry (CA)。在 t = 200 h 的时间内施加 0.2 V 与 RE 的恒定电位 EWE,每 25-40 秒以间隔 dt 记录时间。根据 potentiostat 软件调整时间间隔以获得所需的细节级别。
注意:DHNA 的中点电位约为 -0.093 V(相对于 Ag/AgCl);因此,相对于 RE 施加到工作电极的 0.2 V 电位足以允许电子从 DHNA 转移到电极。 - 输入所有参数后,按 绿色的开始三角形开始运行。按照软件的指示根据需要保存文件,然后单击 优惠.该软件将开始技术 1"OCV"。观察 OCV 轨迹几分钟,以确保所有反应器读数正常,并以稳定的信号靠近。让实验运行过夜以完成 OCV 和初始 CV(有关培养基对照 CV,请参见 补充图 S1 ),并让 CA 运行直至稳定。
- 在无菌条件下,在 50 mL mMRS 中以 1:200 的比例传代培养 植物乳杆菌 的 MRS 培养物。将细胞在 37 °C 下培养过夜,不要摇晃。
注:假设反应器中的最终 OD600 为 0.2,则 50 mL 过夜培养通常产生的细胞足以供 6 个反应器使用。针对更大或更小的实验相应地调整培养体积。
4. 第 3 天:注射细胞和 DHNA/DMSO
- 洗涤细胞并将其注入反应器中。
- 早上从培养箱中取出 mMRS 植物乳杆菌 培养物。在无菌条件下,将培养物转移至 50 mL 锥形管中,并将培养物置于冰上。
- 在无菌、冷的 1x PBS 中洗涤细胞 2 次。为此,将培养物在 4 °C 离心机中以 4,000 × g 离心 5 分钟以沉淀细胞。在无菌条件下,轻轻但彻底地将细胞重悬于 50 mL PBS 中,然后像以前一样再次离心;重复第二次洗涤。最终离心后,将细胞重悬于冷 PBS 中至 OD600 = 11。
- 在无菌条件下,将 2 mL 重悬细胞加载到 3 mL 注射器中,每个反应器都装有针头。
- 在反应器站,取下细胞注射器的盖子,并将针头插入反应器阳极室的顶部。此时不要按下注射器柱塞;对所有反应器重复上述步骤。一旦所有注射器就位,按下柱塞将细胞注射到反应器中,并从 CA 轨迹记录注射时间。该体积的细胞在反应器中产生 0.2 的最终 OD600 。将所有注射器丢弃在生物危害盒中,并将针头丢弃在指定的锐器生物危害容器中。让电流在 CA 走线上稳定到平坦 2-4 小时。
注意:注入时,可以在 CA 迹线上观察到电流波动。2-4 小时后,这些波动将稳定为平坦电流(一小时内电流变化 <2 μA),此时可以注入 DHNA。
- 测量初始 pH 值并注射 DHNA。
- 准备 DHNA 溶液。在 1.5 mL 试管中,通过将粉末状 DHNA 溶解在 100% DMSO 中来制备 500 μL 的 20 mg/mL DHNA 溶液。用 110 μL 的 DHNA 溶液填充 3 个胰岛素注射器,用 110 μL 的 DMSO 填充 3 个胰岛素注射器。
注:虽然 DHNA 微溶于水,但 DMSO 是该浓度下 DHNA 储备液的更好溶剂。如果使用其他介质,介质溶剂可能会有所不同。 - 在 BES 反应器站,将实验反应器标记为 + DHNA ,将溶剂控制反应器标记为 - DHNA。打开DHNA注射器的盖子,并将注射器插入每个指定为 + DHNA的阳极室的顶部。将仅 DMSO 注射器插入每个指定为 - DHNA 的阳极室中。此时不要按下注射器柱塞。
- 取 0 h 时间点样品进行样品分析。使用装有 2 英寸、21 G 针头的 3 mL 注射器,通过未使用的小盖隔膜从每个阳极室中取出 2 mL 培养基样品,并将样品转移到 24 深孔板中,以测量 0 小时时间点的 pH 值(DHNA 注射点)。如果需要,从每个阳极室中取出 1 mL 用过的培养基,并通过 0.2 μm 过滤器过滤到干净标记的试管中,以使用 HPLC 或其他测定法定量代谢物。将用过的培养基样品储存在 -80 °C。
- 按下所有 DHNA 和 DMSO 注射器的柱塞以注入反应器。记录 CA 跟踪的注入时间。适当丢弃所有注射器和针头。
- 测量并记录每个反应器的 0 h pH 样品。
- 准备 DHNA 溶液。在 1.5 mL 试管中,通过将粉末状 DHNA 溶解在 100% DMSO 中来制备 500 μL 的 20 mg/mL DHNA 溶液。用 110 μL 的 DHNA 溶液填充 3 个胰岛素注射器,用 110 μL 的 DMSO 填充 3 个胰岛素注射器。
5. 第 4 天:实验完成和样本采集
- 在 DHNA 注射后 24 小时进行电化学分析并采集最终样品。
- DHNA 注射后 24 小时结束 CA 运行。
- 根据步骤 4.2.3 取 24 小时时间点样品进行样品分析。
- 根据步骤 3.3.4 中描述的参数,在 24 小时时间点再次运行 CV。
- 测量并记录来自每个反应器的 24 小时样品的 pH 值。
- 拆卸并清洁反应器。
- 关闭恒电位仪。然后,断开每个反应器的工作引线、计数器和参比引线。擦去电化学工作站铅鳄鱼夹上的水分。
- 关闭氮气流量。断开气体引线,然后拆入和流出针。将所有针头适当地丢弃在锐器容器中。
- 关闭水泵。断开泵的流入和流出管,让水排入桶中。断开连接时,保持管道末端高于泵中的水线,以防止水虹吸到地板上。逐个断开每个反应器与水套管的连接,从最终流出反应器到初始流入反应器。
- 将反应器中的所有介质倒入一个大型生物危害容器中。按照正常的培养漂白方法进行处理。
- 清空后,拆卸并清洁所有反应器部件。将阳离子交换膜和碳毡圆浆丢弃到适当的生物危害废物中。用 70% 乙醇清洁参比电极和钛丝,并将清洁后的参比电极存放在装满水的浅烧杯中。用实验室清洁剂用温水轻轻清洁反应器瓶、瓶盖、O 形圈和夹具,用去离子水彻底冲洗,并在存放前风干所有部件。
6. 第 5 天:电化学分析
注意:以下是此协议的数据绘图的一般说明。有关分析和数据解释的更详细说明将在代表性结果部分提供。
- 对于 CA 分析:将 DHNA 注射的时间设置为 0 h 时间点。绘制从 0 小时时间点开始每 36 秒对所有重复测量的电流密度(j 以 μA/cm2 为单位)的平均值和标准偏差,作为时间 (h) 的函数。计算电流密度与工作电极面积 (16 cm2) 的函数关系。
- 对于 CV 分析:绘制每个实验条件(仅培养基、DMSO 或 DHNA)的代表性 CV 轨迹,将电流密度 (j in μA/cm2) 描述为工作电极电位 (EWE in V) 的函数。绘制选定 CV 运行的第二个循环。
结果
计时安培分析
植物乳杆菌的 EET 可以通过图 3 中描述的计时安培法 (CA) 数据来观察,其中电流密度轨迹可视化了从植物乳杆菌到工作电极的电子转移。我们监测了电流密度 (j) 与时间的关系,同时保持 +200 mV 对 Ag/AgCl 的恒定电位 24 小时。将 20 μg/mL DHNA 注入搅拌电解质溶液中后,观察到非生物 DHNA 氧化峰值,随后生物电流密度迅速增加,在大约 8 h 时间点达到 132.0 ± 2.47 μA/cm2 的峰值。相反,注入 DMSO 导致电流密度可以忽略不计。这些结果强调了 DHNA 作为促进植物乳杆菌和电极之间电子转移的必要和有效介质的重要性。用户可以通过调整 BES 中 DHNA 的浓度来调整电流输出。先前的研究还表明,植物乳杆菌在广泛的 DHNA 浓度范围内以剂量依赖性方式对 DHNA 做出反应,在 DHNA 浓度低至 0.01 μg/mL 的情况下产生显着电流13,22。
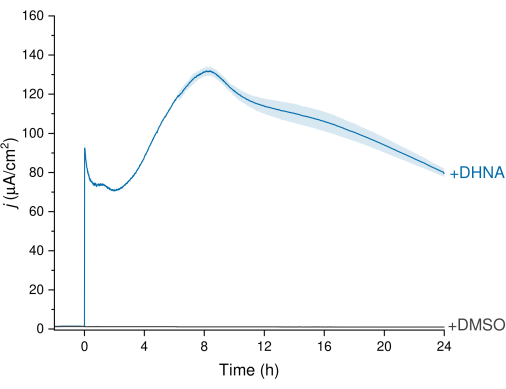
图 3:DHNA 介导的 植物乳植杆菌 EET 的计时安培分析。 将 DHNA (20 μg/mL) 或 DMSO 注射到 mCDM 电解质 (pH~ 6.5) 中,注射时间确定为 t = 0。 j 表示电流密度与工作电极面积的函数关系。实验在 200 mV 与 Ag/AgCl 下使用碳毡电极 (16 cm2) 并搅拌进行。值绘制为在一式三份 BES 反应器中获得的 ± sd 平均值。缩写:EET = 细胞外电子转移;DHNA = 1,4-二羟基-2-萘甲酸;DMSO = 二甲基亚砜;mCDM = 含甘露醇的化学成分确定的培养基。 请单击此处查看此图的较大版本。
循环伏安法分析
为了进一步评估 DHNA 介导的植物乳杆菌 EET,我们在 DHNA 注射后 24 小时进行了循环伏安法。这里我们显示了三种情况的 CV 轨迹:含 20 μg/mL DHNA 的植物乳杆菌、含 DMSO 的植物乳杆菌以及含 20 μg/mL DHNA 的培养基。如图 4A 所示,在含有植物乳杆菌的反应器中存在 20 μg/mL DHNA 导致 50 mV 的氧化电流明显增加,这在单独存在 DMSO 的情况下不会发生。这些数据证实,添加氧化还原介质 DHNA 对于促进植物乳杆菌和阳极之间的电子转移是必要的。虽然我们在植物乳杆菌 + DMSO 迹线中观察到各种较小的氧化还原峰,但这些峰与培养基对照迹线相似,可能归因于 mCDM 中的氧化还原活性成分(补充图 S1)。在图 4B 中,我们比较了生物条件下 (L. plantarum + DHNA) 与非生物条件下 (Media + DHNA) 下的 DHNA 痕迹。虽然两条迹线在 50 mV 左右都表现出明显的 DHNA 氧化峰,但我们仅在生物条件下观察到电流持续增加超过 50 mV。催化峰在 300 mV 时达到 129 μA/cm2 的电流密度,与非生物痕量相比增加了 256%。这种周转 CV 曲线是微生物 EET27 的特征,表明在阳极氧化 DHNA 后,在电子源(甘露醇)存在下,植物乳杆菌细胞会重新还原 DHNA。此外,非生物迹线在 -240 mV 和 -180 mV 附近表现出新的氧化峰。先前的研究表明,这些峰的出现可能是由于 DHNA 降解成 ACNQ(2-氨基-3-羧基-1,4-萘醌)21,28。我们没有在生物痕迹中观察到这些峰值,这表明植物乳杆菌细胞与 DHNA 的相互作用可能会稳定 DHNA 并防止降解。需要注意的一点是,含有 20 μg/mL DHNA 的培养基的 24 小时迹线是根据该方案单独进行的,没有添加细胞。
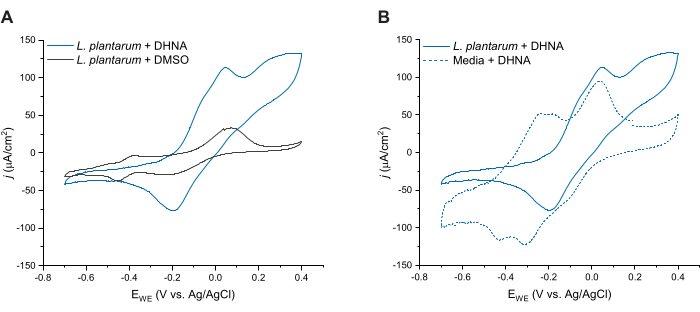
图 4:代表性的循环伏安法迹线。 所有 CV 实验均在 mCDM 中进行,使用碳毡 (16 cm2) 作为工作电极,扫描速率为 2 mV/s,同时搅拌溶液。(A) 在 t = 24 小时时,使用 DHNA (20 μg/mL) 或 DMSO 的植物 乳植杆菌 的 CV 迹线。(B) 在 t = 24 小时时,在 植物乳杆菌 (生物条件)或仅 mCDM(非生物条件)中,20 μg/mL DHNA 的 CV 迹线。缩写: CV = 循环伏安法;mCDM = 含甘露醇的化学成分确定的培养基;DHNA = 1,4-二羟基-2-萘甲酸;DMSO = 二甲基亚砜。 请单击此处查看此图的较大版本。
pH 值分析
L. plantarum 中的 EET 活性导致 pH 值在 24 小时内显着下降。如图 5 所示,暴露于 DHNA 的植物乳杆菌的平均样品 pH 值降至 3.33 ± 0.01 (p = 6.85 × 10-6,n = 3),而暴露于 DMSO 的植物乳杆菌的平均样品 pH 值降至 6.50 ± 0.06 (p = 0.0409,n = 3)。正如先前的研究所展示的那样,这种下降归因于植物乳杆菌执行 EET13 时发生的发酵代谢增加。植物乳杆菌通常通过糖酵解和发酵途径代谢甘露醇,这些途径产生乙酸盐、乳酸和乙醇作为终末发酵产物,并通过底物水平磷酸化产生 ATP29。在 EET 条件下,通过发酵的代谢通量增加,从而增加 BES 培养基中最终发酵产物的产生13。与 DMSO 对照反应器相比,这种代谢变化导致 DHNA 反应器中的介质 pH 值下降得更快。
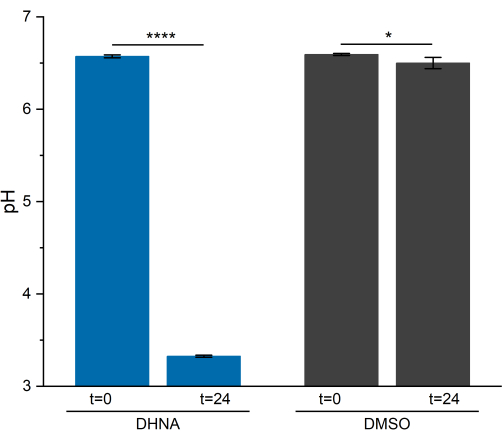
图 5: 植物乳植杆菌 生物电化学系统的 pH 值分析。 在计时安培法期间,在 t = 0 和 t = 24 小时收集样品。值绘制为在一式三份 BES 反应器中获得的 ± sd 平均值。显著性由单尾 t 检验确定。DHNA:P 值 = 6.85 × 10-6。DMSO:P 值 = 0.0409。缩写:DHNA = 1,4-二羟基-2-萘甲酸;DMSO = 二甲基亚砜。 请单击此处查看此图的较大版本。
表 1:制备 mMRS 培养基的成分24.请点击此处下载此表格。
表 2:制备 mCDM 培养基的成分。 该表摘自 Tejedor-Sanz 等人13 和 Aumiller 等人25。 请点击此处下载此表格。
表 3:制备 M9 培养基的成分。请点击此处下载此表格。
表 4:OCV、CA 和 CV 技术的 EC-Lab 参数设置。 缩写: OCV = 开路电压;CA = 计时安培法;CV = 循环伏安法。 请点击此处下载此表格。
补充图 S1:单独使用 DMSO 和 mCDM 的植物 乳植杆菌 的代表性循环伏安法痕迹。 植物 乳杆菌 的 CV 轨迹,DMSO 在 t = 24 小时,单独 mCDM 在 t = 0 小时。所有 CV 实验均使用碳毡 (16 cm2) 作为工作电极,扫描速率为 2 mV/s,同时搅拌溶液。缩写: CV = 循环伏安法;mCDM = 含甘露醇的化学成分确定的培养基;DHNA = 1,4-二羟基-2-萘甲酸;DMSO = 二甲基亚砜。 请点击此处下载此文件。
讨论
使用此处描述的三电极、两室生物电化学系统,我们展示了 DHNA 介导的 EET 在 植物乳杆菌中产生的电流的测量。这些 BES 实验生成高质量的数据;然而,BES 很敏感。因此,方案的成功取决于用户的精度,特别是在反应器和参比电极组装、针和电极在阳极腔室内的定位以及阳离子交换膜的更换。仔细组装反应器至关重要,确保在高压灭菌或实验期间没有水/介质泄漏。通过确保阳离子交换膜被切割成精确适合 O 形圈,并拧紧转向节夹以用手拧紧,可以解决漏水问题。在高压灭菌过程中,还必须将碳毡完全浸入水中,以使其具有亲水性以进行实验。我们建议新用户在高压灭菌前将新组装的装满水的反应器静置 2 小时,检查主瓶液络部下方是否有缓慢泄漏的迹象。此外,确保正确的参比电极组件可确保跨反应器的一致数据复制。如果玻璃外壳内的特氟龙熔块变色、开裂或干燥,则会导致参比电极出现高电阻。用户可以更换玻璃外壳以恢复参比电极的性能。
在实验过程中,阳极腔室内所有针和电极的正确方向对于实验成功至关重要。参比电极不得直接接触碳毡工作电极的任何部分。用户可以从反应器上方轻轻旋转工作电极钛丝来调整碳毡位置。此外,用于氮气鼓泡的针头放置不应直接接触腔室内的电极或腔室上方的任何电极/电化学工作站连接。应调整氮气流,使其不流入任一电极。最后,用户应将工作电极放置在搅拌棒上方 1-2 cm 处,确保搅拌棒不接触工作电极。如果在 OCV 中观察到不稳定的信号,通常可以通过确保在反应器内正确放置电极和氮气流,并检查电化学工作站引线和反应器电极之间的连接是否正确和安全来解决。最后,我们的经验表明,像 DHNA 这样的电子介质可以保留在阳离子交换膜内,如果重复使用太多,会产生高背景电流。我们建议在使用 2 到 3 次后更换阳离子交换膜,尤其是在研究介导的 EET 时,以保证可靠的实验结果。
与直接 EET 不同,直接 EET 中微生物直接附着在电极上促进电子转移,介导的 EET 需要电子穿梭在细胞膜和电极上一致扩散,从而产生此处描述的独特 BES 设置。首先,我们在方案中选择了双室 BES 而不是单室 BES,以使用阳离子交换膜分离阳极和阴极反应。这种分离可以防止自由扩散的电子介质 (DHNA) 和微生物与阴极交叉相互作用,确保微生物 EET 是减少电子介质和阳极的主要电子源。分离还允许精确控制介质浓度/分布和阳极电位等参数。此外,我们还选择碳毡作为负极材料,以及其他选项,例如石墨棒、金属电极、玻碳或氧化铟锡 (ITO)。这是因为碳毡的 3D 多孔结构提供的表面积比电极30 大得多,即使在高浓度下也能有效利用介质。我们的三电极、双腔 BES 设置即使在长期监测中也能提供可靠且可重复的介导 EET 读数;但是,此过程的吞吐量相对较低。该协议适用于对 EET 机制的实验室规模理解或测试原型 EET 应用程序。研究人员可以考虑将便携式或印刷式 BES31,32、互补金属氧化物半导体 (CMOS) 阵列33 或升级的 BES34 等替代 BES 架构用于不同的基础或应用目的。
在该协议中,我们提供了最常用的电化学技术的详细说明:计时安培法 (CA) 和循环伏安法 (CV)。值得注意的是,其他电化学技术,如电化学阻抗谱 (EIS) 和差分脉冲伏安法 (DPV),可以通过分析电荷转移电阻和双电层电容 35,36,37 来更深入地了解 BES。虽然该 BES 协议支持 EET 测量,但将电化学数据与代谢活性和细胞生物量测量相辅相成对于全面分析也是必不可少的。像 L. plantarum 这样的微生物与其他发酵副产物(如乳酸和乙醇)一起参与 EET 作为电子接收器之一。此外,值得注意的是,细胞生物量的增长也起到了电子汇的作用13。因此,量化消耗的电子供体(例如甘露醇)、评估细胞生物量生长和监测发酵副产物可以更深入地了解 EET 的效率和生理影响。细胞代谢物通常使用色谱和酶测定进行定量,而细胞活力和生长分别通过计数菌落形成单位和测量 600 nm 处用过培养基的光密度来评估13。同样重要的是要注意,EET 测量对实验条件下的小扰动很敏感。这包括但不限于 pH 值、温度、搅拌速度和氮气鼓泡率38。因此,通过生物分析测量对测得的 EET 水平进行标准化作为内部对照,有助于在不同日期进行的实验中进行一致的评估。
介导的 EET 将电化学技术与其他生物分析测量相结合,为电发酵和生物电催化创造了新的机会。有机、无机或酶电催化剂的常规使用因其成本高且容易降解而带来挑战。或者,由于微生物的自我修复和自我复制能力,使用微生物作为活性电催化剂提供了一种更便宜且更具可扩展性的解决方案39。植物乳杆菌,通常被认为是一种安全的乳酸菌,是一种特别有趣的底盘。使用本协议中描述的相同电化学设置,我们之前已经表明 L. plantarum 可以在 EET 条件下发酵羽衣甘蓝汁,并加速代谢通量以产生更多的发酵终产物,如乳酸、乙酸盐和琥珀酸盐13;这些有机酸是食品发酵中必不可少的风味化合物。这意味着,通过使用电化学技术,植物乳杆菌中介导的 EET 可能被劫持以纵代谢通量、改变食物风味或产生有价值的化学物质。值得注意的是,本协议中介绍的电化学技术不仅可以应用于植物乳杆菌,而且也可以普遍应用于执行介导的 EET40,41 的其他天然或工程微生物。可以根据所用特定微生物的电子转移机制选择不同的电子介质,例如黄素、二茂铁、中性红、铁氰化物、lawsone 和 menadone22,42。此外,这项工作中建立的 BES 方案可以扩展到执行无介质 EET 的外电原,如之前用 Shewanella 和 Geobacter 物种43,44 所证明的那样。应使用优化的生长培养基来支持特定微生物的细胞活性,以促进其 EET 性能。该协议微调了植物乳杆菌中 DHNA 介导的 EET 的参数,但当应用不同的微生物和电子介质时,预计会进行修改。
披露声明
作者没有需要声明的竞争利益。
致谢
我们感谢 Ajo-Franklin 实验室的成员对 BES 组装、维护、关键步骤和故障排除的深入讨论。该研究由陆军研究办公室赞助,并在资助号 W911NF-22-1-0239(授予 CMAF,支持 RA)和德克萨斯州癌症预防和研究所,授予 # RR190063(授予 CMAF,支持 R.C.、S. L. 和 B. B.K.)。 图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
参考文献
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。