Method Article
אפיון מעבר אלקטרונים חוץ-תאי מתווך בחיידקי חומצה לקטית עם מערכת ביואלקטרוכימית תלת-אלקטרודתית דו-תאית
In This Article
Summary
כאן אנו מציגים פרוטוקול לאפיון העברת אלקטרונים חוץ-תאית מתווכת (EET) בחיידקי חומצה לקטית באמצעות מערכת ביואלקטרוכימית תלת-אלקטרודתית בעלת שני תאים. אנו מדגימים שיטה זו עם Lactiplantibacillus plantarum ומתווך חמצון-חיזור 1,4-dihydroxy-2-naphthoic acid ומספקים תיאור יסודי של הטכניקות האלקטרוכימיות המשמשות להערכת EET מתווך.
Abstract
חיידקים רבים מבצעים העברת אלקטרונים חוץ-תאיים (EET), שבה אלקטרונים מועברים מהתא לקולט אלקטרונים טרמינלי חוץ-תאי. קולט אלקטרונים זה יכול להיות אלקטרודה ואלקטרונים יכולים להיות מועברים בעקיפין באמצעות מולקולת מתווך פעילה חמצון-חיזור. כאן, אנו מציגים פרוטוקול לחקר EET מתווך ב Lactiplantibacillus plantarum, חיידק חומצה לקטית פרוביוטית בשימוש נרחב בתעשיית המזון, באמצעות מערכת ביואלקטרוכימית. אנו מפרטים כיצד להרכיב מערכת ביואלקטרוכימית תלת אלקטרודתית, דו-תאית ומספקים הדרכה לאפיון EET בנוכחות מתווך מסיס באמצעות טכניקות כרונואמפרומטריה ווולטמטריה מחזורית. אנו משתמשים בנתונים מייצגים מניסויי EET בתיווך 1,4-dihydroxy-2-naphthoic acid (DHNA) עם L. plantarum כדי להדגים ניתוח נתונים ופרשנותם. הטכניקות המתוארות בפרוטוקול זה יכולות לפתוח הזדמנויות חדשות לתסיסה חשמלית וביואלקטרוקטליזה. יישומים אחרונים של טכניקה אלקטרוכימית זו עם L. plantarum הדגימו האצה של שטף מטבולי לקראת ייצור תוצרי קצה של תסיסה, שהם רכיבי טעם קריטיים בתסיסה של מזון. ככזו, למערכת זו יש פוטנציאל להתפתח עוד יותר כדי לשנות טעמים בייצור מזון או לייצר כימיקלים יקרי ערך.
Introduction
מערכות ביואלקטרוכימיות מתממשקות בין מיקרובים לאלקטרודות, ומאפשרות לחקור מנגנוני העברת אלקטרונים חוץ-תאיים (EET) ומספקות גישות מתחדשות לביו-אלקטרוקטליזה 1,2,3. מיקרובים המבצעים EET באופן טבעי ידועים כאקסואלקטרוגנים, אשר מעבירים אלקטרונים שמקורם בחילוף חומרים לקולטי אלקטרונים טרמינליים חוץ-תאיים, למשל תחמוצות ברזל (הידר) ואלקטרודות1. מסלולי EET, שאופיינו לראשונה בזנים Geobacter ו-Shewanella 4,5, זוהו מאז בחיידקים רבים. אקסו-אלקטרוגנים אלה ממלאים תפקיד מרכזי במספר טכנולוגיות אלקטרוכימיות מיקרוביאליות, כגון הפקת אנרגיה חשמלית מזרמי פסולת, קיבועCO2 וייצור כימיקלים יקרי ערך באמצעות אלקטרוסינתזה 1,6,7,8,9,10,11,12.
אקסואלקטרוגן אחד כזה הוא Lactiplantibacillus plantarum, חיידק חומצה לקטיתגראם-חיובי 13. L. plantarum הוא חיידק נוודי, פרוביוטי השוכן במגוון רחב של סביבות, כולל מעיים של בני אדם ובעלי חוליות אחרים, כמו גם סוגים רבים של מזון כגון בשר, דגנים, ירקות, מזון מותססומשקאות 14,15,16,17. הגנום שלו מקודד מטבוליזם גמיש והטרופרמנטטיבי, המאפשר הסתגלות מוצלחת בסביבות מגוונות אלה. הוא נחקר היטב, נמצא בשימוש נרחב בתעשיות המזון והבריאות, ומוכר בדרך כלל כבטוח על ידי מנהל המזון והתרופות18,19. ככזה, ל-L. plantarum יש פוטנציאל לשמש פלטפורמה שימושית לטכנולוגיות מבוססות EET.
מחקר שנערך לאחרונה ב- L. plantarum זיהה אופרון רב-גני המקודד מסלול EET מורכב המאופיין במקור בליסטריה מונוציטוגנים13,20. ב-L. plantarum, החלבונים המסונתזים מאופרון זה מסייעים ל-EET במערכת ביואלקטרוכימית (BES) כאשר מספקים להם את הכינון 1,4-dihydroxy-2-naphthoic acid (DHNA) כמתווך אלקטרונים13. החלבון החיוני הראשון במסלול זה הוא NADH-quinone oxidoreductase הקשור לקרום (Ndh2), אשר מחמצן NADH ומפחית DHNA. DHNA מעביר אלקטרונים ישירות לאלקטרודה או בעקיפין דרך חלבון העזר PplA (איור 1)13,21,22. מחקרים אחרונים מצביעים על כך ש-L. plantarum עשוי להשתמש גם בקינונים אחרים הדומים מבחינה מבנית ל-DHNA כמתווכי אלקטרונים; עם זאת, L. plantarum אינו מסוגל לייצר DHNA או קווינון חלופי זה, ולכן מתווכים חייבים להיות נוכחים אקסוגנית בסביבה עבור EET להתרחש 13,22,23.
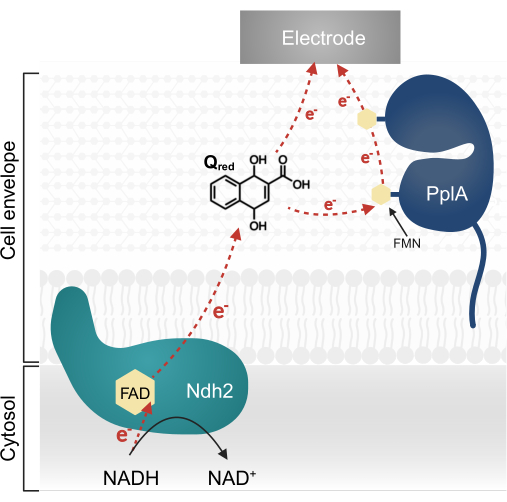
איור 1: זרימת אלקטרונים ב-Lactiplantibacillus plantarum EET. Ndh2 מעביר אלקטרונים מ-NADH לכינון DHNA. אלקטרונים מועברים לאלקטרודה כדי לייצר זרם, ישירות על ידי קינון מופחת או בעקיפין דרך חלבון העזר PplA. קיצורים: FAD = פלבין אדנין דינוקלאוטיד ; FMN = מונונוקלאוטיד פלבין; EET = העברת אלקטרונים חוץ-תאית; NADH = ניקוטין-אמיד אדנין די-נוקלאוטיד מופחת; Ndh2 = NADH-quinone oxidoreductase; DHNA = 1,4-dihydroxy-2-naphthoic acid; PplA = פוספוליפאז A. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
במאמר זה, אנו מספקים פרוטוקול מקיף לשימוש בשיטה מבוססת BES לאפיון EET בתיווך DHNA ב - L. plantarum. מערכת תלת-אלקטרודה דו-תאית מגבילה את החיידקים לאלקטרודה העובדת, ומאפשרת בקרה מדויקת של הפוטנציאל המופעל על החיידקים תוך מניעת תקשורת צולבת בין האלקטרודה העובדת לאלקטרודה הנגדית. אנו מציגים פרוטוקול מקיף המתפרש על פני 5 ימים, המכסה הכנה לפני ניסוי, הרכבת BES, ניתוח EET באמצעות כרונואמפרומטריה (CA) ווולטמטריה מחזורית (CV), וניתוח מדגם לאחר הניסוי. פרוטוקול זה יכול להיות מיושם כדי לפענח את המנגנונים של מסלולי EET ולבנות מערכות עבור electrofermentation ו electrocatalysis.
Protocol
הערה: מכלולי BES דו-תאיים יכונו "כורים" בפרוטוקול הבא.
1. הכנת מדיה
- הכינו את L. plantarum culturing media.
- הכן מדיה מסחרית של MRS (de Man Rogosa Sharpe) לפי ההוראות ומדיה של mMRS24 כמתואר בטבלה 1. התאם את ה- pH של mMRS ל- 6.5. יש לעקר את שתי המדיות על ידי העברתן דרך מסנן של 0.22 מיקרומטר ולאחסן את שתיהן בטמפרטורה של 4°C עד לשימוש.
- הכינו מדיום מוגדר כימית עם מניטול (mCDM)13,25 כמתואר בטבלה 2, וכווננו את ה-pH ל-6.5. הכינו מספיק מדיום כדי למלא את התא האנודי של כל כור עם 110 מ"ל של מדיום. סנן-סטריל mCDM באמצעות מסנן 0.22 מיקרומטר.
הערה: יש להכין mCDM טרי ביום השימוש המיועד. ניתן להכין מראש את פתרונות הרכיבים. סנן וחטא את כל תמיסות הרכיבים באמצעות מסנן 0.22 מיקרומטר ואחסן בטמפרטורה של 4°C. בעת הכנת ויטמינים של וולף, להתאים את ה- pH ל 11 לפני עיקור ולאחסן בחושך או עטוף בנייר כסף. בעת הכנת המינרלים של וולף, להתאים את ה- pH ל 8 לאחר הוספת חומצה ניטרילוטריאצטית (NTA). לאחר מכן, מוסיפים את שאר הרכיבים, מעקרים ומאחסנים בחושך או עטופים בנייר כסף.
- הכינו 1x PBS ו autoclave כדי לעקר. יש לאחסן בטמפרטורה של 4°C לשימוש בפרוטוקול זה.
- הכינו מדיה מסחרית M9 לפי ההוראות (טבלה 3) ואוטוקלאבה לעיקור. הכינו מספיק מדיה כדי למלא את התא הקתודי של כל כור ב-110 מ"ל. יש לאחסן בטמפרטורת החדר.
2. יום 1: הרכבת כור BES וגידול ראשונישל L. plantarum
הערה: איור סימוכין 2 עבור סכימה של כור BES ותרשים המפרט את חלקי ההרכבה המצוינים בפרוטוקול.
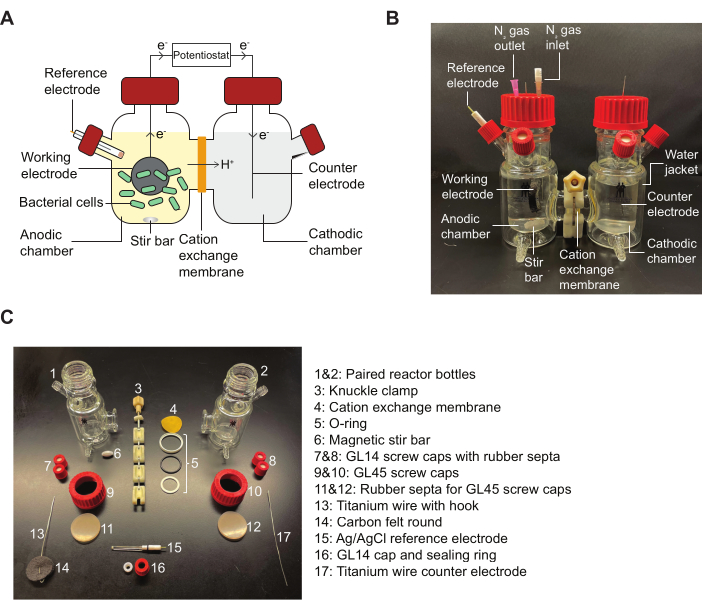
איור 2: רכיבי BES ודיאגרמה להרכבה. (A) סכמה של כור BES דו-תאי. חיידקים (ירוק) בתא האנודי מעבירים אלקטרונים לאלקטרודה עובדת (עיגול שחור) בנוכחות מתווך קינון. אלקטרונים זורמים דרך המעגל אל התא הקתודי, ומאפשרים לבצע מדידות זרם בין האנודה לקתודה על ידי פוטנציוסטט. (B) תמונה המתארת כור BES שהורכב במלואו, כולל מחטי כניסה ויציאה N2 בתא האנודי. (C) תמונה המתארת את כל חלקי הכור המפורק. קיצור: BES = מערכת ביואלקטרוכימית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- הרכבה ועיקור כורים.
- הכן את אלקטרודות העבודה נגד. חוטי טיטניום חתוכים מראש בקוטר 1.0 מ"מ עבור אלקטרודות העבודה והנגד עם נייר זכוכית תחמוצת אלומיניום עד להברקה אחידה. בעזרת צבת, כופפו קצה אחד של כל חוט אלקטרודה עובד לתוך וו קטן. החליקו לבד פחמןעגול בקוטר 16 ס"מ על כל חוט אלקטרודה עובד, ארגו את החוט פנימה והחוצה מהלבד הפחמני פעם אחת ומשכו את הכדור במורד החוט עד להצמדת הוו. אבטחו את האלקטרודות העובדות והנגדיות לתוך כובעי GL45 על ידי פירסינג מחיצת הגומי עם החוט ומשיכתו, דרך כמה סנטימטרים.
- כדי להרכיב כורים זוגיים, תחילה הרכיבו את טבעת ה-O והניחו קרום חילופי קטיונים חתוך מראש שהושרה מראש במים לתוך טבעת ה-O שהורכבה. מניחים את טבעת ה-O עם הממברנה בין הפתחים התחתונים הגדולים של שני בקבוקי כור זוגיים. הדקו את זוג בקבוקי הכור ואת טבעת ה-O עם הממברנה בעזרת מהדק מפרקי אצבעות לחוזק האצבע. יש לטפטף מוט ערבוב מגנטי לכל תא אנודי ולאחר מכן לסגור את כל הפתחים הקטנים בחלק העליון של כל בקבוק עם פקקי GL14 המצוידים במחיצה מגומי.
הערה: אין להדק יתר על המידה את מהדקי מפרקי האצבעות או פקקים כלשהם מכיוון שהדבר עלול להוביל לסדקים או שברים בבקבוקים. - מלאו כל בקבוק כור ב-110 מ"ל מים שעברו דה-יוניזציה (DI), ולאחר מכן סגרו כל בקבוק עם מכסה GL45 המתאים המצויד באלקטרודה. הכנס מכסים המצוידים באלקטרודת עבודה עגולה מפחמן על ידי לחיצה עדינה כלפי מטה בחלק העליון של סבב הלבד כך שהעגול יישאר על הוו.
הערה: פחמן טרי הוא הידרופובי ודוחה מים בכור בהרכבה הראשונית. אוטוקלאבינג יגרום לפחמן המורגש להפוך להידרופילי מתאים לניסויים. - אספו מכסי אלקטרודות GL14 המצוידים בטבעות אטימה מסיליקון.
- שחררו בעדינות את כל מכסי GL45 לפני החצייה. כורים אוטוקלאביים מלאים במים ומכסי אלקטרודות לעיקור. לאחר autoclaving, לאפשר את הכורים להתקרר לטמפרטורת החדר.
- תרבות L. plantarum NCIMB8826. בתנאים סטריליים, יש לגרד חלק מהחיידקים מהחלק העליון של מלאי גליצרול ולחסן לתוך 3 מ"ל של מדיה מסחרית MRS. הגדל את התרבית בן לילה ב 37 ° C מבלי לרעוד.
הערה: L. plantarum אינו משתמש בחמצן כמקבל אלקטרונים טרמינליים; לכן, אין צורך לחמצן את התקשורת על ידי טלטול26. אולם תנאי הגידול ישתנו אם משתמשים במיקרובים אחרים.
3. יום 2: הכנת אלקטרודות ייחוס, הכנת כורים לתחילת הניסוי ותת-תרבית L. plantarum
- הכינו אלקטרודות ייחוס Ag/AgCl.
הערה: שלבים אלה מתארים את הכנת אלקטרודות הייחוס Ag/AgCl המצוינות בטבלת החומרים. על המשתמשים לפעול בהתאם להוראות היצרן אם הם משתמשים באלקטרודת ייחוס אחרת.- לפרק אלקטרודות ייחוס Ag/AgCl ולחול את החוטים. משוך בעדינות את האלקטרודה מבית הזכוכית שלה וסובב את בית הזכוכית כדי לרוקן את תמיסת KCl הישנה. יש לחול בעדינות את חוטי האלקטרודה בנייר זכוכית של תחמוצת אלומיניום עד להברקה אחידה כדי להסיר חומר מחומצן.
- אספו את כל חוטי אלקטרודות הייחוס המנופות בכד קטן עם מוט ערבוב קטן ומלאו את הכד ב-100% אקונומיקה עד שהחוטים שקועים במלואם. כלוריד את החוטים על ידי מתן אפשרות לחוטים להלבין על משטח ערבוב במשך 30 דקות עד שהאלקטרודות הופכות לאפורות כהות יותר. לאחר ההלבנה, שטפו היטב את חוטי האלקטרודות במי DI.
- כדי להרכיב מחדש אלקטרודת ייחוס, השתמש במזרק כדי למלא את בית הזכוכית במלואו בתמיסת KCl 3 M רוויה בכלוריד כסף, תוך הקשה עדינה על הצד כדי לעקור בועות אוויר. באמצעות אותו מזרק, מלא את מכסה חוט האלקטרודה בתמיסת KCl, ולאחר מכן הכנס את החוט לתוך המארז. הניחו את החלק התחתון של בית הזכוכית כנגד מגבת נייר בחלק העליון של הספסל, הכניסו את האלקטרודה לבית הזכוכית ולאחר מכן לחצו בחוזקה כלפי מטה על המכסה כדי לסגור את האלקטרודה. אחסנו את אלקטרודות הייחוס בכד מלא באופן רדוד בתמיסת KCl עד לצורך, וחזרו על הפעולה עם כל אלקטרודות הייחוס הנותרות.
- השתמש במולטימטר דיגיטלי כדי למדוד את המתח של אלקטרודות ייחוס תוצרת בית Ag/AgCl.
- השקיעו את הקצוות של אלקטרודות הייחוס Ag/AgCl (המוערכות ב-197 mV לעומת אלקטרודת המימן הסטנדרטית, SHE) באופן רדוד בכד מלא ב-3 M KCl. חברו היטב את המולטימטר לאלקטרודת קלומל רוויה שנרכשה מסחרית (SCE, 241 mV לעומת SHE) השקועה גם היא באותם אלקטרוליטים של KCl.
- מדוד את הפרש הפוטנציאלים בין כל אלקטרודת ייחוס לבין SCE. ודא שאלקטרודות הייחוס שונות מה-SCE ב-44 ±-10 mV. לפרק ולהרכיב מחדש כל אלקטרודת ייחוס שנמצאת מחוץ לטווח זה.
- אטמו את התפר שבו הפקק פוגש את בית הזכוכית עם פרפילם.
- הכינו את הכורים לניסויים.
- בארון בטיחות ביולוגית סטרילי, החליפו את המים האוטומטיים בכורים עם המדיה המתאימה. יוצקים החוצה את המים האוטומטיים. ממלאים את התאים הקתודיים עם 110 מ"ל של מדיום M9 autoclaved. מלאו את התאים האנודיים ב-110 מ"ל של mCDM טרי.
- התקן את אלקטרודות הייחוס. יש להסיר מכסה GL14 אחד מכל תא אנודי ולהחליף אותו במכסה אלקטרודה אוטוקלאבי (מכסה GL14 עם טבעת אטימה מסיליקון). רססו את אלקטרודות הייחוס באתנול 70% כדי לעקר, ולאחר מכן הכניסו אלקטרודת ייחוס אחת דרך מכסה האלקטרודה לכל תא אנודי.
הערה: ודא שאלקטרודת הייחוס אינה יוצרת מגע ישיר עם הפחמן העגול. - לפני הסרת הכורים מארון הבטיחות הביולוגית, הדקו את כל המכסות והמלחציים כך שיהיו הדוקים לאצבעות כדי למנוע דליפה.
- חברו את הכורים למערכת משאבת המים. הניחו כל כור על משטח מוט הערבוב המתאים. חבר את ברזי מעיל המים של כל כור למשנהו באמצעות צינורות גומי, וחבר כורי קצה לצינורות הזרימה והזרימה של משאבת המים.
הערה: ודא שכל החיבורים הדוקים ללא נזילות, השתמש באזיקונים כדי לאבטח צינורות במידת הצורך. - ממלאים את המשאבה במים ומוסיפים 4-6 טיפות מזגן. הפעל את מערכת המשאבה והגדר את הטמפרטורה ל -30 מעלות צלזיוס. הפעל את המשאבה והתבונן בזרימת המים דרך כל מעילי המים של הכור, כדי לוודא שאין נזילות בחיבורים כלשהם.
- הפעל את פלטפורמות הערבוב והגדר אותן לערבוב רציף במהירות 220 סל"ד.
- חברו את הכורים לקווי הגזים המפיצים חנקן. חבר מסנן אוויר למחט 4 אינץ ', 22 G והכנס את המחט דרך המחיצה העליונה של תא אנודי כור לתוך המדיה כדי לשמש ככניסת חנקן. הכנס עוד מחט 1 אינץ ', 18 G לתוך המחיצה העליונה של החדר האנודי כדי לשמש כמוצא החנקן. חברו קווי גז ממקור חנקן למסנן האוויר ופתחו את השסתום כדי לאפשר לגז לבעבע בעדינות דרך הכור. ודא שחנקן מבעבע דרך כל החדרים האנודיים ברציפות לאורך כל הניסוי כדי לשמור על תנאים אנאירוביים.
הערה: ודא שמחט הכניסה ממוקמת הרחק מהפחמן העגול. זרם הבועות לא אמור ליצור מגע עם הפחמן המורגש או עם אלקטרודות הייחוס. - חברו את הביוריאקטורים למוליכי הפוטנציוסטאט. חבר את תפס התנין של אלקטרודת העבודה, המונה והייחוס מוליך מהפוטנציוסטט לאלקטרודות התואמות שלהם.
הערה: השתמש במולטימטר כדי לבדוק את ההתנגדות בין קולט החוטים/זרם לבין האלקטרודות כדי להבטיח חיבורים חשמליים תקינים ולמזער שגיאות מדידה פוטנציאליות.
- קלט פרמטרים potentiostat עבור prerun.
הערה: הגדרות טכניקה קריטית מפורטות להלן. ראה טבלה 4 לקבלת רשימה מורחבת של הגדרות תוכנה עבור כל טכניקה.- הפעל את potentiostat ואתחל את תוכנת EC-lab במחשב. חבר את הפוטנציוסטאט למחשב על-ידי לחיצה על לחצן סמל potentiostat בחלונית השמאלית העליונה תחת התקנים. לאחר החיבור, שם ההתקן יופיע עם עיגול ירוק בתיבת הטקסט למטה.
- סנכרן את כל הערוצים המחוברים לביוריאקטורים לקבוצה אחת על-ידי לחיצה על הכרטיסיה עריכה ולאחר מכן בחירה באפשרות סנכרן. לחץ על תיבות מספר הערוצים המתאימות | אישור.
- הוסף את הטכניקה מתח מעגל פתוח (OCV) לפוטנציוסטט על ידי לחיצה על הלחצן + בחלונית הגדרות פרמטרים משמאל. בתיבת ההגדרות הכחולה; הגדר אותו למדידת פוטנציאל אלקטרודת העבודה (EWE) כנגד אלקטרודת הייחוס (RE), תוך רישום זמן במרווח dt כל 36 שניות למשך 3 שעות בסך הכל.
- לאחר מכן, הוסף את הטכניקה וולטמטריה מחזורית (CV) לפוטנציוסטט. הגדר את הפוטנציאל הראשוני של EWE ל- Ei של 0 V לעומת RE עם קצב סריקה של 2 mV לשנייה. טאטוא לפוטנציאל קודקוד (E1) של 0.4 V לעומת היפוך RE לפוטנציאל קודקוד (E2) של -0.7 V לעומת RE. חזור על הסריקה עבור שני מטאטאים.
הערה: במערכות אלקטרוכימיות מיקרוביאליות, חיסון מיקרוביאלי והיווצרות ביופילם גורמים ליכולות גבוהות בהשוואה לחומרי מתכת או מולקולות אנאורגניות. במהלך סריקת וולטמטריה מחזורית, הפוטנציאל משתנה, וזרם טעינה משמש כרקע. כדי להשיג יחס אות לרעש גבוה, יש צורך בקצבי סריקה נמוכים יותר, אם כי הדבר מאריך את משך הסריקה. מכיוון שאנו סורקים שני מחזורים המכסים חלון אלקטרוכימי רחב של 1.1 וולט, קצב סריקה של 2 mV/s גורם לחצי מחזור להימשך עד 9.1 דקות. כתוצאה מכך, שני מחזורים נמשכים בסך הכל 36.4 דקות. הפחתה נוספת של קצב הסריקה תגזול זמן רב מדי. - הוסף את הטכניקה chronoamperometry (CA). החל פוטנציאל קבוע EWE של 0.2 V לעומת RE עבור זמן של t = 200 שעות, רישום זמן במרווחים dt כל 25-40 שניות. התאם את מרווח הזמן בהתבסס על תוכנת potentiostat כדי להשיג את רמת הפירוט הרצויה.
הערה: פוטנציאל נקודת האמצע של DHNA הוא בערך -0.093 V לעומת Ag/AgCl; לפיכך, פוטנציאל יישומי של 0.2 V לעומת RE לאלקטרודה העובדת מספיק כדי לאפשר מעבר אלקטרונים מ-DHNA לאלקטרודה. - לאחר הזנת כל הפרמטרים, התחל את הריצה על ידי לחיצה על משולש ההתחלה הירוק. שמור את הקובץ כרצונך בהתאם להוראות התוכנה ולאחר מכן לחץ על שמור. התוכנה תתחיל בטכניקה 1, "OCV". התבונן בעקבות OCV במשך כמה דקות כדי לוודא שכל הכורים קוראים באופן חיובי וקרובים זה לזה עם אות יציב. השאירו את הניסוי לרוץ במשך הלילה כדי להשלים OCV וקורות חיים ראשוניים (ראו איור משלים S1 עבור קורות החיים של בקרת המדיה) ואפשרו ל-CA לרוץ עד לייצוב.
- בתנאים סטריליים, תת-תרבית תרבית MRS של L. plantarum 1:200 ב-50 מ"ל של mMRS. לגדל את התאים בן לילה ב 37 ° C מבלי לרעוד.
הערה: תרבית לילה של 50 מ"ל מייצרת בדרך כלל די והותר תאים לשישה כורים, בהנחה של OD600 סופי של 0.2 בכור. התאם את נפחי התרבית בהתאם לניסויים גדולים או קטנים יותר.
4. יום 3: הזרקת תאים ו- DHNA / DMSO
- שוטפים את התאים ומזריקים אותם לכורים.
- הסר את תרבית mMRS L. plantarum מהאינקובטור בבוקר. בתנאים סטריליים, מעבירים את התרבית לצינור חרוטי של 50 מ"ל ומניחים את התרבית על קרח.
- לשטוף את התאים 2x סטרילי, קר 1x PBS. כדי לעשות זאת, צנטריפוגה את התרבית ב 4,000 × גרם במשך 5 דקות בצנטריפוגה 4 ° C כדי לגלול את התאים. בתנאים סטריליים, בעדינות אך ביסודיות להשעות את התאים ב 50 מ"ל של PBS, ואז צנטריפוגה שוב כמו קודם; חזרו על הפעולה לשטיפה שנייה. לאחר הצנטריפוגה הסופית, השהה מחדש את התאים ב- PBS קר ל- OD600 = 11.
- בתנאים סטריליים, לטעון 2 מ"ל של תאים מרחפים לתוך מזרק 3 מ"ל מצויד מחט עבור כל כור.
- בתחנת הכור, ערפו את ראשו של מזרק התא והכניסו את המחט לחלק העליון של תא אנודי של כור. אין ללחוץ על בוכנה מזרק בשלב זה; חזור על הפעולה עבור כל הכורים. ברגע שכל המזרקים נמצאים במקומם, לחץ על הבוכנות כדי להזריק את התאים לכורים ולרשום את זמן ההזרקה מעקבות CA. נפח תאים זה מייצר OD600 סופי של 0.2 בכורים. יש להשליך את כל המזרקים בקופסאות סיכון ביולוגי ומחטים במיכל המסוכן הביולוגי הייעודי של חדים. אפשר לזרם להתייצב שטוח על עקבות CA למשך 2-4 שעות.
הערה: עם ההזרקה, ניתן לראות תנודות זרם על עקבות CA. לאחר 2-4 שעות, תנודות אלה יתייצבו לזרם שטוח (שינוי של <2 μA בזרם במהלך שעה), ואז ניתן יהיה להזריק DHNA.
- למדוד pH ראשוני ולהזריק DHNA.
- הכינו פתרון DHNA. בצינור של 1.5 מ"ל, הכינו 500 μL של תמיסת DHNA במינון 20 מ"ג/מ"ל על ידי המסת אבקת DHNA ב-100% DMSO. מלא 3 מזרקי אינסולין עם 110 μL של תמיסת DHNA ו -3 מזרקי אינסולין עם 110 μL של DMSO בלבד.
הערה: בעוד DHNA מסיס קלות במים, DMSO הוא ממס טוב יותר עבור מלאי DHNA בריכוז זה. ממס המגשר עשוי להשתנות אם משתמשים במגשרים אחרים. - בתחנת הכור BES, תייגו את כורי הניסוי כ - + DHNA ואת כורי בקרת הממס כ - DHNA. ערפו את ראשו של מזרק DHNA והכניסו את המזרק לחלק העליון של כל תא אנודי המסומן כ - + DHNA. הכנס מזרק DMSO בלבד לכל תא אנודי המוגדר כ - DHNA. אל תלחץ על בוכנות המזרק בשלב זה.
- קח דגימות של 0 שעות נקודת זמן לניתוח דגימה. באמצעות מזרק 3 מ"ל המצויד במחט 2 אינץ ', 21 גרם, לקחת דגימת מדיה 2 מ"ל מכל תא אנודי דרך מחיצת הפקק הקטן שאינו בשימוש ולהעביר את הדגימות לצלחת 24 באר עמוקה כדי לקחת מדידות pH עבור נקודת הזמן 0 שעות (נקודת הזרקת DHNA). אם תרצה, קח 1 מ"ל של מדיה משומשת מכל תא אנודי וסנן דרך מסנן 0.2 מיקרומטר לתוך צינורות מסומנים נקיים לכימות מטבוליטים באמצעות HPLC או בדיקות אחרות. אחסן דוגמאות מדיה בילה ב -80 ° C.
- לחץ על הבוכנות של כל מזרקי DHNA ו- DMSO כדי להזריק לכורים. רשום את זמן ההזרקה ממעקב CA. יש להשליך את כל המזרקים והמחטים בהתאם.
- מדוד ורשום את דגימות ה- pH של 0 שעות עבור כל כור.
- הכינו פתרון DHNA. בצינור של 1.5 מ"ל, הכינו 500 μL של תמיסת DHNA במינון 20 מ"ג/מ"ל על ידי המסת אבקת DHNA ב-100% DMSO. מלא 3 מזרקי אינסולין עם 110 μL של תמיסת DHNA ו -3 מזרקי אינסולין עם 110 μL של DMSO בלבד.
5. יום 4: השלמת הניסוי ואיסוף הדגימות
- בצע ניתוח אלקטרוכימי 24 שעות לאחר הזרקת DHNA ולקחת דגימות סופיות.
- סיים את ריצת CA 24 שעות לאחר הזרקת DHNA.
- קח דגימות של 24 שעות זמן לניתוח דגימה לפי שלב 4.2.3.
- הפעל את CV שוב עבור נקודת הזמן של 24 שעות בהתאם לפרמטרים המתוארים בשלב 3.3.4.
- מדוד ורשום את רמת החומציות עבור דגימות של 24 שעות מכל כור.
- לפרק ולנקות את הכורים.
- כבה את הפוטנציוסטט. לאחר מכן, נתק את לידים העבודה, המונה וההתייחסות מכל כור. נגבו את הלחות מהקליפסים של תנין העופרת פוטנציוסטט.
- כבו את זרימת גז החנקן. נתק את מוליכי הגז ולאחר מכן הסר את מחטי הזרימה והיציאה. יש להשליך את כל המחטים כראוי במיכל חד.
- כבו את משאבת המים. נתקו את צינורות הזרימה והזרימה מהמשאבה ואפשרו למים להתנקז לתוך דלי. בעת הניתוק, יש לשמור על קצוות הצינור מוגבהים מעל קו המים במשאבה כדי למנוע חדירת מים לרצפה. בזה אחר זה, נתקו כל כור מצינור מעטפת המים, ועבדו מהכור הסופי לכור ההזרמה הראשוני.
- רוקנו את כל המדיה מהכורים לתוך מיכל גדול של סכנה ביולוגית. עקוב אחר שיטות הלבנה רגילות של תרבית לסילוק.
- לאחר ריקון, לפרק ולנקות את כל חלקי הכור. יש להשליך את קרומי חילוף הקטיונים ואת עיגולי לבד הפחמן לפסולת ביולוגית מתאימה. נקו אלקטרודות ייחוס וחוטי טיטניום עם 70% אתנול ואחסנו את אלקטרודות הייחוס המנוקות בכד מלא רדודה במים. נקו בעדינות בקבוקים, פקקים, אורינגים ומהדקים של הכור במים חמים עם חומר ניקוי מעבדה, שטפו היטב במי DI וייבשו באוויר את כל החלקים לפני האחסון.
6. יום 5: אנליזה אלקטרוכימית
הערה: להלן תיאור כללי של התוויית נתונים עבור פרוטוקול זה. תיאורים מפורטים יותר בנוגע לניתוח ופרשנות נתונים יסופקו בסעיף תוצאות מייצגות.
- עבור ניתוח CA: הגדר את זמן הזרקת DHNA כנקודת הזמן של 0 שעות. התווה את הממוצע וסטיית התקן של צפיפות הזרם הנמדדת (j ב- μA/cm2) שנלקחה כל 36 שניות עבור כל המשוכפלים מנקודת הזמן של 0 שעות כפונקציה של זמן (h). חישוב צפיפות הזרם כפונקציה של שטח אלקטרודת העבודה (16 ס"מ2).
- לניתוח קורות חיים: התווה מעקב קורות חיים מייצג עבור כל תנאי ניסוי (מדיה בלבד, DMSO או DHNA) המתאר צפיפות זרם (j ב- μA/cm2) כפונקציה של פוטנציאל האלקטרודה העובדת (EWE ב- V). מחזור העלילה שניים מתוך קורות החיים שנבחרו.
תוצאות
ניתוח כרונואמפרומטריה
ניתן לצפות ב-EET של L. plantarum באמצעות נתוני הכרונואמפרומטריה (CA) המתוארים באיור 3, שבהם עקבת הצפיפות הנוכחית מדמיינת את מעבר האלקטרונים מ-L. plantarum לאלקטרודה העובדת. עקבנו אחר צפיפות הזרם (j) לעומת הזמן תוך שמירה על פוטנציאל קבוע של +200 mV לעומת Ag/AgCl במשך 24 שעות. לאחר הזרקת 20 מיקרוגרם/מ"ל DHNA לתמיסת האלקטרוליטים הבוחשת, נצפה ספייק חמצון DHNA אביוטי, ואחריו עלייה מהירה בצפיפות הזרם הביוטי שהגיעה לשיא של 132.0 ± 2.47 μA/cm2 בערך בנקודת הזמן של 8 שעות. לעומת זאת, הזרקת DMSO הביאה לצפיפות זרם זניחה. תוצאות אלה מדגישות את חשיבותו של DHNA כמתווך הכרחי ויעיל כדי להקל על מעבר אלקטרונים בין L. plantarum לבין האלקטרודה. משתמשים יכולים להתאים את הפלט הנוכחי על ידי התאמת ריכוז ה- DHNA ב- BES. מחקרים קודמים מצביעים גם על כך ש-L. plantarum מגיב ל-DHNA באופן תלוי מינון במגוון רחב של ריכוזי DHNA, ומייצר זרם משמעותי בנוכחות ריכוזי DHNA נמוכים עד 0.01 מיקרוגרם/מ"ל13,22.
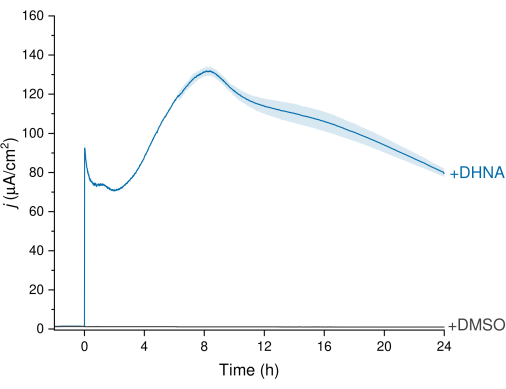
איור 3: ניתוח כרונואמפרומטריה של Lactiplantibacillus plantarum EET בתיווך DHNA. DHNA (20 מיקרוגרם / מ"ל) או DMSO הוזרק לאלקטרוליטים mCDM (pH~ 6.5) עם זמן הזרקה שזוהה כ- t = 0. J מייצג את צפיפות הזרם כפונקציה של אזור האלקטרודה העובדת. הניסויים נערכו ב-200 mV לעומת Ag/AgCl עם אלקטרודת לבד פחמן (16 ס"מ2) וערבוב. הערכים מסומנים כממוצע ± sd המתקבל בכורי BES משולשים. קיצורים: EET = העברת אלקטרונים חוץ-תאית; DHNA = 1,4-dihydroxy-2-naphthoic acid; DMSO = dimethyl sulfoxide; mCDM = מדיום מוגדר כימית עם מניטול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ניתוח וולטמטריה מחזורית
כדי להעריך עוד יותר EET בתיווך DHNA ב-L. plantarum, ערכנו וולטמטריה מחזורית 24 שעות לאחר הזרקת DHNA. כאן אנו מראים עקבות CV עבור שלושה מצבים: L. plantarum עם 20 מיקרוגרם / מ"ל DHNA, L. plantarum עם DMSO, ומדיה עם 20 מיקרוגרם / מ"ל DHNA. כפי שניתן לראות באיור 4A, נוכחות של 20 מיקרוגרם/מ"ל DHNA בכורים המכילים L. plantarum הביאה לעלייה ברורה בזרם החמצוני ב-50 mV שלא התרחשה בנוכחות DMSO בלבד. נתונים אלה מאשרים כי הוספת מתווך חמצון-חיזור DHNA נחוצה כדי להקל על מעבר אלקטרונים בין L. plantarum לבין האנודה. בעוד שראינו פסגות חמצון-חיזור קטנות יותר בעקבות L. plantarum + DMSO, פסגות אלה היו דומות למעקב בקרת המדיה וככל הנראה מיוחסות לרכיבים פעילים של חמצון-חיזור ב-mCDM (איור משלים S1). באיור 4B השווינו עקבות של DHNA בתנאים ביוטיים (L. plantarum + DHNA) לעומת DHNA בתנאים אביוטיים (מדיה + DHNA). בעוד ששתי העקבות הציגו שיא חמצוני מובהק של DHNA סביב 50 mV, ראינו עלייה מתמשכת בזרם מעבר ל-50 mV רק בתנאים ביוטיים. השיא הקטליטי הגיע לצפיפות זרם של 129 μA/cm2 ב-300 mV, המייצג עלייה של 256% בהשוואה לעקבות הא-ביוטיות. פרופיל CV מחזור זה אופייני ל-EET27 מיקרוביאלי, ומצביע על הפחתה מחדש של DHNA על ידי תאי L. plantarum בנוכחות מקור אלקטרונים (מניטול) לאחר חמצון של DHNA באנודה. בנוסף, העקבות הא-ביוטיות הציגו שיאי חמצון חדשים סביב -240 mV ו -180 mV. מחקרים קודמים מצביעים על כך שהופעתן של פסגות אלה עשויה לנבוע מהתפרקות של DHNA ל-ACNQ (2-אמינו-3-קרבוקסי-1,4-נפתוקינון)21,28. לא ראינו את השיאים האלה בעקבות הביוטיים, מה שמצביע על כך שהאינטראקציה של תאי L. plantarum עם DHNA עשויה לייצב את DHNA ולמנוע התפרקות. נקודה לציין היא כי מעקב 24 שעות עבור מדיה עם 20 מיקרוגרם / מ"ל DHNA נערך בנפרד על פי פרוטוקול זה ללא הוספת תאים.
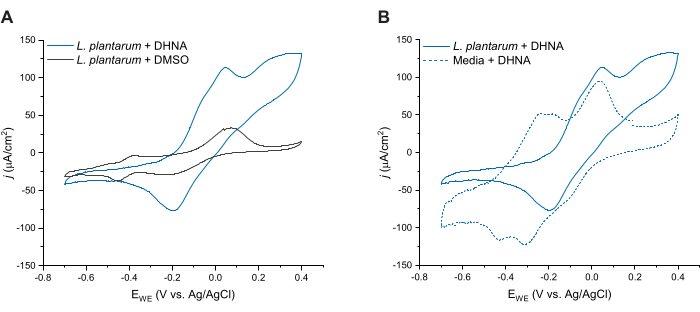
איור 4: עקבות וולטמטריה מחזורית מייצגת. כל ניסויי CV בוצעו ב- mCDM תוך שימוש בפחמן לבד (16 ס"מ2) כאלקטרודה עובדת בקצב סריקה של 2 mV לשנייה תוך ערבוב התמיסה. (A) עקבות CV עבור Lactiplantibacillus plantarum עם DHNA (20 מיקרוגרם/מ"ל) או DMSO ב-t = 24 שעות. (B) עקבות CV של 20 מיקרוגרם/מ"ל DHNA ב-L. plantarum (תנאים ביוטיים) או mCDM בלבד (תנאים אביוטיים) ב-t = 24 שעות. קיצורים: CV = וולטמטריה מחזורית; mCDM = מדיום מוגדר כימית עם מניטול; DHNA = 1,4-dihydroxy-2-naphthoic acid; DMSO = דימתיל סולפוקסיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ניתוח pH
פעילות EET ב-L. plantarum הביאה לירידה ניכרת ב-pH במשך 24 שעות. כפי שניתן לראות באיור 5, רמת החומציות הממוצעת של L. plantarum שנחשף ל-DHNA ירדה ל-3.33 ±-0.01 (p = 6.85 × 10-6, n = 3), בעוד שה-pH הממוצע של L. plantarum שנחשף ל-DMSO ירד ל-6.50 ±-0.06 (p = 0.0409, n = 3). כפי שהוצג במחקר קודם, ירידה זו מיוחסת לעלייה בחילוף החומרים המותסס המתרחשת כאשר L. plantarum מבצע EET13. L. plantarum בדרך כלל מעכל מניטול באמצעות גליקוליזה ומסלולי תסיסה, המייצרים אצטט, לקטט ואתנול כתוצרי תסיסה סופיים ומייצרים ATP באמצעות זרחן ברמת המצע29. בתנאי EET, השטף המטבולי באמצעות תסיסה גדל, ובכך מגביר את הייצור של תוצרי תסיסה סופית במדיה BES13. שינוי מטבולי זה גורם ל-pH התקשורתי לרדת מהר יותר בכורים עם DHNA בהשוואה לכורי הבקרה של DMSO.
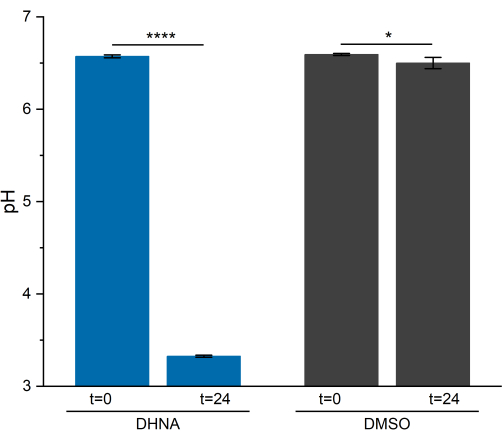
איור 5: ניתוח pH של המערכת הביואלקטרוכימית Lactiplantibacillus plantarum . הדגימות נאספו ב t = 0 ו t = 24 שעות במהלך הכרונואמפרומטריה. הערכים מסומנים כממוצע ± sd המתקבל בכורי BES משולשים. המשמעות נקבעה על ידי מבחן t חד-זנבי. DHNA: ערך P = 6.85 × 10-6. DMSO: ערך P = 0.0409. קיצורים: DHNA = 1,4-dihydroxy-2-naphthoic acid; DMSO = דימתיל סולפוקסיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: מרכיבים להכנת מדיה mMRS24. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: מרכיבים להכנת מדיה mCDM. טבלה זו נלקחה מ Tejedor-Sanz et al.13 ו Aumiller et al.25. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: מרכיבים להכנת מדיה M9. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: הגדרות פרמטר EC-Lab עבור טכניקות OCV, CA ו- CV. קיצורים: OCV = מתח מעגל פתוח; CA = כרונואמפרומטריה; CV = וולטמטריה מחזורית. אנא לחץ כאן כדי להוריד טבלה זו.
איור משלים S1: עקבות וולטמטריה מחזוריות מייצגות של Lactiplantibacillus plantarum עם DMSO ו-mCDM בלבד. קורות חיים עוקבים עבור L. plantarum עם DMSO ב t = 24 h ו mCDM לבד ב t = 0 h. כל ניסויי קורות החיים בוצעו באמצעות פחמן לבד (16 ס"מ2) כאלקטרודה עובדת בקצב סריקה של 2 mV/s תוך ערבוב התמיסה. קיצורים: CV = וולטמטריה מחזורית; mCDM = מדיום מוגדר כימית עם מניטול; DHNA = 1,4-dihydroxy-2-naphthoic acid; DMSO = דימתיל סולפוקסיד. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
באמצעות המערכת הביואלקטרוכימית בעלת שלוש האלקטרודות ושני התאים המתוארת כאן, הראינו מדידה של הדור הנוכחי מ-EET בתיווך DHNA ב-L. plantarum. ניסויי BES אלה מייצרים נתונים באיכות גבוהה; עם זאת, BESs הם רגישים. לפיכך, הצלחת הפרוטוקול תלויה בדיוק המשתמש, במיוחד בהרכבת כורים ואלקטרודות ייחוס, מיקום מחטים ואלקטרודות בתוך התא האנודי, והחלפת קרום חילופי קטיונים. זה קריטי להרכיב כורים בזהירות, להבטיח שלא תהיה דליפת מים/מדיה במהלך אוטוקלאבינג או ניסויים. ניתן לפתור נזילות מים על ידי הקפדה על חיתוך קרומי החלפת קטיונים כך שיתאימו במדויק לטבעת ה-O והידוק מהדק מפרקי האצבעות לחוזק האצבע. כמו כן, חיוני לטבול את הפחמן באופן מלא במים במהלך אוטוקלאבינג כדי לאפשר לו להפוך להידרופילי לצורך ניסויים. אנו ממליצים למשתמשים חדשים לאפשר לכורים שהורכבו לאחרונה מלאים במים לשבת במשך שעתיים לפני האוטוקלאבינג, ולבדוק אם יש סימנים לדליפות איטיות מתחת לצמתי הבקבוקים הראשיים. יתר על כן, הבטחת הרכבה נכונה של אלקטרודות ייחוס מבטיחה שכפול נתונים עקבי בין כורים. אם פריטת הטפלון בתוך בית הזכוכית הופכת דהויה, סדוקה או יבשה, הדבר עלול לגרום להתנגדות גבוהה של אלקטרודת הייחוס. משתמשים יכולים להחליף את בית הזכוכית כדי לשחזר את ביצועי אלקטרודות הייחוס.
כיוון נכון של כל המחטים והאלקטרודות בתוך התא האנודי במהלך הניסוי הוא קריטי להצלחת הניסוי. אסור שאלקטרודת הייחוס תבוא במגע ישיר עם חלק כלשהו של אלקטרודת העבודה הפחמנית. משתמשים יכולים להתאים את מיקום לבד הפחמן על ידי סיבוב עדין של חוט טיטניום אלקטרודת העבודה מעל הכור. בנוסף, מיקום המחט עבור sparging חנקן לא צריך ליצור מגע ישיר עם אלקטרודות בתוך התא או כל חיבורי אלקטרודה/potentiostat מעל התא. יש לכוונן את זרם החנקן כך שלא יזרום לאף אחת מהאלקטרודות. לבסוף, על המשתמשים לוודא שמוט הערבוב אינו בא במגע עם האלקטרודה העובדת על ידי מיקום האלקטרודה העובדת 1-2 ס"מ מעל מוט הערבוב. אם נצפה אות לא יציב ב-OCV, ניתן לפתור זאת בדרך כלל על ידי הבטחת מיקום נכון של אלקטרודות וזרם החנקן בתוך הכור, ועל ידי בדיקה שהקשרים בין מוליכי הפוטנציוסטאט לבין אלקטרודות הכור נכונים ובטוחים. לבסוף, הניסיון שלנו מראה כי מתווכי אלקטרונים כמו DHNA יכולים להישמר בתוך קרום חילופי הקטיונים ולגרום לזרם רקע גבוה אם נעשה בהם שימוש חוזר פעמים רבות מדי. אנו ממליצים להחליף את קרום החלפת הקטיונים לאחר שניים עד שלושה שימושים, במיוחד בעת חקירת EET מתווך, כדי להבטיח תוצאות ניסוי אמינות.
שלא כמו EET ישיר, שבו חיבור מיקרוביאלי ישיר לאלקטרודה מאפשר מעבר אלקטרונים, EET מתווך מחייב דיפוזיה עקבית של מעבורות אלקטרונים על פני קרום התא והאלקטרודה, וכתוצאה מכך הגדרות BES ייחודיות המתוארות כאן. ראשית, בחרנו BES דו-תאי על פני מקבילו החד-תאי בפרוטוקול שלנו כדי להפריד בין תגובות אנודיות וקתודיות באמצעות קרום חילופי קטיונים. הפרדה זו מונעת ממתווכי האלקטרונים המתפזרים בחופשיות (DHNA) ומהמיקרובים אינטראקציה צולבת עם הקתודה, ומבטיחה ש-EET מיקרוביאלי הוא מקור האלקטרונים העיקרי להפחתת מתווכי האלקטרונים והאנודה. ההפרדה מאפשרת גם שליטה מדויקת בפרמטרים כמו ריכוז/פיזור המתווך והפוטנציאל הטמון באנודה. בנוסף, בחרנו פחמן לבד כחומר אנודה בין אפשרויות אחרות כגון מוטות גרפיט, אלקטרודות מתכת, פחמן זכוכיתי או תחמוצת בדיל אינדיום (ITO). הסיבה לכך היא שהמבנה הנקבובי התלת-ממדי של פחמן לבד מספק שטח פנים גדול בהרבה מאלקטרודות30 אלה, ומאפשר ניצול יעיל של מתווכים גם בריכוזים גבוהים. הגדרות ה-BES שלנו בעלות שלוש אלקטרודות ושני תאים מספקות קריאה אמינה וניתנת לשחזור של EET מתווך גם במהלך ניטור ארוך טווח; עם זאת, תהליך זה הוא תפוקה נמוכה יחסית. פרוטוקול זה מתאים להבנה בקנה מידה של מנגנוני EET או לבדיקת יישומי EET אב-טיפוס. ארכיטקטורות BES חלופיות כגון BESs31,32 ניידים או מודפסים, מערכי מוליכים למחצה משלימים של תחמוצת מתכת (CMOS)33, או BESs34 משודרגים יכולים להיחשב על ידי חוקרים למטרות בסיסיות או יישומיות שונות.
בפרוטוקול זה, אנו מספקים הוראות מפורטות עבור הטכניקות האלקטרוכימיות הנפוצות ביותר: כרונואמפרומטריה (CA) ווולטמטריה מחזורית (CV). ראוי לציין כי טכניקות אלקטרוכימיות אחרות, כגון ספקטרוסקופיית עכבה אלקטרוכימית (EIS) ווולטמטריית דופק דיפרנציאלי (DPV), יכולות לספק תובנות עמוקות יותר לגבי BES על ידי ניתוח התנגדות העברת מטען וקיבול דו-שכבתי 35,36,37. בעוד פרוטוקול BES זה מאפשר מדידות EET, השלמת נתונים אלקטרוכימיים עם פעילות מטבולית ומדידות ביומסה של התא יכולה להיות חיונית גם לניתוח מקיף. חיידקים כמו L. plantarum מפעילים EET כאחד משוקעי האלקטרונים לצד תוצרי לוואי אחרים של תסיסה כגון לקטט ואתנול. יתר על כן, ראוי לציין כי גידול ביומסה התא משמש גם ככיור אלקטרונים13. לכן, כימות תורמי אלקטרונים נצרכים, כגון מניטול, הערכת צמיחת ביומסה של תאים וניטור תוצרי לוואי של תסיסה מציעים תובנות עמוקות יותר לגבי היעילות וההשלכות הפיזיולוגיות של EET. מטבוליטים תאיים מכומתים בדרך כלל באמצעות כרומטוגרפיה ובדיקות אנזימטיות, בעוד שיכולת הקיום והצמיחה של התאים מוערכים על ידי ספירת יחידות יוצרות מושבה ומדידת הצפיפות האופטית של מדיה משומשת ב -600 ננומטר, בהתאמה13. חשוב גם לציין כי מדידות EET רגישות להפרעות קטנות בתנאי ניסוי. זה כולל, אך אינו מוגבל ל- pH, טמפרטורה, מהירות ערבוב וקצב התפשטות גז חנקן38. לכן, נרמול רמות EET שנמדדו עם מדידות ביואנליטיות פועל כבקרה פנימית, המאפשר הערכה עקבית על פני ניסויים שנערכו בימים שונים.
שילוב טכניקות אלקטרוכימיות עם מדידות ביואנליטיות אחרות, EET בתיווך יוצר הזדמנויות חדשות עבור תסיסה אלקטרו וביואלקטרוקטליזה. שימוש קונבנציונלי באלקטרוזרזים אורגניים, אנאורגניים או אנזימטיים מציב אתגרים בשל עלותם הגבוהה והם מועדים להתכלות. לחלופין, שימוש במיקרובים כאלקטרוזרזים חיים מציע פתרון זול יותר וניתן להרחבה יותר בשל יכולות התיקון העצמי והשכפול העצמי של המיקרובים39. L. plantarum, המוכר בדרך כלל כחיידק בטוח לחומצה לקטית, הוא שלדה מסקרנת במיוחד. באמצעות שימוש במערכים אלקטרוכימיים זהים המתוארים בפרוטוקול זה, הראינו בעבר כי L. plantarum יכול להתסיס מיץ קייל בתנאי EET ולהאיץ את השטף המטבולי לקראת ייצור תוצרי תסיסה סופיים נוספים כגון לקטט, אצטט וסוקצינאט13; חומצות אורגניות אלה הן תרכובות טעם חיוניות בתסיסה של מזון. משמעות הדבר היא כי על ידי שימוש בטכניקות אלקטרוכימיות, EET מתווך ב L. plantarum יכול להיות חטוף פוטנציאלית כדי לתפעל שטף מטבולי, לשנות טעמי מזון, או לייצר כימיקלים יקרי ערך. ראוי לציין כי הטכניקות האלקטרוכימיות המוצגות בפרוטוקול זה יכולות להיות מיושמות לא רק על L. plantarum אלא ניתן ליישם אותן באופן גנרי גם על מיקרובים מקומיים או מהונדסים אחרים המבצעים EETמתווך 40,41. מתווכי אלקטרונים שונים, כגון פלבין, פרוקן, אדום נייטרלי, פריציאניד, לוסון ומנדיון יכולים להיבחר על סמך מנגנון העברת האלקטרונים של המיקרוב הספציפי הנמצא בשימוש22,42. יתר על כן, פרוטוקול BES שנקבע בעבודה זו יכול להיות מורחב לאקסואלקטרוגנים המבצעים EET ללא מתווך כפי שהודגם בעבר עם המינים Shewanella ו- Geobacter 43,44. יש להשתמש במדיום גדילה אופטימלי כדי לתמוך בפעילות התאית של החיידק המסוים כדי להקל על ביצועי ה-EET שלו. פרוטוקול זה מכוונן את הפרמטרים עבור EET בתיווך DHNA ב-L. plantarum, אך שינויים צפויים כאשר חיידקים שונים ומתווכי אלקטרונים מיושמים.
Disclosures
למחברים אין אינטרסים מתחרים להצהיר.
Acknowledgements
אנו מודים לחברי מעבדת Ajo-Franklin על דיונים מעמיקים על הרכבת BES, תחזוקה, שלבים קריטיים ופתרון בעיות. המחקר מומן על ידי משרד המחקר הצבאי ובוצע תחת מענק מספר W911NF-22-1-0239 (ל- C. M. A-F, התומך ב- R. A.) ועל ידי המכון למניעת סרטן ומחקר של טקסס, מענק # RR190063 (ל- C. M. A-F, תמיכה ב- R. C., S. L. ו- B. B. K). איור 1 נוצר באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
References
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved