Method Article
Laktik Asit Bakterilerinde Üç Elektrotlu, İki Odacıklı Biyoelektrokimyasal Sistem ile Aracılı Hücre Dışı Elektron Transferinin Karakterize Edilmesi
Bu Makalede
Özet
Burada, üç elektrotlu, iki odacıklı bir biyoelektrokimyasal sistem kullanarak laktik asit bakterilerinde aracılı hücre dışı elektron transferini (EET) karakterize etmek için bir protokol sunuyoruz. Bu yöntemi Lactiplantibacillus plantarum ve redoks aracısı 1,4-dihidroksi-2-naftoik asit ile gösteriyoruz ve aracılı EET'yi değerlendirmek için kullanılan elektrokimyasal tekniklerin kapsamlı bir tanımını sunuyoruz.
Özet
Birçok bakteri, hücre dışı elektron transferi (EET) gerçekleştirir, bu sayede elektronlar hücreden hücre dışı bir terminal elektron alıcısına aktarılır. Bu elektron alıcısı bir elektrot olabilir ve elektronlar bir redoks aktif aracı molekül aracılığıyla dolaylı olarak verilebilir. Burada, gıda endüstrisinde yaygın olarak kullanılan bir probiyotik laktik asit bakterisi olan Lactiplantibacillus plantarum'da aracılı EET'yi biyoelektrokimyasal bir sistem kullanarak incelemek için bir protokol sunuyoruz. Üç elektrotlu, iki odacıklı bir biyoelektrokimyasal sistemin nasıl monte edileceğini detaylandırıyoruz ve kronoamperometri ve döngüsel voltametri tekniklerini kullanarak çözünür bir aracının varlığında EET'yi karakterize etme konusunda rehberlik sağlıyoruz. Veri analizini ve yorumlamasını göstermek için L. plantarum ile 1,4-dihidroksi-2-naftoik asit (DHNA) aracılı EET deneylerinden elde edilen temsili verileri kullanıyoruz. Bu protokolde açıklanan teknikler, elektro-fermantasyon ve biyoelektrokataliz için yeni fırsatlar yaratabilir. Bu elektrokimyasal tekniğin L. plantarum ile son uygulamaları, gıda fermantasyonunda kritik lezzet bileşenleri olan fermantasyon son ürünlerinin üretilmesine yönelik metabolik akışın hızlandığını göstermiştir. Bu nedenle, bu sistem, gıda üretimindeki tatları değiştirmek veya değerli kimyasallar üretmek için daha da geliştirilme potansiyeline sahiptir.
Giriş
Biyoelektrokimyasal sistemler, mikropları elektrotlarla arayüzleyerek hücre dışı elektron transferi (EET) mekanizmalarının araştırılmasına olanak tanır ve biyoelektrokatalize yenilenebilir yaklaşımlar sağlar 1,2,3. Doğal olarak EET yapan mikroplar, metabolizmadan türetilen elektronları hücre dışı terminal elektron alıcılarına, örneğin demir (hidr)oksitlere ve elektrotlara aktaran ekzoelektrojenler olarak bilinir1. İlk olarak Geobacter ve Shewanella türleri 4,5'te karakterize edilen EET yolakları, o zamandan beri birçok bakteride tanımlanmıştır. Bu ekzoelektrojenler, atık akışlarından elektrik enerjisi üretmek, CO2'yi sabitlemek ve elektrosentez 1,6,7,8,9,10,11,12 yoluyla değerli kimyasallar üretmek gibi çeşitli mikrobiyal elektrokimyasal teknolojilerde merkezi bir rol oynar.
Böyle bir ekzoelektrojen, gram pozitif bir laktik asit bakterisi olan Lactiplantibacillus plantarum'dur 13. L. plantarum, insanların ve diğer omurgalıların bağırsaklarının yanı sıra et, tahıllar, sebzeler ve fermente yiyecek ve içecekler gibi birçok gıda türü de dahil olmak üzere çok çeşitli ortamlarda bulunan göçebe, probiyotik bir bakteridir 14,15,16,17. Genomu, bu çeşitli ortamlarda başarılı bir adaptasyona izin veren esnek, heterofermentatif bir metabolizmayı kodlar. İyi çalışılmış, gıda ve sağlık endüstrilerinde yaygın olarak kullanılmaktadır ve genellikle Gıda ve İlaç İdaresi18,19 tarafından güvenli olarak kabul edilmektedir. Bu nedenle, L. plantarum, EET tabanlı teknolojiler için yararlı bir platform olarak hizmet etme potansiyeline sahiptir.
L. plantarum'daki son araştırmalar, orijinal olarak Listeria monocytogenes 13,20'de karakterize edilen karmaşık bir EET yolunu kodlayan çok genli bir operon tanımlamıştır. L. plantarum'da, bu operondan sentezlenen proteinler, bir elektron aracısı olarak kinon 1,4-dihidroksi-2-naftoik asit (DHNA) sağlandığında bir biyoelektrokimyasal sistemde (BES) EET'yi kolaylaştırır13. Bu yoldaki ilk temel protein, NADH'yi oksitleyen ve DHNA'yı indirgeyen zara bağlı bir NADH-kinon oksidoredüktazdır (Ndh2). DHNA, elektronları ya doğrudan bir elektroda iletir ya da dolaylı olarak aksesuar protein PplA aracılığıyla iletir (Şekil 1)13,21,22. Son araştırmalar, L. plantarum'un elektron aracıları olarak yapısal olarak DHNA'ya benzeyen diğer kinonları da kullanabileceğini gösteriyor; bununla birlikte, L. plantarum DHNA veya bu alternatif kinonları üretemez, bu nedenle EET'nin meydana gelmesi için aracıların çevrede dışsal olarak bulunması gerekir 13,22,23.
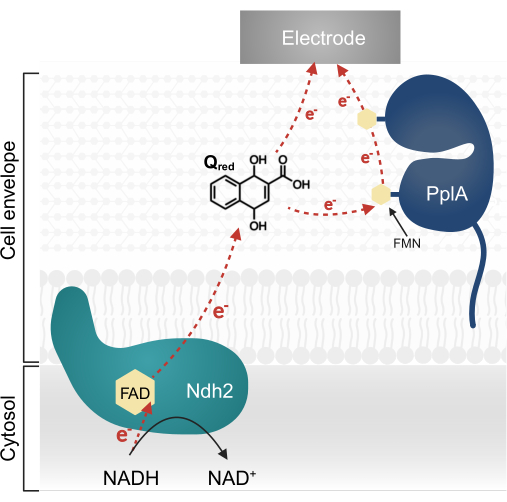
Şekil 1: Lactiplantibacillus plantarum EET'deki elektron akışı. Ndh2 elektronları NADH'den kinon DHNA'ya geçirir. Elektronlar, ya doğrudan indirgenmiş kinon ile ya da dolaylı olarak aksesuar protein PplA yoluyla akım üretmek için elektrota taşınır. Kısaltmalar: FAD = Flavin adenin dinükleotidi; FMN = Flavin mononükleotidi; EET = hücre dışı elektron transferi; NADH = indirgenmiş nikotinamid adenin dinükleotid; Ndh2 = NADH-kinon oksidoredüktaz; DHNA = 1,4-dihidroksi-2-naftoik asit; PplA = fosfolipaz A. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu makalede, L. plantarum'da DHNA aracılı EET'yi karakterize etmek için BES tabanlı bir yöntem kullanmak için kapsamlı bir protokol sunuyoruz. Üç elektrotlu, iki odacıklı bir sistem, bakterileri çalışma elektroduyla sınırlayarak, bakterilere uygulanan potansiyelin hassas bir şekilde kontrol edilmesini sağlarken, çalışma ve karşı elektrot arasındaki karışmayı önler. Deney öncesi hazırlık, BES montajı, kronoamperometri (CA) ve döngüsel voltametri (CV) kullanan EET analizi ve deney sonrası numune analizini kapsayan 5 günlük kapsamlı bir protokol sunuyoruz. Bu protokol, EET yolaklarının mekanizmalarını çözmek ve elektrofermantasyon ve elektrokataliz için sistemler oluşturmak için uygulanabilir.
Protokol
NOT: İki odacıklı BES düzenekleri, aşağıdaki protokolde "reaktörler" olarak anılacaktır.
1. Medya hazırlığı
- L. plantarum kültür ortamını hazırlayın.
- Ticari MRS (de Man Rogosa Sharpe) ortamını talimatlara göre ve mMRS ortamını24'te açıklandığı gibi hazırlayın Tablo 1. mMRS'nin pH değerini 6.5'e ayarlayın. Her iki ortamı da 0,22 μm'lik bir filtreden geçirerek filtreyle sterilize edin ve her ikisini de kullanıma kadar 4 °C'de saklayın.
- Tablo 2'de açıklandığı gibi mannitol (mCDM)13,25 ile Kimyasal Olarak Tanımlanmış bir Ortam hazırlayın ve pH'ı 6.5'e ayarlayın. Her reaktörün anodik odasını 110 mL ortamla doldurmak için yeterli ortam hazırlayın. mCDM'yi 0,22 μm'lik bir filtreden filtreyle sterilize edin.
NOT: mCDM, amaçlanan kullanım gününde taze olarak hazırlanmalıdır. Bileşen çözümleri önceden hazırlanabilir. Tüm bileşen çözeltilerini 0,22 μm'lik bir filtreden geçirerek filtreyle sterilize edin ve 4 °C'de saklayın. Wolfe vitaminlerini hazırlarken, sterilize etmeden önce pH'ı 11'e ayarlayın ve karanlıkta veya folyoya sararak saklayın. Wolfe'un minerallerini hazırlarken, nitrilotriasetik asit (NTA) ekledikten sonra pH'ı 8'e ayarlayın. Ardından kalan bileşenleri ekleyin, sterilize edin ve karanlıkta veya folyoya sararak saklayın.
- Sterilize etmek için 1x PBS ve otoklav hazırlayın. Bu protokolde kullanmak için 4 °C'de saklayın.
- Ticari M9 ortamını talimatlara göre hazırlayın (Tablo 3) ve sterilize etmek için otoklava götürün. Her reaktörün katodik odasını 110 mL ile doldurmak için yeterli ortam hazırlayın. Oda sıcaklığında saklayın.
2. Gün 1: BES reaktör montajı ve ilk L. plantarum kültürü
NOT: Bir BES reaktörünün şeması ve protokolde belirtilen montaj parçalarını detaylandıran bir diyagram için Referans Şekil 2 .
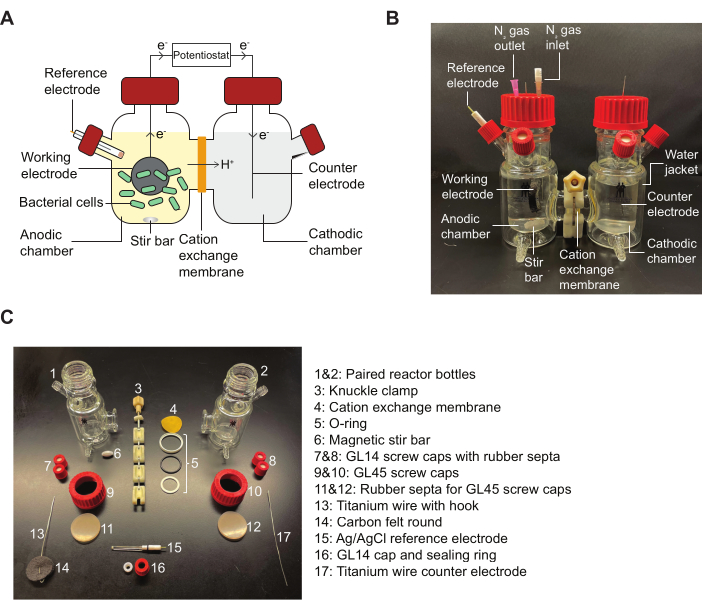
Şekil 2: BES bileşenleri ve montaj şeması. (A) İki odacıklı bir BES reaktörünün şeması. Anodik odadaki bakteriler (yeşil), elektronları bir kinon aracısının varlığında çalışan bir elektrota (siyah daire) aktarır. Elektronlar devre boyunca katodik odaya akar ve anot ve katot arasında bir potansiyostat tarafından akım ölçümlerinin alınmasına izin verir. (B) Anodik odadaki N2 giriş ve çıkış iğneleri de dahil olmak üzere tamamen monte edilmiş bir BES reaktörünü gösteren bir resim. (C) Demonte edilmiş bir reaktörün tüm parçalarını gösteren bir resim. Kısaltma: BES = biyoelektrokimyasal sistem. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Reaktörleri monte edin ve sterilize edin.
- Çalışma ve karşı elektrotları hazırlayın. Çalışma ve karşı elektrotlar için 1.0 mm çapında titanyum telleri alüminyum oksit zımpara kağıdı ile eşit şekilde parlak olana kadar zımparalayın. Pense kullanarak, her bir çalışma elektrot telinin bir ucunu küçük bir kancaya bükün. Her bir çalışan elektrot telinin üzerine 16cm'lik 2 karbonlu bir keçe kaydırın, teli karbon keçenin içine ve dışına bir kez geçirin ve kancaya sabitlenene kadar yuvarlağı telden aşağı çekin. Kauçuk septumu tel ile delerek ve birkaç santimetre çekerek çalışma ve karşı elektrotları GL45 kapaklarına sabitleyin.
- Eşleştirilmiş reaktörleri monte etmek için, önce O-ringi monte edin ve monte edilmiş O-ringe suya önceden batırılmış bir önceden kesilmiş katyon değişim membranı yerleştirin. O-ringi, membranla birlikte iki eşleştirilmiş reaktör şişesinin geniş alt açıklıkları arasına yerleştirin. Reaktör çiftini, şişeleri ve O-ringi bir mafsal ile membran ile sabitleyin.amp parmağınızı sıkılaştırın. Her bir anodik odaya manyetik bir karıştırma çubuğu bırakın ve ardından her şişenin üstündeki tüm küçük açıklıkları kauçuk septa ile donatılmış GL14 kapaklarıyla kapatın.
NOT: Mafsalları aşırı sıkmayınampşişelerde çatlaklara veya kırılmalara neden olabileceğinden veya herhangi bir kapak. - Her reaktör şişesini 110 mL deiyonize (DI) su ile doldurun, ardından her şişeyi uygun elektrot takılı GL45 kapağıyla kapatın. Karbon keçe yuvarlak çalışma elektrodu ile donatılmış kapakları, yuvarlak kancada kalacak şekilde keçe yuvarlağın üst kısmına hafifçe bastırarak yerleştirin.
NOT: Taze karbon keçe hidrofobiktir ve ilk montajda reaktördeki suyu iter. Otoklavlama, hissedilen karbonun deney için uygun şekilde hidrofilik hale gelmesine neden olacaktır. - Silikon sızdırmazlık halkaları ile donatılmış GL14 elektrot kapaklarını toplayın.
- Otoklavlamadan önce tüm GL45 kapaklarını nazikçe gevşetin. Sterilize etmek için su dolu reaktörleri ve elektrot kapaklarını otoklavlayın. Otoklavlamadan sonra reaktörlerin oda sıcaklığına soğumasını bekleyin.
- Kültür L. plantarum NCIMB8826. Steril koşullar altında, bir gliserol stoğunun üstünden bazı bakterileri kazıyın ve 3 mL ticari MRS ortamına aşılayın. Kültürü gece boyunca 37 °C'de çalkalamadan büyütün.
NOT: L. plantarum , terminal elektron alıcısı olarak oksijen kullanmaz; Bu nedenle,ortamı 26 çalkalayarak oksijenlendirmek gerekli değildir. Bununla birlikte, diğer mikroplar kullanılırsa kültür koşulları değişecektir.
3. Gün 2: Referans elektrotların hazırlanması, deney başlangıcı için reaktörlerin hazırlanması ve L. plantarum alt kültürlemesi
- Ag/AgCl referans elektrotlarını hazırlayın.
NOT: Bu adımlar, Malzeme Tablosunda belirtilen Ag/AgCl referans elektrotlarının hazırlanmasını açıklar. Kullanıcılar, farklı bir referans elektrodu kullanıyorlarsa üreticinin talimatlarına uymalıdır.- Ag/AgCl referans elektrotlarını sökün ve telleri zımparalayın. Elektrodu cam muhafazasından yavaşça çekin ve eski KCl solüsyonunu boşaltmak için cam muhafazayı hafifçe vurun. Oksitlenmiş malzemeyi çıkarmak için elektrot tellerini alüminyum oksit zımpara kağıdı ile eşit şekilde parlak olana kadar nazikçe zımparalayın.
- Tüm zımparalanmış referans elektrot tellerini küçük bir karıştırma çubuğu ile küçük bir beherde toplayın ve teller tamamen suya batırana kadar beheri %100 çamaşır suyu ile doldurun. Elektrotlar daha koyu griye dönene kadar tellerin bir karıştırma platformunda 30 dakika ağartmasına izin vererek telleri klorürleyin. Ağartma işleminden sonra, elektrot tellerini DI su ile iyice durulayın.
- Bir referans elektrodunu yeniden monte etmek için, cam muhafazayı gümüş klorür ile doyurulmuş 3 M KCl çözeltisi ile tamamen doldurmak için bir şırınga kullanın ve hava kabarcıklarını çıkarmak için yana hafifçe vurun. Aynı şırıngayı kullanarak, elektrot tel kapağını KCl çözeltisi ile doldurun, ardından teli muhafazaya yerleştirin. Cam muhafazanın altını tezgah üstündeki bir kağıt havluya yerleştirin, elektrodu cam muhafazaya yerleştirin ve ardından elektrodu kapatmak için kapağa sıkıca bastırın. Referans elektrotlarını, ihtiyaç duyulana kadar KCl çözeltisi ile sığ bir şekilde doldurulmuş bir beherde saklayın ve kalan tüm referans elektrotları ile tekrarlayın.
- Ev yapımı Ag/AgCl referans elektrotlarının voltajını ölçmek için dijital bir multimetre kullanın.
- Ag/AgCl referans elektrotlarının uçlarını (standart hidrojen elektroduna karşı 197 mV olarak tahmin edilmektedir, SHE) 3 M KCl ile doldurulmuş bir behere sığ bir şekilde daldırın. Multimetreyi, yine aynı KCl elektrolitlerine batırılmış, ticari olarak satın alınan doymuş bir kalomel elektroduna (SCE, 241 mV'ye karşı SHE) güvenli bir şekilde bağlayın.
- Her bir referans elektrodu ile SCE arasındaki potansiyel farkı ölçün. Referans elektrotların SCE'den 44 ± 10 mV farklı olduğunu onaylayın. Bu aralığın dışında kalan herhangi bir referans elektrodunu sökün ve yeniden monte edin.
- Kapağın cam muhafazayla birleştiği yerdeki dikişi parafilm ile kapatın.
- Reaktörleri deney için hazırlayın.
- Steril bir biyogüvenlik kabininde, reaktörlerdeki otoklavlanmış suyu uygun ortamla değiştirin. Otoklavlanmış suyu boşaltın. Katodik odaları 110 mL otoklavlanmış M9 ortamı ile doldurun. Anodik odaları 110 mL taze hazırlanmış mCDM ile doldurun.
- Referans elektrotlarını takın. Her bir anodik odadan bir GL14 kapağını çıkarın ve otoklavlanmış bir elektrot kapağı (silikon sızdırmazlık halkalı GL14 kapağı) ile değiştirin. Sterilize etmek için referans elektrotlarına %70 etanol püskürtün, ardından elektrot kapağından her bir anodik odaya bir referans elektrot yerleştirin.
NOT: Referans elektrodunun yuvarlak karbon keçe ile doğrudan temas etmediğinden emin olun. - Reaktörleri biyogüvenlik kabininden çıkarmadan önce, sızıntıyı önlemek için tüm kapakları ve kelepçeleri parmak sızdırmazlığı olacak şekilde sıkın.
- Reaktörleri su pompası sistemine takın. Her reaktörü uygun karıştırma çubuğu platformuna yerleştirin. Her bir reaktörün su ceketi musluklarını kauçuk boru ile bir sonrakine bağlayın, uç reaktörleri su pompasının giriş ve çıkış borularına bağlayın.
NOT: Gerekirse boruları sabitlemek için fermuar kullanarak tüm bağlantıların sızıntı olmadan sıkı olduğundan emin olun. - Pompayı suyla doldurun ve 4-6 damla su düzenleyici ekleyin. Pompa sistemini açın ve sıcaklığı 30 °C'ye ayarlayın. Pompayı çalıştırın ve tüm reaktör su ceketlerinden geçen su akışını gözlemleyin, herhangi bir bağlantıda sızıntı olmadığından emin olun.
- Karıştırma platformlarını açın ve 220 RPM'de sürekli karıştırmaya ayarlayın.
- Reaktörleri nitrojen serpme gaz hatlarına bağlayın. 4 inç, 22 G'lik bir iğneye bir hava filtresi takın ve iğneyi bir reaktör anodik odasının üst septumundan nitrojen girişi olarak işlev görmesi için ortama sokun. Nitrojen çıkışı olarak işlev görmesi için anodik odanın üst septumuna 1 inç, 18 G iğne daha sokun. Bir nitrojen kaynağından gelen gaz hatlarını hava filtresine bağlayın ve gazın reaktörden nazikçe kabarmasını sağlamak için valfi açın. Anaerobik koşulları korumak için deney boyunca nitrojenin tüm anodik odalardan sürekli olarak kabarcık çıkardığından emin olun.
NOT: Giriş iğnesinin yuvarlak karbon keçeden uzağa yerleştirildiğinden emin olun. Kabarcık akışı, karbon keçe veya referans elektrotları ile temas etmemelidir. - Biyoreaktörleri potansiyostat uçlarına takın. Potansiyostattan gelen çalışma, sayaç ve referans elektrot timsah klipsi uçlarını karşılık gelen elektrotlarına bağlayın.
NOT: Uygun elektrik bağlantılarını sağlamak ve olası ölçüm hatalarını en aza indirmek için tel/akım toplayıcı ile elektrotlar arasındaki direnci kontrol etmek için bir multimetre kullanın.
- Ön çalıştırma için potansiyostat parametrelerini girin.
NOT: Kritik teknik ayarları aşağıda verilmiştir. Her teknik için genişletilmiş bir yazılım ayarları listesi için Tablo 4'e bakın.- Potansiyostatı açın ve bilgisayardaki EC-lab yazılımını başlatın. Aygıtlar altında sol üst panelde bulunan potansiyostat sembol düğmesine tıklayarak potansiyostatı bilgisayara bağlayın. Bağlandıktan sonra, cihaz adı aşağıdaki metin kutusunda yeşil bir daire ile görünecektir.
- Düzenle sekmesine tıklayarak ve ardından senkronizasyonu seçerek biyoreaktörlere bağlı tüm kanalları tek bir gruba senkronize edin. Uygun kanal numarası kutularını tıklayın | tamam.
- Soldaki Parametre Ayarları panelindeki + düğmesine tıklayarak potansiyostat açık devre voltajı (OCV) tekniğini ekleyin. Mavi ayarlar kutusunda; referans elektroduna (RE) karşı çalışma elektrot potansiyelini (E WE) ölçmek için ayarlayın, toplam 3 saat boyunca her 36 saniyede bir dt aralığında kayıt süresi.
- Ardından, potansiyostata döngüsel voltametri (CV) tekniğini ekleyin. EWE'nin başlangıç potansiyelini, 0 mV/s'lik bir tarama hızıyla RE'ye karşı 2 V'luk Ei olarak ayarlayın. RE'ye karşı 0,4 V'luk bir köşe potansiyeline (E1) kadar süpürün, RE'ye karşı -0,7 V'luk köşe potansiyeline (E2) geri dönün. Taramayı toplam iki tarama için tekrarlayın.
NOT: Mikrobiyal elektrokimyasal sistemlerde, mikrobiyal aşılama ve biyofilm oluşumu, metal malzemelere veya inorganik moleküllere kıyasla yüksek kapasitelere neden olur. Döngüsel voltametri taraması sırasında potansiyel değişir ve bir şarj akımı arka plan görevi görür. Yüksek bir sinyal-gürültü oranı elde etmek için daha düşük tarama hızları gereklidir, ancak bu, tarama süresini artırır. 1,1 V'luk geniş bir elektrokimyasal pencereyi kapsayan iki döngüyü taradığımızdan, 2 mV/sn'lik bir tarama hızı, 9,1 dakikaya kadar süren bir yarım döngüye neden olur. Sonuç olarak, iki döngü toplam 36.4 dakika sürer. Tarama hızını daha da azaltmak aşırı zaman alıcı olacaktır. - Tekniği ekleyin kronoamperometri (CA). t = 200 saatlik bir süre için RE'ye karşı 0,2 V'luk sabit bir potansiyel EWE uygulayın, her 25-40 saniyede bir dt aralıklarında kayıt süresi. İstenen ayrıntı düzeyini elde etmek için potansiyostat yazılımına dayalı olarak zaman aralığını ayarlayın.
NOT: DHNA'nın orta nokta potansiyeli, Ag/AgCl'ye karşı yaklaşık -0.093 V'dir; bu nedenle, çalışma elektroduna RE'ye karşı 0.2 V'luk bir uygulanan potansiyel, DHNA'dan elektrota elektron transferine izin vermek için yeterlidir. - Tüm parametreleri girdikten sonra, yeşil başlangıç üçgenine basarak çalıştırmaya başlayın. Dosyayı yazılımın yönlendirdiği şekilde istediğiniz gibi kaydedin ve ardından Kaydet'e tıklayın. Yazılım, teknik 1, "OCV" ye başlayacaktır. Tüm reaktörlerin pozitif okuduğundan ve sabit bir sinyalle birlikte kapandığından emin olmak için OCV izlerini birkaç dakika gözlemleyin. OCV'yi ve ilk CV'yi tamamlamak için deneyi gece boyunca çalışacak şekilde bırakın (medya kontrolü CV'si için Ek Şekil S1'e bakın) ve CA'nın stabilize olana kadar çalışmasına izin verin.
- Steril koşullar altında, L. plantarum 1:200'ün MRS kültürünü 50 mL mMRS'de alt kültürleyin. Hücreleri gece boyunca 37 °C'de çalkalamadan büyütün.
NOT: 50 mL'lik bir gece kültürü, reaktörde son OD600'ün 0.2 olduğunu varsayarak, tipik olarak altı reaktör için fazlasıyla yeterli hücre üretir. Daha büyük veya daha küçük deneyler için kültür hacimlerini uygun şekilde ayarlayın.
4. Gün 3: Hücrelerin ve DHNA/DMSO'nun enjeksiyonu
- Hücreleri yıkayın ve reaktörlere enjekte edin.
- mMRS L. plantarum kültürünü sabahları inkübatörden çıkarın. Steril koşullar altında, kültürü 50 mL'lik konik bir tüpe aktarın ve kültürü buzun üzerine yerleştirin.
- Hücreleri 2x steril, soğuk 1x PBS'de yıkayın. Bunu yapmak için, hücreleri peletlemek için kültürü 4,000 × g'da 4 ° C'lik bir santrifüjde 5 dakika boyunca santrifüjleyin. Steril koşullar altında, hücreleri 50 mL PBS'de nazikçe ama iyice yeniden süspanse edin, ardından daha önce olduğu gibi tekrar santrifüjleyin; İkinci bir yıkama için tekrarlayın. Son santrifüjden sonra, hücreleri soğuk PBS'de OD600 = 11'e yeniden süspanse edin.
- Steril koşullar altında, her reaktör için bir iğne ile donatılmış 3 mL'lik bir şırıngaya 2 mL yeniden askıya alınmış hücre yükleyin.
- Reaktör istasyonunda, bir hücre şırıngasının kapağını açın ve iğneyi bir reaktör anodik odasının üstüne yerleştirin. Bu sırada şırınga pistonuna basmayın; Tüm reaktörler için tekrarlayın. Tüm şırıngalar yerleştirildikten sonra, hücreleri reaktörlere enjekte etmek için pistonlara bastırın ve CA izinden enjeksiyon zamanını kaydedin. Bu hücre hacmi, reaktörlerde 0.2'lik bir son OD600 üretir. Tüm şırıngaları biyolojik tehlike kutularına ve iğneleri belirlenen keskin biyolojik tehlike kabına atın. Akımın CA izi üzerinde 2-4 saat boyunca düz bir şekilde sabitlenmesine izin verin.
NOT: Enjeksiyondan sonra, CA izinde akım dalgalanmaları gözlemlenebilir. 2-4 saat sonra, bu dalgalanmalar düz bir akıma (bir saat boyunca akımda <2 μA değişiklik) stabilize olur ve bu noktada DHNA enjekte edilebilir.
- İlk pH'ı ölçün ve DHNA enjekte edin.
- Bir DHNA çözeltisi hazırlayın. 1.5 mL'lik bir tüpte, toz haline getirilmiş DHNA'yı% 100 DMSO'da çözerek 500 μL 20 mg / mL DHNA çözeltisi hazırlayın. 3 insülin şırıngasını 110 μL DHNA çözeltisi ve 3 insülin şırıngasını sadece 110 μL DMSO ile doldurun.
NOT: DHNA suda hafifçe çözünürken, DMSO bu konsantrasyonda DHNA stokları için daha iyi bir çözücüdür. Arabulucu çözücü, diğer aracılar kullanılıyorsa değişebilir. - BES reaktör istasyonunda, deney reaktörlerini + DHNA ve solvent kontrol reaktörlerini - DHNA olarak etiketleyin. Bir DHNA şırıngasını çıkarın ve şırıngayı + DHNA olarak belirtilen her bir anodik odanın üstüne yerleştirin. - DHNA olarak belirtilen her anodik odaya yalnızca DMSO'ya özel bir şırınga yerleştirin. Bu sırada şırınga pistonlarına basmayın.
- Numune analizi için 0 saatlik zaman noktası numuneleri alın. 2 inç, 21 G iğne ile donatılmış 3 mL'lik bir şırınga kullanarak, kullanılmayan küçük kapaklı septumdan her bir anodik odadan 2 mL'lik bir ortam numunesi alın ve numuneleri 0 saatlik zaman noktası (DHNA enjeksiyon noktası) için pH ölçümleri almak üzere 24 derin kuyulu bir plakaya aktarın. İstenirse, her bir anodik odadan 1 mL kullanılmış ortam alın ve HPLC veya diğer tahliller kullanarak metabolitleri ölçmek için 0.2 μm'lik bir filtreden temiz etiketli tüplere süzün. Kullanılmış ortam örneklerini -80 °C'de saklayın.
- Reaktörlere enjekte etmek için tüm DHNA ve DMSO şırıngalarının pistonlarına bastırın. CA izlemesinden ekleme zamanını kaydedin. Tüm şırıngaları ve iğneleri uygun şekilde atın.
- Her reaktör için 0 saatlik pH numunelerini ölçün ve kaydedin.
- Bir DHNA çözeltisi hazırlayın. 1.5 mL'lik bir tüpte, toz haline getirilmiş DHNA'yı% 100 DMSO'da çözerek 500 μL 20 mg / mL DHNA çözeltisi hazırlayın. 3 insülin şırıngasını 110 μL DHNA çözeltisi ve 3 insülin şırıngasını sadece 110 μL DMSO ile doldurun.
5. 4. Gün: Deneyin tamamlanması ve numune toplanması
- DHNA enjeksiyonundan 24 saat sonra elektrokimyasal analiz yapın ve son numuneleri alın.
- DHNA enjeksiyonundan 24 saat sonra CA çalışmasını sonlandırın.
- Adım 4.2.3'e göre numune analizi için 24 saatlik zaman noktası numuneleri alın.
- Adım 3.3.4'te açıklanan parametrelere göre 24 saatlik zaman noktası için CV'yi yeniden çalıştırın.
- Her reaktörden alınan 24 saatlik numuneler için pH'ı ölçün ve kaydedin.
- Reaktörleri sökün ve temizleyin.
- Potansiyostatı kapatın. Ardından, çalışma, sayaç ve referans kablolarını her bir reaktörden ayırın. Potansiyostat kurşun timsah klipslerindeki nemi silin.
- Azot gazı akışını kapatın. Gaz kablolarını ayırın ve ardından giriş ve çıkış iğnelerini çıkarın. Tüm iğneleri keskin bir kaba uygun şekilde atın.
- Su pompasını kapatın. Giriş ve çıkış borularını pompadan ayırın ve suyun bir kovaya akmasına izin verin. Bağlantı keserken, suyun zemine sifon çekmesini önlemek için boru uçlarını pompadaki su hattının üzerinde tutun. Son çıkış reaktöründen ilk giriş reaktörüne kadar çalışarak her bir reaktörü birer birer su ceketi borusundan ayırın.
- Reaktörlerdeki tüm ortamları büyük bir biyolojik tehlike kabına boşaltın. Bertaraf için normal kültür ağartma yöntemlerini izleyin.
- Boşaltıldıktan sonra tüm reaktör parçalarını sökün ve temizleyin. Katyon değişim membranlarını ve karbon keçe yuvarlaklarını uygun biyolojik tehlike atıklarına atın. Referans elektrotlarını ve titanyum telleri %70 etanol ile temizleyin ve temizlenmiş referans elektrotlarını suyla sığ bir şekilde doldurulmuş bir beherde saklayın. Reaktör şişelerini, kapaklarını, O-ringlerini ve kelepçeleri laboratuvar deterjanıyla ılık suda nazikçe temizleyin, DI suyla iyice durulayın ve saklamadan önce tüm parçaları havayla kurutun.
6. Gün 5: Elektrokimyasal analiz
NOT: Aşağıda, bu protokol için veri çiziminin genel bir açıklaması bulunmaktadır. Analiz ve veri yorumlama ile ilgili daha ayrıntılı açıklamalar Temsili Sonuçlar bölümünde sağlanacaktır.
- CA analizi için: DHNA enjeksiyonunun zamanını 0 saatlik zaman noktası olarak ayarlayın. Zamanın (h) bir fonksiyonu olarak 0 h zaman noktasından tüm kopyalar için her 36 saniyede bir alınan ölçülen akım yoğunluğunun (μA/cm2 cinsinden j cinsinden) ortalama ve standart sapmasını çizin. Akım yoğunluğunu çalışma elektrot alanının (16cm2) bir fonksiyonu olarak hesaplayın.
- CV analizi için: Çalışma elektrot potansiyelinin (V'de EWE) bir fonksiyonu olarak akım yoğunluğunu (μA/cm2 cinsinden j) gösteren her deneysel koşul (yalnızca ortam, DMSO veya DHNA) için temsili bir CV izi çizin. Seçilen CV çalışmasının ikinci döngüsünü çizin.
Sonuçlar
Kronoamperometri analizi
L. plantarum'un EET'si, akım yoğunluğu izinin L. plantarum'dan çalışma elektroduna elektron transferini görselleştirdiği Şekil 3'te gösterilen kronoamperometri (CA) verileri aracılığıyla gözlemlenebilir. 24 saat boyunca Ag/AgCl'ye karşı +200 mV'luk sabit bir potansiyeli korurken akım yoğunluğunu (j) zamana karşı izledik. Karıştırma elektrolit çözeltisine 20 μg / mL DHNA enjekte edildikten sonra, abiyotik bir DHNA oksidasyon artışı gözlendi, ardından biyotik akım yoğunluğunda hızlı bir artış gözlendi ± yaklaşık 8 saatlik zaman noktasında 132.0 2.47 μA /cm2'de zirve yaptı. Tersine, DMSO'nun enjeksiyonu ihmal edilebilir akım yoğunluğu ile sonuçlandı. Bu sonuçlar, L. plantarum ve elektrot arasındaki elektron transferini kolaylaştırmak için gerekli ve verimli bir aracı olarak DHNA'nın önemini vurgulamaktadır. Kullanıcılar, Hazne Boşaltma Cihazı'ndaki DHNA konsantrasyonunu ayarlayarak akım çıkışını ayarlayabilir. Önceki araştırmalar ayrıca L. plantarum'un DHNA'ya çok çeşitli DHNA konsantrasyonlarında doza bağlı bir şekilde yanıt verdiğini ve 0.01 μg/mL13,22 kadar düşük DHNA konsantrasyonlarının varlığında önemli akım ürettiğini göstermektedir.
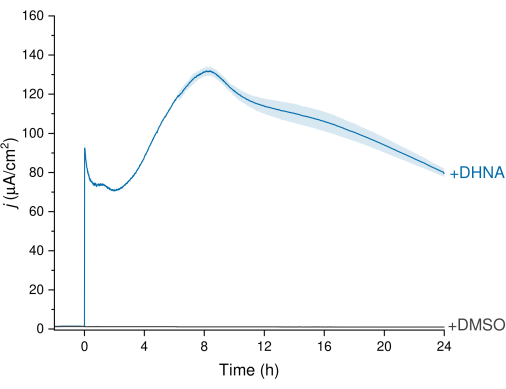
Şekil 3: DHNA'nın aracılık ettiği Lactiplantibacillus plantarum EET'nin kronoamperometri analizi. DHNA (20 μg/mL) veya DMSO, enjeksiyon süresi t = 0 olarak tanımlanan mCDM elektrolitlerine (pH ~ 6.5) enjekte edildi. J , çalışma elektrot alanının bir fonksiyonu olarak akım yoğunluğunu temsil eder. Deneyler, Ag / AgCl'ye karşı 200 mV'de bir karbon keçe elektrot (16cm2) ve karıştırma ile gerçekleştirildi. Değerler, üçlü BES reaktörlerinde elde edilen ortalama ± sd olarak çizilir. Kısaltmalar: EET = hücre dışı elektron transferi; DHNA = 1,4-dihidroksi-2-naftoik asit; DMSO = dimetil sülfoksit; mCDM = Mannitol ile Kimyasal Olarak Tanımlanmış Ortam. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Döngüsel voltametri analizi
L. plantarum'da DHNA aracılı EET'yi daha fazla değerlendirmek için, DHNA enjeksiyonundan 24 saat sonra döngüsel voltametri gerçekleştirdik. Burada üç koşul için CV izlerini gösteriyoruz: 20 μg/mL DHNA ile L. plantarum, DMSO ile L. plantarum ve 20 μg/mL DHNA ile ortam. Şekil 4A'da gösterildiği gibi, L. plantarum içeren reaktörlerde 20 μg/mL DHNA'nın varlığı, 50 mV'de oksidatif akımda tek başına DMSO varlığında meydana gelmeyen belirgin bir artışa neden olmuştur. Bu veriler, L. plantarum ve anot arasındaki elektron transferini kolaylaştırmak için redoks aracısı DHNA'nın eklenmesinin gerekli olduğunu doğrulamaktadır. L. plantarum + DMSO izinde çeşitli daha küçük redoks zirveleri gözlemlemiş olsak da, bu zirveler ortam kontrol izine benzerdi ve muhtemelen mCDM'deki redoks aktif bileşenlere atfedilmiştir (Ek Şekil S1). Şekil 4B'de, biyotik koşullar altında DHNA izleri (L. plantarum + DHNA) ile abiyotik koşullar altında DHNA (Media + DHNA) karşılaştırıldı. Her iki iz de 50 mV civarında belirgin bir DHNA oksidatif zirvesi sergilerken, yalnızca biyotik koşullar altında 50 mV'un üzerindeki akımda sürekli bir artış gözlemledik. Katalitik tepe noktası, 300 mV'de 129 μA/cm2'lik bir akım yoğunluğuna ulaştı ve bu, abiyotik esere kıyasla %256'lık bir artışı temsil etti. Bu devir CV profili, mikrobiyal EET27'nin karakteristiğidir ve anotta DHNA'nın oksidasyonundan sonra bir elektron kaynağı (mannitol) varlığında DHNA'nın L. plantarum hücreleri tarafından yeniden indirgendiğini gösterir. Ek olarak, abiyotik eser -240 mV ve -180 mV civarında yeni oksidatif zirveler sergiledi. Önceki araştırmalar, bu zirvelerin ortaya çıkmasının DHNA'nın ACNQ'ya (2-amino-3-karboksi-1,4-naftokinon) bozunmasından kaynaklanabileceğini göstermektedir21,28. Biyotik izde bu zirveleri gözlemlemedik, bu da L. plantarum hücrelerinin DHNA ile etkileşiminin DHNA'yı stabilize edebileceğini ve bozulmayı önleyebileceğini gösteriyor. Dikkat edilmesi gereken bir nokta, 20 μg/mL DHNA'lı ortamlar için 24 saatlik izlemenin, hücre eklenmeden bu protokole göre ayrı ayrı gerçekleştirilmiş olmasıdır.
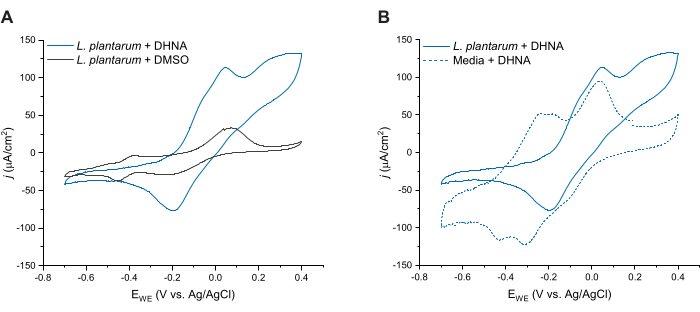
Şekil 4: Temsili döngüsel voltametri izleri. Tüm CV deneyleri, çözelti karıştırılırken 2 mV/s tarama hızında çalışma elektrodu olarak karbon keçe (16cm2) kullanılarak mCDM'de gerçekleştirildi. (A) T = 24 saat'te DHNA (20 μg / mL) veya DMSO ile Lactiplantibacillus plantarum için CV izleri. (B) L plantarum'da 20 μg / mL DHNA'nın CV izleri (biyotik koşullar) veya sadece mCDM (abiyotik koşullar) t = 24 saatte. Kısaltmalar: CV = döngüsel voltametri; mCDM = Mannitol ile Kimyasal Olarak Tanımlanmış Ortam; DHNA = 1,4-dihidroksi-2-naftoik asit; DMSO = dimetil sülfoksit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
pH analizi
L. plantarum'daki EET aktivitesi, 24 saatin üzerinde pH'da kayda değer bir düşüşe neden oldu. Şekil 5'te gösterildiği gibi, DHNA'ya maruz kalan L. plantarum'un ortalama numune pH'ı 3.33 ± 0.01'e düşerken (p = 6.85 × 10-6, n = 3), DMSO'ya maruz kalan L. plantarum'un ortalama numune pH'ı 6.50 ± 0.06'ya düşmüştür (p = 0.0409, n = 3). Önceki araştırmalarda sergilendiği gibi, bu düşüş, L. plantarum EET13'ü gerçekleştirdiğinde meydana gelen fermentatif metabolizmadaki bir artışa bağlanmaktadır. L. plantarum normalde mannitolü, son fermantasyon ürünleri olarak asetat, laktat ve etanol üreten ve substrat düzeyinde fosforilasyon yoluyla ATP üreten glikoliz ve fermentatif yollar yoluyla metabolize eder29. EET koşulları altında, fermantasyon yoluyla metabolik akış artar, böylece BES ortamında son fermantasyon ürünlerinin üretimi artar13. Bu metabolik kayma, DHNA'lı reaktörlerde ortam pH'ının DMSO kontrol reaktörlerine kıyasla daha hızlı düşmesine neden olur.
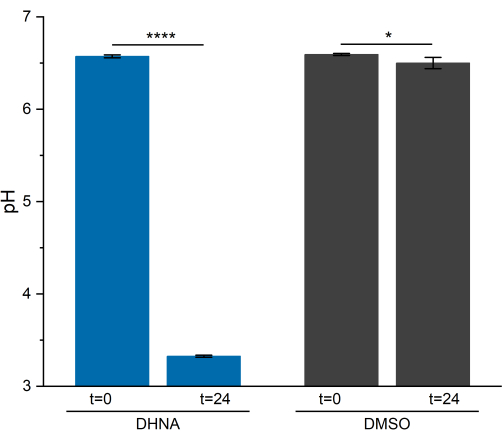
Şekil 5: Lactiplantibacillus plantarum biyoelektrokimyasal sisteminin pH analizi. Örnekler kronoamperometri sırasında t = 0 ve t = 24 saatte toplandı. Değerler, üçlü BES reaktörlerinde elde edilen ortalama ± sd olarak çizilir. Anlamlılık tek kuyruklu t-testi ile belirlendi. DHNA: P değeri = 6.85 × 10-6. DMSO: P değeri = 0.0409. Kısaltmalar: DHNA = 1,4-dihidroksi-2-naftoik asit; DMSO = dimetil sülfoksit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: mMRS ortamının hazırlanması için malzemeler24. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: mCDM ortamının hazırlanması için malzemeler. Bu tablo Tejedor-Sanz ve ark.13 ve Aumiller ve ark.25'ten alınmıştır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: M9 ortamının hazırlanması için malzemeler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: OCV, CA ve CV teknikleri için EC-Lab parametre ayarları. Kısaltmalar: OCV = açık devre voltajı; CA = kronoamperometri; CV = döngüsel voltametri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Şekil S1: Lactiplantibacillus plantarum'un tek başına DMSO ve mCDM ile temsili döngüsel voltametri izleri. CV izleri L. plantarum t = 24 saatte DMSO ve t = 0 saatte tek başına mCDM. Tüm CV deneyleri, çözelti karıştırılırken 2 mV/s tarama hızında çalışma elektrodu olarak karbon keçe (16cm2) kullanılarak gerçekleştirilmiştir. Kısaltmalar: CV = döngüsel voltametri; mCDM = Mannitol ile Kimyasal Olarak Tanımlanmış Ortam; DHNA = 1,4-dihidroksi-2-naftoik asit; DMSO = dimetil sülfoksit. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada tarif edilen üç elektrotlu, iki odacıklı biyoelektrokimyasal sistemi kullanarak, L. plantarum'da DHNA aracılı EET'den akım üretiminin ölçümünü gösterdik. Bu BES deneyleri, yüksek kaliteli veriler üretir; ancak BES'ler hassastır. Bu nedenle, protokolün başarısı, özellikle reaktör ve referans elektrot montajında, iğnelerin ve elektrotların anodik oda içinde konumlandırılmasında ve katyon değişim membranının değiştirilmesinde kullanıcı hassasiyetine bağlıdır. Otoklavlama veya deney sırasında su/ortam sızıntısı olmamasını sağlamak için reaktörleri dikkatli bir şekilde monte etmek çok önemlidir. Su sızıntısı, katyon değişim membranlarının O-ringe tam olarak uyacak şekilde kesilmesini sağlayarak ve mafsal cl'yi sıkarak çözülebilir.amp parmakla sıkıca sıkmak. Deney için hidrofilik hale gelmesine izin vermek için otoklavlama sırasında yuvarlak olarak hissedilen karbonun tamamen suya batırılması da önemlidir. Yeni kullanıcıların, suyla doldurulmuş yeni monte edilmiş reaktörlerin otoklavlamadan önce 2 saat bekletilmesine izin vermelerini ve ana şişe bağlantılarının altında yavaş sızıntı belirtilerini kontrol etmelerini öneririz. Ayrıca, uygun bir referans elektrot düzeneğinin sağlanması, reaktörler arasında tutarlı veri replikasyonunu garanti eder. Cam muhafazanın içindeki Teflon fritin rengi solursa, çatlarsa veya kurursa, bu durum referans elektrodunun yüksek direncine neden olabilir. Kullanıcılar, referans elektrot performansını eski haline getirmek için cam muhafazayı değiştirebilir.
Deney sırasında anodik oda içindeki tüm iğnelerin ve elektrotların uygun şekilde yönlendirilmesi, deney başarısı için kritik öneme sahiptir. Referans elektrodu, karbon keçe çalışma elektrodunun herhangi bir parçasına doğrudan temas etmemelidir. Kullanıcılar, çalışma elektrotu titanyum telini reaktörün üstünden hafifçe döndürerek karbon keçe konumunu ayarlayabilir. Ek olarak, nitrojen serpme için iğne yerleşimi, hazne içindeki elektrotlarla veya haznenin üzerindeki herhangi bir elektrot/potansiyostat bağlantısıyla doğrudan temas etmemelidir. Nitrojen akışı, her iki elektroda da akmayacak şekilde ayarlanmalıdır. Son olarak, kullanıcılar, çalışma elektrodunu karıştırma çubuğunun 1-2 cm yukarısına yerleştirerek karıştırma çubuğunun çalışma elektroduna temas etmediğinden emin olmalıdır. OCV'de düzensiz bir sinyal gözlemlenirse, bu genellikle elektrotların ve nitrojen akışının reaktör içine uygun şekilde yerleştirilmesini sağlayarak ve potansiyostat uçları ile reaktör elektrotları arasındaki bağlantıların doğru ve güvenli olduğunu kontrol ederek çözülebilir. Son olarak, deneyimlerimiz, DHNA gibi elektron aracılarının katyon değişim zarı içinde tutulabileceğini ve çok fazla kez yeniden kullanıldığında yüksek bir arka plan akımına neden olabileceğini göstermektedir. Güvenilir deneysel sonuçları garanti etmek için, özellikle aracılı EET'yi araştırırken, iki ila üç kullanımdan sonra katyon değişim membranının değiştirilmesini öneririz.
Elektroda doğrudan mikrobiyal bağlanmanın elektron transferini kolaylaştırdığı doğrudan EET'den farklı olarak, aracılı EET, elektron mekiklerinin hücre zarı ve elektrot boyunca tutarlı bir şekilde yayılmasını gerektirir ve bu da burada açıklanan benzersiz BES ayarlarıyla sonuçlanır. İlk olarak, anodik ve katodik reaksiyonları bir katyon değişim membranı ile ayırmak için protokolümüzdeki tek odacıklı muadili yerine çift odacıklı bir BES seçtik. Bu ayırma, serbestçe yayılan elektron aracılarının (DHNA) ve mikropların katot ile çapraz etkileşime girmesini önler ve mikrobiyal EET'nin elektron aracılarını ve anodu azaltmak için ana elektron kaynağı olmasını sağlar. Ayırma ayrıca aracı konsantrasyonu/dağılımı ve anoda dengede duran potansiyel gibi parametreler üzerinde hassas kontrol sağlar. Ek olarak, grafit çubuklar, metal elektrotlar, camsı karbon veya indiyum kalay oksit (ITO) gibi diğer seçenekler arasında anot malzemesi olarak karbon keçeyi seçtik. Bunun nedeni, karbon keçenin 3D gözenekli yapısının, bu elektrotlardan30 çok daha geniş bir yüzey alanı sağlaması ve yüksek konsantrasyonlarda bile aracıların verimli bir şekilde kullanılmasına izin vermesidir. Üç elektrotlu, iki odacıklı BES ayarlarımız, uzun süreli izlemede bile aracılı EET'nin güvenilir ve tekrarlanabilir bir okumasını sağlar; Ancak, bu işlem nispeten düşük aktarım hızıdır. Bu protokol, EET mekanizmalarının laboratuvar ölçeğinde anlaşılması veya prototip EET uygulamalarının test edilmesi için uygundur. Taşınabilir veya basılı BES'ler31,32, tamamlayıcı metal oksit yarı iletken (CMOS) dizileri33 veya yükseltilmiş BES'ler34 gibi alternatif BES mimarileri, araştırmacılar tarafından farklı temel veya uygulama amaçları için düşünülebilir.
Bu protokolde, en sık kullanılan elektrokimyasal teknikler için ayrıntılı talimatlar sunuyoruz: kronoamperometri (CA) ve döngüsel voltametri (CV). Elektrokimyasal Empedans Spektroskopisi (EIS) ve Diferansiyel Darbe Voltametrisi (DPV) gibi diğer elektrokimyasal tekniklerin, yük transfer direncini ve çift katmanlı kapasitansı 35,36,37 analiz ederek BES hakkında daha derin bilgiler sağlayabileceğini belirtmekte fayda var. Bu BES protokolü EET ölçümlerini mümkün kılarken, elektrokimyasal verilerin metabolik aktivite ve hücre biyokütle ölçümleri ile tamamlanması da kapsamlı bir analiz için gerekli olabilir. L. plantarum gibi mikroplar, laktat ve etanol gibi diğer fermantasyon yan ürünlerinin yanı sıra elektron lavabolarından biri olarak EET'yi devreye sokar. Ayrıca, hücre biyokütle büyümesinin aynı zamanda bir elektron yutağı13 görevi görmesi dikkat çekicidir. Bu nedenle, tüketilen elektron donörlerinin (örneğin mannitol) miktarının belirlenmesi, hücre biyokütle büyümesinin değerlendirilmesi ve fermantasyon yan ürünlerinin izlenmesi, EET'nin verimliliği ve fizyolojik sonuçları hakkında daha derin bilgiler sunar. Hücresel metabolitler yaygın olarak kromatografi ve enzimatik tahliller kullanılarak ölçülürken, hücre canlılığı ve büyümesi, koloni oluşturan birimlerin sayılması ve harcanan ortamın optik yoğunluğunun sırasıyla 600 nm'de ölçülmesiyle değerlendirilir13. EET ölçümlerinin deneysel koşullarda küçük bozulmalara karşı hassas olduğuna dikkat etmek de önemlidir. Buna pH, sıcaklık, karıştırma hızı ve nitrojen gazı serpme hızı38 dahildir ancak bunlarla sınırlı değildir. Bu nedenle, ölçülen EET seviyelerinin biyoanalitik ölçümlerle normalleştirilmesi, farklı günlerde yapılan deneyler arasında tutarlı bir değerlendirmeyi kolaylaştıran dahili bir kontrol görevi görür.
Elektrokimyasal tekniklerin diğer biyoanalitik ölçümlerle birleştirilmesi aracılı EET, elektro-fermantasyon ve biyoelektrokataliz için yeni fırsatlar yaratır. Organik, inorganik veya enzimatik elektrokatalizörlerin geleneksel kullanımı, yüksek maliyetleri nedeniyle zorluklar doğurur ve bozulmaya eğilimlidir. Alternatif olarak, mikropların canlı elektrokatalizörler olarak kullanılması, mikropların kendi kendini onarma ve kendi kendini kopyalama yetenekleri nedeniyle daha ucuz ve daha ölçeklenebilir bir çözüm sunar39. Genellikle güvenli bir laktik asit bakterisi olarak kabul edilen L. plantarum, özellikle ilgi çekici bir şasidir. Bu protokolde açıklanan aynı elektrokimyasal kurulumları kullanarak, daha önce L. plantarum'un EET koşulları altında lahana suyunu fermente edebildiğini ve laktat, asetat ve süksinat13 gibi daha fazla fermantasyon son ürünü üretmeye yönelik metabolik akışı hızlandırabildiğini göstermiştik; Bu organik asitler, gıda fermantasyonunda temel aroma bileşikleridir. Bu, elektrokimyasal teknikler kullanılarak, L. plantarum'daki aracılı EET'nin, metabolik akıyı manipüle etmek, gıda tatlarını değiştirmek veya değerli kimyasallar üretmek için potansiyel olarak kaçırılabileceği anlamına gelir. Bu protokolde sunulan elektrokimyasal tekniklerin sadece L. plantarum'a uygulanamayacağını, aynı zamanda aracılı EET40,41 gerçekleştiren diğer doğal veya mühendislik mikroplarına da jenerik olarak uygulanabileceğini belirtmek gerekir. Kullanılan spesifik mikrobun elektron transfer mekanizmasına bağlı olarak flavin, ferrosen, nötr kırmızı, ferrisiyanür, lawsone ve menadion gibi farklı elektron aracıları seçilebilir22,42. Ayrıca, bu çalışmada oluşturulan BES protokolü, daha önce Shewanella ve Geobacter türleri43,44 ile gösterildiği gibi aracısız EET gerçekleştiren ekzoelektrojenlere genişletilebilir. EET performansını kolaylaştırmak için belirli bir mikrobun hücresel aktivitesini desteklemek için optimize edilmiş bir büyüme ortamı kullanılmalıdır. Bu protokol, L. plantarum'da DHNA aracılı EET için parametrelere ince ayar yapar, ancak farklı bir mikrop ve elektron aracıları uygulandığında değişiklikler beklenir.
Açıklamalar
Yazarların beyan etmek için rekabet eden çıkarları yoktur.
Teşekkürler
Ajo-Franklin laboratuvarı üyelerine, BES montajı, bakımı, kritik adımlar ve sorun giderme hakkındaki kapsamlı tartışmaları için teşekkür ederiz. Araştırma, Ordu Araştırma Ofisi tarafından desteklendi ve W911NF-22-1-0239 Hibe Numarası (C. M. A-F'ye, RA'yı destekleyen) ve Teksas Kanser Önleme ve Araştırma Enstitüsü, hibe # RR190063 (C. M. AF'ye, RC, SL ve BBK'yi destekleyen). Şekil 1 , BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
Referanslar
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır