Method Article
Характеристика опосредованного внеклеточного переноса электронов у молочнокислых бактерий с помощью трехэлектродной, двухкамерной биоэлектрохимической системы
В этой статье
Резюме
В данной работе мы представляем протокол для определения характеристик опосредованного внеклеточного переноса электронов (ЭЭТ) у молочнокислых бактерий с использованием трехэлектродной двухкамерной биоэлектрохимической системы. Мы проиллюстрируем этот метод на примере Lactiplantibacillus plantarum и редокс-медиатора 1,4-дигидрокси-2-нафтоевой кислоты, а также подробно опишем электрохимические методы, используемые для оценки опосредованной ЭЭТ.
Аннотация
Многие бактерии осуществляют внеклеточный перенос электронов (ЭЭТ), посредством которого электроны переносятся от клетки к внеклеточному концевому акцептору электронов. Этот акцептор электронов может быть электродом, а электроны могут доставляться опосредованно через молекулу редокс-активного медиатора. В данной работе мы представляем протокол изучения опосредованной ЭЭТ в Lactiplantibacillus plantarum, пробиотической молочнокислой бактерии, широко используемой в пищевой промышленности, с использованием биоэлектрохимической системы. Мы подробно описываем, как собрать трехэлектродную двухкамерную биоэлектрохимическую систему, и даем рекомендации по определению характеристик ЭЭТ в присутствии растворимого медиатора с использованием методов хроноамперометрии и циклической вольтамперометрии. Мы используем репрезентативные данные экспериментов по ЭЭТ, опосредованной 1,4-дигидрокси-2-нафтоевой кислотой (ДГНК) с L. plantarum , для демонстрации анализа и интерпретации данных. Методы, описанные в этом протоколе, могут открыть новые возможности для электроферментации и биоэлектрокатализа. Недавнее применение этого электрохимического метода с L. plantarum продемонстрировало ускорение метаболического потока в направлении производства конечных продуктов ферментации, которые являются критически важными компонентами вкуса в ферментации пищевых продуктов. Таким образом, эта система имеет потенциал для дальнейшего развития для изменения вкусов в производстве продуктов питания или производства ценных химических веществ.
Введение
Биоэлектрохимические системы взаимодействуют между микробами и электродами, что позволяет исследовать механизмы внеклеточного переноса электронов (ЭЭТ) и обеспечивает возобновляемые подходы к биоэлектрокатализу 1,2,3. Микробы, которые естественным образом выполняют ЭЭТ, известны как экзоэлектрогены, которые переносят электроны, полученные в результате метаболизма, к внеклеточным концевым акцепторам электронов, например, к (гидро)оксидам железаи электродам. Впервые охарактеризованные у видов Geobacter и Shewanella 4,5, пути ЭЭТ с тех пор были идентифицированы у многих бактерий. Эти экзоэлектрогены играют центральную роль в нескольких микробных электрохимических технологиях, таких как генерация электрической энергии из отходов, фиксация CO2 и производство ценных химических веществ посредством электросинтеза 1,6,7,8,9,10,11,12.
Одним из таких экзоэлектрогенов является Lactiplantibacillus plantarum, грамположительная молочнокислая бактерия13. L. plantarum — это кочевая пробиотическая бактерия, которая обитает в самых разных средах обитания, включая кишечник человека и других позвоночных, а также многие виды пищи, такие как мясо, злаки, овощи, ферментированные продукты и напитки 14,15,16,17. Его геном кодирует гибкий, гетероферментативный метаболизм, что позволяет успешно адаптироваться к этим разнообразным средам. Он хорошо изучен, широко используется в пищевой промышленности и здравоохранении и в целом признан безопасным Управлением по санитарному надзору за качеством пищевых продуктов имедикаментов 18,19. Таким образом, L. plantarum может служить полезной платформой для технологий, основанных на ЭЭТ.
Недавние исследования L. plantarum выявили мультигенный оперон, кодирующий сложный путь ЭЭТ, первоначально описанный у Listeria monocytogenes13,20. В L. plantarum белки, синтезированные из этого оперона, облегчают ЭЭТ в биоэлектрохимической системе (БЭС) при использовании хинон-1,4-дигидрокси-2-нафтоевой кислоты (ДГНК) в качестве электронного медиатора13. Первым важным белком в этом пути является мембраносвязанная NADH-хиноноксидоредуктаза (Ndh2), которая окисляет NADH и восстанавливает DHNA. ДГНК доставляет электроны либо непосредственно к электроду, либо опосредованно через добавочный белок PplA (рис. 1)13,21,22. Недавние исследования показывают, что L. plantarum может также использовать другие хиноны, структурно сходные с ДГНК, в качестве электронных медиаторов; однако L. plantarum не способен продуцировать ДГНК или эти альтернативные хиноны, поэтому медиаторы должны экзогенно присутствовать в окружающей среде для возникновения ЭЭТ 13,22,23.
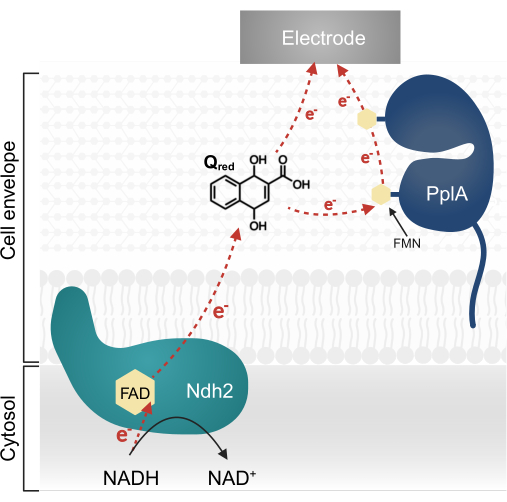
Рисунок 1: Поток электронов в Lactiplantibacillus plantarum EET. Ndh2 пропускает электроны от NADH к хинону DHNA. Электроны перемещаются к электроду для производства тока, либо непосредственно с помощью восстановленного хинона, либо косвенно через добавочный белок PplA. Сокращения: FAD = флавинадениндинуклеотид; FMN = Флавинмононуклеотид; EET = внеклеточный перенос электронов; NADH = восстановленный никотинамидадениндинуклеотид; Ndh2 = NADH-хиноноксидоредуктаза; ДГНК = 1,4-дигидрокси-2-нафтоевая кислота; PplA = фосфолипаза А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этой статье мы предоставляем исчерпывающий протокол для использования метода на основе BES для характеристики DHNA-опосредованной ЭЭТ у L. plantarum. Трехэлектродная двухкамерная система ограничивает бактерии рабочим электродом, что позволяет точно контролировать потенциал, подаваемый на бактерии, и предотвращать перекрестные помехи между рабочим и противоэлектродом. Мы представляем комплексный протокол, охватывающий 5 дней, который включает в себя предварительную подготовку к эксперименту, сборку BES, анализ ЭЭТ с использованием хроноамперометрии (CA) и циклической вольтамперометрии (CV), а также анализ образцов после эксперимента. Этот протокол может быть применен для разгадки механизмов путей ЭЭТ и для создания систем электроферментации и электрокатализа.
протокол
ПРИМЕЧАНИЕ: Двухкамерные сборки BES будут называться «реакторами» в следующем протоколе.
1. Подготовка СМИ
- Подготовьте питательную среду для L. plantarum .
- Готовьте коммерческие среды MRS (de Man Rogosa Sharpe) в соответствии с инструкциями и среды mMRS24 , как описано в таблице 1. Отрегулируйте pH mMRS до 6,5. Простерилизуйте оба фильтрующих материала, пропустив их через фильтр 0,22 мкм, и храните при температуре 4 °C до использования.
- Приготовьте химически определенную среду с маннитолом (mCDM)13,25, как описано в таблице 2, и отрегулируйте pH до 6,5. Подготовьте достаточное количество среды, чтобы заполнить анодную камеру каждого реактора 110 мл среды. Фильтруйте-стерилизуйте mCDM через фильтр 0,22 мкм.
ПРИМЕЧАНИЕ: mCDM следует готовить свежим в день предполагаемого использования. Компонентные растворы могут быть подготовлены заранее. Стерилизуйте все растворы компонентов через фильтр 0,22 мкм и храните при температуре 4 °C. При приготовлении витаминов Вульфа отрегулируйте pH до 11 перед стерилизацией и храните в темноте или завернутыми в фольгу. При приготовлении минералов Вульфа отрегулируйте pH до 8 после добавления нитрилотриуксусной кислоты (NTA). Затем добавьте остальные компоненты, простерилизуйте и храните в темноте или завернув в фольгу.
- Подготовьте 1x PBS и автоклав для стерилизации. Хранить при температуре 4 °C для использования в этом протоколе.
- Подготовьте коммерческий фильтрующий материал M9 в соответствии с инструкциями (Таблица 3) и в автоклаве для стерилизации. Подготовьте достаточное количество среды, чтобы заполнить катодную камеру каждого реактора 110 мл. Хранить при комнатной температуре.
2. День 1: Сборка реактора BES и начальноекультивированиеL. plantarum
ПРИМЕЧАНИЕ: Справочный рисунок 2 для схемы реактора BES и схемы с подробным описанием сборочных частей, указанных в протоколе.
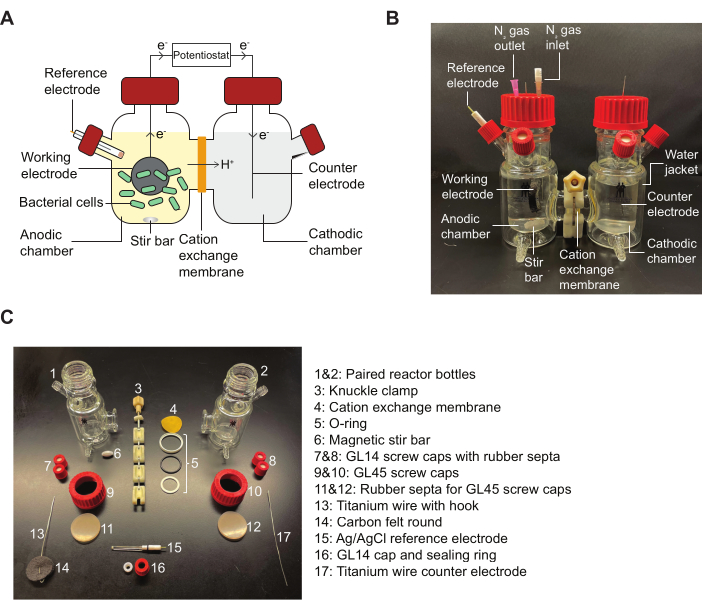
Рисунок 2: Компоненты BES и схема сборки. (A) Схема двухкамерного реактора BES. Бактерии (зеленые) в анодной камере передают электроны на рабочий электрод (черный круг) в присутствии хинонового медиатора. Электроны проходят через цепь в катодную камеру, что позволяет потенциостату измерять ток между анодом и катодом. (B) Изображение, на котором изображен полностью собранный реактор BES, включая входную и выходную иглы N2 в анодной камере. (C) Изображение, на котором изображены все части реактора в разобранном виде. Аббревиатура: BES = биоэлектрохимическая система. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Сборка и стерилизация реакторов.
- Подготовьте рабочий и противоэлектроды. Предварительно отшлифуйте титановые проволоки диаметром 1,0 мм для рабочего и контрэлектродов наждачной бумагой из оксида алюминия до равномерного блеска. С помощью плоскогубцев согните по одному концу каждого рабочего электродного провода в небольшой крючок. Наденьте круглую проволоку из углеродного войлока диаметром 16 см2 на каждую рабочую проволоку электрода, по одному разу втягивая проволоку внутрь и наружу из нее и потянув ее вниз по проволоке, пока она не закрепится на крючке. Закрепите рабочий и противоэлектроды в колпачках GL45, проткнув проволокой резиновую перегородку и протянув ее на несколько сантиметров.
- Чтобы собрать спаренные реакторы, сначала соберите уплотнительное кольцо и поместите в собранное уплотнительное кольцо предварительно вырезанную катионообменную мембрану, предварительно замоченную в воде. Поместите уплотнительное кольцо с мембраной между большими нижними отверстиями двух спаренных бутылок реактора. Закрепите баллоны с реакторной парой и уплотнительное кольцо с мембраной с помощью зажима для пальцев. Опустите магнитную мешалку в каждую анодную камеру, а затем закройте все небольшие отверстия в верхней части каждой бутылки крышками GL14 с резиновыми перегородками.
ПРИМЕЧАНИЕ: Не затягивайте слишком сильно зажимы кастета или крышки, так как это может привести к трещинам или поломкам бутылок. - Наполните каждую бутылку реактора 110 мл деионизированной (DI) воды, затем закройте каждую бутылку крышкой GL45 с соответствующим электродом. Вставьте колпачки, оснащенные круглым рабочим электродом из углеродного войлока, слегка надавливая на верхнюю часть войлочного круга, чтобы круг оставался на крючке.
ПРИМЕЧАНИЕ: Свежий углеродный войлок является гидрофобным и отталкивает воду в реакторе при первоначальной сборке. Автоклавирование приведет к тому, что углеродный войлок станет достаточно гидрофильным для экспериментов. - Соберите колпачки электродов GL14 с силиконовыми уплотнительными кольцами.
- Перед автоклавированием аккуратно ослабьте все колпачки GL45. Автоклавные водонаполненные реакторы и электродные колпачки для стерилизации. После автоклавирования дайте реакторам остыть до комнатной температуры.
- Культура L. plantarum NCIMB8826. В стерильных условиях соскребите несколько бактерий с верхней части глицеринового бульона и внесите 3 мл коммерческой среды MRS. Выращивайте культуру в течение ночи при температуре 37 °C без встряхивания.
ПРИМЕЧАНИЕ: L. plantarum не использует кислород в качестве концевого акцептора электронов; Поэтому нет необходимости насыщать среду кислородом путем встряхивания26. Однако условия культивирования будут отличаться, если используются другие микробы.
3. День 2: Подготовка электродов сравнения, подготовка реакторов к началу эксперимента и субкультурация L. plantarum
- Подготовьте электроды сравнения Ag/AgCl.
ПРИМЕЧАНИЕ: Эти шаги описывают подготовку электродов сравнения Ag/AgCl, указанных в Таблице материалов. Пользователи должны следовать инструкциям производителя при использовании другого электрода сравнения.- Разберите электроды сравнения Ag/AgCl и отшлифуйте провода. Осторожно вытащите электрод из стеклянного корпуса и поверните стеклянный корпус, чтобы слить старый раствор KCl. Аккуратно отшлифуйте электродные провода наждачной бумагой из оксида алюминия до равномерного блеска, чтобы удалить окисленный материал.
- Соберите все отшлифованные провода электродов сравнения в небольшой стакан с небольшой мешалкой и заполните стакан 100% отбеливателем до полного погружения проводов. Хлоридируйте провода, дав им отбелиться на платформе для перемешивания в течение 30 минут, пока электроды не станут темно-серыми. После отбеливания тщательно промойте провода электродов деионизированной водой.
- Чтобы снова собрать электрод сравнения, с помощью шприца полностью заполните стеклянный корпус раствором 3 М KCl, пропитанным хлоридом серебра, осторожно постукивая по боковой стороне, чтобы выбить любые пузырьки воздуха. С помощью того же шприца заполните колпачок электродной проволоки раствором KCl, затем вставьте провод в корпус. Приложите нижнюю часть стеклянного корпуса к бумажному полотенцу на столе, вставьте электрод в стеклянный корпус, затем плотно нажмите на крышку, чтобы закрыть электрод. Храните электроды сравнения в стакане, неглубоко заполненном раствором KCl, до тех пор, пока они не понадобятся, и повторите то же самое со всеми оставшимися электродами сравнения.
- Используйте цифровой мультиметр для измерения напряжения самодельных электродов сравнения Ag/AgCl.
- Погрузите концы электродов сравнения Ag/AgCl (по оценкам 197 мВ по сравнению со стандартным водородным электродом, SHE) в стакан, наполненный 3 M KCl. Надежно подключите мультиметр к коммерчески приобретенному насыщенному каломельному электроду (SCE, 241 мВ против SHE), также погруженному в те же электролиты KCl.
- Измерьте разность потенциалов между каждым электродом сравнения и SCE. Убедитесь, что электроды сравнения отличаются от SCE на 44 ± 10 мВ. Разберите и снова соберите любой электрод сравнения, который выходит за пределы этого диапазона.
- Заклейте шов в месте соприкосновения колпачка со стеклянным корпусом с парапленкой.
- Подготовьте реакторы к экспериментам.
- В стерильном шкафу биобезопасности замените автоклавную воду в реакторах на соответствующую среду. Вылейте автоклавную воду. Заполните катодные камеры 110 мл автоклавированной среды M9. Заполните анодные камеры 110 мл свежеприготовленного mCDM.
- Установите электроды сравнения. Снимите по одному колпачку GL14 с каждой анодной камеры и установите на место колпачок автоклавного электрода (колпачок GL14 с силиконовым уплотнительным кольцом). Распылите на электроды сравнения 70% этанол для стерилизации, затем поместите по одному электроду через крышку электрода в каждую анодную камеру.
ПРИМЕЧАНИЕ: Убедитесь, что электрод сравнения не вступает в прямой контакт с круглым углеродным войлоком. - Перед извлечением реакторов из шкафа биобезопасности затяните все крышки и зажимы так, чтобы они были плотно закрыты пальцами, чтобы избежать утечки.
- Подсоедините реакторы к системе водяного насоса. Поместите каждый реактор на соответствующую платформу для перемешивания. Соедините патрубки водяной рубашки каждого реактора со следующим с помощью резиновых трубок, подсоединив концевые реакторы к входным и выходным трубкам водяного насоса.
ПРИМЕЧАНИЕ: Убедитесь, что все соединения плотно затянуты без утечек, при необходимости используя стяжки для фиксации трубок. - Наполните насос водой и добавьте 4-6 капель кондиционера для воды. Включите насосную систему и установите температуру на 30 °C. Запустите насос и наблюдайте за потоком воды через все водяные рубашки реактора, убедившись, что нет утечек в любых соединениях.
- Включите платформы для перемешивания и установите их на непрерывное перемешивание при 220 об/мин.
- Подсоедините реакторы к газопроводам, разбрызгивающим азот. Прикрепите воздушный фильтр к 4-дюймовой игле 22 G и вставьте иглу через верхнюю перегородку анодной камеры реактора в фильтрующий материал, который будет служить входом азота. Вставьте еще одну иглу 1 дюйм и 18 G в верхнюю перегородку анодной камеры, которая будет служить выходом азота. Подсоедините газовые линии от источника азота к воздушному фильтру и откройте клапан, чтобы газ мог мягко пузыриться через реактор. Убедитесь, что пузырьки азота проходят через все анодные камеры непрерывно на протяжении всего эксперимента для поддержания анаэробных условий.
ПРИМЕЧАНИЕ: Убедитесь, что входная игла расположена в стороне от круглого карбонового войлока. Пузырьковая струя не должна соприкасаться ни с углеродным войлоком, ни с электродами сравнения. - Подсоедините биореакторы к проводам потенциостата. Подсоедините рабочий, ответный и контрольный электроды из крокодила-зажима от потенциостата к соответствующим электродам.
ПРИМЕЧАНИЕ: Используйте мультиметр для проверки сопротивления между проводом/токосъемником и электродами, чтобы обеспечить правильное электрическое соединение и свести к минимуму потенциальные погрешности измерения.
- Ввод параметров потенциостата для предварительного запуска.
ПРИМЕЧАНИЕ: Критические настройки техники приведены ниже. В таблице 4 приведен расширенный список настроек программного обеспечения для каждого метода.- Включите потенциостат и инициализируйте программное обеспечение EC-lab на компьютере. Подключите потенциостат к компьютеру, нажав кнопку с символом потенциостата на верхней левой панели в разделе «Устройства». После подключения имя устройства будет отображаться в виде зеленого кружка в текстовом поле ниже.
- Синхронизируйте все каналы, подключенные к биореакторам, в одну группу, нажав на вкладку «Редактировать », а затем выбрав «Синхронизировать». Нажмите на соответствующие поля с номерами каналов | ok.
- Добавьте технику напряжения разомкнутой цепи (OCV) в потенциостат, нажав кнопку + на панели настроек параметров слева. В синем окне настроек; настройте его на измерение потенциала рабочего электрода (EWE) относительно электрода сравнения (RE), регистрируя время в интервале dt каждые 36 с в общей сложности 3 часа.
- Далее добавьте методику циклической вольтамперометрии (КВ) в потенциостат. Установите начальный потенциал EWE на Ei 0 В в зависимости от RE со скоростью сканирования 2 мВ/с. Развертка до вершинного потенциала (E1) 0,4 В в зависимости от RE с реверсивной разверткой до вершинного потенциала (E2) -0,7 В в зависимости от RE. Повторите сканирование в общей сложности два раза.
ПРИМЕЧАНИЕ: В микробных электрохимических системах микробное инокуляционное образование и образование биопленки обуславливают более высокую емкость по сравнению с металлическими материалами или неорганическими молекулами. Во время циклического вольтамперометрического сканирования потенциал изменяется, а в качестве фона выступает зарядный ток. Для достижения высокого соотношения сигнал/шум необходимо снизить скорость сканирования, хотя это увеличивает продолжительность сканирования. Поскольку мы сканируем два цикла, охватывающих широкое электрохимическое окно 1,1 В, скорость сканирования 2 мВ/с приводит к тому, что полуцикл занимает до 9,1 минуты. Следовательно, два цикла занимают в общей сложности 36,4 минуты. Дальнейшее снижение скорости сканирования было бы чрезмерно трудоемким. - Добавьте методику хроноамперометрии (КА). Применяем постоянный потенциал EWE 0,2 В в зависимости от RE в течение времени t = 200 ч, регистрируя время с интервалами dt каждые 25-40 с. Корректируйте временной интервал на основе программного обеспечения потенциостата для получения нужного уровня детализации.
ПРИМЕЧАНИЕ: Средний потенциал ДГНК составляет приблизительно -0,093 В по сравнению с Ag/AgCl; таким образом, приложенный потенциал 0,2 В в зависимости от РЗЭ к рабочему электроду достаточен для обеспечения переноса электронов от ДГНК к электроду. - После ввода всех параметров начните прогон, нажав зеленый стартовый треугольник. Сохраните файл в соответствии с указаниями программного обеспечения, затем нажмите «Сохранить». Программное обеспечение запустит технику 1, «OCV». Наблюдайте за следами OCV в течение нескольких минут, чтобы убедиться, что все реакторы показывают положительный результат и приближаются друг к другу с постоянным сигналом. Оставьте эксперимент на ночь, чтобы завершить OCV и начальное CV (см. дополнительный рисунок S1 для CV для управления средой) и дайте CA работать до тех пор, пока он не стабилизируется.
- В стерильных условиях субкультурируют культуру MRS L. plantarum в соотношении 1:200 в 50 мл mMRS. Выращивайте клетки в течение ночи при температуре 37 °C без встряхивания.
Примечание: Ночная культура объемом 50 мл обычно производит более чем достаточное количество клеток для шести реакторов, предполагая, что конечный внешний диаметр600 составляет 0,2 в реакторе. Соответствующим образом отрегулируйте объемы культур для больших или малых экспериментов.
4. День 3: Инъекция клеток и ДГНК/ДМСО
- Промойте ячейки и введите их в реакторы.
- Утром извлеките культуру mMRS L. plantarum из инкубатора. В стерильных условиях переложите культуру в коническую пробирку объемом 50 мл и поместите культуру на лед.
- Промойте клетки 2x в стерильном, холодном 1x PBS. Для этого центрифугируйте культуру при давлении 4000 × г в течение 5 минут в центрифуге при температуре 4 °C для гранулирования клеток. В стерильных условиях осторожно, но тщательно ресуспендируйте клетки в 50 мл PBS, затем снова центрифугируете, как и раньше; Повторите для повторного мытья. После финальной центрифуги повторно суспендируйте клетки в холодном PBS до наружного диаметра600 = 11.
- В стерильных условиях загрузите 2 мл ресуспендированных клеток в шприц объемом 3 мл, оснащенный иглой для каждого реактора.
- На реакторной станции снимите крышку с клеточного шприца и вставьте иглу в верхнюю часть анодной камеры реактора. Не нажимайте на поршень шприца в это время; Повторите для всех реакторов. Когда все шприцы будут на месте, нажмите на поршни, чтобы ввести элементы в реакторы, и запишите время впрыска по следу CA. Этот объем ячеек дает итоговый наружный диаметр600 , равный 0,2 в реакторах. Утилизируйте все шприцы в коробках для биологически опасных предметов, а иглы — в специально отведенном контейнере для биологически опасных предметов. Дайте току стабилизироваться до плоского уровня на трассе CA в течение 2-4 часов.
ПРИМЕЧАНИЕ: После инжекции на трассе CA можно наблюдать колебания тока. Через 2-4 часа эти колебания стабилизируются до плоского тока (изменение тока на <2 мкА в течение часа), после чего можно вводить ДГНК.
- Измерьте исходный pH и введите DHNA.
- Приготовьте раствор ДГНК. В пробирке объемом 1,5 мл приготовьте 500 мкл раствора ДГНК 20 мг/мл, растворив порошкообразную ДГНК в 100% ДМСО. Наполните 3 инсулиновых шприца 110 мкл раствором ДГНК и 3 инсулиновых шприца 110 мкл только ДМСО.
Примечание: В то время как ДГНК слабо растворима в воде, ДМСО является лучшим растворителем для запасов ДГНК в этой концентрации. Растворитель медиатора может варьироваться при использовании других медиаторов. - На реакторной станции BES обозначают экспериментальные реакторы как + DHNA , а реакторы контроля растворителей - как - DHNA. Снимите крышку со шприца с ДГНК и вставьте шприц в верхнюю часть каждой анодной камеры, обозначенной как + DHNA. Вставьте шприц, содержащий только ДМСО, в каждую анодную камеру, обозначенную как DHNA. Не нажимайте на поршни шприца в это время.
- Возьмите пробы в 0 ч временных точек для анализа образца. С помощью шприца объемом 3 мл с 2-дюймовой иглой 21 G возьмите образец среды объемом 2 мл из каждой анодной камеры через неиспользуемую перегородку малого колпачка и перенесите образцы в 24-луночный планшет для измерения pH в момент 0 ч (точка инъекции ДГНК). При желании возьмите 1 мл отработанной среды из каждой анодной камеры и отфильтруйте через фильтр 0,2 мкм в чистые пробирки с маркировкой для количественного определения метаболитов с помощью ВЭЖХ или других анализов. Образцы отработанной среды хранить при температуре -80 °C.
- Нажмите на поршни всех шприцев ДНК и ДМСО для впрыска в реакторы. Запишите время внедрения из трассировки ЦС. Выбросьте все шприцы и иглы соответствующим образом.
- Измерьте и запишите пробы pH 0 ч для каждого реактора.
- Приготовьте раствор ДГНК. В пробирке объемом 1,5 мл приготовьте 500 мкл раствора ДГНК 20 мг/мл, растворив порошкообразную ДГНК в 100% ДМСО. Наполните 3 инсулиновых шприца 110 мкл раствором ДГНК и 3 инсулиновых шприца 110 мкл только ДМСО.
5. День 4: Завершение эксперимента и сбор образцов
- Проведите электрохимический анализ через 24 ч после введения ДГНК и возьмите окончательные пробы.
- Завершите сеанс КА через 24 часа после инъекции ДГНК.
- Отберите 24-часовые пробы для анализа образца в соответствии с шагом 4.2.3.
- Запустите CV еще раз для 24-часового временного момента в соответствии с параметрами, описанными в шаге 3.3.4.
- Измерьте и запишите pH для 24-часовых проб из каждого реактора.
- Разберите и очистите реакторы.
- Выключите потенциостат. Затем отсоедините рабочий, счетчик и опорный провода от каждого реактора. Сотрите влагу с потенциостата свинцовыми зажимами типа аллигатора.
- Отключите подачу газообразного азота. Отсоедините газовые провода, а затем снимите иглы притока и вытока. Утилизируйте все иглы в контейнере для острых предметов.
- Выключите водяной насос. Отсоедините входную и выходную трубки от насоса и дайте воде стечь в ведро. При отсоединении держите концы трубок приподнятыми над ватерлинией в насосе, чтобы предотвратить попадание воды на пол. Один за другим отсоединяйте каждый реактор от трубки водяной рубашки, работая от конечного реактора на выходе до реактора на начальном входе.
- Слейте все среды из реакторов в большой контейнер для биологически опасных веществ. Следуйте обычным методам отбеливания культуры для утилизации.
- После опорожнения разберите и очистите все части реактора. Утилизируйте катионообменные мембраны и углеродные войлочные круги в надлежащие биологически опасные отходы. Очистите электроды сравнения и титановые проволоки 70% этанолом и храните очищенные электроды сравнения в стакане, неглубоко заполненном водой. Аккуратно очистите бутылки реактора, крышки, уплотнительные кольца и зажимы в теплой воде с лабораторным моющим средством, тщательно промойте деионизированной водой и высушите все детали на воздухе перед хранением.
6. День 5: Электрохимический анализ
ПРИМЕЧАНИЕ: Ниже приведено общее описание построения графиков данных для этого протокола. Более подробное описание анализа и интерпретации данных будет предоставлено в разделе «Репрезентативные результаты».
- Для анализа КА: Установите время инъекции ДГНК как 0 ч. Построение графика среднего значения и стандартного отклонения измеренной плотности тока (j в мкА/см2), измеряемой каждые 36 с для всех реплик от точки времени 0 ч, в зависимости от времени (ч). Рассчитайте плотность тока в зависимости от площади рабочего электрода (16см2).
- Для CV-анализа: Постройте репрезентативную кривую CV для каждого экспериментального условия (только среда, ДМСО или DHNA), отображающую плотность тока (j в мкА/см2) в зависимости от потенциала рабочего электрода (EWE в V). Постройте второй цикл выбранного прогона CV.
Результаты
Анализ хроноамперометрии
ЭЭТ L. plantarum можно наблюдать по данным хроноамперометрии (КА), показанным на рисунке 3, в которых след плотности тока визуализирует перенос электронов от L. plantarum к рабочему электроду. Мы контролировали зависимость плотности тока (Дж) от времени при сохранении постоянного потенциала +200 мВ по отношению к Ag/AgCl в течение 24 ч. При введении 20 мкг/мл ДГНК в раствор перемешивающего электролита наблюдался абиотический всплеск окисления ДГНК, за которым следовал быстрый рост плотности биотического тока, достигающий пика в 132,0 ± 2,47 мкА/см2 примерно через 8 часов. И наоборот, инжекция ДМСО приводила к пренебрежимо малой плотности тока. Эти результаты подчеркивают важность ДГНК как необходимого и эффективного медиатора для облегчения переноса электронов между L. plantarum и электродом. Пользователи могут регулировать выходной ток, регулируя концентрацию ДГНК в BES. Предыдущие исследования также показывают, что L. plantarum реагирует на ДГНК дозозависимым образом в широком диапазоне концентраций ДГНК, производя значительный ток в присутствии концентраций ДГНК до 0,01 мкг/мл13,22.
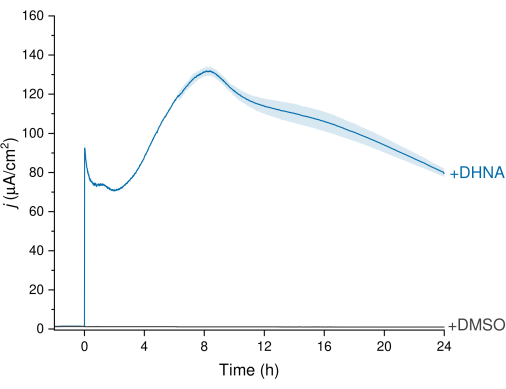
Рисунок 3: Анализ хроноамперометрии Lactiplantibacillus plantarum EET в сочетании с ДГНК. ДГНК (20 мкг/мл) или ДМСО вводили в электролиты mCDM (pH~ 6,5) с временем инъекции, определенным как t = 0. j представляет плотность тока в зависимости от площади рабочего электрода. Эксперименты проводили при напряжении 200 мВ в сравнении с Ag/AgCl с углеродным войлочным электродом (16см2) и перемешиванием. Значения представлены в виде среднего значения ± sd, полученных в реакторах с тройным BES. Сокращения: EET = внеклеточный перенос электронов; ДГНК = 1,4-дигидрокси-2-нафтоевая кислота; ДМСО = диметилсульфоксид; mCDM = Химически определенная среда с маннитолом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Циклический анализ вольтамперометрии
Для дальнейшей оценки ДГНК-опосредованной ЭЭТ у L. plantarum, мы провели циклическую вольтамперометрию через 24 ч после инъекции ДГНК. Здесь мы показываем следы сердечно-сосудистых заболеваний для трех состояний: L. plantarum с 20 мкг/мл ДГНК, L. plantarum с ДМСО и среда с 20 мкг/мл ДГНК. Как показано на рисунке 4А, присутствие 20 г/мл ДГНК в реакторах, содержащих L. plantarum, приводило к заметному увеличению окислительного тока при 50 мВ, которое не происходило в присутствии только ДМСО. Эти данные подтверждают, что добавление редокс-медиатора DHNA необходимо для облегчения переноса электронов между L. plantarum и анодом. Несмотря на то, что мы наблюдали различные меньшие окислительно-восстановительные пики в следе L. plantarum + DMSO, эти пики были похожи на след в контрольной среде и, вероятно, связаны с редокс-активными компонентами в mCDM (дополнительный рисунок S1). На рисунке 4B мы сравнили следы ДГНК в биотических условиях (L. plantarum + DHNA) с ДГНК в абиотических условиях (Media + DHNA). В то время как оба следа продемонстрировали отчетливый окислительный пик ДГНК около 50 мВ, мы наблюдали устойчивое увеличение тока выше 50 мВ только в биотических условиях. Каталитический пик достиг плотности тока 129 мкА/см2 при 300 мВ, что представляет собой увеличение на 256% по сравнению с абиотическим следом. Этот профиль оборота CV характерен для микробной EET27, что указывает на повторное восстановление ДГНК клетками L. plantarum в присутствии источника электронов (маннитола) после окисления ДГНК на аноде. Кроме того, абиотический след продемонстрировал новые окислительные пики в районе -240 мВ и -180 мВ. Предыдущие исследования показывают, что появление этих пиков может быть связано с деградацией ДГНК в ACNQ (2-амино-3-карбокси-1,4-нафтохинон)21,28. Мы не наблюдали этих пиков в биотическом следе, что указывает на то, что взаимодействие клеток L. plantarum с ДГНК может стабилизировать ДГНК и предотвратить деградацию. Следует отметить, что 24-часовая трассировка для сред с 20 мкг/мл ДГНК проводилась отдельно по этому протоколу без добавления клеток.
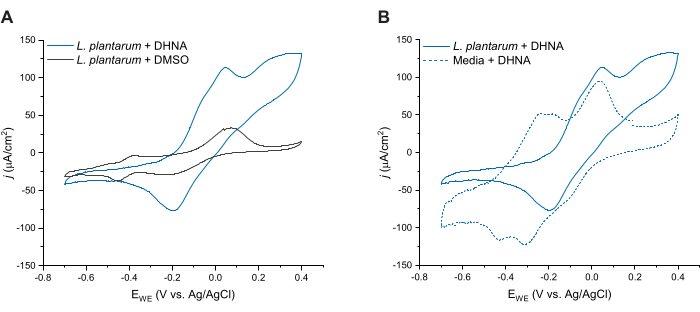
Рисунок 4: Репрезентативные трассы циклической вольтамперометрии. Все CV-эксперименты проводили в mCDM с использованием углеродного войлока (16см2) в качестве рабочего электрода со скоростью сканирования 2 мВ/с при перемешивании раствора. (A) CV-следы Lactiplantibacillus plantarum с ДГНК (20 мкг/мл) или ДМСО при t = 24 ч. (B) CV-следы 20 мкг/мл ДГНК либо у L. plantarum (биотические условия), либо только mCDM (абиотические условия) при t = 24 ч. Сокращения: CV = циклическая вольтамперометрия; mCDM = химически определенная среда с маннитолом; ДГНК = 1,4-дигидрокси-2-нафтоевая кислота; ДМСО = диметилсульфоксид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Анализ pH
Активность ЭЭТ у L. plantarum привела к заметному снижению рН в течение 24 ч. Как показано на рисунке 5, средний рН образца L. plantarum , подвергшегося воздействию ДГНК, снизился до 3,33 ± 0,01 (p = 6,85 × 10-6, n = 3), в то время как средний pH образца L. plantarum , подвергшегося воздействию ДМСО, снизился до 6,50 ± 0,06 (p = 0,0409, n = 3). Как показали предыдущие исследования, это снижение связано с увеличением ферментативного метаболизма, которое происходит, когда L. plantarum выполняет EET13. L. plantarum обычно метаболизирует маннит посредством гликолиза и ферментативных путей, которые производят ацетат, лактат и этанол в качестве продуктов конечного брожения и генерируют АТФ путем фосфорилирования на уровне субстрата29. В условиях ЭЭТ метаболический поток за счет ферментации увеличивается, тем самым увеличивая производство продуктов конечного брожения в средах BES13. Этот метаболический сдвиг приводит к более быстрому падению pH среды в реакторах с ДГНК по сравнению с управляющими реакторами с ДМСО.
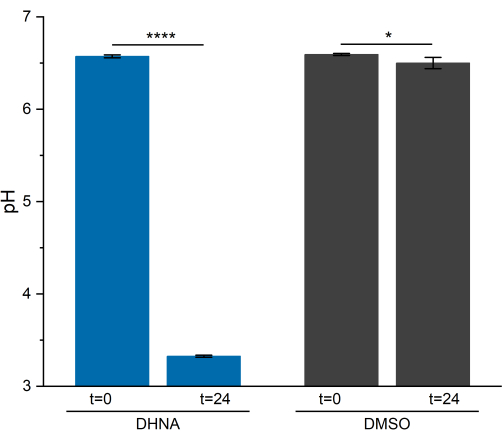
Рисунок 5: Анализ pH биоэлектрохимической системы Lactiplantibacillus plantarum . Образцы отбирали при t = 0 и t = 24 ч во время хроноамперометрии. Значения представлены в виде среднего значения ± sd, полученных в реакторах с тройным BES. Значимость определяли с помощью одностороннего t-критерия. ДГНК: P-значение = 6,85 × 10-6. ДМСО: P-значение = 0,0409. Сокращения: ДГНК = 1,4-дигидрокси-2-нафтоевая кислота; ДМСО = диметилсульфоксид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Ингредиенты для приготовления mMRS среды24. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Ингредиенты для приготовления mCDM среды. Эта таблица взята из Tejedor-Sanz et al.13 и Aumiller et al.25. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Ингредиенты для приготовления среды М9. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Настройки параметров EC-Lab для методов OCV, CA и CV. Сокращения: OCV = напряжение холостого хода; CA = хроноамперометрия; CV = циклическая вольтамперометрия. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный рисунок S1: Репрезентативные следы циклической вольтамперометрии Lactiplantibacillus plantarum только с ДМСО и мХДМ. CV-следы для L. plantarum с ДМСО при t = 24 ч и только mCDM при t = 0 ч. Все эксперименты с CV проводили с использованием углеродного войлока (16см2) в качестве рабочего электрода со скоростью сканирования 2 мВ/с при перемешивании раствора. Сокращения: CV = циклическая вольтамперометрия; mCDM = химически определенная среда с маннитолом; ДГНК = 1,4-дигидрокси-2-нафтоевая кислота; ДМСО = диметилсульфоксид. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Используя описанную здесь трехэлектродную двухкамерную биоэлектрохимическую систему, мы показали измерение генерации тока от ДГНА-опосредованной ЭЭТ у L. plantarum. Эти эксперименты BES позволяют получить высококачественные данные; однако BES чувствительны. Таким образом, успех протокола зависит от точности работы пользователя, особенно при сборке реактора и электрода сравнения, позиционировании игл и электродов в анодной камере, а также замене катионообменной мембраны. Очень важно тщательно собирать реакторы, чтобы не допустить утечки воды/среды во время автоклавирования или экспериментов. Утечку воды можно устранить, обеспечив разрезание катионобменных мембран для точного прилегания к уплотнительному кольцу и затянув зажим поворотного кулака до упора пальца. Также важно полностью погрузить углерод в воду во время автоклавирования, чтобы он стал гидрофильным для экспериментов. Мы рекомендуем новым пользователям оставить вновь собранные реакторы, заполненные водой, в течение 2 часов перед автоклавированием, проверяя наличие признаков медленных утечек ниже основных соединений баллонов. Кроме того, обеспечение правильной сборки электродов сравнения гарантирует согласованную репликацию данных между реакторами. Если тефлоновая фритта внутри стеклянного корпуса обесцвечивается, трескается или высыхает, это может привести к высокому сопротивлению электрода сравнения. Пользователи могут заменить стеклянный корпус для восстановления характеристик электрода сравнения.
Правильная ориентация всех игл и электродов в анодной камере во время эксперимента имеет решающее значение для успеха эксперимента. Электрод сравнения не должен непосредственно соприкасаться с какой-либо частью рабочего электрода с углеродным войлоком. Пользователи могут регулировать положение углеродного войлока, осторожно вращая титановую проволоку рабочего электрода над реактором. Кроме того, игла для распыления азота не должна иметь прямого контакта с электродами внутри камеры или с какими-либо соединениями электрода/потенциостата над камерой. Поток азота должен быть отрегулирован таким образом, чтобы он не попадал ни в один из электродов. Наконец, пользователи должны убедиться, что мешалка не соприкасается с рабочим электродом, расположив рабочий электрод на 1-2 см выше мешалки. Если в OCV наблюдается неустойчивый сигнал, это обычно можно решить, обеспечив правильное размещение электродов и потока азота внутри реактора, а также проверив правильность и надежность соединений между проводами потенциостата и электродами реактора. Наконец, наш опыт показывает, что электронные медиаторы, такие как ДГНК, могут удерживаться в катионообменной мембране и вызывать высокий фоновый ток при слишком частом использовании. Мы рекомендуем заменять катионообменную мембрану после двух-трех использований, особенно при исследовании опосредованной ЭЭТ, чтобы гарантировать надежные экспериментальные результаты.
В отличие от прямой ЭЭТ, где прямое микробное прикрепление к электроду способствует переносу электронов, опосредованная ЭЭТ требует последовательной диффузии электронных челноков через клеточную мембрану и электрод, что приводит к уникальным настройкам BES, описанным здесь. Во-первых, мы выбрали двухкамерный BES вместо однокамерного аналога в нашем протоколе для разделения анодной и катодной реакций с помощью катионообменной мембраны. Такое разделение предотвращает перекрестное взаимодействие свободно диффундирующих электронных медиаторов (ДГНК) и микробов с катодом, гарантируя, что микробная ЭЭТ является основным источником электронов для восстановления электронных медиаторов и анода. Разделение также позволяет точно контролировать такие параметры, как концентрация/распределение медиатора и потенциал, уравновешенный аноду. Кроме того, мы выбрали углеродный войлок в качестве материала анода среди других вариантов, таких как графитовые стержни, металлические электроды, стекловидный углерод или оксид индия-олова (ITO). Это связано с тем, что 3D-пористая структура углеродного войлока обеспечивает гораздо большую площадь поверхности, чем электроды30, что позволяет эффективно использовать медиаторы даже при высоких концентрациях. Наши трехэлектродные, двухкамерные настройки BES обеспечивают надежное и воспроизводимое считывание опосредованной ЭЭТ даже при длительном мониторинге; Однако этот процесс имеет относительно низкую пропускную способность. Этот протокол подходит для понимания механизмов ЭЭТ в масштабе стенда или для тестирования прототипов приложений ЭЭТ. Альтернативные архитектуры BES, такие как портативные или печатные BES31,32, комплементарные матрицы металлооксидных полупроводников (CMOS)33 или масштабируемые BES34, могут быть рассмотрены исследователями для различных фундаментальных или прикладных целей.
В этом протоколе мы предоставляем подробные инструкции по наиболее часто используемым электрохимическим методам: хроноамперометрии (КА) и циклической вольтамперометрии (ХВ). Стоит отметить, что другие электрохимические методы, такие как электрохимическая импедансная спектроскопия (EIS) и дифференциальная импульсная вольтамперометрия (DPV), могут обеспечить более глубокое понимание BES путем анализа сопротивления переносу заряда и емкости двух слоев 35,36,37. В то время как этот протокол BES позволяет проводить измерения ЭЭТ, дополнение электрохимических данных измерениями метаболической активности и биомассы клеток также может иметь важное значение для всестороннего анализа. Микробы, такие как L. plantarum, взаимодействуют с ЭЭТ в качестве одного из поглотителей электронов наряду с другими побочными продуктами брожения, такими как лактат и этанол. Кроме того, следует отметить, что рост биомассы клеток также служит поглотителем электронов13. Таким образом, количественная оценка потребляемых доноров электронов (например, маннита), оценка роста биомассы клеток и мониторинг побочных продуктов ферментации позволяют глубже понять эффективность и физиологические последствия ЭЭТ. Клеточные метаболиты обычно количественно оцениваются с помощью хроматографии и ферментативных анализов, в то время как жизнеспособность и рост клеток оцениваются путем подсчета колониеобразующих единиц и измерения оптической плотности отработанных сред при длине волны 600 нм соответственно13. Также важно отметить, что измерения ЭЭТ чувствительны к небольшим возмущениям в экспериментальных условиях. Это включает, помимо прочего, pH, температуру, скорость перемешивания и скорость разбрызгивания газообразного азота38. Таким образом, нормализация измеренных уровней ЭЭТ с помощью биоаналитических измерений действует как внутренний контроль, способствуя согласованной оценке между экспериментами, проводимыми в разные дни.
Сочетая электрохимические методы с другими биоаналитическими измерениями, опосредованная ЭЭТ создает новые возможности для электроферментации и биоэлектрокатализа. Традиционное использование органических, неорганических или ферментативных электрокатализаторов сопряжено с трудностями из-за их высокой стоимости и склонности к разложению. С другой стороны, использование микробов в качестве живых электрокатализаторов является менее дорогим и более масштабируемым решениемблагодаря способности микробов к самовосстановлению и самовоспроизведению. L. plantarum, общепризнанная как безопасная молочнокислая бактерия, является особенно интригующим шасси. Используя идентичные электрохимические установки, описанные в этом протоколе, мы ранее показали, что L. plantarum может ферментировать сок капусты в условиях EET и ускорять метаболический поток в направлении производства большего количества конечных продуктов брожения, таких как лактат, ацетат и сукцинат13; Эти органические кислоты являются незаменимыми ароматическими соединениями при ферментации пищевых продуктов. Это означает, что при использовании электрохимических методов опосредованная ЭЭТ в L. plantarum потенциально может быть захвачена для манипулирования метаболическим потоком, изменения вкуса пищи или производства ценных химических веществ. Стоит отметить, что электрохимические методы, представленные в этом протоколе, могут быть применены не только к L. plantarum, но также могут быть применены к другим нативным или сконструированным микробам, которые выполняют опосредованную EET40,41. Различные электронные медиаторы, такие как флавин, ферроцен, нейтральный красный, феррицианид, лозон и менадион, могут быть выбраны на основе механизма переноса электронов конкретного используемого микроба22,42. Более того, протокол BES, установленный в этой работе, может быть распространен на экзоэлектрогены, которые осуществляют безмедиаторную ЭЭТ, как это было ранее продемонстрировано на видах Shewanella и Geobacter 43,44. Оптимизированная среда для выращивания должна использоваться для поддержки клеточной активности конкретного микроба, чтобы способствовать его производительности ЭЭТ. Этот протокол точно настраивает параметры для DHNA-опосредованной ЭЭТ у L. plantarum, но при применении других микробов и электронных медиаторов ожидаются изменения.
Раскрытие информации
У авторов нет конкурирующих интересов, о которых они могли бы заявить.
Благодарности
Мы благодарим сотрудников лаборатории Аджо-Франклина за содержательные обсуждения сборки, технического обслуживания, критических этапов и устранения неполадок BES. Исследование было спонсировано Армейским исследовательским офисом и выполнено в рамках гранта No W911NF-22-1-0239 (C. M. A-F, при поддержке R. A.) и от Техасского института профилактики и исследований рака, грант # RR190063 (C. M. A-F, при поддержке R. C., S. L. и B. B. K.). Рисунок 1 был создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
Ссылки
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены