需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微流体评估血小板功能
摘要
可以评估血流下的血小板功能,并且可以使用微流体设备模拟止血复苏,这在创伤和输血医学中具有应用。
摘要
微流体结合了模拟脉管系统的生理相关底物和流动,因此是研究血栓形成和止血方面的宝贵工具。在模拟动脉血流的高剪切环境中,微流控测定有助于研究血小板功能,因为富含血小板的血栓形成于流道的局部狭窄区域。利用允许小样本量的设备还可以帮助评估体积受限的患者样本或动物模型在流中的血小板功能。研究创伤患者样本或血小板产品输注后的样本可能有助于指导血小板功能至关重要的患者群体的治疗策略。在该模型中也可以研究通过药物抑制血小板的影响。该协议的目的是建立一个微流体平台,该平台结合了生理流动、生物表面和相关止血机制,以评估血小板功能,对创伤诱导的凝血病和输血医学的研究具有意义。
引言
创伤是导致全球死亡和残疾的主要原因。严重损伤通常并发于一种独特的内源性止血和血栓形成障碍,称为创伤性凝血病 (TIC)1。血小板在 TIC 中起关键作用,它们被描述为同时具有适应性和适应不良功能2。损伤后血小板功能障碍的机制尚不清楚,迫切需要更好地了解细胞反应,以指导改进复苏和治疗的发展。关于受伤后血小板功能的另一个棘手问题是创伤患者血小板功能当前读数可靠性的不确定性。
多项研究表明,即使是轻度受伤的患者,没有已知的临床出血表型,使用常规血小板功能测试(如凝集测定法)也会出现血小板功能异常 3,4。然而,在损伤情况下评估血小板功能的凝聚物测定法的局限性包括缺乏生理相关的损伤表面、激动剂刺激的还原方法、使用全血阻抗凝聚测定法稀释样本、使用光透射聚集测定法进行血浆分离以及停滞样本评估。此外,在损伤的情况下,血小板功能的这种敏感性是否代表真正的细胞功能障碍或测量伪影,例如基线电阻抗增加,仍不清楚2。因此,在创伤背景下研究相关的血小板功能对于理解 TIC 至关重要,并且在该领域有很大的创新和改进空间。
传统上用于研究血小板功能的平台不包括流体动力学和流动,这对于理解与创伤和创伤诱导的凝血病有关的血小板功能障碍可能至关重要5。依赖于血流的止血机制包括血管性血友病因子 (VWF) 在高剪切力下伸长,高于临界剪切速率,以及通过糖蛋白 1b捕获血小板 6,7,8,这些是通过停滞血小板功能测定法无法捕获的。此外,血小板根据流态优先结合 VWF 或纤维蛋白原,并在动脉血栓形成和静脉血栓形成中发挥不同的作用 9,10。动脉血栓主要由血小板组成,而静脉血栓主要由红细胞组成,部分基于流态11。结合流态的分析有助于阐明与 TIC 表型谱相关的功能障碍,从低凝状态和出血表型到高凝状态和血栓形成表型。最后,创伤患者群体的血容量采样限制可能使传统的血小板功能检测具有挑战性。虽然流式细胞术等检测方法可以而且应该在这些情况下使用,但结果通常描述样品的物理特性,而不是止血功能评估。
虽然在创伤中血小板功能障碍的机制可能尚不完全清楚,但在体外模拟血小板功能障碍,例如使用 P2Y12 拮抗剂,也有助于指导治疗干预的研究。止血复苏对于创伤患者至关重要,因为血液制品以 1:1:1 的单位比例以平衡的方式输注,以解决全血或血液成分(红细胞、血浆和血小板浓缩物)的休克、凝血病和内皮损伤 12,13,14。在创伤患者中,早期使用血液制品与提高生存率相关15,16。为了延长保质期,人们越来越多地研究冷藏的血小板产品。对冷藏血小板的检查显示止血活性增加,以及受伤后输血的安全性17,18。
冷储存血小板复苏的发展强调需要额外的测试,以了解可用于创伤的最有效血小板产品。然而,传统的血小板功能检测通常过度或不足以检测功能障碍,这既发生在接受治疗性血小板输注的创伤患者中,也发生在血小板贮积病变中看到的输血产品本身。鉴于当前血小板功能检测的局限性,包括大多数这些检测的静态性质,确定功能障碍的来源可能具有挑战性。因此,在研究 体外止血复苏时,受体和产物血小板群体的平台和检测方法对于确定最佳治疗干预措施至关重要。
微流体测试提供流量曲线和生物亲和表面,以创建研究血小板的生理相关分析。微流控装置可以定制以研究特定的病理生理学或损伤类型,例如血管穿刺19 或内皮损伤20。这些装置通常由聚二甲基硅氧烷 (PDMS) 组成,这些聚二甲基硅氧烷 (PDMS) 粘合到玻璃显微镜载玻片上,并带有表面改性,例如胶原蛋白,以模拟内皮下损伤和组织损伤。利用这些类型的基于流量的设备可以帮助指导与创伤相关的血小板功能障碍研究,并有助于检查改善血小板功能障碍的最佳输血医学方法。这些策略可能有助于澄清对静态血小板测定(例如聚集性测定法)在受伤患者中的相关性的现有混淆。
研究方案
所有研究均按照机构指南进行。获得了匹兹堡大学人类研究保护办公室的批准,并获得了健康人类志愿者的知情同意。
1. 微流控器件制备
- 要制造设备的 PDMS 部分,请通过计算机数控 (CNC) 微加工使用黄铜准备一个母模。
注意:根据通道尺寸,可以使用光刻技术创建母模。该协议中使用的设备包括八个平行的微机械通道,宽约 480 μm,设备入口和出口高 140 μm,设备狭窄处高 40 μm,进出狭窄区域的斜坡长度约为 0.3 mm。通道长度约为 6 mm。 - 获得母模后,将硅橡胶基(从弹性体套件中获得)倒入称重盘中。添加有机硅固化剂(从弹性体套件中获得),它有助于有机硅聚合物链的交联,以 10:1 的比例(碱剂)将液体 PDMS 转化为耐用且灵活的固体,并充分搅拌混合物。
- 将模具放入培养皿中,将未固化的 PDMS 倒入模具上。将培养皿放入真空干燥器中 30 分钟以去除气泡。
- 将 PDMS 放入设置为 70 °C 的烘箱中 90 分钟,完成母模中的 PDMS 固化。
- PDMS 完全固化后,使用剃须刀片或手术刀切出微流控石膏。在通道边缘打孔(两侧直径为 1.5 mm)。
- 使用实验室胶带清洁载玻片的表面和微流体铸件的蚀刻面。根据需要使用压缩空气清除残留的碎屑。
- 将载玻片和蚀刻面朝上的微流体铸件放入等离子清洁器中。启动真空泵,密封真空室,然后将等离子清洗机调至高设置。将玻片和 PDMS 留在等离子清洁器中 30 秒,然后关闭等离子清洁器并去除真空。
- 将等离子清洁器中正面朝上的侧面轻轻按压在一起,将等离子清洁的石膏和载玻片固定在一起。然后,将微流体装置放入 70 °C 的烘箱/热板中 10 分钟。
注意:将铸件和载玻片粘合在一起时,不要施加太大的压力,因为这可能会导致通道形态的损失。 - 用 10-30 μL 70% 乙醇冲洗每个腔室以消毒,并让微流体装置在 70 °C 热板上干燥。
注意:设备应至少提前 24 小时制作,但可以提前数周至数月制作。设备应储存在室温下的密封容器或有盖的培养皿中。 - 在使用微流体装置进行实验的前一天,用 10-30 μL 70% 乙醇重新冲洗每个腔室以消毒,并让微流体装置在 70 °C 的加热板上干燥。
- 用 1 型马原纤维胶原试剂 (1 mg/mL) 包被腔室,用 0.9% NaCl 以 1:5 的体积比例稀释,通过指定的出口到指定的入口。确保在实验中保持方向性。将装置存放在温暖、潮湿的密闭容器中,以防止涂层的胶原蛋白在通道内蒸发。
- 1 小时后,用磷酸盐缓冲盐水 (PBS) 冲洗以冲洗出胶原蛋白溶液。沿涂层的相反方向冲洗。不使用时,请将设备再次存放在温暖、潮湿、密闭的容器中。
2. 血液样本制备
- 通过静脉穿刺获得柠檬酸盐全血样本。将柠檬酸全血与 FC 受体阻断溶液 (1:600) 一起孵育。
注意:血液样品在实验前和实验期间储存在室温下。 - 将柠檬酸全血与荧光偶联(使用所选荧光团)CD41 抗体 (1:600) 一起孵育。在章动摇杆上染色 30 分钟。
- 作为血小板抑制的阳性对照,添加替格瑞洛,一种 P2Y12 受体拮抗剂,在 PBS 中 30% w/v 2-羟丙基-β-环糊精 (HP-β-CD) 溶液中重构。
注意:应制备高达 6.4 mM 的替格瑞洛储备液,并且可以在实验前在 HP-β-CD 溶液(30% HP-β-CD 溶于 PBS)中进一步稀释替格瑞洛储备液(推荐 1,000x 储备浓度)。 - 将柠檬酸盐样品与替格瑞洛(终浓度高达 6.4 μM)孵育 30 分钟,以观察血小板抑制。
- 如果将血液制品与柠檬酸盐样品混合,则用 FC 受体阻断液 (1:600) 和荧光偶联物(使用单独且不同的荧光团对柠檬酸盐样品)CD41 抗体 (1:600) 对血液制品进行染色。
- 将输注产品单位的体积当量与柠檬酸盐样品混合。例如,为了模拟将 2 个单位的血小板产品输注到出血者体内(每个产品大约 250 mL,总血容量为 5,000 mL),将 100 μL 血液制品混合到 1,000 μL 柠檬酸盐血样中。
- 实验前,立即通过 40 μm 过滤器将血液样品过滤到无菌 1.5 mL 微量离心管中。
3. 流式血小板功能检测(方法 1)
- 打开显微镜和相关软件。
- 使用显微镜的载物台设置撤取注射泵水平。调整注射泵的设置。
- 使用方程 (1) 和 (2)21 计算通道狭窄区域所需平均壁剪切速率 (γ) 为 3,500 s -1 的体积流速 (Q)。
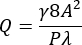 (1)
(1)
 (2)
(2)
其中 A 是通道的横截面积,P 是润湿周长,λ 是形状因子,b 是矩形的短边(高度),a 是矩形的长边(宽度)。
注:由于 VWF 临界剪切,选择了 3,500 s-1 的值,并且处于动脉状态 7,22,23。
- 使用方程 (1) 和 (2)21 计算通道狭窄区域所需平均壁剪切速率 (γ) 为 3,500 s -1 的体积流速 (Q)。
- 将微流体装置放在显微镜载物台上。将微流体装置的边缘粘在载物台上以避免移动。确保出口朝向显微镜的背面。
- 将 1/16 英寸 ID 管(约 30 cm 长)的一端连接到弯头连接器,另一端连接到带有 1/16 英寸 ID 连接器的 10 mL 注射器。
- 用无菌 PBS 填充注射器并将其连接到注射泵。
- 将弯头连接器放入设备插座中。
- 准备约 10 厘米长的入口管路,一端是弯头连接器,另一端是斜切口。
- 将入口弯头连接器连接到设备入口。
- 将入口管路放入位于倾斜支架上的废微量离心管中。
- 将 10 倍物镜用于宽度约为 500 μm 的通道尺寸,并专注于微流体器件通道边缘。
- 用 PBS 灌注管路,并通过手动推进注射泵清除通道中的任何 PDMS/碎屑。请务必检查通道入口和出口附近。
- 打开保存的图像捕获设置或为每 1-2 秒捕获一次的时间序列图像创建图像捕获程序,其中包含与血液样本中使用的荧光 CD41 抗体相对应的明场通道和荧光通道。
- 获得过滤的柠檬酸盐血液样品,并在实验前通过上下吹打混合。将样品放在倾斜的微量离心机支架上。
- 将入口管路定位到样品中。
- 开始录制图像捕获。
- 慢慢地抽出注射器以填充管道中的死体积。血液到达通道后,立即点击注射泵上的 播放 按钮,以所需的剪切速率恢复流速。
- 如果需要,请调整焦距。
- 运行实验,直到血小板完全阻塞微流体装置的狭窄区域或直到实验终点(即 10 分钟)。
- 确保在实验期间将入口管浸没在血液样品中。
- 实验完成后,停止图像捕获并停止注射泵。保存图像捕获。
- 拆下入口弯头连接器,将管路内容物倒入废液锥形瓶中。将注射器和出口管路的内容物也倒入废锥形中。
- 根据需要更换后续样品的入口和出口连接器以及管路。
4. 小体积样品(低于 1 mL)在流式下进行血小板功能检测(方法 2)
- 重复上述步骤 1.1 到 1.4。
- 在通道边缘打一个直径为 1.5 mm 的出口,直径为 3 mm 的入口。
- 重复上述步骤 1.6 到 3.6。
- 将 10 倍物镜用于宽度约为 500 μm 的通道尺寸,并专注于微流体器件通道边缘。
- 通过手动推进注射泵并用实验室擦拭擦去通路液体,清除通道中的任何 PDMS/碎屑。用微流体设备顶部的实验室胶带清除任何碎屑。
- 手动推进泵,用 PBS 填充 3 mm 入口储液罐。
- 打开保存的图像捕获设置或为每 1-2 秒捕获一次的时间序列图像创建图像捕获程序,其中包含与血液样本中使用的荧光 CD41 抗体相对应的明场通道和荧光通道。
- 开始在注射泵上取样(手动或以设定速度),一旦 PBS 进入通道并且储液槽中的填充线下降,暂停泵上的取样。
- 用移液管从储液槽中去除多余的 PBS。
- 开始图像捕获。
- 将血液样品移液到储液槽中(约 40 μL),然后立即启动撤液注射器。确保 flow 启动。
注意:如果在步骤 4.8 中未灌注用于抽取的注射泵电机,则流不会立即开始,应重复实验。 - 在实验期间重新填充储血器,确保没有气穴进入通道。
- 运行实验,直到血小板完全阻塞微流体装置的狭窄区域或直到实验终点(即 10 分钟)。
- 实验完成后,停止图像捕获并停止注射泵。保存图像捕获。
- 通过移液去除储液器中多余的血液。将抽取管的内容物排空到废锥形管中。
- 根据需要更换连接器和管路,以便后续采样。
5. 去污
- 冲洗到 10% 漂白剂溶液中,清除血液的入口和出口管路。
- 如果微流体设备上的所有通道都已使用,则将设备丢弃在 Sharps 生物危害性废物容器中。
注意:所有生物废物都应在生物危害废物中妥善处理。
6. 图像分析
- 使用软件从动力学实验中导出图像,方法是单击 文件 |导出/导入 |导出。
- 选择以下参数:文件类型:标记图像文件格式 (TIFF);压缩:LZW;检查 原始数据 和 移动像素;取消选中 Apply display curve and channel color;选中 定义子集 (区域、矩形区域,然后选择在条件之间具有 Conserve width 和 height 测量值的通道区域)。导出到所需的文件夹并选中 Create folder.
- 请注意软件上的以下实验值:血液进入通道时的开始帧;帧速率 (Info, Time Series)。
- 使用补充文件 1 中提供的 Matlab 代码测量实验中每帧的标准化平均荧光强度,更改每个实验的以下输入:基于实验长度的开始帧/结束帧(确保实验长度在条件之间保持一致);实验名称/文件夹名称;裁剪 X、Y、H 和 W 参数。对受体血小板荧光通道和产物血小板荧光通道运行一次代码。报告标准化的 MFI(第 2 列)和标准化的 AUC 值(标准化到起始帧)。从标准化 AUC 值中减去实验长度值。
结果
使用该方法后的微流体实验应显示流道狭窄区域形成富含血小板的血栓(图 1)。 图 1A 说明了功能性血小板在通道的狭窄区域形成血栓以阻止血液流经通道的代表性结果。在实验期间拍摄的动力学图像的平均荧光强度 (MFI) 曲线说明了生长血栓中血小板掺入的滞后、生长和平台期(图 2A、C...
讨论
上述协议有一些关键步骤来确保实验的可靠性和可重复性。首先,应仔细考虑荧光抗体。用于检测样品中血小板的抗体不应阻断糖蛋白 Ib (GPIb) 血小板受体的功能。实验之间尽可能进行批次匹配对于确保荧光信号的可重复性也至关重要。该方案的另一个关键步骤是尽可能使用无菌耗材和溶液以及过滤样品。在实验前立即过滤血液样本将防止大于通道尺寸的碎片或血小板...
披露声明
作者没有需要声明的利益冲突。
致谢
作者感谢所有参与的献血者,以及创伤和输血医学研究实验室的抽血师和 UPMC Montefiore 临床和转化研究中心在采集方面的帮助。K25HL161401 支持 SMS。MDN 由 1R01HL166944-01A1 支持。
材料
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
参考文献
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。