Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microfluídica en la evaluación de la función plaquetaria
En este artículo
Resumen
Se puede evaluar la función plaquetaria bajo flujo y se puede modelar la reanimación hemostática simulada utilizando un dispositivo microfluídico, que tiene aplicaciones en medicina traumatológica y transfusional.
Resumen
La microfluídica incorpora sustratos y flujos fisiológicamente relevantes que imitan la vasculatura y, por lo tanto, son una herramienta valiosa para estudiar aspectos de la trombosis y la hemostasia. En entornos de alto cizallamiento que simulan el flujo arterial, un ensayo microfluídico facilita el estudio de la función plaquetaria, ya que se forman trombos ricos en plaquetas en una región estenótica localizada de un canal de flujo. El uso de dispositivos que permiten un volumen de muestra pequeño también puede ayudar a evaluar la función plaquetaria bajo flujo de muestras de pacientes de volumen limitado o modelos animales. El estudio de muestras de pacientes con traumatismos o muestras después de una transfusión de productos plaquetarios puede ayudar a dirigir estrategias terapéuticas para las poblaciones de pacientes en las que la función plaquetaria es crítica. En este modelo también se pueden estudiar los efectos de la inhibición plaquetaria a través de agentes farmacológicos. El objetivo de este protocolo es establecer una plataforma microfluídica que incorpore el flujo fisiológico, las superficies biológicas y los mecanismos hemostáticos relevantes para evaluar la función plaquetaria con implicaciones para el estudio de la coagulopatía inducida por trauma y la medicina transfusional.
Introducción
El trauma es una de las principales causas mundiales de muerte y discapacidad. La lesión grave se complica frecuentemente por una alteración endógena única de la hemostasia y la trombosis, denominada coagulopatía inducida por trauma (TIC)1. Las plaquetas juegan un papel crítico en las TIC, y se ha descrito que tienen funciones tanto adaptativas como desadaptativas2. Los mecanismos de la disfunción plaquetaria después de una lesión siguen sin estar claros, y existe una necesidad crítica de comprender mejor la respuesta celular para guiar el desarrollo de una mejor reanimación y terapia. Un problema molesto adicional con respecto a la función plaquetaria después de una lesión es la incertidumbre de la confiabilidad de las lecturas actuales de la función plaquetaria en el paciente con trauma.
Múltiples estudios han demostrado que incluso los pacientes con lesiones leves, sin fenotipo de sangrado clínico conocido, tienen una función plaquetaria anormal utilizando pruebas convencionales de función plaquetaria como la aggregometría 3,4. Sin embargo, las limitaciones de la agregación para evaluar la función plaquetaria en un entorno de lesión incluyen la falta de superficie de lesión fisiológicamente relevante, un enfoque reduccionista de la estimulación agonista, la dilución de la muestra con aggregometría de impedancia de sangre completa, la separación de plasma con agregación de transmisión óptica de luz y la evaluación de muestras estancadas. Además, aún no está claro si esta sensibilidad de la función plaquetaria representa una verdadera disfunción celular o un artefacto de medición, como el aumento de la impedancia eléctrica basal, en el contexto de la lesión2. Por lo tanto, el estudio de las funciones plaquetarias relevantes en el contexto del trauma es crucial para comprender las TIC, y existe un espacio sustancial para la innovación y la mejora en esta área.
Las plataformas tradicionalmente utilizadas para estudiar la función plaquetaria no incluyen la dinámica de fluidos y el flujo, lo que puede ser crítico para comprender la disfunción plaquetaria relacionada con el trauma y la coagulopatía inducida por el trauma5. Los mecanismos de hemostasia que dependen del flujo incluyen la elongación del factor de von Willebrand (VWF) a alto cizallamiento, por encima de una tasa de cizallamiento crítica, y la captura de plaquetas a través de la glicoproteína 1b 6,7,8, que no se capturan mediante ensayos de función plaquetaria estancada. Además, las plaquetas se unen preferentemente al FVW o al fibrinógeno dependiendo del régimen de flujo y provocan funciones diferenciales en la trombosis arterial frente a la venosa 9,10. Los trombos arteriales están compuestos principalmente por plaquetas, mientras que los trombos venosos están compuestos principalmente por glóbulos rojos, basados, en parte, en regímenes de flujo11. Los ensayos que incorporan regímenes de flujo pueden ayudar a dilucidar las disfunciones relacionadas con el espectro de fenotipos de TIC, desde la hipocoagulabilidad y los fenotipos de sangrado hasta la hipercoagulabilidad y los fenotipos trombóticos. Por último, las limitaciones del muestreo del volumen sanguíneo en poblaciones de pacientes con traumatismos pueden dificultar las pruebas tradicionales de la función plaquetaria. Si bien los ensayos como la citometría de flujo pueden y deben utilizarse en estas circunstancias, los resultados a menudo describen una caracterización física de una muestra y no una evaluación funcional hemostática.
Si bien es posible que los mecanismos de la disfunción plaquetaria no se comprendan completamente en el trauma, el modelado de la disfunción plaquetaria in vitro, con antagonistas de P2Y12, por ejemplo, también puede ayudar a guiar el estudio de las intervenciones terapéuticas. La reanimación hemostática es de vital importancia en pacientes con traumatismos en los que los productos sanguíneos se transfunden en un enfoque equilibrado para tratar el shock, la coagulopatía y la lesión endotelial con sangre completa o componentes sanguíneos (glóbulos rojos, plasma y concentrados de plaquetas) en una proporción unitaria de 1:1:1 12,13,14. En pacientes traumatizados, el uso precoz de hemoderivados se asocia con una mejor supervivencia15,16. Para prolongar la vida útil, los productos de plaquetas almacenados en frío se han estudiado cada vez más. El examen de las plaquetas almacenadas en frío muestra un aumento de la actividad hemostática, así como seguridad cuando se transfunden después de una lesión17,18.
La evolución de la reanimación plaquetaria almacenada en frío enfatiza la necesidad de pruebas adicionales para comprender el producto plaquetario más eficaz disponible para el traumatismo. Sin embargo, los ensayos tradicionales de función plaquetaria a menudo están sobrepotenciados o infrapotenciados para detectar disfunciones, que ocurren tanto en el paciente con trauma que recibe una transfusión terapéutica de plaquetas como en el propio producto transfundido que se observa en las lesiones de almacenamiento de plaquetas. Determinar el origen de la disfunción puede ser un desafío, dadas las limitaciones de los ensayos actuales de función plaquetaria, incluida la naturaleza estática de la mayoría de estas pruebas. Por lo tanto, cuando se estudia la reanimación hemostática in vitro, la plataforma y los métodos de detección tanto para las poblaciones de plaquetas receptoras como para las del producto son de vital importancia para determinar las intervenciones terapéuticas óptimas.
Las pruebas microfluídicas ofrecen perfiles de flujo y superficies biofidélicas para crear un ensayo fisiológicamente relevante en el que estudiar las plaquetas. Los dispositivos microfluídicos se pueden personalizar para estudiar la fisiopatología particular o los tipos de lesiones, como la punción de vasos19 o el daño endotelial20. Estos dispositivos generalmente se componen de polidimetilsiloxano (PDMS) unido a un portaobjetos de microscopio de vidrio con modificaciones en la superficie, como el colágeno, para imitar la lesión subendotelial y tisular. El uso de estos tipos de dispositivos basados en flujo puede ayudar a guiar la investigación de la disfunción plaquetaria relacionada con el trauma y ayudar a examinar los enfoques óptimos de la medicina transfusional para mejorar la disfunción plaquetaria. Estas estrategias pueden ayudar a aclarar la confusión existente sobre la relevancia de los ensayos estáticos de plaquetas, como la aggregometría, en el paciente lesionado.
Protocolo
Toda la investigación se realizó de acuerdo con las directrices institucionales. Se obtuvo la aprobación de la Oficina de Protección de la Investigación Humana de la Universidad de Pittsburgh y el consentimiento informado de voluntarios humanos sanos.
1. Preparación del dispositivo microfluídico
- Para fabricar la parte PDMS del dispositivo, prepare un molde maestro con latón a través de micromecanizado de control numérico (CNC) por computadora.
NOTA: Dependiendo de las dimensiones del canal, se pueden utilizar técnicas de fotolitografía para crear un molde maestro. El dispositivo utilizado en este protocolo incluye ocho canales micromecanizados paralelos de aproximadamente 480 μm de ancho, 140 μm de alto en la entrada y salida del dispositivo, y 40 μm de alto en la estenosis del dispositivo, con una longitud de rampa hacia/desde la región estenótica de aproximadamente 0,3 mm. Las longitudes de los canales son de aproximadamente 6 mm. - Con un molde maestro obtenido, vierta la base de elastómero de silicona (obtenida del kit de elastómero) en un plato de pesaje. Añadir el Agente de Curado de Silicona (obtenido del kit de elastómeros), que facilita la reticulación de las cadenas de polímeros de silicona para transformar el PDMS líquido en un sólido duradero y flexible, en una proporción de 10:1 (agente base) y agitar bien la mezcla.
- Coloque el molde en una placa de Petri y vierta el PDMS sin curar en el molde. Coloque la placa de Petri dentro de un desecador de vacío durante 30 minutos para eliminar las burbujas.
- Termine de curar el PDMS en el molde maestro colocándolo en un horno a 70 °C durante 90 min.
- Después de completar el curado del PDMS, corte el yeso microfluídico con una cuchilla de afeitar o un bisturí. Perfore agujeros en los bordes de los canales (1,5 mm de diámetro en ambos lados).
- Con cinta de laboratorio, limpie la superficie de un portaobjetos de vidrio y el lado grabado del molde microfluídico. Utilice aire comprimido según sea necesario para eliminar los residuos restantes.
- Coloque el portaobjetos de vidrio y el molde microfluídico con el lado grabado hacia arriba en un limpiador de plasma. Encienda la bomba de vacío, selle la cámara y encienda el limpiador de plasma a la configuración alta. Deje el portaobjetos y el PDMS en el limpiador de plasma durante 30 s, luego apague el limpiador de plasma y retire la aspiradora.
- Une el molde y el portaobjetos de vidrio limpiados con plasma presionando suavemente los lados que estaban boca arriba en el limpiador de plasma. A continuación, coloque el dispositivo microfluídico en un horno/placa calefactora a 70 °C durante 10 min.
NOTA: No aplique demasiada presión al unir la corredera de fundición y vidrio, ya que eso podría provocar una pérdida en la morfología del canal. - Enjuague cada cámara con 10-30 μL de etanol al 70% para esterilizar y deje que el dispositivo microfluídico se seque en una placa calefactora a 70 °C.
NOTA: Los dispositivos deben fabricarse con al menos 24 horas de anticipación, pero pueden fabricarse con semanas o meses de anticipación. Los dispositivos deben almacenarse en un recipiente hermético o en una placa de Petri cubierta a temperatura ambiente. - El día antes de la experimentación con el dispositivo microfluídico, vuelva a enjuagar cada cámara con 10-30 μL de etanol al 70% para esterilizar y deje que el dispositivo microfluídico se seque en una placa calefactora a 70 °C.
- Cubra la cámara con reactivo de colágeno fibrilar equino tipo 1 (1 mg/mL), diluido en NaCl al 0,9% en una proporción volumétrica de 1:5 a través de una salida designada a la entrada designada. Asegúrese de que se conserva la direccionalidad dentro de un experimento. Guarde el dispositivo en un recipiente cerrado cálido y húmedo para evitar la evaporación del colágeno recubierto dentro del canal.
- Después de 1 hora, enjuague con solución salina tamponada con fosfato (PBS) para eliminar la solución de colágeno. Enrasar en la dirección opuesta al recubrimiento. Cuando no esté en uso, guarde el dispositivo nuevamente en un recipiente cálido, húmedo y cerrado.
2. Preparación de la muestra de sangre
- Obtener una muestra de sangre entera cirada mediante venopunción. Incubar sangre entera cirada con solución bloqueadora del receptor FC (1:600).
NOTA: Las muestras de sangre se almacenan a temperatura ambiente antes y durante la experimentación. - Incubar sangre entera cirada con anticuerpo CD41 conjugado con fluorescencia (usando un fluoróforo de elección) (1:600). Teñir durante 30 minutos sobre un balancín nutante.
- Como control positivo para la inhibición plaquetaria, añadir Ticagrelor, un antagonista del receptor P2Y12 reconstituido en una solución de 2-hidroxipropil-β-ciclodextrina al 30% p/v (HP-β-CD) en PBS.
NOTA: Se deben preparar existencias de Ticagrelor de hasta 6,4 mM y se puede realizar una dilución adicional de las existencias de Ticagrelor en una solución de HP-β-CD (30% de HP-β-CD disuelto en PBS) antes de la experimentación (se recomiendan concentraciones de existencias de 1.000x). - Incubar la muestra cirada con ticagrelor (concentración final de hasta 6,4 μM) durante 30 min para observar la inhibición plaquetaria.
- Si mezcla el producto sanguíneo con la muestra citada, tiña el producto sanguíneo con una solución bloqueadora del receptor FC (1:600) y un anticuerpo CD41 conjugado con fluorescencia (utilizando un fluoróforo separado y distinto a la muestra citrada) (1:600).
- Mezclar un equivalente volumétrico de las unidades de producto transfundido con la muestra citada. Por ejemplo, para simular 2 unidades de productos plaquetarios transfundidos a una persona con hemorragia (aproximadamente 250 ml por producto en un volumen total de sangre de 5.000 ml), mezcle 100 μl de producto sanguíneo en 1.000 μl de muestra de sangre citrada.
- Inmediatamente antes de la experimentación, filtre la muestra de sangre a través de un filtro de 40 μm en un tubo de microcentrífuga estéril de 1,5 mL.
3. Pruebas de función plaquetaria bajo flujo (Método 1)
- Encienda el microscopio y el software asociado.
- Ajuste la bomba de jeringa de extracción al nivel de la platina del microscopio. Ajuste la configuración de la bomba de jeringa.
- Calcule un caudal volumétrico (Q) para un caudal de cortante de pared promedio deseado (γ) de 3.500 s-1 en la región estenótica del canal utilizando las ecuaciones (1) y (2)21.
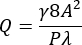 (1)
(1)
 (2)
(2)
Donde A es el área de la sección transversal del canal, P es el perímetro mojado, λ es el factor de forma, b es el lado corto del rectángulo (altura) y a es el lado largo del rectángulo (ancho).
NOTA: Se elige el valor de 3.500 s-1 debido al cizallamiento crítico del FVW y se encuentra en el régimen arterial 7,22,23.
- Calcule un caudal volumétrico (Q) para un caudal de cortante de pared promedio deseado (γ) de 3.500 s-1 en la región estenótica del canal utilizando las ecuaciones (1) y (2)21.
- Coloque el dispositivo microfluídico en la platina del microscopio. Pega los bordes del dispositivo microfluídico a la platina para evitar que se muevan. Asegúrese de que el tomacorriente esté orientado hacia la parte posterior del microscopio.
- Conecte un extremo de un tubo de 1/16" de diámetro interno (aproximadamente 30 cm de largo) a un conector de codo y el otro extremo a una jeringa de 10 ml con un conector de 1/16" de diámetro interior.
- Llene la jeringa con PBS estéril y conéctela a la bomba de jeringa.
- Coloque el conector de codo en la toma de corriente del dispositivo.
- Prepare las líneas de entrada de aproximadamente 10 cm de largo con el conector de codo en un extremo y el corte en ángulo en el otro extremo.
- Conecte el conector del codo de entrada a la entrada del dispositivo.
- Coloque la línea de entrada en un tubo de microcentrífuga de residuos en un soporte en ángulo.
- Utilice el objetivo 10x para dimensiones de canal de aproximadamente 500 μm de ancho y concéntrese en los bordes del canal del dispositivo microfluídico.
- Prepare las líneas con PBS y limpie el canal de cualquier PDMS/residuo avanzando la bomba de jeringa manualmente. Asegúrese de verificar cerca de la entrada y salida del canal.
- Abra la configuración de captura de imágenes guardada o cree un procedimiento de captura de imágenes para imágenes de series temporales capturadas cada 1-2 s con un canal de campo claro y canales fluorescentes correspondientes a los anticuerpos fluorescentes CD41 utilizados en la muestra de sangre.
- Obtenga la muestra de sangre citrada filtrada y mezcle pipeteando hacia arriba y hacia abajo justo antes del experimento. Coloque la muestra en el soporte de microcentrífuga en ángulo.
- Coloque la línea de entrada en la muestra.
- Comience a grabar la captura de la imagen.
- Lentamente, retire la jeringa para llenar el volumen muerto en el tubo. Una vez que la sangre llegue al canal , presione inmediatamente reproducir en la bomba de jeringa para reanudar el flujo a la velocidad de cizallamiento deseada.
- Ajuste el enfoque si es necesario.
- Realice el experimento hasta que las plaquetas hayan ocluido completamente la región estenótica del dispositivo microfluídico o hasta un punto final experimental (es decir, 10 minutos).
- Asegúrese de que el tubo de entrada esté sumergido en la muestra de sangre durante todo el experimento.
- Una vez finalizado el experimento, detenga la captura de la imagen y detenga la bomba de jeringa. Guarde la captura de imagen.
- Retire el conector del codo de entrada y vacíe el contenido del tubo en un cónico de desechos. Vacíe también el contenido de la jeringa y las líneas de salida en el cónico de desechos.
- Reemplace los conectores de entrada y salida y los tubos según sea necesario para muestras posteriores.
4. Pruebas de función plaquetaria bajo flujo con muestras de bajo volumen (menos de 1 mL) (Método 2)
- Repita los pasos 1.1 a 1.4 como se indicó anteriormente.
- Perfore una salida de 1,5 mm de diámetro y una entrada de 3 mm de diámetro en los bordes de los canales.
- Repita los pasos 1.6 a 3.6 como se indicó anteriormente.
- Utilice el objetivo 10x para dimensiones de canal de aproximadamente 500 μm de ancho y concéntrese en los bordes del canal del dispositivo microfluídico.
- Limpie el canal de cualquier PDMS/residuo haciendo avanzar la bomba de jeringa manualmente y absorbiendo el líquido de acceso con una toallita de laboratorio. Retire cualquier residuo con cinta de laboratorio en la parte superior del dispositivo microfluídico.
- Avance manualmente la bomba para llenar el depósito de entrada de 3 mm con PBS.
- Abra la configuración de captura de imágenes guardada o cree un procedimiento de captura de imágenes para imágenes de series temporales capturadas cada 1-2 s con un canal de campo claro y canales fluorescentes correspondientes a los anticuerpos fluorescentes CD41 utilizados en la muestra de sangre.
- Inicie la extracción en la bomba de jeringa (manualmente o con la velocidad establecida) y una vez que el PBS avance hacia el canal y la línea de llenado en el depósito esté bajando, detenga la extracción en la bomba.
- Retire el exceso de PBS del depósito con una pipeta.
- Inicie la captura de la imagen.
- Pipetear la muestra de sangre en el depósito (aproximadamente 40 μL) e inmediatamente poner en marcha la jeringa de extracción. Asegúrese de que se inicie el flujo.
NOTA: Si el motor de la bomba de jeringa para la extracción no se cebó en el paso 4.8, el flujo no comenzará inmediatamente y se debe repetir el experimento. - Vuelva a llenar el depósito de sangre durante el experimento, asegurándose de que no entren bolsas de aire en el canal.
- Ejecute el experimento hasta que las plaquetas hayan ocluido completamente la región estenótica del dispositivo microfluídico o hasta un punto final experimental (es decir, 10 minutos).
- Una vez finalizado el experimento, detenga la captura de imágenes y detenga la bomba de jeringa. Guarde la captura de imagen.
- Elimine el exceso de sangre en el depósito mediante pipeteo. Vacíe el contenido del tubo de extracción en un tubo cónico de desecho.
- Reemplace los conectores y los tubos según sea necesario para muestras posteriores.
5. Descontaminación
- Limpie las líneas de entrada y salida de sangre enjuagándolas en una solución de lejía al 10%.
- Si se han utilizado todos los canales del dispositivo microfluídico, deseche el dispositivo en el contenedor de residuos biopeligrosos de Sharps.
NOTA: Todos los desechos biológicos deben eliminarse adecuadamente en los desechos de riesgo biológico.
6. Análisis de imágenes
- Exporte las imágenes de los experimentos cinéticos utilizando software haciendo clic en Archivo | Exportación/Importación | Exportación.
- Seleccione los siguientes parámetros: tipo de archivo: Formato de archivo de imagen etiquetada (TIFF); compresión: LZW; verifique los datos originales y el píxel de desplazamiento; desmarque Aplicar curva de visualización y color de canal; marque Definir subconjunto (región, región rectangular y seleccione el área del canal con una medición de anchura y altura de conservación entre condiciones). Exporte a la carpeta deseada y marque Crear carpeta.
- Tenga en cuenta los siguientes valores experimentales en el software: cuadro de inicio cuando la sangre ingresa al canal; velocidad de fotogramas (Info, Series temporales).
- Mida la intensidad de fluorescencia media normalizada de cada fotograma en un experimento utilizando el código de Matlab proporcionado como Archivo Suplementario 1, cambiando las siguientes entradas para cada experimento: fotograma inicial/fotograma final en función de la longitud del experimento (asegúrese de que la longitud del experimento se conserve entre condiciones); nombre del experimento/nombre de la carpeta; recorte de los parámetros X, Y, H y W. Ejecute el código una vez para el canal fluorescente de plaquetas del receptor y una vez para el canal fluorescente de plaquetas del producto. Informe de los valores de MFI normalizados (columna 2) y AUC normalizados (normalizados a la trama de inicio). Reste el valor de longitud del experimento del valor de AUC normalizado.
Resultados
Los experimentos microfluídicos posteriores al uso de este método deberían mostrar la formación de trombos ricos en plaquetas en la región de estenosis del canal de flujo (Figura 1). La figura 1A ilustra resultados representativos en los que las plaquetas funcionales formaron un trombo en la región estenótica del canal para bloquear el flujo sanguíneo a través del canal. Las curvas de intensidad media de fluorescencia (...
Discusión
El protocolo anterior tiene algunos pasos críticos para garantizar la fiabilidad y la reproducibilidad de los experimentos. En primer lugar, los anticuerpos fluorescentes deben considerarse cuidadosamente. Los anticuerpos utilizados para detectar plaquetas en la muestra no deben bloquear la función del receptor plaquetario de la glicoproteína Ib (GPIb). La coincidencia de lotes, siempre que sea posible entre experimentos, también es fundamental para garantizar la reproducibilidad de ...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Los autores reconocen y agradecen a todos los donantes de sangre que participaron, así como a los flebotomistas del Laboratorio de Investigación de Medicina Traumatológica y Transfusional y al Centro de Investigación Clínica y Traslacional Montefiore del UPMC por su ayuda en las recolecciones. Los SMS son compatibles con K25HL161401. MDN es compatible con 1R01HL166944-01A1.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Referencias
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados