Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Trombosit Fonksiyonunun Değerlendirilmesinde Mikroakışkanlar
Bu Makalede
Özet
Akış altındaki trombosit fonksiyonu değerlendirilebilir ve simüle edilmiş hemostatik resüsitasyon, travma ve transfüzyon tıbbında uygulamaları olan bir mikroakışkan cihaz kullanılarak modellenebilir.
Özet
Mikroakışkanlar, vaskülatürü taklit eden fizyolojik olarak ilgili substratları ve akışları içerir ve bu nedenle tromboz ve hemostazın yönlerini incelemek için değerli bir araçtır. Arteriyel akışı simüle eden yüksek kesme ortamlarında, bir akış kanalının lokalize stenotik bölgesinde trombositten zengin trombüs oluştuğundan, mikroakışkan bir test trombosit fonksiyonunun incelenmesini kolaylaştırır. Küçük numune hacmine izin veren cihazların kullanılması, hacim sınırlı hasta numunelerinden veya hayvan modellerinden gelen akış altında trombosit fonksiyonunun değerlendirilmesine de yardımcı olabilir. Travma hastası örneklerini veya trombosit ürün transfüzyonunu takiben alınan örnekleri incelemek, trombosit fonksiyonunun kritik olduğu hasta popülasyonları için terapötik stratejilerin yönlendirilmesine yardımcı olabilir. Farmakolojik ajanlar yoluyla trombosit inhibisyonunun etkileri de bu modelde incelenebilir. Bu protokolün amacı, travmaya bağlı koagülopati ve transfüzyon tıbbı çalışmaları için çıkarımlarla trombosit fonksiyonunu değerlendirmek için fizyolojik akışı, biyolojik yüzeyleri ve ilgili hemostatik mekanizmaları içeren mikroakışkan bir platform oluşturmaktır.
Giriş
Travma, önde gelen küresel bir ölüm ve sakatlık nedenidir. Ciddi yaralanma sıklıkla travmaya bağlı koagülopati (TIC) olarak adlandırılan benzersiz, endojen bir hemostaz ve tromboz bozukluğu ile komplike hale gelir1. Trombositler TIC'de kritik bir rol oynar ve hem adaptif hem de maladaptif fonksiyonlara sahip olarak tanımlanmıştır2. Yaralanma sonrası trombosit disfonksiyonunun mekanizmaları belirsizliğini korumaktadır ve gelişmiş resüsitasyon ve tedavinin geliştirilmesine rehberlik etmek için hücresel yanıtı daha iyi anlamak için kritik bir ihtiyaç vardır. Yaralanma sonrası trombosit fonksiyonu ile ilgili ek bir can sıkıcı sorun, travma hastasında trombosit fonksiyonunun mevcut okumalarının güvenilirliğinin belirsizliğidir.
Çok sayıda çalışma, bilinen bir klinik kanama fenotipi olmayan hafif yaralı hastaların bile agregometri 3,4 gibi geleneksel trombosit fonksiyon testleri kullanılarak anormal trombosit fonksiyonuna sahip olduğunu göstermiştir. Bununla birlikte, bir yaralanma ortamında trombosit fonksiyonunu değerlendirmek için agregometrideki sınırlamalar arasında fizyolojik olarak ilgili yaralanma yüzeyinin eksikliği, agonist stimülasyonuna indirgemeci bir yaklaşım, tam kan empedans agregometrisi ile numune seyreltmesi, optik ışık iletim agregometrisi ile plazma ayrılması ve durgun numune değerlendirmesi yer alır. Ek olarak, trombosit fonksiyonunun bu duyarlılığının gerçek hücresel disfonksiyonu mu yoksa yaralanma ortamında artmış temel elektrik empedansı gibi bir ölçüm artefaktını mı temsil ettiği belirsizliğini korumaktadır2. Bu nedenle, travma bağlamında ilgili trombosit fonksiyonlarını incelemek, TIC'yi anlamak için çok önemlidir ve bu alanda yenilik ve iyileştirme için önemli bir alan vardır.
Geleneksel olarak trombosit fonksiyonunu incelemek için kullanılan platformlar, travma ve travmaya bağlı koagülopati ile ilgili trombosit disfonksiyonunun anlaşılmasında kritik olabilecek sıvı dinamiği ve akışını içermez5. Akışa bağlı hemostaz mekanizmaları arasında, kritik bir kayma hızının üzerinde, yüksek kesmede von Willebrand faktörü (VWF) uzaması ve durgun trombosit fonksiyon deneyleri kullanılarak yakalanmayan glikoprotein 1b 6,7,8 yoluyla trombosit yakalama yer alır. Ek olarak, trombositler akış rejimine bağlı olarak tercihen VWF veya fibrinojeni bağlar ve arteriyel ve venöz trombozda farklı roller ortaya çıkarır 9,10. Arteriyel trombüsler esas olarak trombositlerden oluşurken, venöz trombüsler kısmen akış rejimlerine bağlı olarak esas olarak kırmızı kan hücrelerinden oluşur11. Akış rejimlerini içeren tahliller, hipokoagülabilite ve kanama fenotiplerinden hiperkoagülabilite ve trombotik fenotiplere kadar TIC fenotiplerinin spektrumuna ait işlev bozukluklarının aydınlatılmasına yardımcı olabilir. Son olarak, travma hastası popülasyonları ile kan hacmi örnekleme kısıtlamaları, geleneksel trombosit fonksiyon testini zorlaştırabilir. Akış sitometrisi gibi tahliller bu durumlarda kullanılabilir ve kullanılmalıdır, ancak sonuçlar genellikle hemostatik fonksiyonel bir değerlendirmeyi değil, bir numunenin fiziksel karakterizasyonunu gösterir.
Trombosit disfonksiyonunun mekanizmaları travmada tam olarak anlaşılamasa da, örneğin P2Y12 antagonistleri ile in vitro trombosit disfonksiyonunun modellenmesi de terapötik müdahalelerin çalışmasına rehberlik edebilir. Hemostatik resüsitasyon, kan ürünlerinin şok, koagülopati ve endotel hasarını tam kan veya kan bileşenleri (kırmızı kan hücreleri, plazma ve trombosit konsantreleri) ile 1: 1: 1 birim oranında dengeli bir yaklaşımla transfüze edildiği travma hastalarında kritik öneme sahiptir 12,13,14. Travma hastalarında, kan ürünlerinin erken kullanımı sağkalımın artması ile ilişkilidir15,16. Raf ömrünü uzatmak için, soğuk depolanmış trombosit ürünleri giderek daha fazla incelenmektedir. Soğuk depolanmış trombositlerin muayenesi, yaralanma sonrası transfüze edildiğinde güvenliğin yanı sıra hemostatik aktivitenin arttığını gösterir17,18.
Soğuk depolanmış trombosit resüsitasyonunun evrimi, travma için mevcut olan en etkili trombosit ürününü anlamak için ek testlere duyulan ihtiyacı vurgulamaktadır. Bununla birlikte, geleneksel trombosit fonksiyon testleri, hem terapötik trombosit transfüzyonu alan travma hastasında hem de trombosit depolama lezyonlarında görülen transfüzyon ürününün kendisinde meydana gelen disfonksiyonu tespit etmek için genellikle aşırı veya yetersiz güçlendirilir. Bu testlerin çoğunun statik doğası da dahil olmak üzere mevcut trombosit fonksiyon testlerindeki sınırlamalar göz önüne alındığında, disfonksiyonun kökenini belirlemek zor olabilir. Bu nedenle, in vitro hemostatik resüsitasyon çalışırken, hem alıcı hem de ürün trombosit popülasyonları için platform ve tespit yöntemleri, optimal terapötik müdahalelerin belirlenmesinde kritik öneme sahiptir.
Mikroakışkan testi, trombositlerin incelenmesi için fizyolojik olarak ilgili bir test oluşturmak için akış profilleri ve biyofilik yüzeyler sunar. Mikroakışkan cihazlar, damar ponksiyonu19 veya endotel hasarı20 gibi belirli patofizyoloji veya yaralanma tiplerini incelemek için özelleştirilebilir. Bu cihazlar genellikle, sub-endotel ve doku yaralanmasını taklit etmek için kollajen gibi yüzey modifikasyonları ile bir cam mikroskop lamına bağlanmış polidimetilsiloksan (PDMS) içerir. Bu tür akış tabanlı cihazların kullanılması, travma ile ilişkili trombosit disfonksiyonu araştırmalarına rehberlik etmeye ve trombosit disfonksiyonunu iyileştirmek için optimal transfüzyon tıbbı yaklaşımlarının incelenmesine yardımcı olabilir. Bu stratejiler, yaralı hastada agregometri gibi statik trombosit testlerinin önemi hakkındaki mevcut karışıklığı açıklığa kavuşturmaya yardımcı olabilir.
Protokol
Tüm araştırmalar kurumsal yönergelere uygun olarak gerçekleştirilmiştir. Pittsburgh Üniversitesi İnsan Araştırmaları Koruma Ofisi'nden onay alındı ve sağlıklı insan gönüllülerden bilgilendirilmiş onam alındı.
1. Mikroakışkan cihaz hazırlığı
- Cihazın PDMS kısmını imal etmek için, bilgisayarlı sayısal kontrol (CNC) mikro işleme yoluyla pirinç kullanarak bir ana kalıp hazırlayın.
NOT: Kanal boyutlarına bağlı olarak, bir ana kalıp oluşturmak için fotolitografi teknikleri kullanılabilir. Bu protokolde kullanılan cihaz, yaklaşık 480 μm genişliğinde, cihaz giriş ve çıkışında 140 μm yüksekliğinde ve cihaz darlığında 40 μm yüksekliğinde, stenotik bölgeye / bölgeden yaklaşık 0,3 mm'lik bir rampa uzunluğuna sahip sekiz paralel mikro işlenmiş kanal içerir. Kanal uzunlukları yaklaşık 6 mm'dir. - Elde edilen bir ana kalıpla, Silikon Elastomer Tabanı (elastomer kitinden elde edilen) bir tartım kabına dökün. Sıvı PDMS'yi dayanıklı ve esnek bir katıya dönüştürmek için silikon polimer zincirlerinin çapraz bağlanmasını kolaylaştıran Silikon Kürleme Maddesini (elastomer kitinden elde edilir) 10:1 oranında (baz madde) ekleyin ve karışımı iyice karıştırın.
- Kalıbı bir Petri kabına yerleştirin ve kürlenmemiş PDMS'yi kalıba dökün. Kabarcıkları çıkarmak için Petri kabını 30 dakika boyunca bir vakumlu desikatörün içine yerleştirin.
- PDMS'yi 90 dakika boyunca 70 °C'ye ayarlanmış bir fırına yerleştirerek ana kalıpta kürlemeyi bitirin.
- PDMS kürlemesi tamamlandıktan sonra, bir tıraş bıçağı veya neşter kullanarak mikroakışkan dökümü kesin. Kanalların kenarlarına delikler açın (her iki tarafta 1,5 mm çapında).
- Laboratuvar bandı kullanarak, bir cam slaytın yüzeyini ve mikroakışkan kalıbın kazınmış tarafını temizleyin. Kalan kalıntıları temizlemek için gerektiği kadar basınçlı hava kullanın.
- Cam sürgüyü ve mikroakışkan dökümü, kazınmış tarafı yukarı bakacak şekilde bir Plazma Temizleyiciye yerleştirin. Vakum pompasını çalıştırın, hazneyi kapatın ve plazma temizleyiciyi yüksek ayara getirin. Sürgüyü ve PDMS'yi plazma temizleyicide 30 saniye bekletin, ardından plazma temizleyiciyi kapatın ve vakumu çıkarın.
- Plazma temizleyicide yukarı bakan kenarları hafifçe bastırarak plazma ile temizlenmiş döküm ve cam sürgüyü birbirine bağlayın. Ardından, mikroakışkan cihazı 10 dakika boyunca 70 °C'de bir fırına/ocak gözüne yerleştirin.
NOT: Döküm ve cam sürgüyü birbirine yapıştırırken çok fazla basınç uygulamayın çünkü bu, kanal morfolojisinde bir kayba neden olabilir. - Sterilize etmek için her odayı 10-30 μL %70 etanol ile durulayın ve mikroakışkan cihazın 70 °C'lik bir sıcak plaka üzerinde kurumasını bekleyin.
NOT: Cihazlar en az 24 saat önceden yapılmalıdır, ancak haftalar ila aylar öncesinden yapılabilir. Cihazlar hava geçirmez bir kapta veya kapalı Petri kabında oda sıcaklığında saklanmalıdır. - Mikroakışkan cihazla deney yapmadan bir gün önce, sterilize etmek ve mikroakışkan cihazın 70 °C'lik bir ocak gözü üzerinde kurumasını sağlamak için her odayı 10-30 μL% 70 etanol ile yeniden durulayın.
- Odayı, belirlenmiş bir çıkıştan belirlenen girişe 1: 5 hacimsel oranda% 0.9 NaCl ile seyreltilmiş Tip 1 at fibriller kollajen reaktifi (1 mg / mL) ile kaplayın. Bir deney içinde yönlülüğün korunduğundan emin olun. Kanal içindeki kaplanmış kollajenin buharlaşmasını önlemek için cihazı ılık, nemli kapalı bir kapta saklayın.
- 1 saat sonra, kollajen solüsyonunu temizlemek için fosfat tamponlu salin (PBS) ile durulayın. Kaplamanın ters yönünde yıkayın. Kullanılmadığı zaman cihazı tekrar ılık, nemli, kapalı bir kapta saklayın.
2. Kan örneği hazırlama
- Damar delinmesi yoluyla sitrat tam kan örneği alın. Sitratlı tam kanı FC reseptör bloke etme solüsyonu (1:600) ile inkübe edin.
NOT: Kan örnekleri, deney öncesinde ve sırasında oda sıcaklığında saklanır. - Sitrasyonlu tam kanı floresan konjuge (tercih edilen bir florofor kullanarak) CD41 antikoru (1:600) ile inkübe edin. Somunlu bir külbütör üzerinde 30 dakika boyayın.
- Trombosit inhibisyonu için pozitif bir kontrol olarak, PBS'de% 30 w / v 2-hidroksipropil-β-siklodekstrin (HP-β-CD) çözeltisinde yeniden oluşturulan bir P2Y12 reseptör antagonisti olan Ticagrelor'u ekleyin.
NOT: 6,4 mM'ye kadar olan Ticagrelor stokları hazırlanmalı ve deneyden önce HP-β-CD çözeltisinde (PBS'de çözülmüş %30 HP-β-CD) Ticagrelor stoklarının daha fazla seyreltilmesi yapılabilir (1.000x stok konsantrasyonu önerilir). - Trombosit inhibisyonunu gözlemlemek için sitratlı numuneyi Ticagrelor (6.4 μM'ye kadar nihai konsantrasyon) ile 30 dakika inkübe edin.
- Kan ürününü sitrat numunesi ile karıştırıyorsanız, kan ürününü FC reseptör bloke edici solüsyon (1:600) ve floresan konjuge (sitrat numuneye ayrı ve farklı bir florofor kullanarak) CD41 antikoru (1:600) ile boyayın.
- Transfüzyon yapılan ürün birimlerinin hacimsel bir eşdeğerini sitrat numunesi ile karıştırın. Örneğin, kanaması olan bir kişiye transfüzyon yapılan 2 ünite trombosit ürününü simüle etmek için (ürün başına yaklaşık 250 mL, toplam 5.000 mL kan hacmi), 100 μL kan ürününü 1.000 μL sitrat kan örneğine karıştırın.
- Deneyden hemen önce, kan örneğini 40 μm'lik bir filtreden steril 1,5 mL'lik bir mikrosantrifüj tüpüne süzün.
3. Akış altında trombosit fonksiyon testi (Yöntem 1)
- Mikroskobu ve ilgili yazılımı açın.
- Mikroskop aşaması ile bir çekme şırınga pompası seviyesi ayarlayın. Şırınga pompasındaki ayarları yapın.
- Denklem (1) ve (2)21'i kullanarak kanalın stenotik bölgesinde 3.500 s-1'lik istenen ortalama duvar kesme hızı (γ) için bir hacimsel akış hızı (Q) hesaplayın.
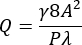 (1)
(1)
 (2)
(2)
Burada A kanalın kesit alanı, P ıslanan çevre, λ şekil faktörü, b dikdörtgenin kısa kenarı (yükseklik) ve a dikdörtgenin uzun kenarı (genişlik) dir.
NOT: 3,500 s-1 değeri, VWF kritik kesme nedeniyle seçilmiştir ve arteriyel rejim 7,22,23'tedir.
- Denklem (1) ve (2)21'i kullanarak kanalın stenotik bölgesinde 3.500 s-1'lik istenen ortalama duvar kesme hızı (γ) için bir hacimsel akış hızı (Q) hesaplayın.
- Mikroakışkan cihazı mikroskop tablasına yerleştirin. Hareketi önlemek için mikroakışkan cihazın kenarlarını sahneye bantlayın. Prizin mikroskobun arkasına baktığından emin olun.
- 1/16" ID tüpünün (yaklaşık 30 cm uzunluğunda) bir ucunu bir dirsek konektörüne ve diğer ucunu 1/16" ID konektörlü 10 mL'lik bir şırıngaya bağlayın.
- Şırıngayı steril PBS ile doldurun ve şırınga pompasına bağlayın.
- Dirsek konektörünü cihaz çıkışına yerleştirin.
- Bir ucunda dirsek konektörü ve diğer ucunda açılı kesim ile yaklaşık 10 cm uzunluğunda giriş hatları hazırlayın.
- Giriş dirseği konektörünü cihaz girişine bağlayın.
- Giriş hattını açılı bir tutucu üzerindeki bir atık mikrosantrifüj tüpüne yerleştirin.
- Yaklaşık 10 μm genişliğindeki kanal boyutları için 500x objektifi kullanın ve mikroakışkan cihaz kanal kenarlarına odaklanın.
- Hatları PBS ile doldurun ve şırınga pompasını manuel olarak ilerleterek herhangi bir PDMS / kalıntı kanalını temizleyin. Kanal girişinin ve çıkışının yakınında kontrol ettiğinizden emin olun.
- Kaydedilen görüntü yakalama ayarlarını açın veya kan örneğinde kullanılan floresan CD41 antikorlarına karşılık gelen bir parlak alan kanalı ve floresan kanallarla her 1-2 saniyede bir yakalanan zaman serisi görüntüleri için bir görüntü yakalama prosedürü oluşturun.
- Filtrelenmiş sitrat kan örneğini alın ve deneyden hemen önce yukarı ve aşağı pipetleyerek karıştırın. Numuneyi açılı mikrosantrifüj tutucusuna yerleştirin.
- Giriş hattını numunenin içine yerleştirin.
- Görüntü yakalamayı kaydetmeye başlayın.
- Borudaki ölü hacmi doldurmak için şırıngayı yavaşça geri çekin. Kan kanala ulaştığında, istenen kesme hızında akışa devam etmek için hemen şırınga pompasındaki oynat düğmesine basın.
- Gerekirse odağı ayarlayın.
- Trombositler mikroakışkan cihazın stenotik bölgesini tamamen tıkayana kadar veya deneysel bir son noktaya kadar (yani 10 dakika) deneyi çalıştırın.
- Giriş borusunun deney süresince kan örneğine daldırıldığından emin olun.
- Deney tamamlandıktan sonra, görüntü yakalamayı durdurun ve şırınga pompasını durdurun. Yakalanan görüntüyü kaydedin.
- Giriş dirseği konektörünü çıkarın ve borunun içindekileri bir atık konik içine boşaltın. Şırınga ve çıkış hatlarının içindekileri de atık konik olarak boşaltın.
- Sonraki numuneler için giriş ve çıkış konektörlerini ve hortumlarını gerektiği gibi değiştirin.
4. Düşük hacimli numunelerle (1 mL'nin altında) akış altında trombosit fonksiyon testi (Yöntem 2)
- 1.1'den 1.4'e kadar olan adımları yukarıdaki gibi tekrarlayın.
- Kanalların kenarlarına 1.5 mm çapında bir çıkış ve 3 mm çapında bir giriş delin.
- 1.6'dan 3.6'ya kadar olan adımları yukarıdaki gibi tekrarlayın.
- Yaklaşık 10 μm genişliğindeki kanal boyutları için 500x objektifi kullanın ve mikroakışkan cihaz kanal kenarlarına odaklanın.
- Şırınga pompasını manuel olarak ilerleterek ve erişim sıvısını bir laboratuvar mendiliyle emerek herhangi bir PDMS/kalıntı kanalını temizleyin. Mikroakışkan cihazın üst kısmındaki kalıntıları laboratuvar bandı ile temizleyin.
- 3 mm'lik giriş rezervuarını PBS ile doldurmak için pompayı manuel olarak ilerletin.
- Kaydedilen görüntü yakalama ayarlarını açın veya kan örneğinde kullanılan floresan CD41 antikorlarına karşılık gelen bir parlak alan kanalı ve floresan kanallarla her 1-2 saniyede bir yakalanan zaman serisi görüntüleri için bir görüntü yakalama prosedürü oluşturun.
- Şırınga pompasında para çekmeye başlayın (manuel olarak veya ayarlanan hızda) ve PBS kanala ilerlediğinde ve rezervuardaki doldurma hattı aşağı indiğinde, pompadaki para çekme işlemini duraklatın.
- Fazla PBS'yi bir pipetle rezervuardan çıkarın.
- Görüntü yakalamayı başlatın.
- Kan örneğini rezervuara (yaklaşık 40 μL) pipetleyin ve hemen çekme şırıngasını başlatın. Akışın başladığından emin olun.
NOT: Geri çekme için şırınga pompası motoru adım 4.8'de astarlanmamışsa, akış hemen başlamaz ve deney tekrarlanmalıdır. - Deney süresince kan haznesini tekrar doldurun ve kanala hava cebi girmediğinden emin olun.
- Trombositler mikroakışkan cihazın stenotik bölgesini tamamen tıkayana kadar veya deneysel bir son noktaya kadar (yani 10 dakika) deneyi çalıştırın.
- Deney tamamlandıktan sonra görüntü yakalamayı durdurun ve şırınga pompasını durdurun. Yakalanan görüntüyü kaydedin.
- Pipetleme ile rezervuardaki fazla kanı alın. Çekme borusunun içeriğini atık bir konik tüpe boşaltın.
- Sonraki numuneler için konektörleri ve boruları gerektiği gibi değiştirin.
5. Dekontaminasyon
- % 10'luk bir çamaşır suyu çözeltisine akıtarak kan giriş ve çıkış hatlarını temizleyin.
- Mikroakışkan cihazdaki tüm kanallar kullanılmışsa, cihazı Sharps biyolojik olarak tehlikeli atık kabına atın.
NOT: Tüm biyolojik atıklar, biyolojik tehlike atıklarına uygun şekilde atılmalıdır.
6. Görüntü analizi
- Kinetik deneylerden elde edilen görüntüleri, Dosya | İhracat/İthalat | İhracat.
- Aşağıdaki parametreleri seçin: dosya türü: Etiketli Görüntü Dosyası Biçimi (TIFF); sıkıştırma: LZW; Orijinal Verileri kontrol edin ve Pikseli Kaydırın; işaretini kaldırın Görüntü eğrisini ve kanal rengini uygula; Alt Kümeyi Tanımla'yı (Bölge, Dikdörtgen bölge) işaretleyin ve koşullar arasında koruma genişliği ve yüksekliği ölçümü ile kanal alanını seçin. İstediğiniz klasöre aktarın ve Klasör oluştur'u işaretleyin.
- Yazılımda aşağıdaki deneysel değerlere dikkat edin: kan kanala girdiğinde çerçeveyi başlatın; kare hızı (Bilgi, Zaman Serisi).
- Ek Dosya 1 olarak sağlanan Matlab kodunu kullanarak bir deneyde her karenin normalleştirilmiş ortalama floresan yoğunluğunu ölçün ve her deney için aşağıdaki girdileri değiştirin: deney uzunluğuna göre başlangıç karesi/bitiş karesi (deney uzunluğunun koşullar arasında korunduğundan emin olun); deney adı/klasör adı; X, Y, H ve W parametrelerini kırpma. Kodu alıcı trombosit floresan kanalı için bir kez ve ürün trombosit floresan kanalı için bir kez çalıştırın. Normalleştirilmiş MFI (sütun 2) ve normalleştirilmiş AUC değerlerini (başlangıç karesine normalleştirilmiş) raporlayın. Deney uzunluğu değerini normalleştirilmiş AUC değerinden çıkarın.
Sonuçlar
Bu yöntemin kullanımını takiben yapılan mikroakışkan deneyler, akım kanalının darlık olan bölgede trombositten zengin trombüs oluşumunu göstermelidir (Şekil 1). Şekil 1A , fonksiyonel trombositlerin kanaldan kan akışını engellemek için kanalın stenotik bölgesinde bir trombüs oluşturduğu temsili sonuçları göstermektedir. Deney süresince çekilen kinetik görüntülerin ortalama floresan yoğunluğu ...
Tartışmalar
Yukarıdaki protokol, deneylerin güvenilirliğini ve tekrarlanabilirliğini sağlamak için bazı kritik adımlara sahiptir. İlk olarak, floresan antikorlar dikkatlice düşünülmelidir. Numunedeki trombositleri tespit etmek için kullanılan antikorlar, glikoprotein Ib (GPIb) trombosit reseptörünün işlevini engellememelidir. Deneyler arasında mümkün olduğunda parti eşleştirmesi de floresan sinyalin tekrarlanabilirliğini sağlamak için kritik öneme sahiptir. Bu protokolde...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, katılan tüm kan bağışçılarının yanı sıra Travma ve Transfüzyon Tıbbı Araştırma Laboratuvarı flebotomistleri ve UPMC Montefiore Klinik ve Translasyonel Araştırma Merkezi'ne koleksiyonlarda yardım için teşekkür eder ve teşekkür eder. SMS, K25HL161401 tarafından desteklenmektedir. MDN, 1R01HL166944-01A1 tarafından desteklenir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Referanslar
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır