JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
혈소판 기능 평가에서의 미세유체역학(Microfluidics in Assessing Platelet Function)
요약
혈류 하의 혈소판 기능을 평가하고 시뮬레이션된 지혈 소생술을 외상 및 수혈 의학에 응용하는 미세유체 장치를 사용하여 모델링할 수 있습니다.
초록
Microfluidics는 혈관 구조를 모방하는 생리학적으로 관련된 기질과 흐름을 통합하므로 혈전증과 지혈의 측면을 연구하는 데 유용한 도구입니다. 동맥 흐름을 시뮬레이션하는 고전단 환경에서 미세유체 분석은 유동 채널의 국부적인 협착 영역에서 혈소판이 풍부한 혈전이 형성됨에 따라 혈소판 기능에 대한 연구를 용이하게 합니다. 소량의 검체를 허용하는 장치를 활용하면 부피가 제한된 환자 검체 또는 동물 모델에서 유동 하의 혈소판 기능을 평가하는 데 추가로 도움이 될 수 있습니다. 외상 환자 샘플 또는 혈소판 제품 수혈 후 샘플을 연구하는 것은 혈소판 기능이 중요한 환자 집단에 대한 치료 전략을 지시하는 데 도움이 될 수 있습니다. 약리학적 제제를 통한 혈소판 억제의 효과도 이 모델에서 연구할 수 있습니다. 이 프로토콜의 목적은 생리학적 흐름, 생물학적 표면 및 관련 지혈 메커니즘을 통합하여 외상 유발 응고병증 및 수혈 의학 연구에 영향을 미치는 혈소판 기능을 평가하는 미세유체 플랫폼을 구축하는 것입니다.
서문
트라우마는 전 세계적으로 사망 및 장애의 주요 원인입니다. 심각한 부상은 종종 외상 유발 응고병증(TIC)이라고 하는 지혈 및 혈전증의 독특한 내인성 장애로 인해 복잡해집니다1. 혈소판은 TIC에서 중요한 역할을 하며, 적응 기능과 부적응 기능을 모두 가지고 있는 것으로 설명되었습니다2. 손상 후 혈소판 기능 장애의 메커니즘은 여전히 불분명하며, 개선된 소생술 및 치료법의 개발을 안내하기 위해 세포 반응을 더 잘 이해할 필요가 있습니다. 부상 후 혈소판 기능과 관련된 또 다른 골치 아픈 문제는 외상 환자의 혈소판 기능에 대한 현재 판독값의 신뢰성이 불확실하다는 것입니다.
여러 연구에 따르면 알려진 임상적 출혈 표현형이 없는 경미한 부상 환자조차도 응집법(aggregometry)과 같은 기존 혈소판 기능 검사를 사용하여 비정상적인 혈소판 기능을 보인다 3,4. 그러나 부상 환경에서 혈소판 기능을 평가하기 위한 응집계의 한계에는 생리학적으로 관련된 손상 표면의 부족, 작용제 자극에 대한 환원주의적 접근 방식, 전혈 임피던스 응집법을 사용한 검체 희석, 광학 광 투과 응집법을 사용한 혈장 분리, 정체된 검체 평가 등이 있습니다. 또한, 이러한 혈소판 기능의 민감도가 실제 세포 기능 장애를 나타내는지, 아니면 손상 환경에서 기준선 전기 임피던스 증가와 같은 측정 아티팩트를 나타내는지는 불분명합니다2. 따라서 외상의 맥락에서 관련 혈소판 기능을 연구하는 것은 TIC를 이해하는 데 매우 중요하며, 이 영역에는 혁신과 개선의 여지가 상당히 있습니다.
전통적으로 혈소판 기능을 연구하는 데 사용되는 플랫폼에는 유체 역학 및 흐름이 포함되어 있지 않으며, 이는 외상 및 외상 유발 응고병증과 관련된 혈소판 기능 장애를 이해하는 데 중요할 수 있습니다5. 흐름에 의존하는 지혈 메커니즘에는 임계 전단 속도 이상의 높은 전단에서 von Willebrand factor(VWF) 신장과 정체된 혈소판 기능 분석을 사용하여 캡처되지 않는 당단백질 1b 6,7,8을 통한 혈소판 캡처가 포함됩니다. 또한, 혈소판은 혈류 조절에 따라 VWF 또는 피브리노겐에 우선적으로 결합하고 동맥 혈전증과 정맥 혈전증에서 차별적인 역할을 유도합니다 9,10. 동맥 혈전은 주로 혈소판으로 구성되는 반면, 정맥 혈전은 주로 적혈구로 구성되며, 부분적으로 흐름 체제에 기초합니다11. 유동 요법을 통합하는 분석은 저응고성 및 출혈 표현형에서 과응고성 및 혈전성 표현형에 이르기까지 TIC 표현형 스펙트럼과 관련된 기능 장애를 설명하는 데 도움이 될 수 있습니다. 마지막으로, 외상 환자 집단에 대한 혈액량 샘플링 제약으로 인해 기존의 혈소판 기능 검사가 어려울 수 있습니다. 유세포 분석과 같은 분석은 이러한 상황에서 활용될 수 있고 활용되어야 하지만, 결과는 종종 지혈 기능 평가가 아닌 샘플의 물리적 특성을 나타냅니다.
혈소판 기능 장애의 메커니즘은 외상에서 완전히 이해되지 않을 수 있지만, 예를 들어 P2Y12 길항제를 사용하여 체외에서 혈소판 기능 장애를 모델링하는 것도 치료 개입 연구를 안내하는 데 도움이 될 수 있습니다. 전혈 또는 혈액 성분(적혈구, 혈장 및 혈소판 농축물)을 1:1:1 단위 비율로 사용하여 쇼크, 응고병증 및 내피 손상을 해결하기 위해 균형 잡힌 접근법으로 혈액 제제를 수혈하는 외상 환자에서 지혈 소생술이 매우 중요합니다 12,13,14. 외상 환자의 경우, 혈액 제제의 조기 사용은 생존율 향상과 관련이 있다 15,16. 유통 기한을 연장하기 위해 냉장 보관된 혈소판 제품에 대한 연구가 점점 더 많이 이루어지고 있습니다. 냉장저장된 혈소판을 검사한 결과, 지혈 활동이 증가하고, 부상 후 수혈 시 안전성이 확인되는 것으로 나타났다17,18.
냉장 보관 혈소판 소생술의 발전은 외상에 사용할 수 있는 가장 효과적인 혈소판 제품을 이해하기 위한 추가 검사의 필요성을 강조합니다. 그러나 전통적인 혈소판 기능 분석법은 종종 기능 장애를 감지하기 위해 과도하게 또는 과소 강화되며, 이는 치료적 혈소판 수혈을 받는 외상 환자와 혈소판 저장 병변에서 볼 수 있는 수혈된 산물 자체에서 모두 발생합니다. 기능 장애의 원인을 파악하는 것은 대부분의 검사의 정적 특성을 포함하여 현재 혈소판 기능 분석의 한계를 감안할 때 어려울 수 있습니다. 따라서 in vitro 지혈 소생술을 연구할 때 수용자와 제품 혈소판 집단 모두에 대한 플랫폼과 검출 방법은 최적의 치료 개입을 결정하는 데 매우 중요합니다.
미세유체 검사는 혈소판 연구에 필요한 생리학적으로 관련된 분석을 생성하기 위해 유동 프로파일과 생체 표면을 제공합니다. 미세유체 장치는 혈관 천자19 또는 내피 손상20과 같은 특정 병태생리학 또는 부상 유형을 연구하기 위해 맞춤화할 수 있습니다. 이러한 장치는 일반적으로 콜라겐과 같은 표면 변형을 통해 유리 현미경 슬라이드에 결합된 폴리디메틸실록산(PDMS)으로 구성되어 내피하 및 조직 손상을 모방합니다. 이러한 유형의 흐름 기반 장치를 활용하면 외상 관련 혈소판 기능 장애 연구를 안내하는 데 도움이 될 수 있으며 혈소판 기능 장애를 개선하기 위한 최적의 수혈 의학 접근 방식을 검토하는 데 도움이 될 수 있습니다. 이러한 전략은 부상 환자의 응집법(aggregometry)과 같은 정적 혈소판 분석의 관련성에 대한 기존의 혼란을 명확히 하는 데 도움이 될 수 있습니다.
프로토콜
모든 연구는 기관 지침에 따라 수행되었습니다. University of Pittsburgh Human Research Protection Office의 승인을 받았으며 건강한 인간 지원자로부터 정보에 입각한 동의를 얻었습니다.
1. 미세유체 장치 준비
- 장치의 PDMS 부분을 제작하려면 CNC(Computer Numerical Control) 미세 가공을 통해 황동을 사용하여 마스터 금형을 준비합니다.
참고: 채널 치수에 따라 포토리소그래피 기술을 사용하여 마스터 금형을 만들 수 있습니다. 이 프로토콜에 사용되는 장치에는 약 480μm 너비, 장치 입구 및 출구 140μm 높이, 장치 협착 시 40μm 높이의 8개의 병렬 미세 가공 채널이 포함되며 협착 영역과의 램프 길이는 약 0.3mm입니다. 채널 길이는 약 6mm입니다. - 얻은 마스터 몰드와 함께 실리콘 엘라스토머 베이스(엘라스토머 키트에서 얻음)를 계량 접시에 붓습니다. 실리콘 폴리머 사슬의 가교를 촉진하여 액체 PDMS를 내구성 있고 유연한 고체로 변환하는 실리콘 경화제(엘라스토머 키트에서 얻음)를 10:1(염기제)의 비율로 첨가하고 혼합물을 잘 저어줍니다.
- 금형을 페트리 접시에 넣고 경화되지 않은 PDMS를 금형에 붓습니다. 페트리 접시를 진공 데시케이터에 30분 동안 넣어 거품을 제거합니다.
- PDMS를 70°C로 설정된 오븐에서 90분 동안 넣어 마스터 몰드에서 경화를 마칩니다.
- PDMS 경화가 완료된 후 면도날이나 메스를 사용하여 미세유체 캐스트를 잘라냅니다. 채널 가장자리에 펀치 구멍을 뚫습니다(양쪽 직경 1.5mm).
- 실험실 테이프를 사용하여 유리 슬라이드의 표면과 미세유체 주조물의 에칭된 면을 청소합니다. 필요에 따라 압축 공기를 사용하여 남아 있는 이물질을 제거합니다.
- 유리 슬라이드와 에칭된 면이 위쪽을 향하도록 미세유체 주조물을 플라즈마 클리너에 넣습니다. 진공 펌프를 시작하고 챔버를 밀봉한 다음 플라즈마 클리너를 높은 설정으로 켭니다. 슬라이드와 PDMS를 플라즈마 클리너에 30초 동안 그대로 둔 다음 플라즈마 클리너를 끄고 진공을 제거합니다.
- 플라즈마 세척 캐스트와 유리 슬라이드를 플라즈마 클리너에서 앞면이 위로 향하게 한 면을 부드럽게 눌러 함께 묶습니다. 그런 다음 미세유체 장치를 70°C의 오븐/핫플레이트에 10분 동안 놓습니다.
알림: 캐스트와 유리 슬라이드를 함께 접착할 때 채널 형태가 손실될 수 있으므로 너무 많은 압력을 가하지 마십시오. - 각 챔버를 10-30 μL의 70% 에탄올로 헹구어 멸균하고 미세유체 장치를 70 °C 핫 플레이트에서 건조시킵니다.
참고: 장치는 최소 24시간 전에 제작해야 하지만 몇 주에서 몇 달 전에 제작될 수도 있습니다. 장치는 밀폐 용기 또는 실온의 덮개를 씌운 페트리 접시에 보관해야 합니다. - 미세유체 소자를 사용한 실험 전날, 각 챔버를 10-30μL의 70% 에탄올로 다시 헹구어 살균하고 미세유체 장치를 70°C 핫플레이트에서 건조시킵니다.
- 지정된 배출구를 통해 지정된 주입구까지 1:5 부피 비율로 0.9% NaCl에 희석된 Type 1 말 섬유소 콜라겐 시약(1mg/mL)으로 챔버를 코팅합니다. 실험 내에서 방향성이 유지되는지 확인합니다. 채널 내에서 코팅된 콜라겐의 증발을 방지하기 위해 장치를 따뜻하고 습한 밀폐된 용기에 보관하십시오.
- 1시간 후, 인산염 완충 식염수(PBS)로 헹구어 콜라겐 용액을 씻어냅니다. 코팅의 반대 방향으로 플러시합니다. 사용하지 않을 때는 따뜻하고 습하며 밀폐된 용기에 장치를 다시 보관하십시오.
2. 혈액 샘플 준비
- venipunculture를 통해 인용된 전혈 샘플을 얻습니다. FC 수용체 차단 용액으로 구연산 전혈을 배양합니다(1:600).
알림: 혈액 샘플은 실험 전과 실험 중에 실온에서 보관됩니다. - 형광 접합(선택한 형광단 사용) CD41 항체(1:600)로 구연산 전혈을 배양합니다. 너팅 로커에 30분 동안 염색합니다.
- 혈소판 억제에 대한 양성 대조군으로, PBS에서 30% w/v 2-하이드록시프로필-β-사이클로덱스트린(HP-β-CD) 용액으로 재구성된 P2Y12 수용체 길항제인 Ticagrelor를 첨가합니다.
참고: 최대 6.4mM의 Ticagrelor 스톡을 준비해야 하며, 실험 전에 HP-β-CD 용액(PBS에 용해된 30% HP-β-CD)에서 Ticagrelor 스톡을 추가로 희석할 수 있습니다(1,000배 스톡 농도 권장). - 구연산 시료를 Ticagrelor(최종 농도 최대 6.4μM)로 30분 동안 배양하여 혈소판 억제를 관찰합니다.
- 혈액 제제를 구연산 샘플과 혼합하는 경우, 혈액 제제를 FC 수용체 차단 용액(1:600) 및 형광 접합(구연산 샘플에 대해 별도의 별개의 형광단 사용) CD41 항체(1:600)로 염색합니다.
- 수혈된 제품 단위의 부피 등가물을 인용된 샘플과 혼합합니다. 예를 들어, 출혈이 있는 사람에게 수혈된 2단위의 혈소판 제품(총 혈액량 5,000mL에 제품당 약 250mL)을 시뮬레이션하려면 100μL의 혈액 제제를 1,000μL의 구연산 혈액 샘플에 혼합합니다.
- 실험 직전에 40μm 필터를 통해 혈액 샘플을 멸균 1.5mL 마이크로 원심분리 튜브로 여과합니다.
3. 유동 하에서 혈소판 기능 테스트(방법 1)
- 현미경 및 관련 소프트웨어를 켭니다.
- 현미경의 스테이지와 함께 인출 주사기 펌프 레벨을 설정합니다. 주사기 펌프의 설정을 조정합니다.
- 방정식 (1) 및 (2)21을 사용하여 수로의 협착 영역에서 3,500 s-1의 원하는 평균 벽 전단 속도(γ)에 대한 체적 유량(Q)을 계산합니다.
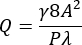 (1)
(1)
 (2)
(2)
여기서 A는 채널의 단면적, P는 습식 둘레, λ는 형상 계수, b는 직사각형의 짧은 면(높이), a는 직사각형의 긴 면(너비)입니다.
참고: 3,500 s-1의 값은 VWF 임계 전단으로 인해 선택되며 동맥 영역 7,22,23에 있습니다.
- 방정식 (1) 및 (2)21을 사용하여 수로의 협착 영역에서 3,500 s-1의 원하는 평균 벽 전단 속도(γ)에 대한 체적 유량(Q)을 계산합니다.
- 현미경 스테이지에 미세유체 장치를 놓습니다. 움직임을 피하기 위해 미세 유체 장치의 가장자리를 스테이지에 테이프로 붙입니다. 배출구가 현미경 뒷면을 향하고 있는지 확인하십시오.
- 1/16" ID 튜브(약 30cm 길이)의 한쪽 끝을 엘보우 커넥터에 연결하고 다른 쪽 끝을 1/16" ID 커넥터가 있는 10mL 주사기에 연결합니다.
- 주사기에 멸균 PBS를 채우고 주사기 펌프에 연결합니다.
- 엘보우 커넥터를 장치 콘센트에 놓습니다.
- 한쪽 끝에는 엘보우 커넥터가 있고 다른 쪽 끝에는 각진 절단부가 있는 약 10cm 길이의 흡입 라인을 준비합니다.
- 입구 엘보우 커넥터를 장치 입구에 연결합니다.
- 흡입 라인을 각진 홀더의 폐기물 마이크로 원심분리기 튜브에 배치합니다.
- 약 500μm 너비의 채널 치수에 대해 10x 대물렌즈를 사용하고 미세유체 장치 채널 가장자리에 초점을 맞춥니다.
- PBS로 라인을 프라임하고 주사기 펌프를 수동으로 전진시켜 PDMS/파편이 있는 채널을 제거합니다. 채널 입구와 출구 근처를 확인하십시오.
- 저장된 이미지 캡처 설정을 열거나 혈액 샘플에 사용된 형광 CD41 항체에 해당하는 명시야 채널 및 형광 채널을 사용하여 1-2초마다 캡처된 시계열 이미지에 대한 이미지 캡처 절차를 만듭니다.
- 여과된 citrated 혈액 샘플을 얻고 실험 직전에 위아래로 피펫팅하여 혼합합니다. 샘플을 각진 마이크로 원심분리기 홀더에 놓습니다.
- 주입 라인을 샘플에 배치합니다.
- 이미지 캡처 기록을 시작합니다.
- 천천히 주사기를 빼서 튜브의 데드 볼륨을 채웁니다. 혈액이 채널에 도달하면 즉시 주사기 펌프의 재생을 눌러 원하는 전단 속도로 흐름을 재개합니다.
- 필요한 경우 초점을 조정합니다.
- 혈소판이 미세유체 장치의 협착 영역을 완전히 폐색할 때까지 또는 실험 종료(즉, 10분)까지 실험을 실행합니다.
- 주입구 튜브가 혈액 샘플에 잠겨 있는지 확인합니다.
- 실험이 완료되면 이미지 캡처를 중지하고 실린지 펌프를 중지합니다. 이미지 캡처를 저장합니다.
- 입구 엘보우 커넥터를 제거하고 튜브의 내용물을 폐기물 원뿔형으로 비웁니다. 주사기와 배출 라인의 내용물도 폐기물 원뿔형으로 비우십시오.
- 후속 샘플에 필요한 경우 주입구 및 배출구 커넥터와 튜브를 교체합니다.
4. 저용량 샘플(1mL 미만)을 사용한 유속 혈소판 기능 테스트(방법 2)
- 위와 같이 1.1-1.4단계를 반복합니다.
- 채널 가장자리에 직경 1.5mm의 배출구와 직경 3mm의 흡입구를 펀칭합니다.
- 위와 같이 1.6-3.6단계를 반복합니다.
- 약 500μm 너비의 채널 치수에 대해 10x 대물렌즈를 사용하고 미세유체 장치 채널 가장자리에 초점을 맞춥니다.
- 주사기 펌프를 수동으로 전진시키고 실험실용 물티슈로 접근 유체를 흡수하여 PDMS/파편이 있는 채널을 청소합니다. 미세유체 장치 상단의 실험실 테이프로 이물질을 제거합니다.
- 펌프를 수동으로 전진시켜 3mm 흡입구 저장소를 PBS로 채웁니다.
- 저장된 이미지 캡처 설정을 열거나 혈액 샘플에 사용된 형광 CD41 항체에 해당하는 명시야 채널 및 형광 채널을 사용하여 1-2초마다 캡처된 시계열 이미지에 대한 이미지 캡처 절차를 만듭니다.
- 주사기 펌프에서 회수를 시작하고(수동 또는 설정된 속도로) PBS가 채널로 전진하고 저장소의 충전 라인이 내려가면 펌프에서 회수를 일시 중지합니다.
- 피펫으로 저장소에서 과도한 PBS를 제거합니다.
- 이미지 캡처를 시작합니다.
- 혈액 샘플을 저장소(약 40μL)에 피펫으로 주입하고 즉시 회수 주사기를 시작합니다. 흐름이 시작되는지 확인합니다.
알림: 인출용 주사기 펌프 모터가 4.8단계에서 프라이밍되지 않은 경우 흐름이 즉시 시작되지 않으며 실험을 반복해야 합니다. - 실험 기간 동안 혈액 저장소를 다시 채우고 공기 주머니가 채널로 들어가지 않도록 합니다.
- 혈소판이 미세유체 장치의 협착 영역을 완전히 폐색할 때까지 또는 실험 종료(즉, 10분)까지 실험을 실행합니다.
- 실험이 완료되면 이미지 캡처를 중지하고 주사기 펌프를 중지합니다. 이미지 캡처를 저장합니다.
- 피펫팅으로 저장통에 있는 과도한 혈액을 제거합니다. 배출 튜브의 내용물을 폐기물 원뿔형 튜브에 비우십시오.
- 후속 샘플에 필요한 대로 커넥터와 튜브를 교체합니다.
5. 오염 제거
- 10% 표백제 용액에 씻어내어 혈액의 입구와 출구 라인을 청소합니다.
- 미세유체 장치의 모든 채널을 사용한 경우 Sharps 생물학적 유해 폐기물 용기에 장치를 버리십시오.
알림: 모든 생물학적 폐기물은 생물학적 유해 폐기물에 적절하게 처리해야 합니다.
6. 이미지 분석
- File( 파일) | 수출/수입 | 내보내기.
- 다음 매개변수를 선택합니다. 파일 유형: 태그가 지정된 이미지 파일 형식(TIFF); 압축: LZW; 원본 데이터를 확인하고 픽셀을 이동하십시오. Apply display curve and channel color를 선택 취소하십시오. Define Subset (Region, Rectangle region, and select width and height measures between conditions 사이의 너비 및 높이 측정으로 채널 영역을 선택)을 선택합니다. 원하는 폴더로 내보내고 폴더 생성을 선택합니다.
- 소프트웨어에서 아래 실험 값을 주목하십시오 : 혈액이 채널에 들어갈 때 시작 프레임; 프레임 속도(정보, 시계열).
- 보충 파일 1로 제공된 Matlab 코드를 사용하여 실험에서 각 프레임의 정규화된 평균 형광 강도를 측정하고 각 실험에 대해 다음 입력을 변경합니다. 실험 길이를 기반으로 한 시작 프레임/종료 프레임(실험 길이가 조건 간에 보존되는지 확인). 실험 이름/폴더 이름; X, Y, H 및 W 매개 변수 자르기. 수신자 혈소판 형광 채널에 대해 한 번, 제품 혈소판 형광 채널에 대해 한 번 코드를 실행합니다. 정규화된 MFI(열 2) 및 정규화된 AUC 값(시작 프레임으로 정규화된 값)을 보고합니다. 정규화된 AUC 값에서 실험 길이 값을 뺍니다.
결과
이 방법의 사용에 따른 미세유체 실험은 유동 채널의 협착 영역에서 혈소판이 풍부한 혈전 형성을 보여주어야 합니다(그림 1). 그림 1A 는 기능적 혈소판이 채널을 통한 혈류를 차단하기 위해 채널의 협착 영역에 혈전을 형성한 대표적인 결과를 보여줍니다. 실험 기간 동안 촬영한 동역학 이미지의 평균 형광 강도(MFI) 곡선은 성...
토론
위의 프로토콜에는 실험의 신뢰성과 재현성을 보장하기 위한 몇 가지 중요한 단계가 있습니다. 첫째, 형광 항체를 신중하게 고려해야 합니다. 샘플에서 혈소판을 검출하는 데 사용되는 항체는 GPIb(glycoprotein Ib) 혈소판 수용체의 기능을 차단해서는 안 됩니다. 실험 사이에 가능할 때마다 로트 매칭은 형광 신호의 재현성을 보장하기 위해 중요합니다. 이 프로토콜의 또 다른...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는 참여한 모든 헌혈자와 외상 및 수혈 의학 연구소 정맥 채혈사, UPMC 몬테피오레 임상 및 중개 연구 센터(UPMC Montefiore Clinical and Translational Research Center)에 대한 수혈에 도움을 준 것에 대해 감사를 표합니다. SMS는 K25HL161401에서 지원됩니다. MDN은 1R01HL166944-01A1에서 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
참고문헌
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유