Method Article
大鼠视网膜下注射和视网膜脱离的术中可视化
摘要
本文介绍了大鼠视网膜下注射的方法,利用术中可视化来控制注射部位和视网膜脱离区域。
摘要
视网膜下注射,即在光感受器和视网膜色素上皮 (RPE) 之间输送溶液,形成一个视网膜下空间,其中组件与光感受器和 RPE 细胞直接接触。这种递送方法允许对这些细胞进行靶向处理。视网膜下注射的治疗方法已经开发并获得批准,特别是针对遗传性视网膜疾病的治疗。在动物中,由于晶状体尺寸的原因,视网膜下注射程序可能具有挑战性,尤其是在啮齿动物中。本文介绍了大鼠视网膜下注射的方法,能够像在人类中一样在术中可视化和控制注射部位和脱离区域的大小。该手术在全身麻醉和局部麻醉下进行,需要散瞳。使用眼科显微镜,通过 30 G 巩膜通道进行视网膜下注射,将套管尖端轻轻地应用于视网膜以创建视网膜切开术。可输送 10-25 μL 的体积,相当于大鼠视网膜的五分之二到一半。使用眼底照相和光学相干断层扫描的术后即刻检查证实,可见视网膜下积液成功输送到视网膜下间隙。该手术的主要风险包括晶状体损伤(白内障)、脱离失败、玻璃体内出血、视网膜下出血和术后角膜炎。除了将治疗药物输送到视网膜下空间外,该技术还分别用于使用水性或粘性产品诱导短期或长期视网膜脱离。与经巩膜入路不同,这种方法能够在术中精确定位视网膜脱离。
引言
视网膜是位于眼球内部和外部的感光神经元组织。神经视网膜的外层包含光感受器,光感受器是专门将光转换为电化学信号的神经元,因此对视力至关重要。视网膜色素上皮 (RPE) 位于神经视网膜下方,为光感受器提供广泛的代谢支持,促进视觉色素再生及其外部段的定期更新1。
光感受器变性是不可逆性视力丧失的最常见原因,发生在各种视网膜疾病中,例如年龄相关性黄斑变性、色素性视网膜炎、糖尿病性视网膜病变和视网膜脱离 1,2,3,4。这些情况大多由原发性或继发性光感受器丧失引起,通常继发于 RPE 丧失或功能障碍。因此,在体内研究光感受器和 RPE 细胞以防止其退化尤为重要。迄今为止,许多视网膜疾病尚无有效的治疗方法,例如视网膜营养不良(包括色素性视网膜炎)或黄斑变性(包括年龄相关性黄斑变性)。
视网膜下注射,即在光感受器和 RPE 之间输送溶液,创建一个视网膜下空间,其中组件与光感受器和 RPE 细胞直接接触。这种递送方法允许对这些细胞进行靶向治疗,绕过各种视网膜或血管屏障。已经开发并批准了几种用于视网膜下输送的治疗方法,特别是针对遗传性视网膜疾病 5,6。
协调视网膜下分娩的手术实践很重要。在人类中,标准手术涉及 25 G 睫状体玻璃体切除术,由于晶状体与整个眼睛的比例很小,因此相对容易进入眼睛的后段。视网膜下输送通过 25 G 穿刺管刺进行,使用 38 G 或 41 G 硅胶尖端的生物相容性套管,可实现平稳的经视网膜流动5。
在动物中,由于晶状体尺寸的原因,视网膜下注射程序可能具有挑战性。例如,在啮齿动物中,晶状体占据了玻璃体腔的 90%。在大鼠中,晶状体比小鼠占用更少的空间,但仍然很重要(参见图 1A)。此外,视网膜下注射可用于模拟视网膜脱离 (RD),方法是使用粘性溶液来防止 RPE 细胞清除视网膜下液体 7,8。这些模型主要用于视网膜疾病治疗药物的开发。
本文介绍了大鼠视网膜下递送或诱导 RD 的方法,可实现注射部位和脱离视网膜区域的完全术中控制。
研究方案
实验和程序由当地动物伦理委员会批准,并根据当地法律在与实验室相关的设施中进行。所有实验工作均遵守有关生物安全和安全程序的机构政策(当地动物伦理委员会 Charles Darwin CEEACD #5),并遵循欧洲指令 2010/63/EU。本研究使用 8 周龄野生型雌性 Long Evans 大鼠 (Rattus norvegicus)。大鼠的各种视网膜变性模型,如 P23H 和 RCS,可用于测试不同疗法(包括药物和基因疗法)的视网膜下递送。材料表中提供了本研究中使用的试剂和设备的详细信息。
1. 溶液的制备
- 视网膜下递送:在 PBS 或二甲基亚砜中稀释分子,用于视网膜下水递送。
- 诱导 RD:使用 2% 羟丙基甲基纤维素或 1%-5% 透明质酸钠诱导长期 RD。
2. 实验装置
- 将粘合在 10 μL 或 25 μL 注射器上的非斜面 10 mm 30 G 套管金属尖端安装到显微注射器上。
- 将准备好的溶液装入注射器中。
3. 动物准备
- 麻醉
- 全身麻醉:腹膜内注射 40 mg/kg 氯胺酮和 0.14 mg/kg 美托咪定麻醉大鼠。
注意:这种麻醉在手术期间和术后立即探查时持续足够长的时间。 - 散瞳:滴一滴 0.5% 托吡卡胺,使一只眼睛瞳孔散大。
注意:对于右撇子外科医生,左眼的手术会更容易, 反之亦然。 - 局部麻醉( 图 2B):将一滴奥布卡因滴入待手术的眼睛中。
- 全身麻醉:腹膜内注射 40 mg/kg 氯胺酮和 0.14 mg/kg 美托咪定麻醉大鼠。
4. 显微镜下手术
- 术中可视化:使用连接到脚踏开关的眼科显微镜进行手术。
- 巩膜暴露(图 2C、D)
- 使用两根眼睑拉缝线(5-0 或 6-0),固定在上下眼睑睑缘的外侧四分之一。
- 拉动缝合线以实现眼睛的轻柔凸出。
- 巩膜通道(图 2E,F):使用 30 G 针穿过颞球结膜创建巩膜通道,距离角膜缘约 1-2 毫米。
注意:不要勉强插入斜面针尖,而不进一步推动它,以避免接触晶状体和随后白内障的风险。在这个阶段观察结膜出血数十秒。避免填塞出血,因为这会导致血液在玻璃体中淤积并危及手术。使用棉签轻轻擦去通道区域或妨碍可视化的血液。 - 角膜保护(图 2G):在整个过程中使用泪液凝胶作为晶状体-眼睛接口。
- 视网膜平面的可视化(图 2G)
- 将扁平隐形眼镜(直径 8 毫米)放在眼睛表面,以适当的放大倍率观察视网膜平面。
- 使用显微镜的脚踏开关聚焦在视网膜平面上。
- 视网膜下注射(图 2H - M)
- 将套管垂直插入预先形成的巩膜通道(图 2H)。
- 保持套管垂直,避免接触晶状体。
- 慢慢接近视网膜并轻轻按压它,直到观察到视网膜变白( 图 2I 中的箭头)。
- 通过注射流形成的视网膜切开术注射时保持尖端的稳定性(图 2J)。避免过早地从视网膜切开术中抽出尖端,因为这会导致产品被注射到玻璃体中。
- 注射后,从视网膜切开术中取出尖端,然后轻轻地将整个套管从玻璃体腔中取出,确保不触碰晶状体(图 2K)。
注意:如果水泡发育不充分或在注射器排空后脱离的视网膜区域太受限,请使用相同的巩膜通道进行重新注射,并将尖端插入先前形成的视网膜切开术中。 - 确保视网膜脱离改变了瞳孔红反射,而不观察玻璃体腔内的血流(图 2L,M)。
- 手术结束(图 2N,O)
- 取下眼睑缝合线并仔细擦拭任何出血(图 2N)。
- 手动简要评估眼压。
注意:少量玻璃体液可能会进入结膜下间隙,但不得发生主动渗漏(图 2O)。
5. 术后护理和觉醒
- 将氯霉素-视黄醇眼膏涂抹在手术眼上。
- 腹膜内注射 1 mL 5% 葡萄糖一水合物。
- 皮下注射 0.9 mg/kg 阿替美唑。
- 将动物放在温控室中并监测它直到它醒来。
结果
视网膜下注射的成功取决于通过视网膜切开术精确和排他性地输送到视网膜下空间(即,在光感受器和 RPE 层之间),避免视网膜下出血,因为血液对光感受器和 RPE 细胞有毒。通过术中可视化(图 2L)、术后即刻眼底摄影和光学相干断层扫描 (OCT) 确认成功分娩。眼底照相可排除视网膜下出血,而 OCT B 扫描可通过透明视网膜下积液确认视网膜脱离 (RD)(图 1 和 图 3)。此外,眼底照相可以识别手术过程中可能被忽视的晶状体触摸或诱发的白内障(图 3C,D)。摄影和 OCT 扫描都可以估计分离区域或气泡的大小(图 1B-E)。
有几个因素会影响气泡的大小: (1) 注射部位位置:注射部位离视盘越远,脱落区域越小;(2) 注射量:20-25 μL 的注射量可使大鼠约一半的视网膜脱落;(3) 脱离视网膜的质量:在视网膜变性模型(例如 P23H、RCS)中,由于退行性过程(如神经胶质增生和视网膜下物质积累)引起的光感受器和 RPE 细胞之间的阻力增加,脱离可能具有挑战性。在这种情况下,诱导的视网膜脱离通常是平坦的,OCT 扫描对于清晰描绘脱离区域至关重要。
注射部位可能会发生轻微的玻璃体内出血,因为视网膜微血管并不总是可以完全避免(图 3E)。然而,这种出血通常不会扩散到视网膜下间隙。
在脱离不充分的情况下,必须在术中识别该问题,需要立即通过预先形成的视网膜切开术重新注射。在对 20 只大鼠进行的实验过程中,两名外科医生(一名经验丰富的外科医生和一名初学者)执行了分步方法。经验丰富的外科医生在 10 次手术中有 9 次成功,而初学者在 6 次手术中成功了 10 次。
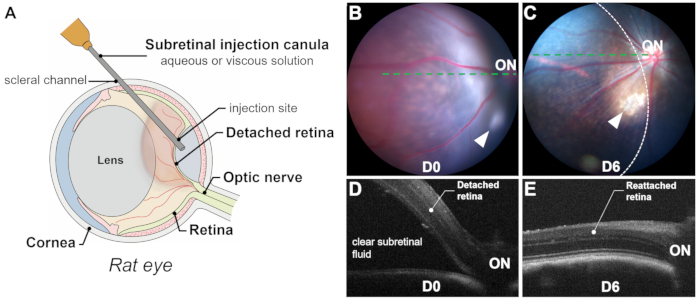
图 1:过程和结果概述。 (A) 大鼠眼视网膜下注射过程的示意图,显示了晶状体的大量体积。(B,C)注射后立即 (B) 和注射后 6 天 (C) 的眼底照片。箭头表示注射部位。视网膜脱离区域由虚线勾勒。(D,E)注射后立即 (D) 和注射后 6 天 (E) 的光学相干断层扫描 B 扫描。ON:视神经。放大倍率:1 倍。 请点击此处查看此图的较大版本。
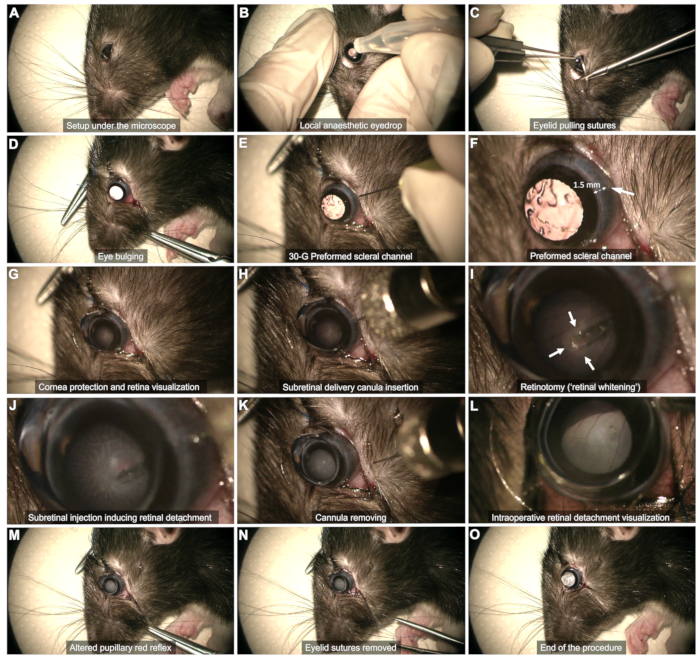
图 2:视网膜下注射方案的步骤。 该方案在全身麻醉下的 8 周龄 Long Evans 大鼠中得到证明。有关每个步骤的详细说明,请参阅视频或文本中的“协议”部分。 请单击此处查看此图的较大版本。

图 3:各种术后眼底摄影结果的示例。 (A) 术后外观正常,注射部位有轻微的色素分散(箭头)。(B) 术后外观正常,注射部位玻璃体内有小气泡。这些小气泡来自注射器,即使在视网膜下空间也是无害的。(C,D)镜片触摸导致轻微 (C) 或显着 (D) 镜片混浊(白内障)。(东、女)轻微 (E) 或更广泛 (F) 玻璃体内出血位于注射部位附近,未扩散到视网膜下间隙。(G) 注射部位出血主要扩散到视网膜下间隙。在这种情况下,视网膜切开术会导致视网膜血管损伤。(H) 巩膜渗透引起的广泛玻璃体内出血。放大倍率:1 倍。 请点击此处查看此图的较大版本。
讨论
本文介绍了大鼠经玻璃体视网膜下递送的方法,术中可视化和控制注射部位和脱离区域。
该方案有两个关键步骤:巩膜暴露和视网膜切开术。正确的定位、暴露和进入是任何外科手术的基本先决条件。在这种情况下,确保最佳进入缝膜和注射部位至关重要。巩膜暴露不足会导致后续步骤中出现可避免的困难。此外,视网膜切开术的质量决定了出血的风险。应尽可能轻柔地进行,并尽可能远离任何视网膜血管。如果作正确,严重玻璃体内或视网膜下出血的风险非常低。
当使用这种方法进行视网膜下注射时,视网膜脱离 (RD) 诱导可能由于多种原因而失败。学习过程中最具挑战性的一步是注射本身。必须仔细选择注射部位,以使液体通过视网膜切开术流过视网膜。由于啮齿动物的玻璃体后部致密,它可以作为经视网膜血流的物理屏障。根据我们的经验,当套管尖端与视网膜成大约 90° 时,经视网膜穿透会顺利发生。强烈建议,尤其是在开始时,练习使用有色溶液(例如荧光素),以确认注射的溶液仅流入视网膜下间隙。
可以确定该技术的两个局限性。首先,经玻璃体通道有接触晶状体的风险。如果保留晶状体后囊,晶状体触摸可能是无害的,因为它不会导致白内障的形成。然而,如果晶状体后囊受损,白内障形成的风险很高,动物可能不再适合实验项目,特别是如果需要视网膜随访检查。其次,这种技术可能会导致多个阶段出血,这可能会阻碍实验过程。结膜出血可能是由眼睑缝合引起的,但这通常不是问题,可以用棉签清洁。此外,在手术过程中进行了两次视网膜切开术,两者都有出血的风险。第一次视网膜切开术是在实验者对视网膜不知情时进行的(通过巩膜通道),这可能导致巩膜穿孔期间玻璃体内出血,使手术进一步复杂化。极少数情况下,可能会发生视网膜下或脉络膜出血。这种“入口视网膜切开术”可以通过通过角膜9 注射来避免,尽管这种方法显着限制了可能的注射部位的范围。如果视网膜血管被套管尖端接触,则第二次视网膜切开术出血的风险更高。必须严格避免视网膜下出血,因为血液成分对光感受器有毒10。由于这些风险,新手实验者应该预期注射失败率为 1/5 到 1/10。根据我们的经验,尚未遇到脉络膜脱离、眼内炎或肌张力亢进引起的视网膜损伤病例。
或者,已经描述了使用经巩膜入路进行视网膜下分娩的方法,以避免经玻璃体排出 8,11。然而,根据我们的经验,这些程序不允许准确或可重复的注射部位或气泡,并且只能在使用小鼠时进行。此外,这些手术需要一个自密封的巩膜切口,该针头穿过 RD 位置的脉络膜和视网膜色素上皮 (RPE)。这带来了视网膜下色素迁移的风险,这可能导致炎症后果并可能扭曲 RD 模型11。此外,注射是在看不到注射器尖端的情况下进行的,这增加了脉络膜上或脉络膜下脱离的风险,而不是 RD。还存在意外视网膜切开术的风险,导致随后的玻璃体内分娩,尤其是在使用视网膜更薄、更脆弱的视网膜变性模型时。
视网膜下递送或诱导 RD 的应用包括在视网膜变性模型或 RD8、11、12、13、14 病例中测试各种治疗方法。在这两种情况下,该程序的目标是模拟最终发生在人类身上的过程。经巩膜和经玻璃体入路都可以模拟 RD,只要 RD 的高度和持续时间足够15。在视网膜下分娩的情况下,目前的方法更接近于非人灵长类动物16 和人类5 中使用的方法,从而增强了数据的可翻译性。
披露声明
S.P:顾问和个人经济利益 - Pixium Vision、GenSight Biologics(这些活动都与此处提供的数据无关)。
致谢
这项研究得到了IHU FOReSIGHT(巴黎)、Fondation Voir & Entendre(巴黎)、UNADEV/Aviesan(在“锥形光感受器神经保护”项目下)、HyVIS(GA 964468)、抗盲基金会(FFB PPA视力恢复:PPA-0919-0772-INSERM;FFB PPA Usher 1B:PPA-0922-0840-INSERM)。AD 的薪水由医学研究基金会(资助号 M2R202106013349,巴黎)、法兰西基金会(资助号 WB-2023-49302,巴黎)和法国眼科学会的资助提供。申办方或资助组织在本研究的设计或实施中没有作用。
材料
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
参考文献
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。