Method Article
Интраоперационная визуализация субретинальной инъекции и отслойки сетчатки у крыс
В этой статье
Резюме
В данной статье описаны методы субретинальной инъекции у крыс с использованием интраоперационной визуализации для контроля как места инъекции, так и области отслойки сетчатки.
Аннотация
Субретинальная инъекция, доставка раствора между фоторецепторами и пигментным эпителием сетчатки (РПЭ), создает субретинальное пространство, в котором компоненты находятся в прямом контакте с фоторецепторами и клетками РПЭ. Этот метод доставки позволяет проводить целенаправленное лечение этих клеток. Разработаны и одобрены терапевтические средства для субретинальных инъекций, особенно при наследственных заболеваниях сетчатки. У животных процедуры субретинальной инъекции могут быть сложными из-за размера хрусталика, особенно у грызунов. В этой статье описываются методы субретинальной инъекции у крыс, позволяющие интраоперационную визуализацию и контроль как места инъекции, так и размера отслоившейся области, как это делается у людей. Процедура проводится под общей и местной анестезией и требует расширения зрачка. С помощью офтальмологического микроскопа субретинальная инъекция выполняется через склеральный канал 30 G, при этом кончик канюли мягко прикладывается к сетчатке для создания ретинотомии. Объем может варьироваться от 10 до 25 мкл, что соответствует от двух пятых до половины сетчатки крысы. Немедленные послеоперационные обследования с использованием фотографирования глазного дна и оптической когерентной томографии подтверждают успешную доставку в субретинальное пространство видимой субретинальной жидкости. Основными рисками этой процедуры являются повреждение хрусталика (катаракта), несостоятельность отслойки, интравитреальное кровоизлияние, субретинальное кровоизлияние и послеоперационный кератит. В дополнение к доставке терапевтических средств в субретинальное пространство, эта техника используется для индуцирования кратковременной или долгосрочной отслойки сетчатки с использованием водных или вязких продуктов соответственно. В отличие от транссклерального доступа, этот метод позволяет точно интраоперационно позиционировать отслойку сетчатки.
Введение
Сетчатка – это светочувствительная нейронная ткань, расположенная во внутренней и задней части глазного яблока. Внешний слой нейросетчатки содержит фоторецепторы, которые являются специализированными нейронами, предназначенными для преобразования света в электрохимические сигналы и, таким образом, необходимы для зрения. Пигментный эпителий сетчатки (РПЭ), расположенный под нейросетчаткой, обеспечивает обширную метаболическую поддержку фоторецепторов, способствуя зрительной пигментной регенерации и регулярному обновлению их внешнихсегментов.
Дегенерация фоторецепторов является наиболее распространенной причиной необратимой потери зрения и возникает при различных заболеваниях сетчатки, таких как возрастная макулярная дегенерация, пигментный ретинит, диабетическая ретинопатия и отслойка сетчатки 1,2,3,4. Большинство этих состояний являются результатом первичной или вторичной потери фоторецепторов, часто вторичной по отношению к потере или дисфункции РПЭ. Поэтому особенно важно изучать фоторецепторы и клетки РПЭ in vivo для предотвращения их дегенерации. На сегодняшний день не существует эффективных методов лечения многочисленных заболеваний сетчатки, таких как дистрофия сетчатки (включая пигментный ретинит) или макулярная дегенерация (включая возрастную макулярную дегенерацию).
Субретинальная инъекция, доставка раствора между фоторецепторами и RPE, создает субретинальное пространство, в котором компоненты находятся в прямом контакте с фоторецепторами и клетками RPE. Такой метод доставки позволяет проводить целенаправленное лечение этих клеток, минуя различные сетчатые или сосудистые барьеры. Было разработано и одобрено несколько терапевтических средств для субретинального родоразрешения, в частности, для лечения наследственных заболеваний сетчатки 5,6.
Важно гармонизировать хирургические практики для субретинального родоразрешения. У людей стандартная процедура включает в себя витрэктомию pars plana 25 G, которая обеспечивает относительно легкий доступ к заднему отрезку глаза, поскольку хрусталик имеет небольшой размер по отношению ко всему глазу. Субретинальная доставка осуществляется через троакар 25 G с использованием биосовместимой канюли с силиконовым наконечником 38 G или 41 G, что обеспечивает плавный трансретинальный поток5.
У животных субретинальные инъекции могут быть сложными из-за размера хрусталика. Например, у грызунов хрусталик занимает до 90% полости стекловидного тела. У крыс хрусталик занимает меньше места, чем у мышей, но остается значимым (см. рисунок 1А). Кроме того, субретинальные инъекции могут быть использованы для моделирования отслойки сетчатки (ПД) с использованием вязких растворов для предотвращения клиренса субретинальной жидкости клетками РПЭ 7,8. Эти модели в основном используются при разработке терапевтических средств для лечения заболеваний сетчатки.
В данной статье описаны методы субретинальной доставки или индуцированной ПД у крыс, позволяющие осуществлять полный интраоперационный контроль места инъекции и отслоившейся области сетчатки.
протокол
Эксперименты и процедуры были одобрены местным комитетом по этике животных и проводились в помещениях, связанных с лабораторией, в соответствии с местным законодательством. Все экспериментальные работы соответствовали институциональной политике по биозащите и процедурам безопасности (Local Animal Ethics Committee, Charles Darwin CEEACD #5) и соответствовали Европейской директиве 2010/63/EU. В этом исследовании использовались восьминедельные самки дикого типа крыс Лонг Эванс (Rattus norvegicus). Различные модели дегенерации сетчатки у крыс, такие как P23H и RCS, могут быть использованы для тестирования субретинальной доставки различных терапевтических средств, включая лекарства и генную терапию. Подробная информация о реагентах и оборудовании, использованных в данном исследовании, представлена в Таблице материалов.
1. Приготовление растворов
- Субретинальная доставка: Разбавьте молекулы в PBS или диметилсульфоксиде для доставки в водный субретинальный период.
- Индукция ПД: Используйте 2% гидроксипропилметилцеллюлозу или 1%-5% гиалуронат натрия для индуцирования долгосрочного РД.
2. Экспериментальная установка
- Установите металлический наконечник канюли диаметром 10 мм 30 G, зацементированный на шприце объемом 10 μл или 25 μл, на микроинъектор.
- Загрузите приготовленный раствор в шприц.
3. Подготовка животных
- Анестезия
- Общая анестезия: Обезболите крыс с помощью внутрибрюшинной инъекции 40 мг/кг кетамина и 0,14 мг/кг медетомидина.
ПРИМЕЧАНИЕ: Эта анестезия длится достаточно долго на протяжении всей процедуры и для непосредственных послеоперационных исследований. - Расширение зрачка: Нанесите одну каплю 0,5% тропикамида для получения мидриаза в одном глазу.
ПРИМЕЧАНИЕ: Для хирургов-правшей процедура будет проще в левом глазу, и наоборот. - Местная анестезия ( Рисунок 2B): Закапайте одну глазную каплю оксибупрокаина в оперируемый глаз.
- Общая анестезия: Обезболите крыс с помощью внутрибрюшинной инъекции 40 мг/кг кетамина и 0,14 мг/кг медетомидина.
4. Хирургическое вмешательство под микроскопом
- Интраоперационная визуализация: для проведения операции используйте офтальмологический микроскоп, подключенный к ножному переключателю.
- Склеральное воздействие (рис. 2C,D)
- Используйте два оттягивающих век швов (5-0 или 6-0), закрепленных на внешней четверти глазного края на верхнем и нижнем веках.
- Натяните швы, чтобы добиться мягкого выпуклости глаза.
- Склеральный канал (рис. 2E,F): Используйте иглу 30 G для создания склерального канала через височную бульбарную конъюнктиву, примерно в 1-2 мм от лимба роговицы.
ПРИМЕЧАНИЕ: Едва вставляйте скошенный кончик иглы, не продвигая его дальше, чтобы избежать риска прикосновения к линзе и последующей катаракты. Наблюдайте за кровоизлиянием в конъюнктиву в течение десятков секунд на этой стадии. Избегайте тампонадирования кровотечения, так как это может привести к скоплению крови в стекловидном теле и поставить под угрозу процедуру. Аккуратно сотрите ватной палочкой кровь в области канала или затрудняющую визуализацию. - Защита роговицы (Рисунок 2G): Используйте слезный гель в качестве интерфейса хрусталик-глаз на протяжении всей процедуры.
- Визуализация плоскости сетчатки (Рисунок 2G)
- Поместите плоскую контактную линзу (диаметром 8 мм) на поверхность глаза, чтобы визуализировать плоскость сетчатки с правильным увеличением.
- Используйте ножной переключатель микроскопа для фокусировки на плоскости сетчатки.
- Субретинальная инъекция (Рисунок 2H - M)
- Вставьте канюлю вертикально через предварительно сформированный склеральный канал (Рисунок 2H).
- Избегайте прикосновения к линзе, держа канюлю вертикально.
- Медленно приближайтесь к сетчатке и осторожно нажимайте на нее, пока не будет наблюдаться отбеливание сетчатки (стрелки на рисунке 2I).
- Сохраняйте стабильность наконечника во время инъекции через ретинотомию, образованную потоком инъекции (Рисунок 2J). Избегайте слишком раннего извлечения наконечника из ретинотомии, так как это приведет к введению продукта в стекловидное тело.
- После инъекции удалите наконечник из ретинотомии, а затем аккуратно извлеките всю канюлю из полости стекловидного тела, следя за тем, чтобы хрусталик не был тронут (Рисунок 2K).
ПРИМЕЧАНИЕ: Если пузырь недостаточно развит или отслоившаяся область сетчатки слишком ограничена после того, как шприц опустеет, выполните повторную инъекцию с использованием того же склерального канала и вставкой наконечника в ранее сформированную ретинотомию. - Убедитесь, что зрачковый красный рефлекс изменен отслойкой сетчатки, не наблюдая за кровотоком в полости стекловидного тела (рис. 2L,M).
- Окончание операции (Рисунок 2N,O)
- Снимите швы на веках и тщательно промойте любое кровотечение (Рисунок 2N).
- Кратко оцените внутриглазное давление вручную.
ПРИМЕЧАНИЕ: Небольшое количество стекловидной жидкости может выйти в субконъюнктивальное пространство, но активная утечка не должна происходить (Рисунок 2O).
5. Послеоперационный уход и пробуждение
- Нанесите на прооперированный глаз глазную мазь хлорамфеникол-ретинол.
- Введите 1 мл 5% моногидрата глюкозы внутрибрюшинно.
- Введите 0,9 мг/кг атипамезола подкожно.
- Поместите животное в камеру с регулируемой температурой и следите за ним, пока оно не проснется.
Результаты
Успех субретинальной инъекции зависит от точной и эксклюзивной доставки в субретинальное пространство (т.е. между фоторецепторами и слоями RPE) через ретинотомию, избегая субретинального кровоизлияния, поскольку кровь токсична для фоторецепторов и клеток RPE. Успешное родоразрешение подтверждается интраоперационной визуализацией (рис. 2L), фотографированием глазного дна сразу после операции и оптической когерентной томографией (ОКТ). Фотография глазного дна исключает субретинальное кровоизлияние, в то время как ОКТ-В-сканирование подтверждает отслойку сетчатки (ПД) с прозрачной субретинальной жидкостью (Рисунок 1 и Рисунок 3). Кроме того, фотография глазного дна может выявить прикосновение к хрусталику или индуцированную катаракту, которые могут быть незамечены во время процедуры (Рисунок 3C, D). Как фотография, так и ОКТ-сканирование могут оценить размер отслоившейся области или пузырька (Рисунок 1B-E).
На размер пузырька влияют несколько факторов: (1) Расположение места инъекции: чем дальше место инъекции от диска зрительного нерва, тем меньше отслоившаяся область; (2) Объем инъекции: объем инъекции 20-25 мкл может отсоединить примерно половину сетчатки у крыс; (3) Качество отслоившейся сетчатки: В моделях дегенерации сетчатки (например, P23H, RCS) отслоение может быть затруднено из-за повышенной резистентности между фоторецепторами и клетками RPE, вызванной дегенеративными процессами, такими как глиоз и накопление субретинального материала. В таких случаях индуцированная отслойка сетчатки, как правило, плоская, и ОКТ-сканирование имеет решающее значение для четкого разграничения отслоившейся области.
В месте инъекции может произойти незначительное интравитреальное кровоизлияние, поскольку микрососуды сетчатки не всегда можно полностью избежать (рисунок 3E). Однако такие кровоизлияния обычно не распространяются в субретинальное пространство.
В случаях недостаточной отслойки проблема должна быть распознана интраоперационно, что требует немедленной повторной инъекции через предварительно сформированную ретинотомию. Во время экспериментального сеанса с 20 крысами два хирурга (один опытный и один начинающий) провели поэтапный метод. Опытный хирург добился успеха в 9 из 10 процедур, в то время как новичок – в 6 из 10.
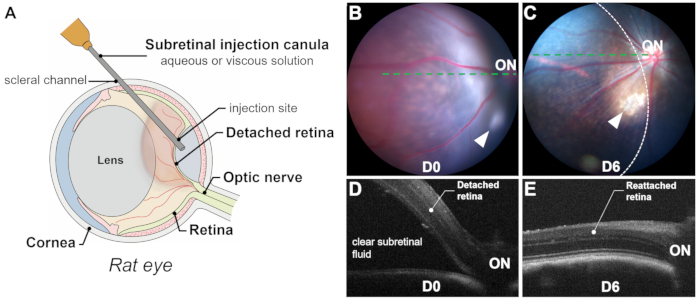
Рисунок 1: Обзор процесса и результатов. (A) Схематическое изображение процесса субретинальной инъекции в глаз крысы, показывающее значительный объем хрусталика. (В,В) Фотографирование глазного дна сразу после инъекции (В) и через 6 дней после инъекции (С). Стрелками обозначено место инъекции. Область отслойки сетчатки очерчена пунктирной линией. (Д,Э) Оптическая когерентная томография B-скан сразу после инъекции (D) и через 6 дней после инъекции (E). ВКЛ: зрительный нерв. Увеличение: 1x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
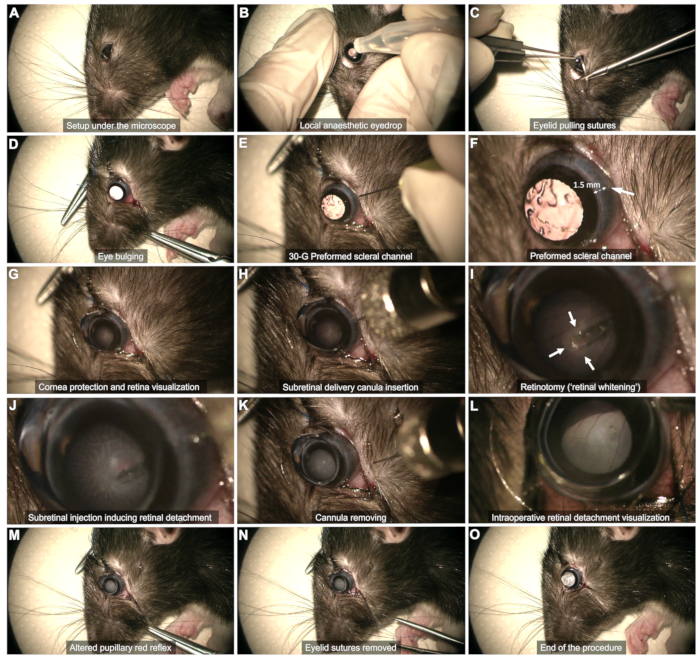
Рисунок 2: Этапы протокола субретинальной инъекции. Протокол был продемонстрирован на 8-недельной крысе Лонг Эванс под общим наркозом. Подробное описание каждого шага можно найти в видео или в разделе «Протокол» в тексте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Примеры различных результатов послеоперационной фотографии глазного дна. (A) Нормальный послеоперационный вид с незначительной дисперсией пигмента в месте инъекции (стрелка). (В) Нормальный послеоперационный вид с небольшим интравитреальным пузырьком воздуха в месте инъекции. Эти маленькие пузырьки воздуха исходят из шприца и безвредны даже в субретинальном пространстве. (К,Г) Прикосновение к хрусталику приводит к незначительному (C) или значительному (D) помутнению хрусталика (катаракте). (Э,Ж) Незначительное (E) или более обширное (F) интравитреальное кровотечение, локализованное вблизи места инъекции, без распространения в субретинальное пространство. (G) Кровотечение в месте инъекции распространяется преимущественно в субретинальное пространство. В этом случае ретинотомия привела к повреждению кровеносного сосуда сетчатки. (H) Обширное интравитреальное кровоизлияние в результате проникновения склеры. Увеличение: 1x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
Обсуждение
В данной статье описаны методы трансвитреальной субретинальной доставки у крыс с интраоперационной визуализацией и контролем как места инъекции, так и отслоившейся области.
В этом протоколе есть два важнейших этапа: склеральный контакт и ретинотомия. Правильное позиционирование, воздействие и доступ являются фундаментальными предпосылками для любой хирургической процедуры. В этом случае крайне важно обеспечить оптимальный доступ к склере и месту инъекции. Недостаточное воздействие склеры может привести к предотвратимым трудностям на последующих этапах. Кроме того, качество ретинотомии определяет риск кровотечения. Она должна выполняться как можно более щадяще и как можно дальше от любых сосудов сетчатки. При правильном подходе риск значительного интравитреального или субретинального кровотечения очень низок.
При использовании этого подхода для субретинальной инъекции индукция отслойки сетчатки (ПД) может быть неудачной по нескольким причинам. Самым сложным этапом в процессе обучения является сама инъекция. Место инъекции должно быть тщательно выбрано, чтобы жидкость могла течь через сетчатку через ретинотомию. Из-за плотного заднего стекловидного тела у грызунов оно может выступать в качестве физического барьера для трансретинального потока. По нашему опыту, трансретинальное проникновение происходит плавно, когда кончик канюли расположен примерно под углом 90° к сетчатке. Настоятельно рекомендуется, особенно в начале, попрактиковаться в использовании цветных растворов, таких как флуоресцеин, чтобы подтвердить, что введенный раствор течет только в субретинальное пространство.
Можно выделить два ограничения этого метода. Во-первых, трансвитреальный проход подвержен риску соприкосновения с хрусталиком. Прикосновение к линзе может быть безобидным, если капсула заднего хрусталика сохранена, так как оно не должно приводить к образованию катаракты. Однако, если капсула заднего хрусталика повреждена, риск образования катаракты высок, и животное может больше не быть пригодным для экспериментального проекта, особенно если требуется последующее обследование сетчатки. Во-вторых, этот метод может привести к кровотечению на нескольких стадиях, что может затруднить экспериментальный процесс. Кровотечение из конъюнктивы может возникнуть в результате наложения швов на веки, хотя обычно это не является проблемой и может быть очищено ватным тампоном. Кроме того, во время процедуры проводятся две ретинотомии, обе из которых несут риск кровотечения. Первая ретинотомия выполняется, когда экспериментатор слеп к сетчатке (через склеральный канал), что может привести к интравитреальному кровоизлиянию во время склеральной перфорации, что еще больше усложняет процедуру. В редких случаях может наблюдаться субретинальное или хориоидальное кровотечение. Этой «входной ретинотомии» можно избежать путем инъекции через роговицу9, хотя такой подход значительно ограничивает диапазон возможных мест инъекции. Вторая ретинотомия имеет более высокий риск кровотечения, если кончик канюли затрагивает сосуды сетчатки. Субретинального кровоизлияния необходимо строго избегать, так как компоненты крови токсичны для фоторецепторов10. Из-за этих рисков начинающим экспериментаторам следует ожидать частоты неудач от 1 из 5 до 1 из 10 инъекций. По нашему опыту, не было обнаружено ни одного случая отслойки хориоидеи, эндофтальмита или повреждения сетчатки, вызванного гипертонией.
В качестве альтернативыбыли описаны методы, использующие транссклеральные подходы для субретинальной доставки, которые позволяют избежать трансвитреозного пассажа. Однако, по нашему опыту, эти процедуры не позволяют точно или воспроизводимо получить места инъекций или пузырьки и должны выполняться только при использовании мышей. Кроме того, эти процедуры требуют самогерметизирующегося склерального разреза с иглой, которая пересекает сосудистую оболочку и пигментный эпителий сетчатки (РПЭ) в месте ПД. Это создает риск субретинальной миграции пигмента, что может привести к воспалительным последствиям и может исказить модель RD11. Кроме того, инъекция выполняется без видимости кончика шприца, что увеличивает риск супра- или субхориоидальной отслойки, а не ПД. Также существует риск непреднамеренной ретинотомии, приводящей к последующей интравитреальной доставке, особенно при работе с моделями дегенерации сетчатки, которые имеют более тонкую и хрупкую сетчатку.
Применение субретинальной доставки или индуцированной ПД включает тестирование различных терапевтических средств на моделях дегенерации сетчатки или в случаях ПД 8,11,12,13,14. В обоих случаях целью процедуры является имитация процессов, которые в конечном итоге происходят у человека. Как транссклеральный, так и трансвитреальный подходы могут моделировать ПД, если высота и продолжительность ПД достаточны15. В случае субретинальной доставки современные методы более точно повторяют те, которые используются у нечеловекообразных приматов16 ичеловека5, тем самым улучшая переводимость данных.
Раскрытие информации
С..: Консультанты и личные финансовые интересы - Pixium Vision, GenSight Biologics (ни одна из этих видов деятельности не имеет никакого отношения к представленным здесь данным).
Благодарности
Это исследование было поддержано IHU FOReSIGHT (Париж), Fondation Voir & Entendre (Париж), UNADEV/Aviesan (в рамках проекта «Нейропротекция конусных фоторецепторов», Париж), HyVIS (GA 964468), Фондом борьбы со слепотой (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). Заработная плата A.D. была обеспечена за счет грантов Фонда медицинских исследований (грант No M2R202106013349, Париж), Фонда де Франс (грант No WB-2023-49302, Париж) и Французского общества офтальмологии. Спонсор или финансирующие организации не играли никакой роли в планировании или проведении этого исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Ссылки
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены