Method Article
Visualizzazione intraoperatoria dell'iniezione sottoretinica e del distacco di retina nei ratti
In questo articolo
Riepilogo
Questo articolo descrive i metodi per l'iniezione sottoretinica nei ratti, utilizzando la visualizzazione intraoperatoria per controllare sia il sito di iniezione che l'area di distacco della retina.
Abstract
L'iniezione sottoretinica, la somministrazione di una soluzione tra i fotorecettori e l'epitelio pigmentato retinico (RPE), crea uno spazio sottoretinico in cui i componenti sono in contatto diretto con i fotorecettori e le cellule RPE. Questo metodo di somministrazione consente un trattamento mirato di queste cellule. Sono stati sviluppati e approvati terapie per l'iniezione sottoretinica, in particolare per le malattie retiniche ereditarie. Negli animali, le procedure di iniezione sottoretinica possono essere difficili a causa delle dimensioni della lente, specialmente nei roditori. Questo articolo descrive i metodi per l'iniezione sottoretinica nei ratti, consentendo la visualizzazione intraoperatoria e il controllo sia del sito di iniezione che delle dimensioni dell'area distaccata, come eseguito nell'uomo. La procedura viene eseguita in anestesia generale e locale e richiede la dilatazione della pupilla. Utilizzando un microscopio oftalmico, l'iniezione sottoretinica viene eseguita attraverso un canale sclerale da 30 G, con la punta della cannula applicata delicatamente alla retina per creare una retinotomia. Possono essere erogati volumi compresi tra 10 e 25 μl, corrispondenti a due quinti o metà della retina di ratto. Gli esami postoperatori immediati mediante fotografia del fondo oculare e tomografia a coerenza ottica confermano l'avvenuta somministrazione nello spazio sottoretinico con liquido sottoretinico visibile. I principali rischi di questa procedura includono danni al cristallino (cataratta), ritardo del distacco, emorragia intravitreale, emorragia sottoretinica e cheratite postoperatoria. Oltre a somministrare terapie nello spazio sottoretinico, questa tecnica viene utilizzata per indurre il distacco di retina a breve o lungo termine utilizzando prodotti acquosi o viscosi, rispettivamente. A differenza dell'approccio transsclerale, questo metodo consente un preciso posizionamento intraoperatorio del distacco di retina.
Introduzione
La retina è un tessuto neuronale sensibile alla luce situato nella parte interna e posteriore del bulbo oculare. Lo strato esterno della neuroretina contiene fotorecettori, che sono neuroni specializzati dedicati a convertire la luce in segnali elettrochimici e sono quindi essenziali per la visione. L'epitelio pigmentato retinico (RPE), situato sotto la neuroretina, fornisce un ampio supporto metabolico ai fotorecettori, facilitando la rigenerazione visiva del pigmento e il rinnovamento regolare dei loro segmentiesterni1.
La degenerazione dei fotorecettori è la causa più comune di perdita irreversibile della vista e si verifica in varie malattie della retina, come la degenerazione maculare legata all'età, la retinite pigmentosa, la retinopatia diabetica e il distacco della retina 1,2,3,4. La maggior parte di queste condizioni deriva dalla perdita primaria o secondaria di fotorecettori, spesso secondaria alla perdita o alla disfunzione dell'RPE. Pertanto, è particolarmente importante studiare i fotorecettori e le cellule RPE in vivo per prevenirne la degenerazione. Ad oggi, non esistono terapie efficaci per numerose malattie della retina, come le distrofie retiniche (inclusa la retinite pigmentosa) o la degenerazione maculare (inclusa la degenerazione maculare legata all'età).
L'iniezione sottoretinica, la somministrazione di una soluzione tra i fotorecettori e l'RPE, crea uno spazio sottoretinico in cui i componenti sono a diretto contatto con i fotorecettori e le cellule RPE. Questo metodo di somministrazione consente un trattamento mirato di queste cellule, bypassando varie barriere retiniche o vascolari. Sono state sviluppate e approvate diverse terapie per il rilascio sottoretinico, in particolare per le malattie retiniche ereditarie 5,6.
È importante armonizzare le pratiche chirurgiche per il parto sottoretinico. Nell'uomo, la procedura standard prevede la vitrectomia pars plana di 25 G, che fornisce un accesso relativamente facile al segmento posteriore dell'occhio perché il cristallino è piccolo in proporzione all'intero occhio. Il rilascio sottoretinico viene eseguito attraverso un trocar da 25 G utilizzando una cannula biocompatibile con punta in silicone da 38 G o 41 G, che consente un flusso transretinico regolare5.
Negli animali, le procedure di iniezione sottoretinica possono essere difficili a causa delle dimensioni della lente. Ad esempio, nei roditori, il cristallino occupa fino al 90% della cavità vitreale. Nei ratti, la lente occupa meno spazio rispetto ai topi, ma rimane significativa (vedi Figura 1A). Inoltre, le iniezioni sottoretiniche possono essere utilizzate per modellare il distacco di retina (RD) utilizzando soluzioni viscose per prevenire la clearance del liquido sottoretinico da parte delle cellule RPE 7,8. Questi modelli sono impiegati principalmente nello sviluppo di terapie per le malattie della retina.
Questo articolo descrive i metodi per la somministrazione sottoretinica o la RD indotta nei ratti, consentendo il controllo intraoperatorio totale del sito di iniezione e dell'area retinica distaccata.
Protocollo
Gli esperimenti e le procedure sono stati approvati dal Comitato Etico Animale Locale e condotti in strutture associate al laboratorio, nel rispetto della legislazione locale. Tutti i lavori sperimentali hanno aderito alle politiche istituzionali in materia di biosicurezza e procedure di sicurezza (Local Animal Ethics Committee, Charles Darwin, CEEACD #5) e hanno seguito la Direttiva Europea 2010/63/UE. In questo studio sono stati utilizzati ratti Long Evans femmina di tipo selvatico di otto settimane (Rattus norvegicus). Vari modelli di degenerazione retinica dei ratti, come P23H e RCS, possono essere utilizzati per testare la somministrazione sottoretinica di diverse terapie, inclusi farmaci e terapie geniche. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono forniti nella Tabella dei materiali.
1. Preparazione delle soluzioni
- Consegna sottoretinica: Diluire le molecole in PBS o dimetilsolfossido per la somministrazione acquosa sottoretinica.
- Induzione di RD: utilizzare il 2% di idrossipropilmetilcellulosa o l'1%-5% di ialuronato di sodio per indurre RD a lungo termine.
2. Configurazione sperimentale
- Montare una punta metallica non smussata da 10 mm e 30 G, cementata su una siringa da 10 μl o 25 μl, su un microiniettore.
- Caricare la soluzione preparata nella siringa.
3. Preparazione degli animali
- Anestesia
- Anestesia generale: anestetizzare i ratti con un'iniezione intraperitoneale di 40 mg/kg di ketamina e 0,14 mg/kg di medetomidina.
NOTA: Questa anestesia dura abbastanza a lungo per la durata della procedura e per le esplorazioni postoperatorie immediate. - Dilatazione della pupilla: Mettere una goccia di tropicamide allo 0,5% per ottenere la midriasi in un occhio.
NOTA: Per i chirurghi destrimani, la procedura sarà più facile nell'occhio sinistro e viceversa. - Anestesia locale (Figura 2B): Mettere un collirio di ossibuprocaina nell'occhio da operare.
- Anestesia generale: anestetizzare i ratti con un'iniezione intraperitoneale di 40 mg/kg di ketamina e 0,14 mg/kg di medetomidina.
4. Chirurgia al microscopio
- Visualizzazione intraoperatoria: utilizzare un microscopio oftalmico collegato a un interruttore a pedale per eseguire l'intervento chirurgico.
- Esposizione sclerale (Figura 2C,D)
- Utilizzare due punti di sutura per l'estrazione delle palpebre (5-0 o 6-0) ancorate al quarto esterno del margine palpebrale alle palpebre superiore e inferiore.
- Tirare i punti di sutura per ottenere un leggero rigonfiamento dell'occhio.
- Canale sclerale (Figura 2E, F): utilizzare un ago da 30 G per creare un canale sclerale attraverso la congiuntiva bulbare temporale, a circa 1-2 mm dal limbus corneale.
NOTA: Inserire a malapena la punta dell'ago smussata senza spingerla ulteriormente per evitare il rischio di contatto con la lente e successiva cataratta. Osservare l'emorragia congiuntivale per decine di secondi in questa fase. Evitare di tamponare l'emorragia, in quanto ciò può causare il ristagno di sangue nel vitreo e compromettere la procedura. Asciugare delicatamente il sangue nell'area del canale o che impedisce la visualizzazione utilizzando un batuffolo di cotone. - Protezione della cornea (Figura 2G): utilizzare un gel lacrimale come interfaccia lente-occhio durante tutta la procedura.
- Visualizzazione del piano retinico (Figura 2G)
- Posizionare una lente a contatto piatta (8 mm di diametro) sulla superficie dell'occhio per visualizzare il piano retinico con un ingrandimento adeguato.
- Utilizzare l'interruttore a pedale del microscopio per mettere a fuoco il piano retinico.
- Iniezione sottoretinica (Figura 2H - M)
- Inserire la cannula verticalmente attraverso il canale sclerale preformato (Figura 2H).
- Evitare di toccare la lente mantenendo la cannula verticale.
- Avvicinarsi lentamente alla retina e premerla delicatamente fino a quando non si osserva lo sbiancamento della retina (frecce nella Figura 2I).
- Mantenere la stabilità della punta durante l'iniezione attraverso la retinotomia formata dal flusso di iniezione (Figura 2J). Evitare di estrarre la punta troppo presto dalla retinotomia, poiché ciò causerà l'iniezione del prodotto nel vitreo.
- Dopo l'iniezione, rimuovere la punta dalla retinotomia, quindi estrarre delicatamente l'intera cannula dalla cavità vitreale, assicurandosi che la lente non venga toccata (Figura 2K).
NOTA: Se la bolla non è sufficientemente sviluppata o l'area retinica distaccata è troppo ristretta una volta che la siringa è vuota, eseguire una reiniezione utilizzando lo stesso canale sclerale e inserendo la punta nella retinotomia precedentemente formata. - Assicurarsi che il riflesso pupillare del rosso sia alterato dal distacco di retina senza osservare il flusso sanguigno all'interno della cavità vitreale (Figura 2L,M).
- Fine dell'intervento chirurgico (Figura 2N,O)
- Rimuovere le suture palpebrali e tamponare accuratamente l'eventuale sanguinamento (Figura 2N).
- Valutare brevemente la pressione intraoculare manualmente.
NOTA: Una piccola quantità di liquido vitreo può emergere nello spazio sottocongiuntivale, ma non deve verificarsi una perdita attiva (Figura 2O).
5. Cure postoperatorie e risveglio
- Applicare l'unguento oculare al cloramfenicolo-retinolo sull'occhio operato.
- Somministrare 1 mL di glucosio monoidrato al 5% per via intraperitoneale.
- Iniettare 0,9 mg/kg di atipamezolo per via sottocutanea.
- Metti l'animale in una camera a temperatura controllata e monitoralo fino al suo risveglio.
Risultati
Il successo di un'iniezione sottoretinica si basa su una somministrazione precisa ed esclusiva nello spazio sottoretinico (cioè tra i fotorecettori e gli strati di RPE) attraverso la retinotomia, evitando l'emorragia sottoretinica, poiché il sangue è tossico per i fotorecettori e le cellule RPE. Il successo del parto è confermato dalla visualizzazione intraoperatoria (Figura 2L), dalla fotografia del fondo oculare postoperatorio immediato e dalla tomografia a coerenza ottica (OCT). La fotografia del fondo oculare esclude l'emorragia sottoretinica, mentre le scansioni OCT B confermano il distacco di retina (RD) con liquido sottoretinico chiaro (Figura 1 e Figura 3). Inoltre, la fotografia del fondo oculare può identificare il contatto con la lente o la cataratta indotta che potrebbero passare inosservate durante la procedura (Figura 3C, D). Sia la fotografia che le scansioni OCT possono stimare le dimensioni dell'area staccata o della bolla (Figura 1B-E).
Diversi fattori influenzano le dimensioni della bolla: (1) Posizione del sito di iniezione: più il sito di iniezione è lontano dal disco ottico, più piccola è l'area distaccata; (2) Volume iniettato: un volume di iniezione di 20-25 μL può staccare circa metà della retina nei ratti; (3) Qualità della retina distaccata: nei modelli di degenerazione retinica (ad esempio, P23H, RCS), il distacco può essere difficile a causa dell'aumento della resistenza tra fotorecettori e cellule RPE causata da processi degenerativi, come la gliosi e l'accumulo di materiale sottoretinico. In questi casi, i distacchi di retina indotti sono tipicamente piatti e le scansioni OCT sono fondamentali per delineare chiaramente l'area distaccata.
Una piccola emorragia intravitreale può verificarsi nel sito di iniezione perché i microvasi retinici non possono sempre essere completamente evitati (Figura 3E). Tuttavia, tali emorragie in genere non si estendono nello spazio sottoretinico.
Nei casi di distacco insufficiente, il problema deve essere riconosciuto intraoperatoriamente, rendendo necessaria l'immediata reiniezione attraverso la retinotomia preformata. Durante una sessione sperimentale con 20 ratti, due chirurghi (uno esperto e uno principiante) hanno eseguito il metodo passo dopo passo. Il chirurgo esperto ha ottenuto il successo in 9 procedure su 10, mentre il principiante ha avuto successo in 6 su 10.
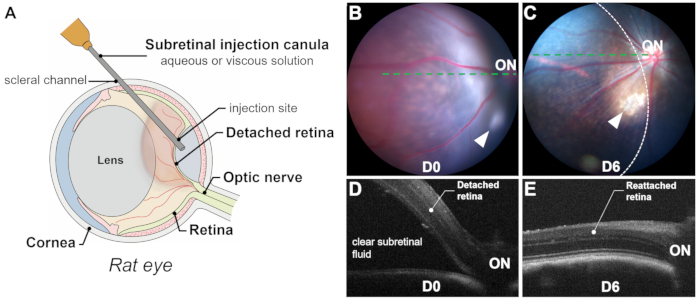
Figura 1: Panoramica del processo e dei risultati. (A) Rappresentazione schematica del processo di iniezione sottoretinica in un occhio di ratto, che mostra il volume significativo del cristallino. (B,C) Fotografia del fondo oculare subito dopo l'iniezione (B) e 6 giorni dopo l'iniezione (C). Le punte delle frecce indicano il sito di iniezione. L'area di distacco della retina è delineata da una linea tratteggiata. (D,E) Tomografia a coerenza ottica B-scan immediatamente dopo l'iniezione (D) e 6 giorni dopo l'iniezione (E). ON: nervo ottico. Ingrandimento: 1x. Clicca qui per visualizzare una versione più grande di questa figura.
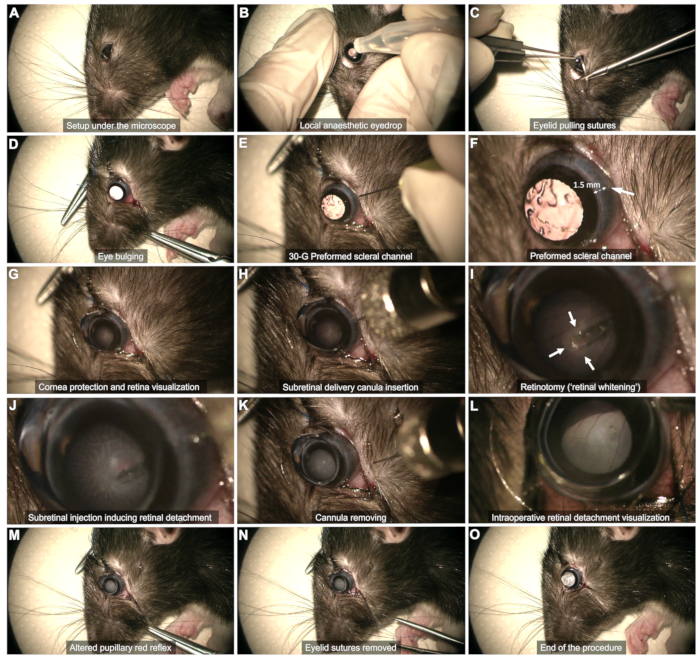
Figura 2: Fasi del protocollo di iniezione sottoretinica. Il protocollo è stato dimostrato in un ratto Long Evans di 8 settimane in anestesia generale. Per una descrizione dettagliata di ogni fase, fare riferimento al video o alla sezione "Protocollo" nel testo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Esempi di vari risultati della fotografia del fondo oculare postoperatorio. (A) Aspetto postoperatorio normale con minore dispersione di pigmento nel sito di iniezione (freccia). (B) Aspetto postoperatorio normale con una piccola bolla d'aria intravitreale nel sito di iniezione. Queste piccole bolle d'aria hanno origine dalla siringa e sono innocue, anche nello spazio sottoretinico. (C, D) Contatto con la lente con conseguente opacizzazione minore (C) o significativa (D) della lente (cataratta). (E,F) Sanguinamento intravitreale minore (E) o più esteso (F) localizzato vicino al sito di iniezione, senza diffusione nello spazio sottoretinico. (G) Sanguinamento nel sito di iniezione che si diffonde prevalentemente nello spazio sottoretinico. In questo caso, la retinotomia ha causato una lesione di un vaso sanguigno retinico. (H) Emorragia intravitreale estesa derivante da penetrazione sclerale. Ingrandimento: 1x. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo descrive i metodi per la somministrazione sottoretinica transvitreale nei ratti con visualizzazione intraoperatoria e controllo sia del sito di iniezione che dell'area distaccata.
Ci sono due passaggi critici in questo protocollo: l'esposizione sclerale e la retinotomia. Il corretto posizionamento, l'esposizione e l'accesso sono prerequisiti fondamentali per qualsiasi procedura chirurgica. In questo caso, è fondamentale garantire un accesso ottimale alla sclera e al sito di iniezione. Un'esposizione sclerale insufficiente può portare a difficoltà evitabili nelle fasi successive. Inoltre, la qualità della retinotomia determina il rischio di emorragia. Dovrebbe essere eseguito il più delicatamente possibile e il più lontano possibile da qualsiasi vaso retinico. Se eseguito correttamente, il rischio di sanguinamento intravitreale o sottoretinico significativo è molto basso.
Quando si utilizza questo approccio per l'iniezione sottoretinica, l'induzione del distacco di retina (RD) può fallire per diversi motivi. La fase più impegnativa del processo di apprendimento è l'iniezione stessa. Il sito di iniezione deve essere scelto con cura per consentire al liquido di fluire attraverso la retina attraverso la retinotomia. A causa del denso corpo vitreo posteriore nei roditori, può fungere da barriera fisica al flusso transretinico. Nella nostra esperienza, la penetrazione transretinica avviene senza problemi quando la punta della cannula è posizionata a circa 90° rispetto alla retina. Si consiglia vivamente, soprattutto all'inizio, di esercitarsi nell'uso di soluzioni colorate, come la fluoresceina, per confermare che la soluzione iniettata fluisce solo nello spazio sottoretinico.
Si possono identificare due limitazioni di questa tecnica. In primo luogo, il passaggio transvitreale è a rischio di toccare la lente. Un tocco di lente può essere innocuo se la capsula posteriore del cristallino è conservata, poiché non dovrebbe portare alla formazione di cataratta. Tuttavia, se la capsula posteriore del cristallino è danneggiata, il rischio di formazione di cataratta è elevato e l'animale potrebbe non essere più adatto al progetto sperimentale, in particolare se sono necessari esami di follow-up della retina. In secondo luogo, questa tecnica può portare a sanguinamento in diverse fasi, il che potrebbe ostacolare il processo sperimentale. Il sanguinamento congiuntivale può derivare dalle suture palpebrali, anche se questo di solito non è un problema e può essere pulito con un batuffolo di cotone. Inoltre, durante la procedura vengono eseguite due reretitomie, entrambe le quali comportano un rischio di emorragia. La prima retinotomia viene eseguita mentre lo sperimentatore è cieco alla retina (attraverso il canale sclerale), il che può portare a un'emorragia intravitreale durante la perforazione sclerale, complicando ulteriormente la procedura. Raramente, può verificarsi sanguinamento subretinico o coroideale. Questa "retinotomia d'ingresso" può essere evitata iniettando attraverso la cornea9, sebbene questo approccio limiti significativamente la gamma di possibili siti di iniezione. La seconda retinotomia è a maggior rischio di sanguinamento se i vasi retinici vengono toccati dalla punta della cannula. L'emorragia sottoretinica deve essere rigorosamente evitata, poiché i componenti del sangue sono tossici per i fotorecettori10. A causa di questi rischi, gli sperimentatori alle prime armi dovrebbero aspettarsi un tasso di fallimento da 1 su 5 a 1 su 10 iniezioni. Nella nostra esperienza, non sono stati riscontrati casi di distacco coroideale, endoftalmite o danno retinico indotto da ipertonia.
In alternativa, sono stati descritti metodi che utilizzano approcci transsclerali per il rilascio sottoretinico, che evitano il passaggio transvitreo 8,11. Tuttavia, nella nostra esperienza, queste procedure non consentono siti di iniezione o bolle accurati o riproducibili e devono essere eseguite solo quando si utilizzano topi. Inoltre, queste procedure richiedono un'incisione sclerale autosigillante con un ago che attraversa la coroide e l'epitelio pigmentato retinico (RPE) nella posizione della RD. Ciò comporta un rischio di migrazione del pigmento sottoretinico, che può portare a conseguenze infiammatorie e può distorcere il modello RD11. Inoltre, l'iniezione viene eseguita senza visibilità della punta della siringa, aumentando il rischio di distacco sopra- o subcoroideale piuttosto che di RD. Esiste anche il rischio di retinotomia non intenzionale, che porta al successivo parto intravitreale, soprattutto quando si lavora con modelli di degenerazione retinica che hanno retine più sottili e fragili.
Le applicazioni della somministrazione sottoretinica o della RD indotta includono la sperimentazione di varie terapie su modelli di degenerazione retinica o nei casi di RD 8,11,12,13,14. In entrambe le condizioni, l'obiettivo della procedura è quello di imitare i processi che alla fine si verificano negli esseri umani. Sia l'approccio transsclerale che quello transvitreo possono modellare la RD, purché l'altezza e la durata della RD siano sufficienti15. Nel caso della somministrazione sottoretinica, i metodi attuali replicano più fedelmente quelli utilizzati nei primati non umani16 e nell'uomo5, migliorando così la traducibilità dei dati.
Divulgazioni
S.P: Consulente e interessi finanziari personali - Pixium Vision, GenSight Biologics (nessuna di queste attività è di alcuna rilevanza per i dati qui presentati).
Riconoscimenti
Questo studio è stato sostenuto da IHU FOReSIGHT (Parigi), Fondation Voir & Entendre (Parigi), UNADEV/Aviesan (nell'ambito del progetto "neuroprotezione dei fotorecettori a cono", Parigi), HyVIS (GA 964468), Fighting Blindness Foundation (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). Gli stipendi di A.D. sono stati forniti da sovvenzioni della Fondation pour la Recherche Médicale (numero di sovvenzione M2R202106013349, Parigi), della Fondation de France (numero di sovvenzione WB-2023-49302, Parigi) e della Società francese di oftalmologia. Lo sponsor o le organizzazioni finanziatrici non hanno avuto alcun ruolo nella progettazione o nella conduzione di questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Riferimenti
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon