Method Article
Intraoperative Visualisierung der subretinalen Injektion und Netzhautablösung bei Ratten
In diesem Artikel
Zusammenfassung
In diesem Artikel werden Methoden zur subretinalen Injektion bei Ratten beschrieben, bei denen intraoperative Visualisierung verwendet wird, um sowohl die Injektionsstelle als auch den Bereich der Netzhautablösung zu kontrollieren.
Zusammenfassung
Die subretinale Injektion, die Abgabe einer Lösung zwischen den Photorezeptoren und dem retinalen Pigmentepithel (RPE), schafft einen subretinalen Raum, in dem Komponenten in direktem Kontakt mit Photorezeptoren und RPE-Zellen stehen. Diese Verabreichungsmethode ermöglicht eine gezielte Behandlung dieser Zellen. Therapeutika für die subretinale Injektion wurden entwickelt und zugelassen, insbesondere für erbliche Netzhauterkrankungen. Bei Tieren können subretinale Injektionsverfahren aufgrund der Linsengröße eine Herausforderung darstellen, insbesondere bei Nagetieren. In diesem Artikel werden Methoden zur subretinalen Injektion bei Ratten beschrieben, die eine intraoperative Visualisierung und Kontrolle sowohl der Injektionsstelle als auch der Größe des abgelösten Bereichs ermöglichen, wie sie beim Menschen durchgeführt wird. Der Eingriff wird unter Vollnarkose und örtlicher Betäubung durchgeführt und erfordert eine Pupillenerweiterung. Mit einem ophthalmologischen Mikroskop wird die subretinale Injektion durch einen 30 G Sklerakanal durchgeführt, wobei die Kanülenspitze sanft auf die Netzhaut aufgebracht wird, um eine Retinotomie zu erzeugen. Es können Volumina von 10 bis 25 μl abgegeben werden, was zwei Fünfteln bis zur Hälfte der Netzhaut der Ratte entspricht. Unmittelbare postoperative Untersuchungen mittels Fundusfotografie und optischer Kohärenztomographie bestätigen die erfolgreiche Einbringung in den subretinalen Raum mit sichtbarer subretinaler Flüssigkeit. Zu den Hauptrisiken dieses Verfahrens gehören Linsenschäden (Katarakt), Ablösungsversagen, intravitreale Blutungen, subretinale Blutungen und postoperative Keratitis. Zusätzlich zur Verabreichung von Therapeutika in den subretinalen Raum wird diese Technik verwendet, um eine kurz- oder langfristige Netzhautablösung mit wässrigen bzw. viskosen Produkten zu induzieren. Im Gegensatz zum transskleralen Zugang ermöglicht diese Methode eine präzise intraoperative Positionierung der Netzhautablösung.
Einleitung
Die Netzhaut ist ein lichtempfindliches neuronales Gewebe, das sich im inneren und hinteren Teil des Augapfels befindet. Die äußere Schicht der Neuroretina enthält Photorezeptoren, bei denen es sich um spezialisierte Neuronen handelt, die Licht in elektrochemische Signale umwandeln und daher für das Sehen unerlässlich sind. Das retinale Pigmentepithel (RPE), das sich unter der Neuroretina befindet, bietet den Photorezeptoren eine umfassende metabolische Unterstützung und erleichtert die Regeneration der visuellen Pigmente und die regelmäßige Erneuerung ihrer äußeren Segmente1.
Die Photorezeptordegeneration ist die häufigste Ursache für irreversiblen Sehverlust und tritt bei verschiedenen Netzhauterkrankungen auf, wie z. B. der altersbedingten Makuladegeneration, der Retinitis pigmentosa, der diabetischen Retinopathie und der Netzhautablösung 1,2,3,4. Die meisten dieser Erkrankungen resultieren aus dem primären oder sekundären Verlust von Photorezeptoren, oft sekundär zu RPE-Verlust oder -Dysfunktion. Daher ist es besonders wichtig, Photorezeptoren und RPE-Zellen in vivo zu untersuchen, um deren Degeneration zu verhindern. Für zahlreiche Netzhauterkrankungen, wie z.B. Netzhautdystrophien (u.a. Retinitis pigmentosa) oder Makuladegeneration (u.a. altersbedingte Makuladegeneration), gibt es bislang keine wirksamen Therapien.
Die subretinale Injektion, die Abgabe einer Lösung zwischen den Photorezeptoren und dem RPE, schafft einen subretinalen Raum, in dem die Komponenten in direktem Kontakt mit Photorezeptoren und RPE-Zellen stehen. Diese Verabreichungsmethode ermöglicht eine gezielte Behandlung dieser Zellen unter Umgehung verschiedener Netzhaut- oder Gefäßbarrieren. Mehrere Therapeutika für die subretinale Verabreichung wurden entwickelt und zugelassen, insbesondere für erbliche Netzhauterkrankungen 5,6.
Es ist wichtig, die chirurgischen Praktiken für die subretinale Entbindung zu harmonisieren. Beim Menschen umfasst das Standardverfahren eine 25-G-Pars-Plana-Vitrektomie, die einen relativ einfachen Zugang zum hinteren Augenabschnitt ermöglicht, da die Linse im Verhältnis zum gesamten Auge klein ist. Die subretinale Verabreichung erfolgt über einen 25-G-Trokar mit einer 38-G- oder 41-G-Kanüle mit Silikonspitze, die einen reibungslosen transretinalen Fluss ermöglicht5.
Bei Tieren können subretinale Injektionsverfahren aufgrund der Linsengröße eine Herausforderung darstellen. Bei Nagetieren nimmt die Linse beispielsweise bis zu 90 % der Glaskörperhöhle ein. Bei Ratten nimmt die Linse weniger Platz ein als bei Mäusen, bleibt aber signifikant (siehe Abbildung 1A). Darüber hinaus können subretinale Injektionen verwendet werden, um die Netzhautablösung (RD) zu modellieren, indem viskose Lösungen verwendet werden, um die Beseitigung der subretinalen Flüssigkeit durch RPE-Zellen zu verhindern 7,8. Diese Modelle werden vor allem bei der Entwicklung von Therapeutika für Netzhauterkrankungen eingesetzt.
In diesem Artikel werden Methoden zur subretinalen Verabreichung oder induzierten RD bei Ratten beschrieben, die eine vollständige intraoperative Kontrolle der Injektionsstelle und des abgelösten Netzhautbereichs ermöglichen.
Protokoll
Die Experimente und Verfahren wurden von der lokalen Tierethikkommission genehmigt und in Einrichtungen durchgeführt, die mit dem Labor verbunden sind, in Übereinstimmung mit den örtlichen Gesetzen. Alle experimentellen Arbeiten entsprachen den institutionellen Richtlinien zur Biosicherheit und Sicherheitsverfahren (Local Animal Ethics Committee Charles Darwin CEEACD #5) und folgten der europäischen Richtlinie 2010/63/EU. In dieser Studie wurden acht Wochen alte weibliche Wildtyp-Ratten vom langen Evans (Rattus norvegicus) verwendet. Verschiedene Netzhautdegenerationsmodelle von Ratten, wie P23H und RCS, können verwendet werden, um die subretinale Verabreichung verschiedener Therapeutika, einschließlich Medikamente und Gentherapien, zu testen. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Herstellung von Lösungen
- Subretinale Verabreichung: Verdünnen Sie Moleküle in PBS oder Dimethylsulfoxid für die wässrige subretinale Verabreichung.
- Induktion von RD: Verwenden Sie 2% Hydroxypropylmethylcellulose oder 1%-5% Natriumhyaluronat, um eine langfristige RD zu induzieren.
2. Versuchsaufbau
- Montieren Sie eine nicht abgeschrägte 10 mm 30 G Kanüle aus Metallspitze, die auf einer 10 μl oder 25 μl Spritze zementiert ist, auf einen Mikroinjektor.
- Laden Sie die vorbereitete Lösung in die Spritze.
3. Vorbereitung der Tiere
- Anästhesie
- Vollnarkose: Narkose der Ratten mit einer intraperitonealen Injektion von 40 mg/kg Ketamin und 0,14 mg/kg Medetomidin.
HINWEIS: Diese Anästhesie dauert lange genug für die Dauer des Eingriffs und für unmittelbare postoperative Untersuchungen. - Pupillenerweiterung: Geben Sie einen Tropfen 0,5% Tropicamid in ein Auge, um Mydriasis zu erhalten.
HINWEIS: Für Rechtshänder ist der Eingriff auf dem linken Auge einfacher und umgekehrt. - Lokalanästhesie ( Abbildung 2B): Geben Sie einen Augentropfen Oxybuprocain in das zu operierende Auge.
- Vollnarkose: Narkose der Ratten mit einer intraperitonealen Injektion von 40 mg/kg Ketamin und 0,14 mg/kg Medetomidin.
4. Operation unter dem Mikroskop
- Intraoperative Visualisierung: Verwenden Sie ein ophthalmologisches Mikroskop, das mit einem Fußschalter verbunden ist, um die Operation durchzuführen.
- Skleralexposition (Abbildung 2C,D)
- Verwenden Sie zwei Lidziehnähte (5-0 oder 6-0), die am äußeren Viertel des Lidrandes an den oberen und unteren Augenlidern verankert sind.
- Ziehen Sie an den Nähten, um eine sanfte Vorwölbung des Auges zu erreichen.
- Skleralkanal (Abbildung 2E,F): Verwenden Sie eine 30-G-Nadel, um einen Skleralkanal durch die temporale bulbäre Bindehaut zu erzeugen, etwa 1-2 mm vom Hornhautlimbus entfernt.
HINWEIS: Führen Sie die abgeschrägte Nadelspitze kaum ein, ohne sie weiter zu drücken, um das Risiko einer Linsenberührung und eines anschließenden Katarakts zu vermeiden. Beobachten Sie in diesem Stadium einige Sekunden lang auf Bindehautblutungen. Vermeiden Sie es, die Blutung zu tamponieren, da dies dazu führen kann, dass sich Blut im Glaskörper ansammelt und den Eingriff gefährdet. Wischen Sie mit einem Wattestäbchen vorsichtig das Blut im Kanalbereich oder das die Sichtbarkeit behindert. - Hornhautschutz (Abbildung 2G): Verwenden Sie während des gesamten Eingriffs ein Tränengel als Schnittstelle zwischen Linse und Auge.
- Visualisierung der Netzhautebene (Abbildung 2G)
- Platzieren Sie eine flache Kontaktlinse (8 mm Durchmesser) auf der Augenoberfläche, um die Netzhautebene mit der richtigen Vergrößerung sichtbar zu machen.
- Verwenden Sie den Fußschalter des Mikroskops, um auf die Netzhautebene zu fokussieren.
- Subretinale Injektion (Abbildung 2H - M)
- Führen Sie die Kanüle senkrecht durch den vorgeformten Skleralkanal ein (Abbildung 2H).
- Vermeiden Sie es, die Linse zu berühren, indem Sie die Kanüle senkrecht halten.
- Nähern Sie sich langsam der Netzhaut und drücken Sie sanft darauf, bis eine Netzhautaufhellung zu beobachten ist (Pfeile in Abbildung 2I).
- Die Stabilität der Spitze bleibt während der Injektion durch die durch den Injektionsfluss gebildete Retiotomie erhalten (Abbildung 2J). Vermeiden Sie es, die Spitze zu früh aus der Retinotomie zu ziehen, da dies dazu führt, dass das Produkt in den Glaskörper injiziert wird.
- Entfernen Sie nach der Injektion die Spitze aus der Retinotomie und ziehen Sie dann vorsichtig die gesamte Kanüle aus der Glaskörperhöhle heraus, wobei Sie darauf achten, dass die Linse nicht berührt wird (Abbildung 2K).
HINWEIS: Wenn die Blase unzureichend entwickelt ist oder der abgelöste Netzhautbereich zu stark eingeengt ist, sobald die Spritze leer ist, führen Sie eine erneute Injektion mit demselben Skleralkanal durch und führen Sie die Spitze in die zuvor gebildete Retinotomie ein. - Stellen Sie sicher, dass der pupillenrote Reflex durch die Netzhautablösung verändert wird, ohne den Blutfluss in der Glaskörperhöhle zu beobachten (Abbildung 2L, M).
- Ende der Operation (Abbildung 2N,O)
- Entfernen Sie die Lidnähte und tupfen Sie eventuelle Blutungen vorsichtig ab (Abbildung 2N).
- Beurteilen Sie den Augeninnendruck kurz manuell.
HINWEIS: Eine kleine Menge Glaskörperflüssigkeit kann in den subkonjunktivalen Raum austreten, aber es darf nicht zu einer aktiven Leckage kommen (Abbildung 2O).
5. Postoperative Pflege und Erwachen
- Tragen Sie die Chloramphenicol-Retinol-Augensalbe auf das operierte Auge auf.
- Verabreichen Sie 1 ml 5% Glucosemonohydrat intraperitoneal.
- Injizieren Sie 0,9 mg/kg Atipamezol subkutan.
- Setzen Sie das Tier in eine klimatisierte Kammer und überwachen Sie es, bis es aufwacht.
Ergebnisse
Der Erfolg einer subretinalen Injektion beruht auf der präzisen und ausschließlichen Verabreichung in den subretinalen Raum (d. h. zwischen den Photorezeptoren und den RPE-Schichten) durch die Retinotomie, um subretinale Blutungen zu vermeiden, da Blut für Photorezeptoren und RPE-Zellen toxisch ist. Die erfolgreiche Entbindung wird durch die intraoperative Visualisierung (Abbildung 2L), die unmittelbare postoperative Fundusfotografie und die optische Kohärenztomographie (OCT) bestätigt. Die Fundusfotografie schließt eine subretinale Blutung aus, während OCT B-Scans eine Netzhautablösung (RD) mit klarer subretinaler Flüssigkeit bestätigen (Abbildung 1 und Abbildung 3). Darüber hinaus können mit der Fundusfotografie Linsenberührungen oder induzierte Katarakte identifiziert werden, die während des Eingriffs möglicherweise unbemerkt bleiben (Abbildung 3C,D). Sowohl mit Fotografien als auch mit OCT-Scans kann die Größe des abgelösten Bereichs oder der Blase geschätzt werden (Abbildung 1B-E).
Mehrere Faktoren beeinflussen die Größe der Blase: (1) Lage der Injektionsstelle: Je weiter die Injektionsstelle von der Papille entfernt ist, desto kleiner ist der abgelöste Bereich; (2) Injiziertes Volumen: Ein Injektionsvolumen von 20-25 μl kann bei Ratten etwa die Hälfte der Netzhaut ablösen; (3) Qualität der abgelösten Netzhaut: In retinalen Degenerationsmodellen (z. B. P23H, RCS) kann die Ablösung aufgrund des erhöhten Widerstands zwischen Photorezeptoren und RPE-Zellen, der durch degenerative Prozesse wie Gliose und subretinale Materialakkumulation verursacht wird, eine Herausforderung darstellen. In solchen Fällen sind induzierte Netzhautablösungen in der Regel flach, und OCT-Scans sind entscheidend für die klare Abgrenzung des abgelösten Bereichs.
An der Injektionsstelle kann es zu einer leichten intravitrealen Blutung kommen, da retinale Mikrogefäße nicht immer vollständig vermieden werden können (Abbildung 3E). Solche Blutungen erstrecken sich jedoch typischerweise nicht bis in den subretinalen Raum.
Bei unzureichender Ablösung muss das Problem intraoperativ erkannt werden, was eine sofortige Reinjektion durch die vorgeformte Retinotomie erforderlich macht. Während einer experimentellen Sitzung mit 20 Ratten führten zwei Chirurgen (ein erfahrener und ein Anfänger) die Schritt-für-Schritt-Methode durch. Der erfahrene Chirurg erzielte bei 9 von 10 Eingriffen Erfolge, während der Anfänger bei 6 von 10 Eingriffen erfolgreich war.
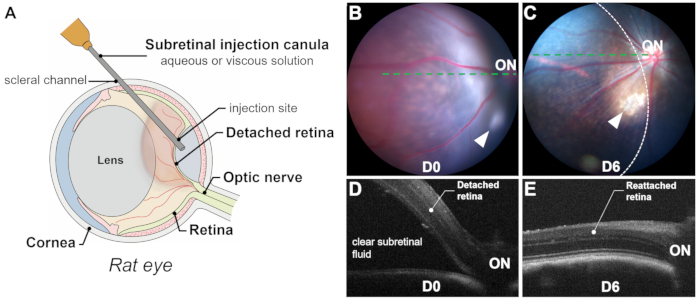
Abbildung 1: Überblick über den Prozess und die Ergebnisse. (A) Schematische Darstellung des subretinalen Injektionsprozesses in einem Rattenauge, die das signifikante Volumen der Linse zeigt. (B,C) Fundusfotografie unmittelbar nach der Injektion (B) und 6 Tage nach der Injektion (C). Pfeilspitzen zeigen die Injektionsstelle an. Der Bereich der Netzhautablösung ist durch eine gestrichelte Linie umrandet. (D,E) Optische Kohärenztomographie B-Scans unmittelbar nach der Injektion (D) und 6 Tage nach der Injektion (E). EIN: Sehnerv. Vergrößerung: 1x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
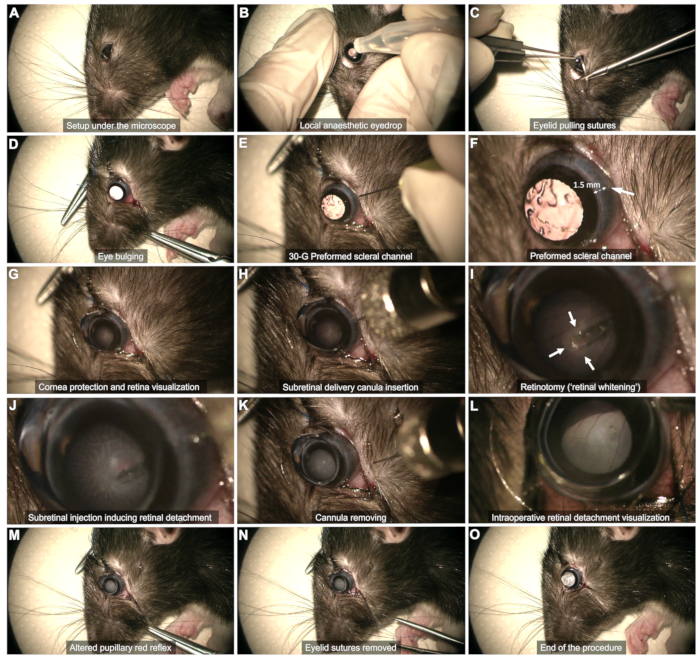
Abbildung 2: Schritte des subretinalen Injektionsprotokolls. Das Protokoll wird an einer 8 Wochen alten Long-Evans-Ratte unter Vollnarkose demonstriert. Eine detaillierte Beschreibung der einzelnen Schritte finden Sie im Video oder im Abschnitt "Protokoll" im Text. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beispiele für verschiedene Ergebnisse der postoperativen Fundusfotografie. (A) Normales postoperatives Erscheinungsbild mit geringer Pigmentdispersion an der Injektionsstelle (Pfeil). (B) Normales postoperatives Erscheinungsbild mit einer kleinen intravitrealen Luftblase an der Injektionsstelle. Diese kleinen Luftbläschen stammen aus der Spritze und sind auch im subretinalen Raum harmlos. (C,D) Linsenberührung, die zu einer leichten (C) oder signifikanten (D) Linsentrübung (Katarakt) führt. (E,F) Leichte (E) oder ausgedehntere (F) intravitreale Blutungen, die in der Nähe der Injektionsstelle lokalisiert sind und sich nicht in den subretinalen Raum ausbreiten. (G) Blutungen an der Injektionsstelle, die sich überwiegend in den subretinalen Raum ausbreiten. In diesem Fall führte die Retiotomie zu einer Verletzung eines retinalen Blutgefäßes. (H) Ausgedehnte intravitreale Blutung infolge einer Skleralpenetration. Vergrößerung: 1x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel werden Methoden zur transvitrealen subretinalen Verabreichung bei Ratten mit intraoperativer Visualisierung und Kontrolle sowohl der Injektionsstelle als auch des abgelösten Bereichs beschrieben.
Es gibt zwei kritische Schritte in diesem Protokoll: Sklera-Exposition und Retinotomie. Die richtige Positionierung, Belichtung und der richtige Zugang sind grundlegende Voraussetzungen für jeden chirurgischen Eingriff. In diesem Fall ist es entscheidend, einen optimalen Zugang zur Sklera und zur Injektionsstelle zu gewährleisten. Eine unzureichende Sklerabelastung kann in den nachfolgenden Schritten zu vermeidbaren Schwierigkeiten führen. Darüber hinaus bestimmt die Qualität der Retiotomie das Risiko einer Blutung. Sie sollte so schonend wie möglich und so weit wie möglich von eventuellen Netzhautgefäßen entfernt durchgeführt werden. Bei richtiger Anwendung ist das Risiko signifikanter intravitrealer oder subretinaler Blutungen sehr gering.
Bei Verwendung dieses Ansatzes für die subretinale Injektion kann die Induktion der Netzhautablösung (RD) aus mehreren Gründen fehlschlagen. Der schwierigste Schritt im Lernprozess ist die Injektion selbst. Die Injektionsstelle muss sorgfältig ausgewählt werden, damit die Flüssigkeit durch die Retinotomie über die Netzhaut fließen kann. Aufgrund des dichten hinteren Glaskörpers bei Nagetieren kann es als physikalische Barriere für den transretinalen Fluss wirken. Unserer Erfahrung nach erfolgt die transretinale Penetration reibungslos, wenn die Kanülenspitze in einem Winkel von etwa 90° zur Netzhaut positioniert ist. Es wird dringend empfohlen, vor allem zu Beginn mit farbigen Lösungen wie Fluorescein zu üben, um zu bestätigen, dass die injizierte Lösung nur in den subretinalen Raum fließt.
Es lassen sich zwei Einschränkungen dieser Technik identifizieren. Erstens besteht die Gefahr, dass die transvitreale Passage die Linse berührt. Eine Linsenberührung kann harmlos sein, wenn die hintere Linsenkapsel erhalten bleibt, da sie nicht zur Bildung des Grauen Stars führen sollte. Ist jedoch die hintere Linsenkapsel beschädigt, ist das Risiko der Kataraktbildung hoch und das Tier kann für das Versuchsvorhaben nicht mehr geeignet sein, insbesondere wenn Netzhautnachuntersuchungen erforderlich sind. Zweitens kann diese Technik in mehreren Stadien zu Blutungen führen, die den experimentellen Prozess behindern könnten. Von den Lidnähten kann es zu Bindehautblutungen kommen, die jedoch in der Regel kein Problem darstellen und mit einem Wattestäbchen gereinigt werden können. Zusätzlich werden während des Eingriffs zwei Retinotomien durchgeführt, die beide das Risiko einer Blutung bergen. Die erste Retinotomie wird durchgeführt, während der Experimentator für die Netzhaut blind ist (durch den Skleralkanal), was während der Skleraperforation zu intravitrealen Blutungen führen kann, was den Eingriff weiter erschwert. In seltenen Fällen kann es zu subretinalen oder choroidalen Blutungen kommen. Diese "Eintrittsretinotomie" kann durch eine Injektion durch die Hornhaut vermieden werden9, obwohl dieser Ansatz den Bereich der möglichen Injektionsstellen erheblich einschränkt. Bei der zweiten Retiotomie besteht ein erhöhtes Blutungsrisiko, wenn die Netzhautgefäße mit der Kanülenspitze berührt werden. Subretinale Blutungen müssen strikt vermieden werden, da Blutbestandteile für Photorezeptoren toxisch sind10. Aufgrund dieser Risiken sollten unerfahrene Experimentatoren mit einer Misserfolgsrate von 1 von 5 bis 1 von 10 Injektionen rechnen. Nach unserer Erfahrung sind keine Fälle von Aderhautablösung, Endophthalmitis oder Hypertonie-induzierten Netzhautschäden aufgetreten.
Alternativ wurden Methoden beschrieben, die transsklerale Ansätze für die subretinale Verabreichung verwenden und die transvitreöse Passage vermeiden 8,11. Nach unserer Erfahrung erlauben diese Verfahren jedoch keine genauen oder reproduzierbaren Injektionsstellen oder Bläschen und sollten nur bei der Verwendung von Mäusen durchgeführt werden. Zusätzlich ist bei diesen Eingriffen ein selbstdichtender Skleralschnitt mit einer Nadel erforderlich, die die Aderhaut und das retinale Pigmentepithel (RPE) an der Stelle der RD kreuzt. Dies birgt das Risiko einer subretinalen Pigmentmigration, die zu entzündlichen Folgen führen und das RD-Modellverzerren kann 11. Darüber hinaus wird die Injektion ohne Sichtbarkeit der Spritzenspitze durchgeführt, was das Risiko einer supra- oder subchoroidalen Ablösung anstelle von RD erhöht. Es besteht auch das Risiko einer unbeabsichtigten Retiotomie, die zu einer anschließenden intravitrealen Entbindung führt, insbesondere bei der Arbeit mit Netzhautdegenerationsmodellen mit dünnerer und fragilerer Netzhaut.
Zu den Anwendungen der subretinalen Verabreichung oder induzierten RD gehören die Erprobung verschiedener Therapeutika an Netzhautdegenerationsmodellen oder in Fällen von RD 8,11,12,13,14. In beiden Fällen besteht das Ziel des Verfahrens darin, Prozesse nachzuahmen, die letztlich beim Menschen ablaufen. Sowohl transsklerale als auch transvitreöse Zugänge können RD modellieren, solange die Höhe und Dauer der RD ausreichend sind15. Im Falle der subretinalen Verabreichung replizieren die derzeitigen Methoden eher die bei nichtmenschlichen Primaten16 und Menschen5, wodurch die Übertragbarkeit der Daten verbessert wird.
Offenlegungen
S.P: Berater und persönliche finanzielle Interessen - Pixium Vision, GenSight Biologics (keine dieser Aktivitäten ist für die hier vorgestellten Daten von Bedeutung).
Danksagungen
Diese Studie wurde unterstützt von der IHU FOReSIGHT (Paris), der Fondation Voir & Entendre (Paris), UNADEV/Aviesan (im Rahmen des Projekts "cone photoreceptor neuroprotection", Paris), HyVIS (GA 964468), der Fighting Blindness Foundation (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). Die Gehälter von A.D. wurden durch Zuschüsse der Fondation pour la Recherche Médicale (Fördernummer M2R202106013349, Paris), der Fondation de France (Fördernummer WB-2023-49302, Paris) und der Französischen Gesellschaft für Augenheilkunde bereitgestellt. Der Sponsor oder die Förderorganisationen spielten keine Rolle bei der Konzeption oder Durchführung dieser Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Referenzen
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten