Method Article
新型透明质酸水凝胶在三维卵泡培养中的应用及小鼠卵巢卵泡冷冻保存方法
摘要
该方案描述了一种新的三维 (3-D) 培养模型,使用酪胺连接的透明质酸水凝胶封装和培养小鼠卵巢的窦前卵泡。我们还详细介绍了通过玻璃化冷冻保存卵巢卵泡的两种方法。
摘要
卵巢卵泡的 3-D 结构以及细胞质和核成熟所必需的体细胞成分与卵母细胞之间的复杂相互作用在传统的二维 (2-D) 培养系统中难以维持。我们描述了一种新的 3-D 培养模型,使用酪胺连接的透明质酸水凝胶包埋和培养小鼠卵巢卵泡。透明质酸包封技术允许卵泡的 3-D 生长和营养因子保留在发育中的卵泡附近。这种水凝胶用途广泛,可应用于分离的卵泡以及卵巢组织碎片。HA 凝胶的粘弹性可以根据凝胶浓度调整刚度和成型性。在这种培养模型中发育的窦前卵泡能够在培养后 10-12 天内完成减数分裂成熟,并在 hCG 触发时排卵中期 II 卵母细胞。本文还详细介绍了通过玻璃化冷冻保存卵巢卵泡的两种方法。
引言
即使在体外受精首次出生四十年后,人类体外卵泡发生仍然是一个挑战。迄今为止,仍然缺乏支持产生活胚胎从而产生健康婴儿的人类卵巢卵泡培养方法1。人类体外卵泡生长所需的最佳物理特性仍有待确定。完整的卵巢中生长着数千个处于不同发育阶段的卵泡,调节它们的生长是一个复杂的过程(图 1)2。来自人窦前卵泡的生发囊泡期 (GV) 卵母细胞在培养中需要长达 30 天才能减数分裂成熟并达到中期II 阶段 3。卵母细胞和周围颗粒细胞之间通过间隙连接进行双向通讯对于细胞质和细胞核成熟至关重要 4,5,6。
传统的 2-D 培养系统不适用于卵泡培养,尤其是在需要长时间培养的大型哺乳动物模型中。卵泡附着在培养皿上,随着颗粒细胞的迁移,颗粒细胞和卵母细胞之间的联系变得更加脆弱。因此,卵泡的三维 (3-D) 培养系统已成为一种更接近体内生理学的手段 7,8。
将卵泡包埋在基质中以促进 3-D 生长是在体外培养 (IVC) 期间保持滤泡结构的一种方法。来自天然聚合物(如胶原蛋白、琼脂糖、纤维蛋白、藻酸盐和透明质酸)以及合成聚合物(如聚乙二醇、聚乙烯醇和聚乙醇酸)的生物基质已经过测试7,9,10,11,12,13。生物基质的机械特性已被证明会影响营养扩散、鞘膜细胞分化、胃窦形成以及激素分泌14。胶原蛋白作为细胞天然细胞外基质 (ECM) 的一部分,是最早测试的基质之一,最初有希望 15,16,17。然而,胶原蛋白标准化制剂的物流、较差的机械性能和稳定性限制了它的使用18。琼脂糖已在从窦卵泡和原始卵泡释放的卵丘-卵母细胞复合物 (COC) 上进行了测试19,20。最近,打印的 3-D 琼脂糖模具显示出无支架卵泡培养的前景21。海藻酸钙包封于 2003 年首次报道,迄今为止,它是 IVC22 研究最广泛的系统。它已在小鼠、牛、猴以及人类卵泡23、24、25、26、27 上进行了测试。使用海藻酸钙,卵泡被单独加载到聚合物的微滴中,并暴露于氯化钙中以产生凝胶珠。从珠子中提取卵泡需要用螯合剂处理。但是,此矩阵有一些缺点。海藻酸盐是从藻类中分离出来的多糖,虽然它提供支持,但它不是卵泡天然细胞外基质的一部分。数据表明海藻酸盐28 中 IVC 后纺锤体缺损的发生率更高。后来通过将海藻酸盐与纤维蛋白或其他细胞外基质成分 (ECM) 相结合来对系统进行修饰,有助于使海藻酸钙系统更有效29,30。
越来越多的证据表明,细胞外基质是细胞生长的关键调节剂 10,31,32 。它不仅提供支持,而且在细胞附着、功能、生长和通信中起着关键作用。ECM 的主要成分之一是透明质酸,这是一种天然存在的糖胺聚糖。在卵巢卵泡中,透明质酸由颗粒细胞产生,有助于发育卵泡的结构完整性和功能33,34。因此,将透明质酸整合到卵泡培养模型中可能有助于创造更生理的环境并增强功能正常的卵母细胞的产生。
这项工作描述了酪胺连接的透明质酸作为新鲜和冷冻卵巢卵泡培养和卵母细胞 体外 成熟 (IVM) 的生物基质的新应用。我们还详细介绍了在两种类型的设备上通过玻璃化冷冻保存卵泡的技术。一种方法涉及直接浸入液氮中,而在第二种方法中,卵泡在浸入前被封闭在吸管中。主要目的是表明,尽管存在差异,但方法和设备都可以可靠地用于卵泡冷冻保存。
研究方案
所有动物实验均根据克利夫兰诊所的机构动物使用和护理协议进行,并遵循美国国立卫生研究院关于实验动物护理和使用的指导方针和规定。
1. 培养基制备
注意:下面描述的培养基将用于此过程中的不同步骤:卵巢组织 (OT) 处理、OT 胶原酶消化、卵泡培养 (FCM) 和玻璃化。使用无菌技术在组织培养罩中准备所有培养基。
- 卵巢组织处理培养基
- 在 50 mL 组织培养瓶 (T-50) 中补充 20 mL Leibovitz 培养基 (L-15) 和 0.1% 胎牛血清 (FBS)。
- 使用前,将培养瓶盖上并置于培养箱中加热至 37 °C。该培养基用于在培养箱外处理卵巢组织和卵泡,不需要 CO2 即可将 pH 值维持在 7.2 至 7.4
注意: 不要将培养皿暴露在 CO2 气体中,否则培养基会变成酸性。
- 胶原酶消化培养基
- 在卵泡收获的早晨,将 1 mg I 型胶原酶 (295 U/mg) 加入装有 2.2 mL 预热 OT 处理培养基的试管中。胶原酶的最终所需浓度为 134 U/mL,使用 0.22 μm 注射器过滤器进行过滤灭菌。盖紧盖子并放入加热块中。
- 卵泡培养基和油
- 在 T-50 培养瓶中制备 30 mL 添加 5% 胎牛血清的最低必需 α 培养基。补充 100 mIU/mL FSH、10 mIU/mL LH、10 μg/mL 胰岛素、5 μg/mL 转铁蛋白和 5 ng/m 硒。
- 使用 FCM 在 37 °C 下用 6% CO2 预平衡,并在培养箱中通风过夜。
- 将 50 mL 矿物油放入培养瓶中,松散地盖上盖子并在培养箱中平衡过夜。
- 用于 FL 和 FL 簇的玻璃化介质
- 所有溶液的基础培养基均为 Global-Hepes,添加 20% 合成蛋白替代品。在基础培养基中制备 20 mL 含有 7.5% 乙二醇 (EG) 和 7.5% 二甲基亚砜 (DMSO) 的 VS1 溶液。
- 在基础培养基中制备 20 mL VS2,其中含有 15% EG、15% DMSO 和 0.5 M 蔗糖。用 0.22 μm 注射器过滤器对所有溶液进行消毒,并在 4 °C 下储存直至使用。溶液可使用长达 4 周。
- 用于玻璃化卵泡和 FL 簇的加热介质
- 所有溶液的基础培养基均为 Global-Hepes,添加 20% 合成蛋白替代品。制备 20 mL 含 0.25 M 蔗糖的基础培养基。标记为 WS1。
- 制备 20 mL 含 0.125 M 蔗糖的基础培养基,并标记为 WS2。用 0.22 μm 注射器过滤器过滤消毒。将溶液在 4 °C 下储存长达 4 周。
2. 卵巢收获
- 通过颈椎脱位(无麻醉)对 10-14 天龄的 B6D2F1 幼崽实施安乐死。使用 3-4 只幼崽获得 250-300 个完整的窦前卵泡用于实验。
- 将动物仰卧,用 70% 异丙醇擦拭腹部。用干净的剪刀在中线做一个小的水平切割。用细镊子抓住上方和下方的皮肤,然后向两个方向(朝向头部和脚)拉动以露出腹部。
- 使用第二套干净的剪刀和细镊子,剪断腹壁。将肠线圈抬起。找到子宫角、输卵管和卵巢。切除卵巢并置于含有 1 mL 加热至 37 °C 的 OT 处理培养基的中心孔培养皿中。
- 使用解剖显微镜,切除任何脂肪和输卵管组织。将卵巢一分为二。
3. 卵泡和 FL 簇 (FL-C) 分离
- 使用具有 37 °C 加热表面的层流罩进行毛囊分离和处理。在通风橱中无菌工作。小心 FCM 盘子。在层流罩中工作时,使用起泡器使培养皿保持 5% CO2 的气体。
注:所有溶液必须预热至 37 °C。FCM 培养基以及矿物油必须在使用前在 37 °C 和 6% CO2 的培养箱中预平衡过夜。培养基 pH 值在培养箱外超过 10 分钟时会发生变化。 - 将 6 mL 预平衡的 FCM 移液到两个 60 mm 培养皿中,并覆盖矿物油。放回培养箱中。
- 在中心孔培养皿中吸取 1 mL 胶原酶,在外壁吸取 3 mL OT 培养基。使用玻璃微量移液器 (1000 μm) 将卵巢移至胶原酶溶液中。将培养皿在层流罩的加热表面上孵育 30-40 分钟。
- 在胶原酶孵育结束时,将 6 mL OT 培养基移液到两个标记为 1 和 2 的 60 mm 组织培养皿中。放在引擎盖的温暖表面上。
- 使用微量移液器,将胶原酶处理的卵巢移至外孔,以冲洗掉胶原酶。更换微量移液器,然后将卵巢移至 OT 培养皿 1。
- 使用 P200 移液器从每个卵巢中收获卵泡。通过切割成不同大小的移液管尖端反复抽吸和排出酶处理的卵巢来释放卵泡。移液前用两个 27G 针头将组织机械梳理成碎片也有助于释放单个卵泡。每只小鼠幼崽应产生 60-75 个所需大小的完整卵泡。
- 如有必要,将未解离的卵巢片段放回胶原酶中再 5-10 分钟,冲洗并重复移液以释放更多卵泡。
注意:过度暴露于胶原酶会导致卵母细胞周围的颗粒细胞层破裂。不要试图打破整个卵巢。一旦收集到 250-300 个卵泡,就停止。 - 使用解剖显微镜以 40 倍放大倍率检查释放的卵泡。识别次生窦前卵泡(直径 ~120 -140 μm),其位于中央的卵母细胞被封闭在完整的基底膜(基底层)内。这个大小的卵泡通常有 2-4 层颗粒细胞围绕着卵子(见 图 1)。
注意:将毛囊与 175 μm 微量移液器吸头的开口进行比较,以估计毛囊大小。毛囊的大小应为移液器直径的 3/4 左右。这是选择所需大小的卵泡的最快方法。 - 使用 175 μm 微量移液器,将选定的卵泡移动到 OT2 培养皿中。收集完成后,冲洗 FCM1 培养皿中的所有卵泡以去除 OT 培养基的任何痕迹。然后转移到 FCM2 培养皿中。
- 在开始包埋过程之前,将培养皿放入培养箱中 60 分钟。
- 对于毛囊簇隔离,请执行步骤 3.1 到 3.5。使用两个结核菌素注射器 (27 G) 将卵巢梳理成碎片,然后梳成 6-10 个卵泡的小簇。
注:卵泡簇培养 (FL-C) 是培养单个卵泡的替代方法。这种方法保留了天然滤泡结构以及基质成分。FL-C 中的卵泡大小不均匀。卵泡保留其 体内 构型,存在原始、初级和次级卵泡。 - 用 200 μm 微量移液器将这些卵泡簇 (FL-C) 收集到 OT2 培养皿中。收集完成后,冲洗所有 FL-C 并转移到 FCM2 等待包埋。
4. 包埋卵泡和卵泡簇
- 制备 10 mg/mL 活化酪胺连接的透明质酸水凝胶 (HA) 储备液。将 250 毫克酪胺替代的透明质酸钠粉末与 25 mL 辣根过氧化物酶 (HRP;10 IU/mL) 在磷酸盐缓冲盐水中再水化。溶解后,将 500 μL 等分试样的这种活化 HA 储备液储存在 -4 °C 以备将来实验。
- 对于卵泡实验,解冻 HA 储备液,并在加热至 37 °C 的整体培养基中将其稀释至 3 mg/mL 的浓度。 在层流罩中执行所有包埋步骤,工作台表面加热至 37 °C。 使用具有 8 个 100 μL 孔的 60 mm 培养皿进行包埋和随后的卵泡培养。
- 将要包埋的卵泡或 FL 簇从 FCM 培养皿移动到一滴 HA 凝胶中,以冲洗掉培养基。示踪介质会干扰凝胶形成。将 FCM 培养皿放回起泡器下方加气。
注意:根据实验,分离的卵泡可以单独或成组嵌入。我们通常喜欢每颗珠子接种 2-4 个卵泡。 - 将 1 μL 0.03% 过氧化氢 (H2O2) 放在培养皿上。将 25 μL 3 mg/mL HA 凝胶添加到过氧化氢滴液上,并通过移液混合以引发交联(见 图 2)。
- 使用 P20 移液器,吸取 HA-H2O2 混合物,并将一滴 (~8-10 μL) 移液到 8 孔培养皿的两个独立孔中。避免产生气泡。
- 使用 200 μm 微量移液器,将卵泡或 FL-C 快速转移到每滴的中心(图 3)。速度很重要,因为一旦 HA 暴露于催化剂(过氧化物)中,它将在 1-2 分钟内开始凝胶化。小心不要在播种过程中引入气泡。
注意:要跟踪单个毛囊的生长,请将毛囊彼此保持一定距离。不要将卵泡放在离凝胶底部太近的地方,否则在 IVC 期间,它们可能会下降到足以附着。 - 等待 ~ 3 分钟完成胶凝过程,然后向每个孔中加入 100 μL 预平衡的 FCM。重复此过程并将卵泡加载到所有八个孔中。覆盖温热的预平衡矿物油,然后将培养皿放入培养箱中。
5. 卵泡和 FL 簇的玻璃化
注意:玻璃化可以使用开放式载体(Cryoloop;CL),允许直接与液氮接触,或者与密闭载体 (Rapid I;RI),其中样品密封在外部吸管中,因此永远不会与液氮接触。 图 4 显示了两种玻璃化系统的装置和对比。两种设备上的玻璃化处理已被证明对胚胎冷冻保存有效35。
- 封闭载流子 RI 玻璃化
- 将 2 mL 等分试样的 VS 溶液在加热块中预热至 37 °C。使用解剖显微镜在层流罩的加热表面上执行所有玻璃化步骤,以观察卵泡和载体。
- 用液氮 (LN2) 填充绝缘的冻存盒。将设备的外吸管放入盒子内的固定槽中,使其部分浸入液氮中。将内部塑料棒放在培养皿的盖子上,并在培养皿的盖子上开一个小孔,以准备装载。
- 将两滴 VS1 并排放在靠近顶部的培养皿上。使用 200 μm 微量移液器将两个卵泡放入第一滴中。冲洗并快速移至 VS1 的第二滴。孵育 5 分钟。如果玻璃化 FL 簇,则一次处理一个簇。
- 当第一次孵育几乎完成时,将三滴 VS2 并排放在同一皿中。然后,在 60 秒内快速依次通过三个 VS2 液滴并加载到载体上。小心用卵泡吸取少量液体,以避免培养基从一个液滴到另一个液滴。
- 要加载载体,请拿起两个卵泡并将少量液体沉积到塑料棒上的小孔中。孔中的最终液体体积极小,< 0.5 μL。避免过度填充,否则会导致液体从孔中溢出并溅到塑料棒上。
- 将棒子放入预冷的外部吸管中。使用超声波封口机关闭并密封吸管。将吸管放入附在低温甘蔗上的高脚杯中。同一个高脚杯中最多可以放置 4 根吸管。
- 用塑料保护套盖住手杖。将手杖放入液氮储存 (LN2) 罐中。
- 开放载体 CL 玻璃化
- 将 VS 溶液预热至 37 °C。 在层流罩的加热表面上执行所有玻璃化步骤。提前准备所需的 CL 开放式载体数量。将金属 CL 杆插入磁化样品瓶盖中,确保其固定牢固(如有必要,请使用一小块粘合剂)。
- 用液氮 (LN2) 填充绝缘的冻存箱。在冻存盒中放置一个架子以容纳冻存管,使 LN2 位于冻存管顶部下方。
- 用 LN2 填充特殊的磁化和通气样品瓶。将其放在机架上。按照步骤 6.1.3 至 6.1.5 中的说明执行玻璃化步骤。唯一的区别是我们通常一次处理五个卵泡。同样,要小心尽量减少一滴又一滴的跟踪液。
- 要加载卵泡,请使用金属棒抓住 CL 打开的载体连接的磁帽。将 CL 开路载体浸入单独的 VS2 中,以形成一层冷冻保护剂。
- 使用微量移液器,吸取所有卵泡或 FL-Cluster 并将它们以最少的液体放在胶片上。快速工作,因为必须在胶片开始干燥之前加载卵泡。
- 立即将 CL 浸入装有 LN2 的冷冻管中以使样品玻璃化。盖上样品瓶盖并将样品瓶放在低温藤上。用塑料套管盖住。将手杖放入液氮储罐中。
6. 玻璃化卵泡和 FL 簇的增温
- RI 封闭式载流子预热
- 准备一个中心孔培养皿,外孔中含有 3 mL 预平衡的 FCM,中孔中含有 1 mL。涂上油,放入培养箱中。
- 将 0.5 mL 预热的 WS1 和 WS2 放入两个标记的中心孔培养皿中。将装有样品的手杖从储存罐中移入装有 LN2 的冻存箱中。
- 取下塑料手杖盖。从高脚杯中取出吸管,保持浸入水中,然后将其滑入冷冻盒的固定槽中。
- 使用细剪刀,剪下黑点正上方的外吸管,指示带有毛囊的内部 RI 载体的顶部。
- 使用细镊子将内部塑料棒从外部吸管中略微提起。抓住设备并将棒快速浸入 WS1 中,轻轻旋转以卸载毛囊。速度至关重要。卵泡需要在 10 秒内卸载到 WS1 中。
- 使用解剖显微镜观察毛囊,并确保所有毛囊都已从载体中取出。在 WS1 中 2 分钟后,使用微量移液器将所有卵泡(或 FL-Cluster)移动到 WS2,注意不要跟踪培养基。
- 3 分钟后,在 FCM 培养皿的外孔中冲洗毛囊,然后移至中心孔中。包埋前放回培养箱中 1-2 小时。
- CL 开路载流子加温
- 如上所述准备 FCM 和 WS 菜肴。将带有卵泡的手杖从储存罐中移入装满 LN2 的冷冻盒中。取下塑料手杖套。
- 使用磁棒提起冷冻管盖,直到看到 CL 的金属杆。
- 使用镊子抓住金属杆。从样品瓶中取出 CL 并快速浸入 WS 1 中,轻轻旋转以卸载卵泡。在 10 秒内卸载到 WS1 中。使用解剖镜,验证是否已卸载所有毛囊
- 从步骤 7.1.6 开始,所有剩余的升温步骤与 RI 封闭式载波步骤相同。
7. 卵泡和 FL 簇成像和介质变化
- 在 10-12 天的培养间隔期间,使用带有 Hoffman 对比调制光学器件并配备高清摄像头的倒置光学显微镜监测孔中的卵泡和 FL 簇。使用成像软件以 40 倍和 100 倍或 200 倍的总放大倍率捕获图像,具体取决于大小。
- 卵泡的成像和评估
- 在培养第 1 天,包埋后,使用倒置显微镜以 40 倍和 200 倍放大倍率对所有培养孔进行成像,以确定基线形态和大小。将培养皿放回培养箱中。
- 查看图像并记录每个凝胶珠中完全包埋的卵泡数量。对于 FL-C,在培养开始时估计卵泡数量。
- 使用成像软件,从基底膜边缘沿垂直和水平平面测量卵泡直径。从带的外边缘以类似方式测量卵母细胞大小。记录平均值。对簇直径进行垂直和水平测量。
- 继续每 2-3 天对培养物进行成像。测量彼此不接触的卵泡的直径。使用 FL-C,在 IVC 期间簇会膨胀,因此可以在垂直和水平面上测量整个簇。
注意:对于紧密组合在一起的卵泡,在培养第 4 天后可能无法辨别单个卵泡边界,因此不进行测量。 - 对变暗或凋亡的卵泡以及卵母细胞不再被颗粒细胞包围或被挤出为无活力的卵泡进行分类。跟踪附着在培养皿表面的任何卵泡或 FL-C(参见 图 5)。
- 从第 8 天开始,仔细观察卵泡是否形成胃窦。带有胃窦的毛囊看起来内部有空隙或较轻的空间(图 6)。
- 每 2 天更换一半的培养基。使用设置为 50 μL 的 P200 移液器。将吸头插入油覆盖层下方的孔中,远离凝胶珠。缓慢吸出 50 μL 培养基。通过在油覆盖层下缓慢移液 50 μL 新鲜 FCM 来更换培养基。避免产生气泡。
8. 包膜卵泡中卵母细胞的成熟
注意:当总有籽(和活)卵泡中的胃窦形成达到 40% 以上时,通常开始最后的成熟步骤。但是,如果胃窦形成量低或不可见,我们建议在培养第 12 天触发。我们没有观察到再等待有什么好处。对于 FL-C 培养物,通常在 40% 的孔中观察到胃窦时触发成熟,或者最迟在第 12 天触发。
- 通过在 FCM 中补充 1.5 IU/mL 人绒毛膜促性腺激素 (hCG) 和 5 ng/mL 表皮生长因子 (EGF) 来制备 体外 成熟培养基 (IVM)。
- 通过在下午 5 点左右用 100 μL IVM 培养基替换每个孔中的 FCM 来触发成熟。过夜成熟后(触发后 16-18 小时),使用 40 倍放大的解剖显微镜检查每个培养孔中是否有从 HA 凝胶珠中排卵的卵丘-卵母细胞复合物 (COC)。COC 通常位于凝胶珠的正上方或附近。
- 将排卵的 COC 收集到装有 1 mL 预平衡 FCM 的中心孔培养皿中,上面覆盖着油,然后将培养皿放回培养箱中。
- 通过使用 P200 移液器轻轻移液 HA 珠以释放未排卵的 COC,从仍然包埋的卵泡中收集卵母细胞。将这些收集在 FCM 的单独培养皿中。
- 在外壁中准备一个中心孔培养皿,其中含有 1 mL 透明质酸酶 (10 IU/mL) 和 3 mL FCM 培养基。
- 将排卵的 COC 转移到透明质酸酶溶液中,并短暂暴露于酶中(30-45 秒)以去除颗粒细胞的卵母细胞,以便观察卵母细胞核状态。冲洗卵母细胞以去除酶,然后将 5 μL 新鲜培养基滴入油中进行详细评估。将培养皿放入培养箱中。对未排卵的 COC 重复此过程。
- 记录回收的排卵和非排卵卵的总数。拍摄并评估每个回收卵母细胞的核状态(GV、中期 I 或中期 II)。测量和记录直径。
- 根据总活卵泡(存活到 hCG 触发当天的卵泡)和回收的总卵子计算 IVC 存活率。计算来自排卵 COC 的中期 II 卵母细胞的百分比。对从未排卵的 COC 中回收的任何卵母细胞重复此作。
- 以相同的方式确定 FL-C 的中期 II 成熟速率。
结果
本文详细介绍了使用新型酪胺连接的透明质酸凝胶进行小鼠窦前卵泡体外培养的方法36,37。图 6 说明了放置在传统 2-D 培养系统中时窦前卵泡生长与用于 3-D 培养的 HA 凝胶中封装的单个卵泡之间的差异。在培养的 12 天期间保持天然卵泡结构,在生长的最后一天清晰可见胃窦。
HA 凝胶用途广泛,允许孤立的卵泡单独或成组生长,并且卵巢组织被机械分解成小簇卵泡。凝胶是透明的,因此即使在不同的深度也可以看到毛囊。包膜的卵泡和 FL-C 因持续的颗粒细胞增殖而表现出径向扩张(图 7)。初始卵泡直径平均为 139.8 ± 28 μm,GV 卵母细胞直径为 63.5 ± 4.6 μm。在单独培养的卵泡中,最终直径约为 385.6 ± 36.7 μm,大小大约增加了 3 倍。排卵的中期 II 卵母细胞大小约为 84.8 ± 3.8 μm。在培养的 FL 簇中,卵泡大小相当多样化(图 5、 图 7)。hCG 触发后排卵的卵母细胞位于卵泡附近(图 8)。大多数中期 II 卵母细胞将从排卵的 COC 中取出。触发后仍嵌入的卵泡通常包含 GV 和中期 I 卵母细胞。
表 1 对比了来自新鲜或冷冻卵巢的分离卵泡和 FL 簇之间的成熟率。来自冷冻保存卵巢的 FL-C 具有显着较低的成熟率。显微镜观察表明,它们的基底层经常断裂,这使得它们很容易过早挤出卵母细胞。卵泡簇的脆弱性在一定程度上被封装所抵消。避免了对冷冻保存的卵巢进行胶原酶处理,因为它对完整卵泡的低存活率和低产量尤其有害。
分离卵泡的冷冻保存比整个卵巢保存有效得多。两种玻璃化方法可以实现高成熟速率(表 2)。尽管冷却速率存在很大差异,但 IVC 后卵母细胞成熟没有差异。CL 开放式载体确实允许更高的效率,因为单个 CL 开放式载体上最多可以加载 10 个卵泡。这也缩短了恢复多个冷冻保存卵泡的总时间。然而,对于人类卵泡玻璃化的任何最终临床应用,封闭密封系统可能是更可取的。
GV 卵母细胞核仁周围的染色质排列可用于识别最有可能在排卵后受精并发育成囊胚的卵母细胞38。 图 9 说明了卵母细胞的活体染色,以可视化染色质分布模式。
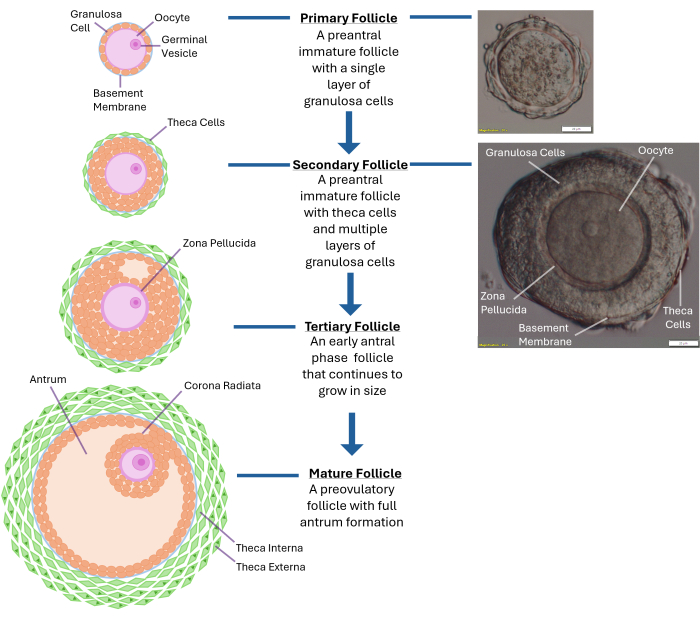
图 1:卵泡生长示意图。 该图说明了卵泡发育的不同阶段,从初级卵泡到次级窦前阶段,最后到完全成熟的第三级卵泡,准备排卵。典型窦前卵泡的显微图像还显示了其不同的形态学特征。 请单击此处查看此图的较大版本。
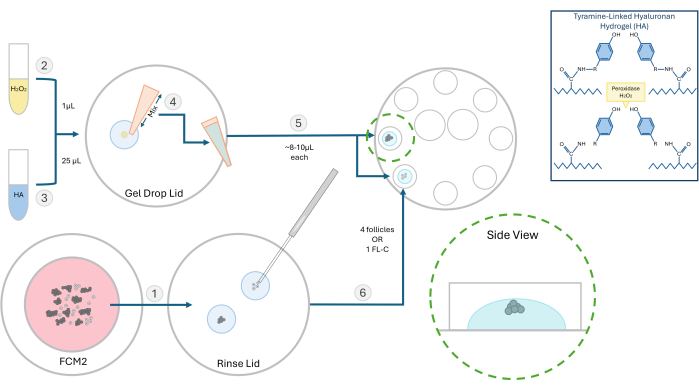
图 2:HA 封装方法示意图。透明质酸凝胶的结构和毛囊包埋的不同步骤如图所示。请单击此处查看此图的较大版本。
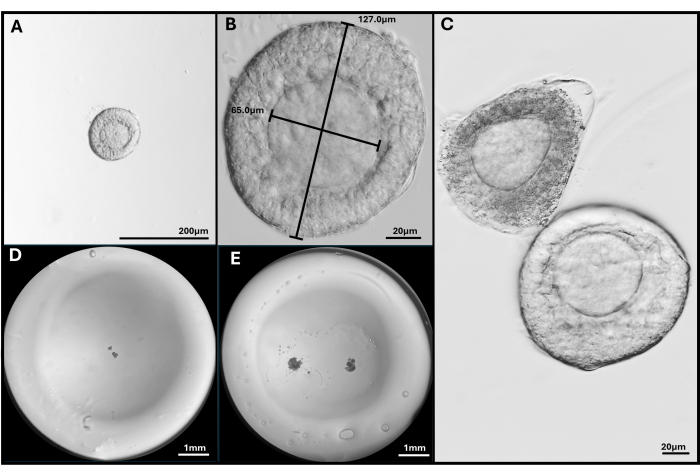
图 3:卵泡分离和包膜。 (A、B) 选择以 40 倍和 200 倍放大镜包埋的窦前卵泡。(C) 凋亡卵泡与健康的窦前卵泡一起显示,卵母细胞不是很中心。(D) 用卵泡接种的 HA 凝胶珠和 (E) 用两个 FL-C 接种的图像。使用立体显微镜拍摄的图像,显示整个凝胶珠。 请单击此处查看此图的较大版本。

图 4:用于冷冻保存分离卵泡的玻璃化装置。 使用 CL 开放式载体装置,玻璃化步骤是通过将卵泡直接浸入液氮中来进行的。因此,冷却速率非常高,超过 -20,000 °C/min。相比之下,使用 RI 封闭载体时,卵泡被加载到内部塑料棒上,并落入浸入浸入液氮中的外部吸管中。这种密闭玻璃化方法避免了与液氮的直接接触。然而,冷却速率在 -1220 °C/min 时明显较低。从任一载体中加载和回收卵泡都很容易。CL 开放式载体每个设备最多可容纳 10 个卵泡,而 RI 封闭式载体只能加载 2 个卵泡。这个数字是从35 个修改而来的。 请单击此处查看此图的较大版本。
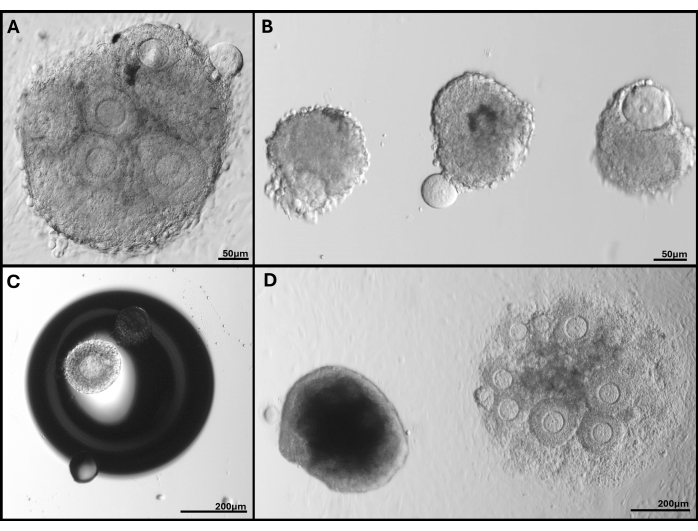
图 5:遇到的问题的代表性图像。 (A) 卵母细胞被挤出的卵泡簇。(B) 基底层膜破损的孤立卵泡和一个卵母细胞挤出的卵泡。(C) 凝胶中气泡下的包埋卵泡。(D) 留在凝胶中的卵泡簇(左)与包埋太深最终附着在培养皿上的卵泡簇的比较。FL-C 中广泛的卵泡大小范围清晰可见。 请单击此处查看此图的较大版本。
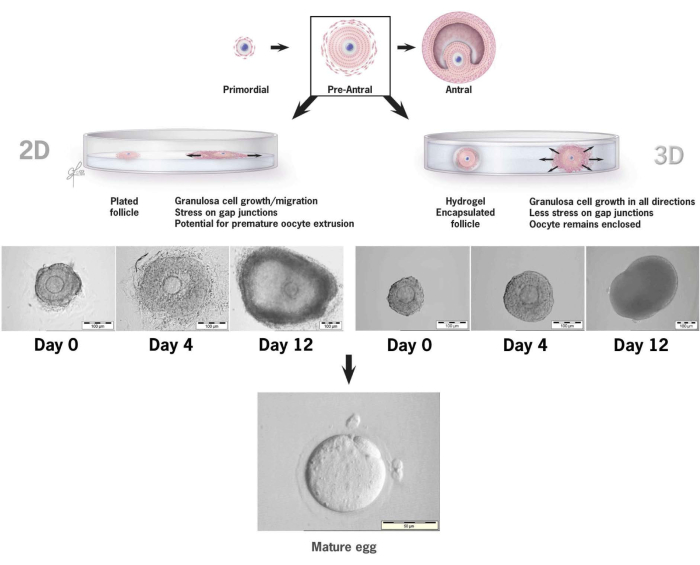
图 6:HA 中常规 2-D 培养与 3-D 培养中卵泡生长的比较。 随着 2-D 生长,到第 4 天观察到卵泡变平和颗粒细胞附着在组织培养皿上,使卵母细胞容易受到颗粒细胞迁移、间隙连接破坏和卵母细胞过早挤出的影响。HA 包膜的卵泡在整个培养间隔期间保持未附着。颗粒细胞向各个方向扩增,包裹卵母细胞并保持 3-D 结构。此数字已从36 个修改而来。 请单击此处查看此图的较大版本。
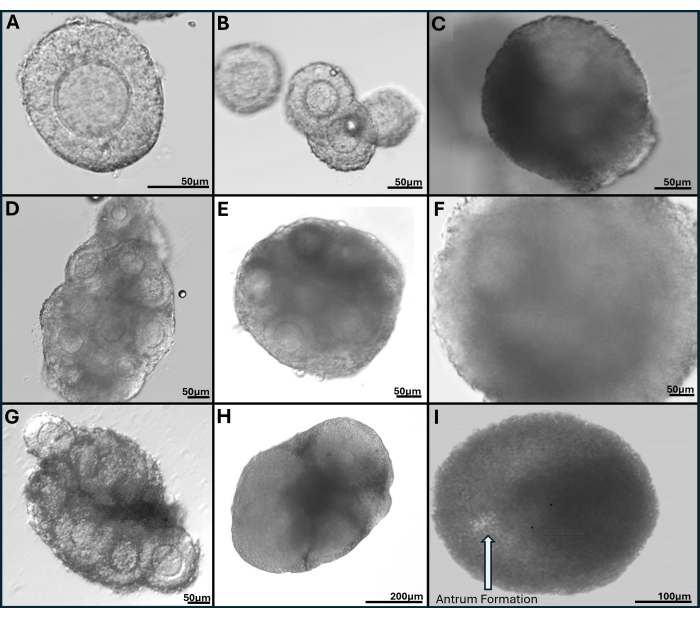
图 7:包裹在酪胺连接的透明质酸凝胶中的卵泡的代表性图像。 (A) 第 1 天新鲜卵巢胶原酶消化后收集的窦前卵泡。(B) 在培养的第 1 天和 (C) 第 4 天成像的四个窦前卵泡的凝胶滴 (D) 培养第 2 天 (E) 第 6 天和 (F) 第 9 天来自新鲜卵巢的卵泡簇。(G) 从玻璃化全卵巢中机械解剖的卵泡簇,分别在培养的第 2 天和 (H) 第 6 天显示。(I) 在培养第 9 天清晰可见有胃窦形成的卵泡。 请单击此处查看此图的较大版本。
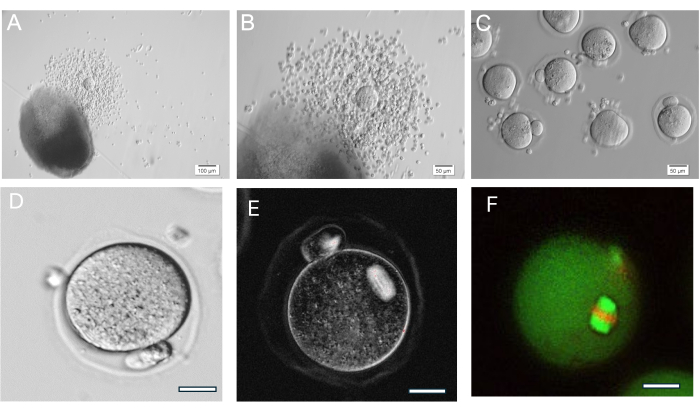
图 8:卵母细胞排卵。 (A、B) 排卵的卵丘-卵母细胞复合物 (COC) 显示下一个 HA 凝胶珠。(C) 用透明质酸酶对 COCs 进行酶促处理以去除周围的卵丘细胞后,对卵母细胞进行成像。许多中期 II 卵母细胞。(D) 具有突出极性体的中期 II 卵母细胞。放大倍数 400 倍。(E) 使用偏振光和成像系统对中期 II 卵母细胞进行实时成像,以可视化减数分裂纺锤体并评估组织,如37 中所述。放大倍数 400 倍。正常的双折射纺锤可见。(F) 中期 II 卵母细胞固定并用抗 α/β-微管蛋白和碘化丙啶染色,以观察减数分裂纺锤体组织。 请单击此处查看此图的较大版本。
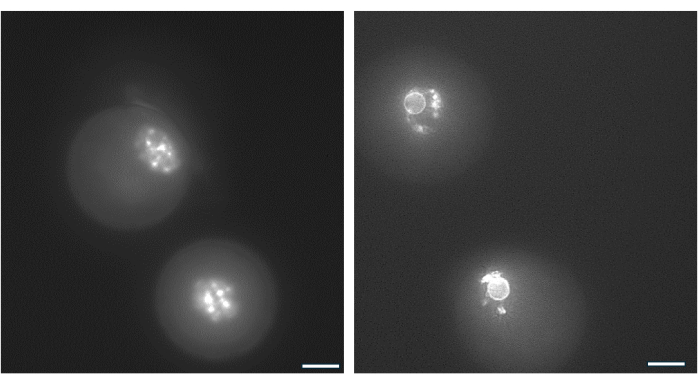
图 9:GV 卵母细胞中的染色质重组。 通过用 Hoechst 33342 (50 ng/mL) 对 DNA 染色来检查胃窦形成后 GV 卵母细胞中染色质的排列。通过轻轻移液从 HA 珠子中收获代表性卵泡。使用透明质酸酶去除颗粒细胞。然后将 GV 卵母细胞染色 15 分钟(参见 Monti 等人的方案 38)。图像以 40 倍放大倍率拍摄。(A) 培养开始时第 1 天显示的 GV 卵母细胞表现出未包围的染色质 (NSN) 染色模式。(B) 来自 hCG 触发当天生长卵泡的 GV 卵母细胞和胃窦。染色质浓缩并在核仁周围形成核周环。 请单击此处查看此图的较大版本。
| 参数 | 新鲜卵巢 | 冷冻卵巢 | |
| FL 隔离 | FL 群集 | FL 群集 | |
| IVC 期间观察到的卵泡 | 130 | 154 | 69 |
| HCG 后排卵 (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| MII 卵母细胞形成 (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
表 1:来自新鲜和玻璃化卵巢的 HA 包埋卵泡的结果。 来自新鲜卵巢的卵泡和 FL-C 封装在 HA 凝胶中后在 体外 成熟。HA 凝胶还在使用 EG/DMSO 方案玻璃化的卵巢卵泡上进行了测试39。对于新鲜卵巢,胶原酶消化后收集单个卵泡 (FL) 和卵泡簇 (FL-C)。对于玻璃化卵巢,暴露于胶原酶实际上会损害卵泡。冷冻保存卵巢的最佳方法是分离 FL 簇而不是单个卵泡,并且仅使用针头机械解剖。该表对比了 4-6 个卵泡接种卵泡的 HA 珠子与含有 6-10 个卵泡的单个 FL-C 的珠子的结果。*冷冻保存卵巢中 FL-C 的成熟率显着降低 (p = 0.008;卡方分析以检验显著性)。
| 载体 | 日 | CL |
| (已结束) | (打开) | |
| 存活率 (%) | 100% (24/24) | 100% (41/41) |
| 胃窦形成* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| 排卵率 (%) | 66.7% (16/24) | 87.8% (36/41) |
| 成熟率 (% MII) | 81.3% (13/16) | 69.4% (25/36) |
表 2:在两种不同的玻璃化设备上冷冻保存分离的卵泡后的结果。 开放式 CL 装置和封闭式 RI 载体均实现了高成熟速率,冷却速率较低。胃窦形成是唯一观察到的显着结局指标,但不影响总成熟率 (p < 0.05;卡方分析以检验显著性)。
讨论
控制酪胺连接的 HA 水凝胶的机械性能和生物降解性的能力为组织工程应用提供了许多优势。我们的实验室是第一个将这种特定的 HA 凝胶用于卵巢卵泡生长的实验室。这种获得专利的酪胺取代透明质酸钠凝胶 (TS-NAHY) 是在克利夫兰诊所开发的一种基于透明质酸的新型水凝胶系统。活化凝胶混合物中的过氧化物酶暴露于氧化剂中,从而驱动凝胶的交联。这可以在 体外 或 体内完成。形成的 TS-NAHY 水凝胶表现出从弱凝胶、糊状物到易碎固体的广泛特性,具体取决于凝胶40 的浓度。
卵巢卵泡培养令人失望的进展凸显了设计新培养模型的必要性。创建完全基于天然细胞外基质成分的培养系统可能是一种更有利的方法。所描述的 HA 培养模型易于以生理方式使用,无需额外的 ECM 成分。凝胶是透明的,可以详细观察毛囊。HA 凝胶的粘弹性有助于调整刚度和成型性。此功能增加了该生物基质的多功能性。生物基质的刚性会影响颗粒细胞增殖和胃窦形成 30,41,42。据报道,来自允许胃窦形成的培养环境的卵泡与非支持性培养系统中的卵泡具有不同的基因表达谱43。灵长类卵泡似乎需要更坚硬的基质44。定制生物基质以满足包括人类在内的不同动物物种的要求对于成功的体外成熟可能很重要。
对于小鼠窦前卵泡生长,我们测试了 2-5 mg/mL36 的凝胶浓度。卵母细胞成熟率从 44% 到 58% 不等。较高浓度的 HA 凝胶允许更多的可塑性和 3-D 结构的保留,但卵泡扩张受到影响。较低的 HA 浓度允许卵泡更多的径向扩张,但增加了卵泡在 IVC 结束前自发挤出的风险。3-3.5 mg/mL 浓度的 HA 对小鼠窦前卵泡效果最好。保持较小的凝胶滴对于形成具有足够深度的 HA 凝胶珠至关重要,以在整个 IVC 中保持卵泡处于 3-D 配置。较大的液滴变平,导致卵泡通过凝胶下降并附着在板表面。使用这种生物材料进行包埋的一个限制是极快的凝胶化时间。这使得一次接种两个以上的 HA 凝胶珠变得困难。提高卵泡接种到 HA 凝胶中的效率是我们正在努力改进的一个领域。
使用 HA 在 3-D 环境中培养卵泡簇具有巨大潜力。保留了正常的卵巢结构,不同大小的卵泡彼此接触并支持基质。LH 可能通过诱导早期分化鞘膜细胞的变化来帮助 FL-C 中较小窦前卵泡的生长,因此它被包含在 FCM 培养基45 中。在 12 天后继续培养 FL-C,看看是否可以在 hCG 触发后仍然嵌入的任何较小卵泡中开始新的生长浪潮,这需要进一步研究。进一步优化培养环境可能是在组织片段中培养不同大小范围的卵泡的先决条件。这种具有 FL-C 的 3-D HA 培养模型的优点是它允许密切模拟 体内 滤泡排列和相互作用。另一个重要属性是,与海藻酸钙和其他聚合物系统不同,可以在不从组织或凝胶基质中物理去除卵泡的情况下诱导排卵和成熟。
体外卵泡培养和获得成熟卵母细胞进行冷冻所需的时间很长,尤其是在大型哺乳动物中。冷冻保存收获的卵泡或卵泡簇的能力提供了一种将此步骤延迟到更晚且可能更有利的时间的方法。如果有一天,这种技术可以在卵巢收获期间应用于人类卵泡,那可能是有益的。目前,用于保留生育能力的全卵巢冷冻保存是患者的唯一选择。但实际上,这是否是最好的方法还有待确定。在本文中,我们提出了一种用于窦前卵泡冷冻保存的玻璃化方法,该方法在 3-D 培养后提供了出色的升温后存活率和成熟率。
总之,我们描述了一种使用透明质酸的新 3-D 培养模型,透明质酸是天然 ECM 的一个组成部分。HA 包封技术允许将营养因子保留在发育中的卵泡附近。在生物基质中封装的方法很简单,可以容纳孤立的卵泡和卵泡簇。后者可能开辟新的研究途径,并提供对卵泡发生及其调节的基础生物学的见解。来自 HA 包膜卵泡的卵母细胞已被证明具有功能能力37。这些卵母细胞可以受精,在体外形成囊胚,并在转移到假怀孕小鼠时植入。这些数据验证了酪胺连接的透明质酸作为 3-D 卵泡培养和体外卵母细胞成熟的生物基质的使用。该方案可能适用于其他动物模型(包括人类)的卵巢卵泡培养。这种 3-D HA 凝胶系统的其他可能应用可能是胚状体和类器官培养。
披露声明
无利益冲突或披露。
致谢
我们要感谢克利夫兰诊所的整个胚胎学团队的帮助,以及 REI 部门,尤其是 Falcone 博士的支持。该项目由克利夫兰诊所的研究基金资助。
材料
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
参考文献
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。