Method Article
Aplicação de um novo hidrogel de hialuronano para cultura de folículos tridimensionais e metodologia para criopreservação de folículos ovarianos de camundongos
Neste Artigo
Resumo
Este protocolo descreve um novo modelo de cultura tridimensional (3-D) usando um hidrogel de hialuronano ligado à tiramina para encapsular e cultivar folículos pré-antrais do ovário de camundongo. Também detalhamos duas abordagens para a criopreservação do folículo ovariano por vitrificação.
Resumo
A arquitetura 3-D do folículo ovariano e as complexas interações entre os componentes das células somáticas e o oócito que são necessárias para a maturação citoplasmática e nuclear são difíceis de manter em sistemas convencionais de cultura bidimensional (2-D). Descrevemos um novo modelo de cultura 3-D usando um hidrogel de hialuronano ligado à tiramina para encapsulamento e cultura de folículos ovarianos de camundongos. A técnica de encapsulamento de hialuronano permite o crescimento 3-D dos folículos e a retenção de fatores tróficos nas proximidades dos folículos em desenvolvimento. Este hidrogel é altamente versátil e pode ser aplicado em folículos isolados, bem como em fragmentos de tecido ovariano. As propriedades viscoelásticas do gel HA permitem o ajuste da rigidez, bem como a moldabilidade com base na concentração do gel. Os folículos pré-antrais que se desenvolvem neste modelo de cultura são capazes de completar a maturação meiótica dentro de 10-12 dias após a cultura e ovular um oócito metafásico II após o desencadeamento com hCG. Este artigo também detalha duas abordagens para a criopreservação de folículos ovarianos por vitrificação.
Introdução
A foliculogênese humana in vitro continua sendo um desafio mesmo quatro décadas após o primeiro nascimento da fertilização in vitro. Até o momento, ainda falta metodologia para cultura de folículos ovarianos humanos que apoie a produção de um embrião viável resultando em um bebê saudável1. As propriedades físicas ideais necessárias para o crescimento do folículo humano in vitro ainda precisam ser determinadas. O ovário intacto é povoado por milhares de folículos em vários estágios de desenvolvimento, e a regulação de seu crescimento é um processo complexo (Figura 1)2. Os oócitos do estágio da vesícula germinativa (GV) de folículos pré-antrais humanos levam até 30 dias em cultura para se tornarem meioticamente maduros e atingirem o estágio3 da metáfase II. A comunicação bidirecional entre o oócito e as células da granulosa circundante através de junções comunicantes é crítica para a maturação citoplasmática e nuclear 4,5,6.
Os sistemas convencionais de cultura 2-D não são ideais para cultura de folículos, especialmente em modelos de mamíferos maiores que requerem tempo prolongado na cultura. Os folículos se ligam ao prato e a ligação entre as células da granulosa e o oócito torna-se mais tênue à medida que as células da granulosa migram. Os sistemas de cultura tridimensionais (3-D) para folículos surgiram, portanto, como um meio de imitar mais de perto a fisiologia in vivo 7,8.
O encapsulamento de folículos dentro de uma matriz para promover o crescimento 3-D tem sido uma abordagem para preservar a arquitetura folicular durante o cultivo in vitro (IVC). Biomatrizes de polímeros naturais (como colágeno, agarose, fibrina, alginato e ácido hialurônico), bem como polímeros sintéticos (como polietilenoglicol, álcool polivinílico e ácido poliglicólico) foram testadas 7,9,10,11,12,13. As propriedades mecânicas de uma biomatriz demonstraram influenciar a difusão de nutrientes, a diferenciação celular tecal, a formação de antro e a secreção hormonal14. O colágeno, como parte da matriz extracelular natural (MEC) da célula, é uma das primeiras matrizes testadas e foi inicialmente promissora 15,16,17. No entanto, a logística de padronização de preparações de colágeno, propriedades mecânicas precárias e estabilidade limitaram seu uso18. A agarose foi testada em complexos cumulus-oócitos (COCs) liberados de folículos antrais, bem como folículos primordiais19,20. Mais recentemente, um molde de agarose 3-D impresso mostrou-se promissor para a cultura folicular livre deandaimes 21. O encapsulamento de alginato de cálcio, relatado pela primeira vez em 2003, tem sido, até o momento, o sistema mais amplamente estudado para a VCI22. Foi testado em camundongos, bovinos, macacos e folículos humanos 23,24,25,26,27. Com o alginato de cálcio, os folículos são carregados individualmente em microgotas do polímero e expostos ao cloreto de cálcio para gerar um grânulo de gel. A extração de folículos do grânulo requer tratamento com um agente quelante. No entanto, essa matriz tem algumas desvantagens. O alginato é um polissacarídeo isolado de algas e, embora forneça suporte, não faz parte da matriz extracelular natural do folículo. Os dados sugerem uma maior incidência de defeitos fusiformes após a VCI em alginato28. Modificações posteriores do sistema, combinando alginato com fibrina ou outros componentes da matriz extracelular (MEC), ajudaram a tornar o sistema de alginato de cálcio mais eficaz29,30.
Evidências crescentes apontam para a matriz extracelular como um modulador chave no crescimento celular 10,31,32. Ele não apenas fornece suporte, mas desempenha um papel crítico na ligação, função, crescimento e comunicação celular. Um dos principais componentes da ECM é o hialuronano, um glicosaminoglicano natural. No folículo ovariano, o hialuronano é produzido pelas células da granulosa e contribui para a integridade estrutural e função do folículo em desenvolvimento33,34. A integração do hialuronano em um modelo de cultura folicular pode, portanto, ajudar na criação de um ambiente mais fisiológico e aumentar a produção de oócitos funcionalmente competentes.
Este trabalho descreve a nova aplicação de um hialuronano ligado à tiramina como biomatriz para cultivo de folículos ovarianos frescos e congelados e maturação in vitro de oócitos (IVM). Também detalhamos técnicas de criopreservação folicular por vitrificação em dois tipos de dispositivos. Um método envolve imersão direta em nitrogênio líquido, enquanto no segundo método os folículos são colocados em um canudo antes da imersão. O objetivo principal é mostrar que, apesar das diferenças, tanto as metodologias quanto os dispositivos podem ser usados de forma confiável para a criopreservação folicular.
Protocolo
Todos os experimentos com animais foram realizados sob os protocolos institucionais de Uso e Cuidados com Animais da Cleveland Clinic e seguindo as diretrizes e regulamentos dos Institutos Nacionais de Saúde para Cuidados e Uso de Animais de Laboratório.
1. Preparação média
NOTA: Os meios descritos abaixo serão usados para as diferentes etapas deste procedimento: manuseio do tecido ovariano (OT), digestão da colagenase OT, cultura folicular (FCM) e vitrificação. Prepare todo o meio em uma capa de cultura de tecidos usando a técnica estéril.
- Meio de manuseio de tecido ovariano
- Suplementar 20 mL de meio de Leibovitz (L-15) com 0,1% de soro fetal bovino (FBS) em um frasco de cultura de tecidos de 50 mL (T-50).
- Tampe bem e coloque o frasco na incubadora durante a noite para aquecer a 37 °C antes de usar. Este meio é usado para manusear tecido ovariano e folículos fora da incubadora e não requer CO2 para manter o pH de 7,2 a 7,4
CUIDADO: Não exponha a louça ao gás CO2 ou o meio ficará ácido.
- Meio de digestão de colagenase
- Na manhã da colheita do folículo, adicione 1 mg de colagenase tipo I (295 U/mg) ao tubo de ensaio com 2,2 mL de meio de manipulação OT pré-aquecido. A concentração final desejada de colagenase é de 134 U/mL Esterilize com filtro de seringa de 0,22 μm. Tampe bem e coloque no bloco de aquecimento.
- Meio de cultura folicular e óleo
- Prepare 30 mL de Minimum Essential Medium alfa suplementado com 5% de soro fetal bovino em um frasco T-50. Suplemento com 100 mUI/mL de FSH, 10 mUI/mL de LH, 10 μg/mL de insulina, 5 μg/mL de transferrina e 5 ng/m de selênio.
- Pré-equilibre o FCM a 37 °C com 6% de CO2 e areje durante a noite na incubadora antes de usar.
- Coloque 50 mL de óleo mineral no frasco, tampe frouxamente e equilibre durante a noite na incubadora.
- Meios de vitrificação para FL e FL-Clusters
- O meio basal para todas as soluções é o Global-Hepes suplementado com 20% de substituto de proteína sintética. Prepare 20 mL de solução VS1 com 7,5% de etilenoglicol (EG) e 7,5% de dimetilsulfóxido (DMSO) em meio basal.
- Prepare 20 mL de VS2 com 15% de EG, 15% de DMSO e 0,5 M de sacarose em meio basal. Esterilize todas as soluções com um filtro de seringa de 0,22 μm e armazene a 4 °C até o uso. As soluções podem ser usadas por até 4 semanas.
- Meios de aquecimento para folículos vitrificados e FL-Clusters
- O meio basal para todas as soluções é o Global-Hepes suplementado com 20% de substituto de proteína sintética. Prepare 20 mL de meio basal com sacarose 0,25 M. Rótulo como WS1.
- Preparar 20 ml de meio basal com sacarose 0,125 M e rotular como WS2. Esterilize o filtro com filtro de seringa de 0,22 μm. Armazene as soluções a 4 °C por até 4 semanas.
2. Colheita do ovário
- Eutanasiar filhotes B6D2F1 de 10 a 14 dias por luxação cervical (sem anestesia). Use 3-4 filhotes para obter 250-300 folículos pré-antrais intactos para experimentação.
- Deite o animal de costas e limpe a barriga com álcool isopropílico 70%. Faça um pequeno corte horizontal na linha média usando uma tesoura limpa. Segure a pele acima e abaixo do corte com uma pinça fina e puxe em ambas as direções (em direção à cabeça e aos pés) para expor o abdômen.
- Usando um segundo conjunto de tesouras limpas e pinças finas, corte a parede abdominal. Levante as bobinas intestinais. Localize os cornos uterinos, ovidutos e ovários. Extirpar os ovários e colocá-los numa cápsula de poço central contendo 1 ml de meio de manipulação OT aquecido a 37 °C.
- Usando um microscópio de dissecação, corte qualquer gordura e tecido oviductal. Dividir os ovários ao meio.
3. Isolamento de folículo e FL-Cluster (FL-C)
- Use uma capela de fluxo laminar com uma superfície aquecida a 37 °C para isolamento e manuseio do folículo. Trabalhe assepticamente no exaustor. Tenha cuidado com o prato FCM. Use o borbulhador para manter o prato gaseado com 5% de CO2 ao trabalhar na capela de fluxo laminar.
NOTA: Todas as soluções devem ser pré-aquecidas a 37 °C. O meio FCM, assim como o óleo mineral, deve ser pré-equilibrado durante a noite em uma incubadora a 37 °C com 6% de CO2 antes do uso. O pH médio mudará quando estiver fora da incubadora por mais de 10 min. - Pipetar 6 mL de FCM pré-equilibrado em dois pratos de 60 mm e cobrir com óleo mineral. Coloque de volta na incubadora.
- Pipetar 1 mL de colagenase em uma placa de poço central e 3 mL de meio OT na parede externa. Mova os ovários para a solução de colagenase usando uma micropipeta de vidro (1000 μm). Incubar a placa durante 30-40 min na superfície aquecida da campânula de fluxo laminar.
- Ao final da incubação da colagenase, pipetar 6 mL de meio OT em duas placas de cultura de tecidos de 60 mm marcadas como 1 e 2. Coloque na superfície quente do exaustor.
- Usando uma micropipeta, mova os ovários tratados com colagenase para o poço externo para enxaguar a colagenase. Troque as micropipetas e, em seguida, mova os ovários para a placa OT 1.
- Colha folículos de cada ovário usando um pipetador P200. Libere folículos por aspiração repetida e expulsão do ovário tratado com enzima através da ponta da pipeta cortada em tamanhos diferentes. A separação mecânica do tecido em fragmentos com duas agulhas 27G antes da pipetagem também é útil na liberação de folículos individuais. Cada filhote de camundongo deve produzir 60-75 folículos intactos do tamanho desejado.
- Se necessário, devolva os pedaços não dissociados do ovário de volta à colagenase por mais 5 a 10 minutos, enxágue e repita a pipetagem para liberar mais folículos.
NOTA: A superexposição à colagenase resultará na ruptura das camadas de células da granulosa ao redor do oócito. Não tente quebrar todo o ovário. Pare assim que 250-300 folículos forem coletados. - Examine os folículos liberados usando um microscópio de dissecação com ampliação de 40x. Identifique folículos pré-antrais secundários (~ 120 -140 μm de diâmetro) com um oócito localizado centralmente dentro de uma membrana basal intacta (lâmina basal). Esse folículo de tamanho normalmente terá de 2 a 4 camadas de células da granulosa ao redor do óvulo (ver Figura 1).
NOTA: Compare os folículos com a abertura de uma ponta de micropipeta de 175 μm para aproximar o tamanho do folículo. O folículo deve ser dimensionado para cerca de 3/4 do diâmetro da pipeta. Este é o método mais rápido para selecionar folículos do tamanho desejado. - Usando uma micropipeta de 175 μm, mova os folículos selecionados para a placa OT2. Após a conclusão da coleta, enxágue todos os folículos na placa FCM1 para remover quaisquer vestígios do meio OT. Em seguida, transfira para o prato FCM2.
- Coloque o prato em uma incubadora por 60 minutos antes de iniciar o processo de incorporação.
- Para isolamento de cluster de folículos, execute as etapas 3.1 a 3.5. Use duas seringas de tuberculina (27 G) para separar o ovário em fragmentos e depois em pequenos grupos de 6 a 10 folículos.
NOTA: A cultura de aglomerados de folículos (FL-C) é uma alternativa à cultura de folículos individuais. Este método retém a arquitetura folicular nativa junto com os componentes estromais. O tamanho do folículo no FL-C não é uniforme. Os folículos mantêm sua configuração in vivo com folículos primordiais, primários e secundários presentes. - Colete esses aglomerados de folículos (FL-C) com uma micropipeta de 200 μm na placa OT2. Após a conclusão da coleta, enxágue todo o FL-C e transfira para FCM2 para aguardar a incorporação.
4. Incorporação de folículos e aglomerados de folículos
- Prepare uma solução-mãe de 10 mg/ml de hidrogel de hialuronano (HA) ligado à tiramina ativado. Reidrate 250 mg de hialuronato de sódio em pó substituído por tiramina com 25 mL de enzima peroxidase de rábano (HRP; 10 UI / mL) em solução salina tamponada com fosfato. Uma vez solubilizado, armazenar alíquotas de 500 μL deste estoque de AH ativado a -4 °C para experimentos futuros.
- Para experimentos foliculares, descongele a solução estoque de HA e dilua-a a uma concentração de 3 mg / mL em um meio global aquecido a 37 ° C. Execute todas as etapas de incorporação em uma capela de fluxo laminar com uma superfície de bancada aquecida a 37 °C. Use uma placa de 60 mm com oito poços de 100 μL para inclusão e subsequente cultura de folículos.
- Mova folículos ou aglomerados de FL a serem incorporados da placa FCM para uma gota de gel de HA para enxaguar sem meio de cultura. O meio de rastreamento interferirá na formação do gel. Coloque o prato FCM de volta sob o borbulhador para gás.
NOTA: Os folículos isolados podem ser incorporados, individualmente ou em grupos, dependendo do experimento. Geralmente preferimos semear 2-4 folículos por conta. - Coloque 1 μL de peróxido de hidrogênio a 0,03% (H2O2) em uma placa de Petri. Adicione 25 μL de gel de 3 mg/mL de HA na gota de peróxido de hidrogênio e misture pipetando para iniciar a reticulação (ver Figura 2).
- Usando um pipetador P20, retire a mistura HA-H2O2 e pipete uma gota (~ 8-10 μL) em dois poços separados da placa de cultura de 8 poços. Evite fazer bolhas.
- Usando uma micropipeta de 200 μm, transfira rapidamente os folículos ou um FL-C para o centro de cada gota (Figura 3). A velocidade é importante, pois uma vez que o HA é exposto ao catalisador (peróxido), ele começará a gelificar em 1-2 minutos. Tenha cuidado para não introduzir bolhas durante a semeadura.
NOTA: Para rastrear o crescimento do folículo individual, posicione-os distantes um do outro. Não coloque os folículos muito perto do fundo do gel ou então durante a VCI eles podem descer o suficiente para se fixar. - Aguarde ~ 3 min para concluir o processo de gelificação e, em seguida, adicione 100 μL de FCM pré-equilibrado a cada poço. Repita esse processo e carregue os folículos em todos os oito poços. Cubra com óleo mineral pré-equilibrado quente e coloque o prato em uma incubadora.
5. Vitrificação de folículos e aglomerados de FL
NOTA: A vitrificação pode ser feita usando um portador aberto (Cryoloop; CL), permitindo o contato direto com nitrogênio líquido, ou então um transportador fechado (Rapid I; RI), onde a amostra é selada dentro de um canudo externo e, portanto, nunca entra em contato com nitrogênio líquido. A Figura 4 mostra os dispositivos e contrastes dos dois sistemas de vitrificação. A vitrificação em ambos os dispositivos demonstrou ser eficaz para a criopreservação de embriões35.
- Vitrificação RI de portador fechado
- Pré-aqueça alíquotas de 2 ml de soluções VS a 37 °C num bloco aquecido. Execute todas as etapas de vitrificação na superfície aquecida da capela de fluxo laminar usando um microscópio de dissecação para visualizar o folículo e o transportador.
- Encha a caixa criogênica isolada com nitrogênio líquido (LN2). Coloque o canudo externo do dispositivo em uma ranhura de retenção dentro da caixa para que fique parcialmente imerso em nitrogênio líquido. Coloque o bastão de plástico interno com um pequeno orifício na tampa de uma placa de Petri em preparação para o carregamento.
- Coloque duas gotas de VS1 lado a lado em uma placa de Petri perto do topo. Use uma micropipeta de 200 μm para colocar dois folículos na primeira gota. Enxágue e passe rapidamente para a segunda gota de VS1. Incubar por 5 min. Se vitrificar clusters FL, processe um único cluster por vez.
- Coloque três gotas de VS2 lado a lado no mesmo prato quando a primeira incubação estiver quase completa. Em seguida, mova rapidamente os folículos sequencialmente através das três gotas de VS2 em 60 s e carregue no transportador. Tenha o cuidado de extrair uma quantidade mínima de fluido com os folículos para evitar rastrear o meio de uma gota para outra.
- Para carregar o transportador, pegue dois folículos e deposite com o mínimo de fluido no pequeno orifício do bastão de plástico. O volume final de fluido no orifício é minúsculo < 0,5 μL. Evite encher demais, o que faz com que o fluido derrame para fora do orifício e para o bastão de plástico.
- Solte o palito no canudo externo pré-resfriado. Use o selador ultrassônico para fechar e selar o canudo. Coloque o canudo em uma taça presa à criocano. Até 4 canudos podem ser colocados na mesma taça.
- Cubra a bengala com uma capa protetora de plástico. Mergulhe a cana em um tanque de armazenamento de nitrogênio líquido (LN2).
- Vitrificação CL de portador aberto
- Pré-aqueça as soluções VS a 37 °C. Execute todas as etapas de vitrificação na superfície aquecida da capela de fluxo laminar. Prepare o número de transportadoras abertas CL necessárias com antecedência. Insira a haste de metal CL na tampa do frasco magnetizada, certificando-se de que esteja segurando firmemente (use um pouco de adesivo, se necessário).
- Encha a caixa criogênica isolada com nitrogênio líquido (LN2). Coloque um rack na caixa criogênica para segurar os criogenianos de forma que o LN2 fique abaixo da parte superior do frasco.
- Encha o frasco especial magnetizado e ventilado com LN2. Coloque-o no rack. Execute as etapas de vitrificação conforme descrito nas etapas 6.1.3 a 6.1.5. A única diferença é que normalmente processamos cinco folículos por vez. Mais uma vez, tome cuidado para minimizar o rastreamento de fluido de gota a gota.
- Para carregar folículos, segure o suporte aberto do CL pela tampa magnética anexada usando a varinha de metal. Mergulhe o transportador aberto CL em uma gota separada de VS2 para criar um filme de crioprotetor.
- Usando uma micropipeta, pegue todos os folículos ou o FL-Cluster e coloque-os no filme com o mínimo de fluido. Trabalhe rapidamente, pois os folículos devem ser carregados antes que o filme comece a secar.
- Mergulhe imediatamente o CL no criogênico preenchido com LN2 para vitrificar a amostra. Tampe e coloque o frasco sobre a criocana. Cubra com uma manga de plástico. Mergulhe a cana em um tanque de armazenamento de nitrogênio líquido.
6. Aquecimento de folículos vitrificados e aglomerados FL
- Aquecimento de portadora fechada RI
- Prepare um prato de poço central com 3 mL de FCM pré-equilibrado no poço externo e 1 mL no poço central. Cubra com óleo e coloque na incubadora.
- Coloque 0,5 mL de WS1 e WS2 pré-aquecidos em dois pratos de poço de centro rotulados. Mova as bengalas com amostras do tanque de armazenamento para uma caixa criogênica cheia de LN2.
- Remova a tampa plástica da bengala. Remova o canudo do copo, mantendo-o imerso, e deslize-o para dentro do slot de retenção na caixa criogênica.
- Usando uma tesoura fina, corte o canudo externo logo acima do ponto preto que indica o topo do portador interno de RI com folículos.
- Usando uma pinça fina, levante o bastão de plástico interno ligeiramente para fora do canudo externo. Segure o dispositivo e mergulhe rapidamente o bastão no WS1, girando suavemente para descarregar os folículos. A velocidade é crítica. Os folículos precisam ser descarregados no WS1 dentro de 10 s.
- Use um microscópio de dissecação para visualizar os folículos e garantir que todos tenham sido descarregados do transportador. Após 2 min em WS1, use uma micropipeta para mover todos os folículos (ou FL-Cluster) para WS2, tomando cuidado para não rastrear o meio.
- Após 3 min, enxágue os folículos no poço externo do prato FCM e depois vá para o poço central. Coloque de volta na incubadora por 1-2 h antes de incorporar.
- CL Aquecimento do portador aberto
- Prepare pratos FCM e WS conforme descrito acima. Mova a cana com folículos de um tanque de armazenamento para uma caixa criogênica cheia de LN2. Retire a tampa plástica da bengala.
- Use a varinha magnética para levantar a tampa criogênica até que a haste de metal do CL fique visível.
- Usando uma pinça, segure a haste de metal. Remova o CL do frasco e mergulhe rapidamente em WS 1, girando suavemente para descarregar os folículos. Descarregue no WS1 dentro de 10 s. Usando um escopo de dissecação, verifique se todos os folículos foram descarregados
- Todas as etapas restantes para aquecimento são as mesmas que as etapas de portadora fechada de RI a partir da etapa 7.1.6.
7. Imagem do folículo e do aglomerado FL e alteração da mídia
- Monitore folículos e aglomerados de FL em poços durante o intervalo de cultura de 10 a 12 dias usando um microscópio de luz invertida com óptica de modulação de contraste Hoffman e equipado com uma câmera de alta definição. Use o software de imagem para capturar imagens com ampliação total de 40x e 100x ou 200x, dependendo do tamanho.
- Exames de imagem e avaliação de folículos
- No dia 1 da cultura, após a incorporação, obtenha imagens de todos os poços de cultura com ampliação de 40x e 200x usando um microscópio invertido para estabelecer a morfologia e o tamanho da linha de base. Devolva o prato à incubadora.
- Visualize imagens e registre o número de folículos totalmente incorporados em cada grânulo de gel. Para FL-C, faça uma estimativa do número de folículos no início da cultura.
- Usando um software de imagem, meça o diâmetro do folículo ao longo dos planos vertical e horizontal a partir da borda da membrana basal. Meça o tamanho do oócito de forma semelhante a partir da borda externa da zona. Registre valores médios. Faça uma medida vertical e horizontal do diâmetro do cluster.
- Continue a criar imagens de culturas a cada 2-3 dias. Meça os diâmetros dos folículos que não estão em contato uns com os outros. Com FL-C, os clusters se enrolam durante a IVC, de modo que todo o cluster pode ser medido no plano vertical e horizontal.
NOTA: Para folículos agrupados, as bordas dos folículos individuais podem não ser discerníveis após o dia 4 da cultura, portanto, as medições não são feitas. - Classifique os folículos que se tornam escuros ou apoptóticos, bem como aqueles em que o oócito não está mais cercado por células da granulosa ou foi extrudado como inviável. Acompanhe quaisquer folículos ou FL-C que tenham se fixado na superfície da placa (consulte a Figura 5).
- Observe cuidadosamente os folículos quanto à formação do antro a partir do dia 8. Os folículos com antros parecerão ter uma clareira ou um espaço mais claro dentro deles (Figura 6).
- Realizar meia mudança de meio de cultura a cada 2 dias. Use um pipetador P200, ajustado para 50 μL. Insira a ponta no poço sob a camada de óleo e longe do grânulo de gel. Retire lentamente 50 μL do meio de cultura. Substitua o meio pipetando lentamente 50 μL de FCM fresco sob a camada de óleo. Evite fazer bolhas.
8. Maturação de oócitos em folículos encapsulados
NOTA: A etapa final de maturação é normalmente iniciada quando a formação do antro entre o total de folículos semeados (e viáveis) atinge mais de 40%. No entanto, caso a formação do antro seja baixa ou não visível, recomendamos o acionamento até o dia 12 da cultura. Não observamos nenhum benefício em esperar mais. Para culturas FL-C, a maturação é normalmente desencadeada quando os antros são observados em 40% dos poços ou, o mais tardar, no dia 12.
- Prepare o meio de maturação in vitro (IVM) suplementando FCM com 1,5 UI / mL de gonadotrofina coriônica humana (hCG) e 5 ng / mL de fator de crescimento epidérmico (EGF).
- Desencadeie a maturação substituindo o FCM em cada poço por 100 μL de meio IVM por volta das 17h. Após a maturação durante a noite (16-18 h após o gatilho), use um microscópio de dissecação com ampliação de 40x para examinar bem cada cultura em busca de complexos cumulus-oócitos (COCs) que ovularam a partir do grânulo de gel de HA. Os COCs geralmente são encontrados logo acima do grânulo de gel ou então próximos.
- Colete os COCs ovulados em um prato de poço central com 1 mL de FCM pré-equilibrado coberto com óleo e coloque o prato de volta na incubadora.
- Colete oócitos de folículos que ainda estão embutidos pipetando suavemente o talão de HA usando um pipetador P200 para liberar COCs não ovulados. Colete-os em um prato separado com o FCM.
- Prepare uma placa de poço central com 1 mL de hialuronidase (10 UI / mL) e 3 mL de meio FCM na parede externa.
- Transfira os COCs ovulados para a solução de hialuronidase e exponha brevemente à enzima (30-45 s) para desnudar o oócito das células da granulosa, a fim de visualizar o estado nuclear do oócito. Enxágue os oócitos para remover a enzima antes de colocar em gotas de 5 μL de meio fresco sob óleo para avaliação detalhada. Coloque o prato na incubadora. Repita este processo para os COCs não ovulados.
- Registre o número total de óvulos ovulados e não ovulados recuperados. Fotografar e avaliar o estado nuclear (GV, metáfase I ou metáfase II) de cada oócito recuperado. Meça e registre o diâmetro.
- Calcule a taxa de sobrevivência da VCI com base no total de folículos viáveis (aqueles que chegam ao dia do gatilho do hCG) e no total de óvulos recuperados. Calcule a porcentagem de oócitos metafásicos II dos COCs ovulados. Repita isso para quaisquer oócitos recuperados dos COCs não ovulados.
- Determinar a taxa de maturação até à metáfase II da mesma forma para FL-C.
Resultados
Este artigo detalha a metodologia para o uso de um novo gel de hialuronano ligado à tiramina para cultura in vitro de folículos pré-antrais de camundongos36,37. A Figura 6 ilustra as diferenças entre o crescimento do folículo pré-antral quando colocado em um sistema de cultura 2-D convencional versus um único folículo encapsulado em gel de HA para cultura 3-D. A arquitetura do folículo nativo é mantida durante os 12 dias de cultivo com um antro claramente visível no último dia de crescimento.
O gel HA é muito versátil, permitindo o crescimento de folículos isolados isoladamente ou em grupos e também o tecido ovariano é mecanicamente quebrado em pequenos aglomerados de folículos. O gel é transparente, permitindo visualizar os folículos, mesmo que em profundidades diferentes. Os folículos encapsulados e FL-C exibem expansão radial devido à proliferação contínua de células da granulosa (Figura 7). Os diâmetros iniciais dos folículos são em média de 139,8 ± 28 μm, com o diâmetro do oócito GV medindo 63,5 ± 4,6 μm. Em folículos cultivados individualmente, os diâmetros finais medem cerca de 385,6 ± 36,7 μm, um aumento de aproximadamente 3 vezes no tamanho. Os oócitos ovulados metafásicos II medem cerca de 84,8 ± 3,8 μm. Dentro dos clusters FL cultivados, o tamanho do folículo é bastante diverso (Figura 5, Figura 7). Oócitos ovulados após o gatilho de hCG são encontrados próximos ao folículo (Figura 8). A maioria dos oócitos metafásicos II será recuperada dos COCs ovulados Os folículos ainda incorporados após o gatilho geralmente contêm oócitos GV e metáfase I.
A Tabela 1 contrasta as taxas de maturação entre folículos isolados e aglomerados de FL de ovários frescos ou congelados. FL-C de ovários criopreservados teve taxas de maturação significativamente mais baixas. Observações microscópicas mostraram que eles freqüentemente têm lâmina basal quebrada, tornando-os bastante suscetíveis à extrusão prematura de oócitos. A natureza frágil dos aglomerados foliculares foi um pouco contrariada pelo encapsulamento. O tratamento com colagenase de ovários criopreservados foi evitado, pois era especialmente prejudicial com baixa sobrevivência e baixo rendimento de folículos intactos.
A criopreservação de folículos isolados é muito mais eficaz do que a preservação de todo o ovário. Altas taxas de maturação podem ser alcançadas com ambos os métodos de vitrificação examinados (Tabela 2). Apesar das grandes diferenças nas taxas de resfriamento, a maturação do oócito após a VCI não diferiu. O transportador aberto CL permite mais eficiência, pois até dez folículos podem ser carregados em um único transportador aberto CL. Isso também reduz o tempo total de recuperação de vários folículos criopreservados. No entanto, para qualquer eventual aplicação clínica de vitrificação para folículos humanos, o sistema fechado e selado pode ser preferível.
O arranjo da cromatina ao redor do nucléolo do oócito GV pode ser usado para identificar oócitos com maior probabilidade de fertilizar após a ovulação e evoluir para blastocistos38. A Figura 9 ilustra a coloração viva de oócitos para visualizar o padrão de distribuição da cromatina.
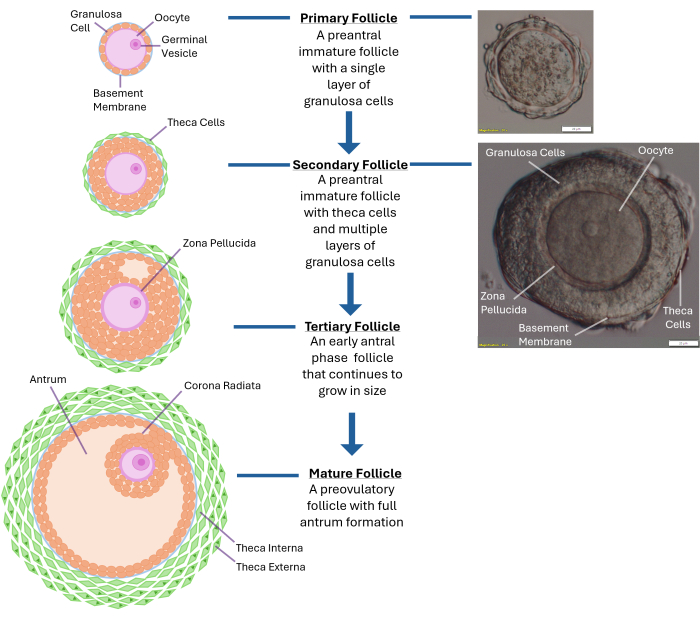
Figura 1: Esquema do crescimento folicular. Este diagrama ilustra os diferentes estágios do desenvolvimento do folículo, de um folículo primário ao estágio pré-antral secundário e, finalmente, a um folículo terciário totalmente maduro pronto para a ovulação. Uma imagem microscópica de um folículo pré-antral típico também é mostrada com suas diferentes características morfológicas. Clique aqui para ver uma versão maior desta figura.
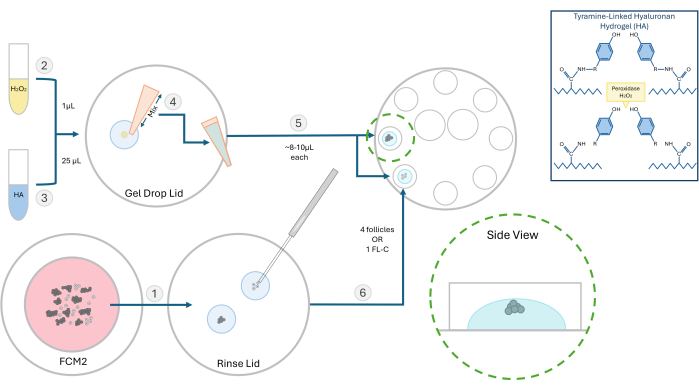
Figura 2: Esquema do método de encapsulamento de HA. A estrutura do gel de hialuronano e as diferentes etapas para a incorporação do folículo são ilustradas neste diagrama. Clique aqui para ver uma versão maior desta figura.
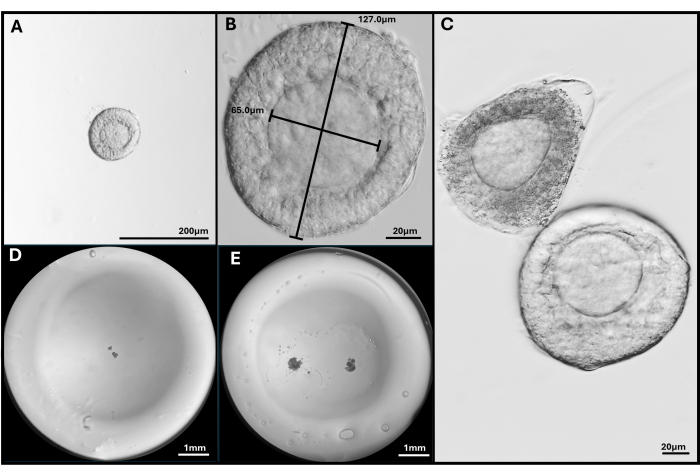
Figura 3: Isolamento e encapsulamento do folículo. (A, B) Folículo pré-antral selecionado para incorporação com aumento de 40x e 200x. (C) O folículo apoptótico é mostrado com folículo pré-antral saudável com oócito não muito central. (D) Imagem de grânulo de gel de HA semeado com folículos e (E) com dois FL-C. Imagens tiradas com um estereomicroscópio para mostrar todo o grânulo de gel. Clique aqui para ver uma versão maior desta figura.

Figura 4: Dispositivos de vitrificação para criopreservação de folículos isolados. Com o dispositivo de suporte aberto CL, a etapa de vitrificação é conduzida por imersão direta dos folículos em nitrogênio líquido. A taxa de resfriamento é, portanto, extremamente alta, acima de -20.000 °C/min. Em contraste, com o transportador fechado RI, os folículos são carregados no bastão de plástico interno e jogados em um canudo externo imerso em nitrogênio líquido. Este método de vitrificação fechado evita o contato direto com nitrogênio líquido. No entanto, a taxa de resfriamento é significativamente menor a -1220 °C/min. O carregamento e a recuperação de folículos de qualquer um dos portadores são fáceis. O transportador aberto CL acomodou a carga de até dez folículos por dispositivo, em comparação com apenas dois com o transportador fechado RI. Este número foi modificado de35. Clique aqui para ver uma versão maior desta figura.
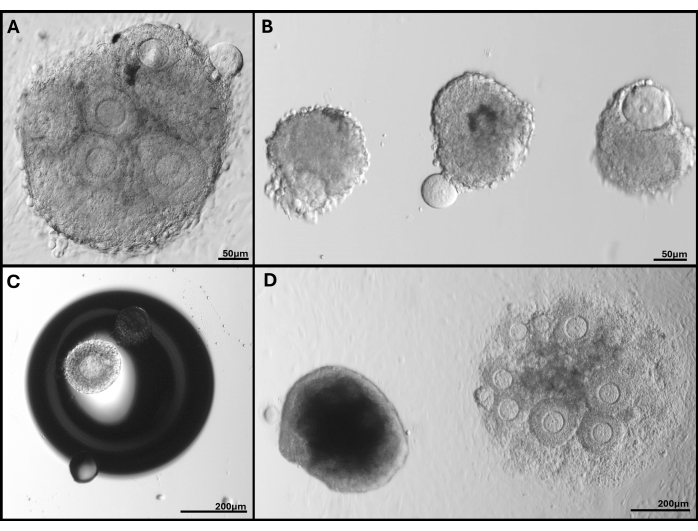
Figura 5: Imagens representativas dos problemas encontrados. (A) Aglomerado de folículos com oócito sendo extrudado. (B) Folículos isolados com membrana da lâmina basal quebrada e um com oócito extrudado. (C) Folículo embutido sob uma bolha no gel. (D) Aglomerado de folículos que permaneceu no gel (esquerda) em comparação com o aglomerado embutido muito profundo que acabou se fixando no prato. A ampla gama de tamanhos de folículos em FL-C é claramente visível. Clique aqui para ver uma versão maior desta figura.
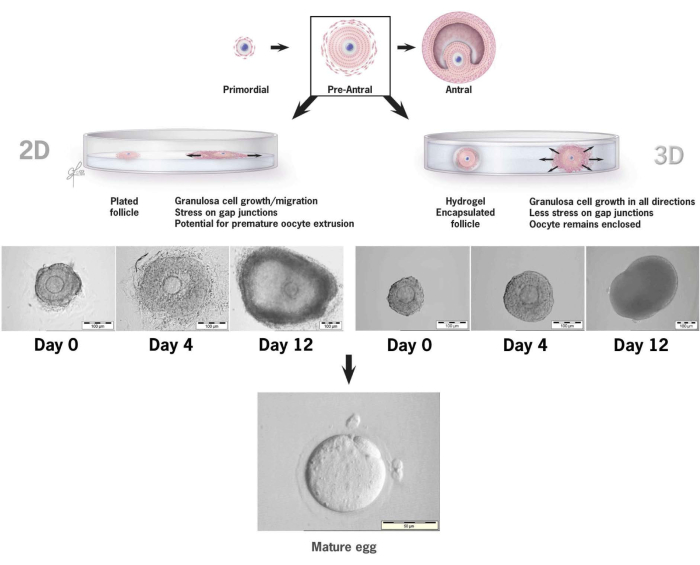
Figura 6: Comparação do crescimento folicular em convenções 2-D versus cultura 3-D em HA. Com o crescimento 2-D, o achatamento do folículo e a fixação das células da granulosa à placa de cultura de tecidos foram observados no dia 4, deixando o oócito vulnerável à migração de células da granulosa, ruptura das junções comunicantes e extrusão prematura de oócitos. O folículo encapsulado em AH permaneceu solto durante todo o intervalo de cultivo. A expansão das células da granulosa ocorreu em todas as direções, envolvendo o oócito e mantendo a arquitetura 3-D. Este número foi modificado de36. Clique aqui para ver uma versão maior desta figura.
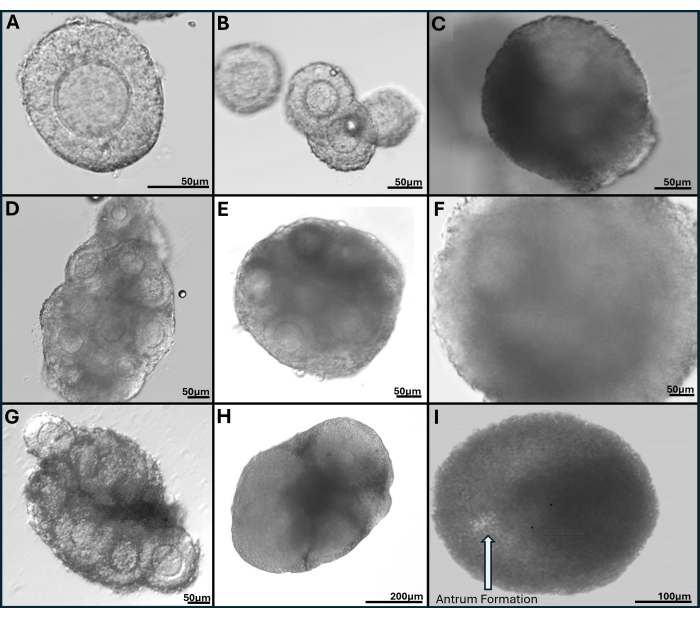
Figura 7: Imagens representativas de folículos encapsulados em gel de hialuronano ligado à tiramina. (A) Folículo pré-antral coletado após a digestão da colagenase do ovário fresco no Dia 1. (B) Gota de gel semeada com quatro folículos pré-antrais fotografados no dia 1 e (C) Dia 4 de cultura, (D) Aglomerado de folículos de ovário fresco no dia 2, (E) no dia 6 e (F) no dia 9 de cultura. (G) Aglomerado de folículos dissecado mecanicamente do ovário inteiro vitrificado mostrado no dia 2 e (H) no dia 6 da cultura. (I) O folículo com formação de antro é claramente visível no dia 9 da cultura. Clique aqui para ver uma versão maior desta figura.
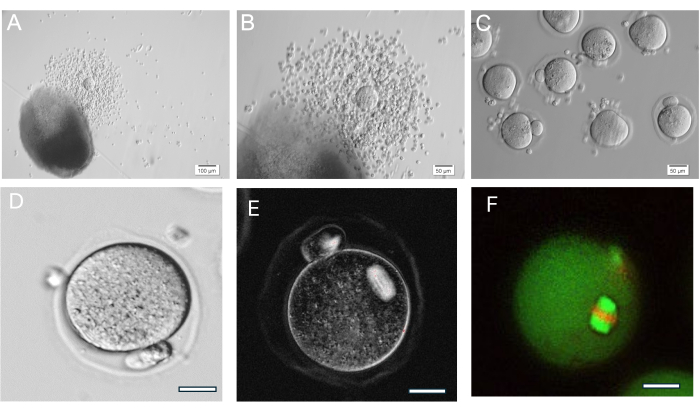
Figura 8: Ovulação do oócito. (A, B) Complexo cumulus-oócito ovulado (COC) mostrado ao lado do talão de gel HA. (C) Os oócitos foram fotografados após o tratamento enzimático de COCs com hialuronidase para remover as células do cumulus circundantes. Numerosos oócitos metafásicos II. (D) Oócito metafásico II com corpo polar proeminente. Ampliação 400x. (E) Imagem ao vivo do oócito metásico II usando luz polarizada e um sistema de imagem para visualizar o fuso meiótico e avaliar a organização, feita conforme descrito em37. Ampliação 400x. Fuso birrefringente normal visível. (F) Oócito metafásico II fixado e corado com anti-alfa/beta-tubulina e iodeto de propídio para visualizar a organização do fuso meiótico. Clique aqui para ver uma versão maior desta figura.
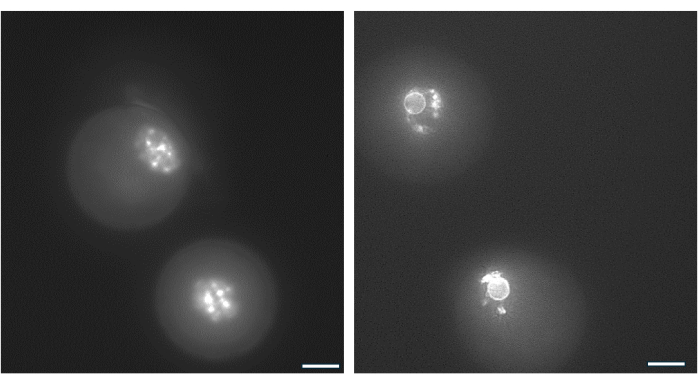
Figura 9: Reorganização da cromatina em oócitos GV. O arranjo da cromatina em oócitos GV após a formação do antro foi examinado pela coloração de DNA com Hoechst 33342 (50 ng/mL). Folículos representativos foram colhidos de grânulos de AH por pipetagem suave. As células da granulosa foram removidas com hialuronidase. Os oócitos GV foram então corados por 15 min. (Ver protocolo de Monti et al.38). As imagens foram tiradas com ampliação de 40x. (A) Oócito GV mostrado no Dia 1 no início da cultura exibindo o padrão de coloração da cromatina não circundada (NSN). (B) Oócito GV do folículo em crescimento com antro mostrado no dia do gatilho do hCG. A cromatina condensou-se e formou um anel perinuclear ao redor do nucléolo. Clique aqui para ver uma versão maior desta figura.
| Parâmetro | Ovário fresco | Ovário congelado | |
| FL-isolado | FL-Cluster | FL-Cluster | |
| Folículos observados durante a VCI | 130 | 154 | 69 |
| Ovulação após HCG (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| Formação de oócitos MII (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tabela 1: Resultados com folículos embebidos em HA de ovários frescos e vitrificados. Folículos e FL-C de ovários frescos foram amadurecidos in vitro após encapsulamento em gel de HA. O gel de HA também foi testado em folículos de ovários vitrificados usando um protocolo EG / DMSO39. Com ovários frescos, tanto os folículos individuais (FL) quanto os aglomerados de folículos (FL-C) foram coletados após a digestão da colagenase. Para ovários vitrificados, a exposição à colagenase foi, de fato, prejudicial aos folículos. A melhor abordagem com ovários criopreservados foi isolar aglomerados de FL em vez de folículos individuais e usar apenas dissecção mecânica com agulhas. A tabela contrasta os resultados entre grânulos de HA semeados com folículos em grupos de 4-6 versus grânulos com um único FL-C contendo 6-10 folículos. *A taxa de maturação com FL-C de ovários criopreservados foi significativamente menor (p = 0,008; Análise qui-quadrado para testar a significância).
| Portador | RI | CL |
| (Fechado) | (Aberto) | |
| Sobrevida (%) | 100% (24/24) | 100% (41/41) |
| Formação de antro* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Taxa de ovulação (%) | 66.7% (16/24) | 87.8% (36/41) |
| Taxa de maturação (% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
Tabela 2: Resultados após criopreservação de folículos isolados em dois dispositivos de vitrificação diferentes. Altas taxas de maturação foram alcançadas tanto com o dispositivo CL aberto quanto com o portador RI fechado, com sua menor taxa de resfriamento. A formação de antro foi a única medida de desfecho observada como significativa, mas não impactou a taxa de maturação geral (p < 0,05; Análise qui-quadrado para testar a significância).
Discussão
A capacidade de controlar as propriedades mecânicas e a biodegradabilidade do hidrogel de HA ligado à tiramina oferece muitas vantagens para aplicações de engenharia de tecidos. Nosso laboratório é o primeiro a aplicar este gel HA específico para o crescimento do folículo ovariano. Este gel patenteado de hialuronato de sódio substituído por tiramina (TS-NAHY) é um novo sistema de hidrogel à base de hialuronano desenvolvido na Cleveland Clinic. A reticulação do gel é impulsionada pela exposição da peroxidase na mistura de gel ativado a um agente oxidante. Isso pode ser feito tanto in vitro quanto in vivo. Os hidrogéis TS-NAHY formados exibem um amplo espectro de propriedades, desde gel fraco, uma pasta até um sólido frágil, dependendo da concentração de gel40.
O progresso decepcionante com a cultura de folículos ovarianos destaca a necessidade de projetar novos modelos de cultura. A criação de um sistema de cultura baseado exclusivamente em componentes nativos da matriz extracelular pode ser uma abordagem mais vantajosa. O modelo de cultura de HA descrito é fácil de usar de maneira fisiológica, sem necessidade de componentes adicionais da MEC. O gel é transparente, permitindo a visualização detalhada dos folículos. As propriedades viscoelásticas do gel HA facilitam o ajuste da rigidez, bem como da moldabilidade. Essa característica aumenta a versatilidade dessa biomatriz. A rigidez de uma biomatriz pode afetar a proliferação de células da granulosa e a formação do antro 30,41,42. Foi relatado que folículos derivados de ambientes de cultura permissivos à formação de antro têm perfis de expressão gênica diferentes daqueles em um sistema de cultura sem suporte43. Os folículos primatas parecem exigir uma matriz mais rígida44. Adaptar a biomatriz para atender aos requisitos de diferentes espécies animais, incluindo humanos, provavelmente será importante para o sucesso da maturação in vitro.
Para o crescimento do folículo pré-antral de camundongos, testamos concentrações de gel variando de 2-5 mg / mL36. As taxas de maturação oocitária variaram de 44% a 58%. Concentrações mais altas do gel de AH permitiram maior moldabilidade e retenção de uma estrutura 3-D, mas a expansão do folículo foi afetada. Concentrações mais baixas de HA permitiram maior expansão radial do folículo, mas aumentaram o risco de o folículo ser expulso espontaneamente antes do final da VCI. A concentração de 3-3,5 mg / mL de HA funcionou melhor para folículos pré-antrais de camundongos. Manter a gota de gel pequena foi essencial para formar grânulos de gel HA com profundidade suficiente para manter os folículos em uma configuração 3-D durante toda a VCI. Gotas maiores se achataram, resultando na descida dos folículos através do gel e na fixação à superfície da placa. Uma limitação do uso desse biomaterial para incorporação é o tempo de gelificação extremamente rápido. Isso dificulta a semeadura de mais de duas esferas de gel de HA por vez. Aumentar a eficiência da semeadura de folículos no gel de HA é uma área que estamos tentando melhorar.
A cultura de aglomerados de folículos em um ambiente 3-D usando HA tem grande potencial. A arquitetura ovariana normal é mantida, com folículos de tamanhos diferentes em contato uns com os outros e com o estroma de suporte. O LH pode ajudar no crescimento de folículos pré-antrais menores no FL-C, induzindo alterações nas células tecais diferenciadoras precoces, por isso foi incluído no meio FCM45. Continuar a cultura de FL-C nos últimos 12 dias para ver se uma nova onda de crescimento pode ser iniciada em qualquer um dos folículos menores ainda incorporados após o gatilho de hCG precisa de mais estudos. Uma otimização adicional do meio de cultura pode ser um pré-requisito para o cultivo de folículos de diferentes faixas de tamanho em um fragmento de tecido. Uma vantagem deste modelo de cultura de HA 3-D com FL-C é que ele permite a imitação próxima do arranjo folicular in vivo e das interações. Outro atributo importante é que, ao contrário do alginato de cálcio e de outros sistemas poliméricos, a ovulação e a maturação podem ser induzidas sem remover fisicamente os folículos do tecido ou da matriz de gel.
O tempo necessário para a cultura de folículos in vitro e obtenção de oócitos maduros para congelamento é longo, principalmente em mamíferos de grande porte. A capacidade de criopreservar folículos colhidos ou aglomerados de folículos apresenta uma maneira de atrasar essa etapa até um momento posterior e possivelmente mais favorável. Se essa tecnologia puder algum dia ser aplicada aos folículos humanos durante a colheita do ovário, pode ser benéfica. A criopreservação de ovário inteiro para preservação da fertilidade é, atualmente, a única opção para os pacientes. Mas se é, de fato, o melhor método ainda precisa ser determinado. Neste artigo, apresentamos uma metodologia de vitrificação para criopreservação de folículos pré-antrais que fornece excelentes taxas de sobrevivência e maturação pós-aquecimento após cultura 3-D.
Em conclusão, descrevemos um novo modelo de cultura 3-D usando hialuronano, um componente da ECM nativa. A técnica de encapsulamento de AH permite a retenção de fatores tróficos próximos aos folículos em desenvolvimento. A metodologia para encapsulação na biomatriz é simples e pode acomodar folículos isolados, bem como aglomerados foliculares. Este último pode abrir novos caminhos de pesquisa e fornecer informações sobre a biologia fundamental da foliculogênese e sua regulação. Os oócitos de folículos encapsulados em HA demonstraram ser funcionalmente competentes37. Esses oócitos podem ser fertilizados, formar blastocistos in vitro e implantados após a transferência para camundongos pseudo-prenhes. Esses dados validam o uso do hialuronano ligado à tiramina como biomatriz para cultura de folículos 3-D e maturação de oócitos in vitro. Este protocolo poderia ser aplicado à cultura de folículos ovarianos em outros modelos animais, incluindo humanos. Outras aplicações possíveis para este sistema de gel 3-D HA podem ser o corpo embrióide e a cultura organoide.
Divulgações
Sem conflitos de interesse ou divulgações.
Agradecimentos
Queremos agradecer a toda a equipe de embriologia da Cleveland Clinic por sua assistência, bem como ao departamento de REI e especialmente ao Dr. Falcone pelo apoio. Este projeto foi financiado por meio de um fundo de pesquisa na Cleveland Clinic.
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Referências
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados