Method Article
Üç Boyutlu Folikül Kültürü için Yeni Bir Hyaluronan Hidrojelin Uygulanması ve Fare Yumurtalık Folikülü Kriyoprezervasyonu için Metodoloji
Bu Makalede
Özet
Bu protokol, fare yumurtalığından preantral folikülleri kapsüllemek ve kültürlemek için tiramin bağlantılı bir hyaluronan hidrojel kullanan yeni bir üç boyutlu (3 D) kültür modelini açıklar. Ayrıca vitrifikasyon yoluyla yumurtalık folikülü kriyoprezervasyonuna yönelik iki yaklaşımı da detaylandırıyoruz.
Özet
Over folikülünün 3 boyutlu mimarisi ve sitoplazmik ve nükleer olgunlaşma için gerekli olan somatik hücre bileşenleri ile oosit arasındaki karmaşık etkileşimlerin, geleneksel iki boyutlu (2 boyutlu) kültür sistemlerinde sürdürülmesi zordur. Fare yumurtalık foliküllerinin kapsüllenmesi ve kültürü için tiramin bağlantılı bir hyaluronan hidrojel kullanan yeni bir 3 boyutlu kültür modelini açıklıyoruz. Hyaluronan kapsülleme tekniği, foliküllerin 3 boyutlu büyümesine ve trofik faktörlerin gelişmekte olan foliküllere yakın bir yerde tutulmasına izin verir. Bu hidrojel çok yönlüdür ve izole edilmiş foliküllere ve yumurtalık dokusu parçalarına uygulanabilir. HA jelin viskoelastik özellikleri, jel konsantrasyonuna bağlı olarak sertliğin yanı sıra kalıplanabilirliğin ayarlanmasını sağlar. Bu kültür modelinde gelişen preantral foliküller, kültürden sonraki 10-12 gün içinde mayotik olgunlaşmayı tamamlayabilir ve hCG ile tetiklendiğinde bir metafaz II oositi yumurtlayabilir. Bu makale ayrıca vitrifikasyon yoluyla yumurtalık folikülü kriyoprezervasyonuna yönelik iki yaklaşımı da detaylandırmaktadır.
Giriş
İnsan in vitro folikülogenez, in vitro fertilizasyondan ilk doğumdan kırk yıl sonra bile bir zorluk olmaya devam etmektedir. Bugüne kadar, sağlıklı bir bebekle sonuçlanan canlı bir embriyonun üretimini destekleyen insan yumurtalık folikül kültürü metodolojisi hala eksiktir1. İnsan in vitro folikül büyümesi için gerekli olan optimal fiziksel özellikler henüz belirlenmemiştir. Sağlam yumurtalık, gelişimin çeşitli aşamalarında binlerce folikül ile doldurulur ve büyümelerinin düzenlenmesi karmaşık bir süreçtir (Şekil 1)2. Germinal vezikül evresi (GV) İnsan preantral foliküllerinden elde edilen oositlerin mayotik olarak olgunlaşması ve metafaz II evre3'e ulaşması kültürde 30 gün kadar sürer. Oosit ve çevresindeki granüloza hücreleri arasındaki boşluk bağlantıları yoluyla çift yönlü iletişim, sitoplazmik ve nükleer olgunlaşma için kritiktir 4,5,6.
Geleneksel 2 boyutlu kültür sistemleri, özellikle kültürde uzun süre gerektiren daha büyük memeli modellerinde folikül kültürü için ideal değildir. Foliküller tabağa yapışır ve granüloza hücreleri ile oosit arasındaki bağlantı, granüloza hücreleri göç ettikçe daha zayıf hale gelir. Bu nedenle, foliküller için üç boyutlu (3 boyutlu) kültür sistemleri, in vivo fizyolojiyi daha yakından taklit etmenin bir yolu olarak ortaya çıkmıştır 7,8.
3 boyutlu büyümeyi teşvik etmek için foliküllerin bir matris içinde kapsüllenmesi, in vitro kültür (IVC) sırasında foliküler mimariyi korumak için bir yaklaşım olmuştur. Doğal polimerlerden (kollajen, agaroz, fibrin, aljinat ve hyaluronik asit gibi) ve sentetik polimerlerden (polietilen glikol, polivinil alkol ve poliglikolik asit gibi) elde edilen biyomatrislertest edilmiştir 7,9,10,11,12,13. Bir biyomatrisin mekanik özelliklerinin besin difüzyonunu, tekal hücre farklılaşmasını, antrum oluşumunu ve hormonal sekresyonunu etkilediği gösterilmiştir14. Hücrenin doğal hücre dışı matrisinin (ECM) bir parçası olan kolajen, test edilen en eski matrislerden biridir ve başlangıçta umut vericiydi 15,16,17. Bununla birlikte, kollajen preparatlarının standardize edilmesinin lojistiği, zayıf mekanik özellikleri ve stabilitesi kullanımını sınırlamıştır18. Agaroz, antral foliküllerden ve ayrıca primordial foliküllerdensalınan kümülüs-oosit kompleksleri (COC'ler) üzerinde test edilmiştir 19,20. Daha yakın zamanlarda, basılı bir 3 boyutlu agaroz kalıbı, iskele içermeyen folikül kültürü21 için umut vaat etmiştir. İlk olarak 2003 yılında rapor edilen kalsiyum aljinat kapsüllemesi, bugüne kadar IVC22 için en çok çalışılan sistem olmuştur. Fare, sığır, maymun ve insan folikülleri üzerinde test edilmiştir 23,24,25,26,27. Kalsiyum aljinat ile foliküller tek tek polimerin mikro damlalarına yüklenir ve bir jel boncuk oluşturmak için kalsiyum klorüre maruz bırakılır. Boncuktan foliküllerin çıkarılması, bir şelatlama maddesi ile tedavi gerektirir. Ancak, bu matrisin bazı dezavantajları vardır. Aljinat, alglerden izole edilen bir polisakkarittir ve destek sağlarken, folikülün doğal hücre dışı matrisinin bir parçası değildir. Veriler, aljinat28'de IVC'den sonra daha yüksek bir iğ kusuru insidansı olduğunu göstermektedir. Aljinatı fibrin veya diğer hücre dışı matris bileşenleri (ECM) ile birleştirerek sistemin daha sonra modifikasyonları, kalsiyum aljinat sisteminin daha etkili olmasına yardımcı olmuştur29,30.
Artan kanıtlar, hücre büyümesinde anahtar bir modülatör olarak hücre dışı matrise işaret etmektedir 10,31,32 . Sadece destek sağlamakla kalmaz, aynı zamanda hücre bağlanması, işlevi, büyümesi ve iletişiminde kritik bir rol oynar. ECM'nin ana bileşenlerinden biri, doğal olarak oluşan bir glikozaminoglikan olan hyaluronandır. Yumurtalık folikülünde hyaluronan, granüloza hücreleri tarafından üretilir ve gelişmekte olan folikülün yapısal bütünlüğüne ve işlevine katkıda bulunur33,34. Hyaluronanın bir folikül kültürü modeline entegrasyonu, bu nedenle daha fizyolojik bir ortam yaratılmasına yardımcı olabilir ve işlevsel olarak yetkin oositlerin üretimini artırabilir.
Bu çalışma, taze ve donmuş yumurtalık folikülü ekimi ve oositlerin in vitro olgunlaşması (IVM) için bir biyomatris olarak tiramin bağlantılı bir hyaluronanın yeni uygulamasını açıklamaktadır. Ayrıca, iki tür cihazda vitrifikasyon yoluyla folikül kriyoprezervasyonu tekniklerini de detaylandırıyoruz. Bir yöntemde doğrudan sıvı nitrojene daldırma, ikinci yöntemde ise foliküller daldırılmadan önce bir pipet içine alınır. Birincil amaç, farklılıklara rağmen, hem metodolojilerin hem de cihazların folikül kriyoprezervasyonu için güvenilir bir şekilde kullanılabileceğini göstermektir.
Protokol
Tüm hayvan deneyleri, Cleveland Clinic'in kurumsal Hayvan Kullanımı ve Bakımı protokolleri altında ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri'nin yönerge ve düzenlemelerine uygun olarak gerçekleştirildi.
1. Orta hazırlık
NOT: Aşağıda açıklanan ortam, bu prosedürdeki farklı adımlar için kullanılacaktır: yumurtalık dokusu (OT) kullanımı, OT kollajenaz sindirimi, folikül kültürü (FCM) ve vitrifikasyon. Tüm besiyerini steril teknik kullanarak bir doku kültürü başlığında hazırlayın.
- Yumurtalık dokusu işleme ortamı
- 50 mL'lik bir doku kültürü şişesinde (T-50) %0.1 fetal sığır serumu (FBS) ile 20 mL Leibovitz ortamını (L-15) destekleyin.
- Kullanmadan önce şişeyi sıkıca kapatın ve 37 °C'ye ısınması için gece boyunca inkübatöre koyun. Bu besiyeri, inkübatörün dışındaki yumurtalık dokusunu ve folikülleri işlemek için kullanılır ve pH'ı 7.2 ila 7.4 arasında tutmak için CO2 gerektirmez
DİKKAT: Bulaşıkları CO2 gazına maruz bırakmayın, aksi takdirde ortam asidik hale gelir.
- Kollajenaz sindirim ortamı
- Folikül hasadı sabahı, 2.2 mL önceden ısıtılmış OT işleme ortamı ile test tüpüne 1 mg Tip I kollajenaz (295 U / mg) ekleyin. İstenen nihai kollajenaz konsantrasyonu 134 U / mL'dir, filtre 0.22 μm şırınga filtresi kullanarak sterilize edilir. Sıkıca kapatın ve ısıtma bloğuna yerleştirin.
- Folikül kültürü ortamı ve yağı
- Bir T-50 şişesinde% 5 fetal sığır serumu ile desteklenmiş 30 mL Minimum Esansiyel Orta alfa hazırlayın. 100 mIU / mL FSH, 10 mIU / mL LH, 10 μg / mL insülin, 5 μg / mL transferrin ve 5 ng / m selenyum ile takviye edin.
- FCM'yi 37 ° C'de% 6 CO2 ile önceden dengeleyin ve kullanmadan önce inkübatörde gece boyunca havalandırın.
- 50 mL mineral yağı şişeye koyun, gevşek bir şekilde kapatın ve gece boyunca inkübatörde dengeleyin.
- FL ve FL Kümeleri için vitrifikasyon ortamı
- Tüm çözeltiler için bazal ortam, %20 sentetik protein ikamesi ile desteklenmiş Global-Hepe'dir. Bazal ortamda% 7.5 etilen glikol (EG) ve% 7.5 dimetil sülfoksit (DMSO) ile 20 mL VS1 çözeltisi hazırlayın.
- Bazal ortamda% 15 EG,% 15 DMSO ve% 0.5 M sükroz ile 20 mL VS2 hazırlayın. Tüm solüsyonları 0,22 μm'lik bir şırınga filtresi ile sterilize edin ve kullanılana kadar 4 °C'de saklayın. Solüsyonlar 4 haftaya kadar kullanılabilir.
- Vitrifiye foliküller ve FL Kümeleri için ısıtma ortamı
- Tüm çözeltiler için bazal ortam, %20 sentetik protein ikamesi ile desteklenmiş Global-Hepe'dir. 0.25 M sükroz ile 20 mL bazal ortam hazırlayın. WS1 olarak etiketleyin.
- 0.125 M sükroz ile 20 mL bazal ortam hazırlayın ve WS2 olarak etiketleyin. Filtre, 0.22 μm şırınga filtresi ile sterilize edilir. Solüsyonları 4 °C'de 4 haftaya kadar saklayın.
2. Yumurtalık hasadı
- 10-14 günlük B6D2F1 yavrularını servikal çıkık ile ötenazi yapın (anestezi olmadan). Deney için 250-300 sağlam preantral folikül elde etmek için 3-4 yavru kullanın.
- Hayvanı sırt üstü yatırın ve% 70 izopropil alkol ile karnını temizleyin. Temiz bir makas kullanarak orta çizgide küçük bir yatay kesim yapın. İnce forseps ile kesilmiş cildi yukarıda ve aşağıda kavrayın ve karnı ortaya çıkarmak için her iki yönde (baş ve ayaklara doğru) çekin.
- İkinci bir temiz makas seti ve ince forseps kullanarak karın duvarını kesin. Bağırsak bobinlerini kaldırın. Rahim boynuzlarını, yumurta kanallarını ve yumurtalıkları bulun. Yumurtalıkları çıkarın ve 37 ° C'ye ısıtılmış 1 mL OT işleme ortamı içeren bir orta kuyu kabına yerleştirin.
- Bir diseksiyon mikroskobu kullanarak, herhangi bir yağ ve yumurta dokusunu kesin. Yumurtalıkları ikiye bölün.
3. Folikül ve FL-Küme (FL-C) izolasyonu
- Folikül izolasyonu ve kullanımı için 37 °C ısıtılmış yüzeye sahip bir laminer akış başlığı kullanın. Davlumbazda aseptik olarak çalışın. FCM çanağına dikkat edin. Laminer akış davlumbazında çalışırken çanağı %5CO2 ile gazda tutmak için fıskiyeyi kullanın.
NOT: Tüm çözeltiler 37 ° C'ye önceden ısıtılmalıdır. FCM ortamı ve mineral yağ, kullanımdan önce% 6 CO2 ile 37 ° C'de bir inkübatörde gece boyunca önceden dengelenmelidir. Orta pH, inkübatörün dışında 10 dakikadan fazla kaldığında değişecektir. - 6 mL önceden dengelenmiş FCM'yi iki adet 60 mm'lik tabağa pipetleyin ve mineral yağ ile kaplayın. Kuluçka makinesine geri yerleştirin.
- Bir merkez kuyu kabına 1 mL kollajenaz ve dış duvara 3 mL OT ortamı pipetleyin. Yumurtalıkları bir cam mikropipet (1000 μm) kullanarak kollajenaz çözeltisine taşıyın. Çanağı, laminer akış başlığının ısıtılmış yüzeyinde 30-40 dakika inkübe edin.
- Kollajenaz inkübasyonunun sonunda, 1 ve 2 etiketli iki adet 60 mm'lik doku kültürü kabına 6 mL OT besiyerini pipetleyin. Davlumbazın ılık yüzeyine yerleştirin.
- Bir mikropipet kullanarak, kollajenaz ile muamele edilmiş yumurtalıkları, kollajenazdan arındırmak için dış kuyuya hareket ettirin. Mikropipetleri değiştirin ve ardından yumurtalıkları OT kabı 1'e taşıyın.
- Bir P200 pipetleyici kullanarak her yumurtalıktan folikülleri toplayın. Enzimle muamele edilen yumurtalığın farklı boyutlarda kesilmiş pipet ucundan tekrar tekrar aspirasyonu ve dışarı atılmasıyla folikülleri serbest bırakın. Pipetlemeden önce dokunun iki adet 27G iğne ile parçalara mekanik olarak ayrılması da tek tek foliküllerin serbest bırakılmasında yardımcı olur. Her fare yavrusu, istenen boyutta 60-75 sağlam folikül vermelidir.
- Gerekirse, ayrışmamış yumurtalık parçalarını 5-10 dakika daha kollajenaz içine geri koyun, durulayın ve daha fazla folikülü serbest bırakmak için pipetlemeyi tekrarlayın.
NOT: Kollajenaza aşırı maruz kalma, oositi çevreleyen granüloza hücre tabakalarının bozulmasına neden olacaktır. Tüm yumurtalığı parçalamaya çalışmayın. 250-300 folikül toplandıktan sonra durun. - Serbest bırakılan folikülleri 40x büyütmede bir diseksiyon mikroskobu kullanarak inceleyin. İkincil pre-antral folikülleri (~ 120 -140 μm çapında), sağlam bir bazal membran (bazal lamina) içine alınmış merkezi olarak yerleştirilmiş bir oosit ile tanımlayın. Bu büyüklükteki folikül tipik olarak yumurtayı çevreleyen 2-4 kat granüloza hücresine sahip olacaktır (Bkz. Şekil 1).
NOT: Folikülleri yaklaşık folikül boyutuna göre 175 μm'lik bir mikropipet ucunun açılmasıyla karşılaştırın. Folikül, pipet çapının yaklaşık 3 / 4'ü kadar boyutlandırılmalıdır. Bu, istenen büyüklükteki folikülleri seçmek için en hızlı yöntemdir. - 175 μm'lik bir mikropipet kullanarak, seçilen folikülleri OT2 kabına taşıyın. Toplama işleminin tamamlanmasının ardından, OT ortamının izlerini gidermek için FCM1 kabındaki tüm folikülleri durulayın. Ardından FCM2 kabına aktarın.
- Gömme işlemine başlamadan önce çanağı 60 dakika boyunca bir kuluçka makinesine koyun.
- Folikül kümesi izolasyonu için 3.1 ila 3.5 arasındaki adımları gerçekleştirin. Yumurtalığı parçalara ayırmak için iki tüberkülin şırıngası (27 G) kullanın ve daha sonra 6-10 folikülden oluşan küçük kümeler halinde ayırın.
NOT: Folikül kümelerinin kültürü (FL-C), tek tek foliküllerin kültürlenmesine bir alternatiftir. Bu yöntem, stromal bileşenlerle birlikte doğal foliküler mimariyi korur. FL-C'deki folikül boyutu tek tip değildir. Foliküller, primordial, primer ve sekonder foliküllerin mevcut olduğu in vivo konfigürasyonlarını korurlar. - Bu folikül kümelerini (FL-C) 200 μm'lik bir mikropipet ile OT2 kabına toplayın. Toplama işlemi tamamlandıktan sonra, tüm FL-C'yi durulayın ve gömülmeyi beklemek için FCM2'ye aktarın.
4. Foliküllerin ve folikül kümelerinin gömülmesi
- 10 mg / mL'lik bir aktif tiramin bağlantılı hyaluronan hidrojel (HA) stok çözeltisi hazırlayın. 250 mg tiramin ikameli sodyum hyaluronat tozunu fosfat tamponlu salin içinde 25 mL yaban turpu peroksidaz enzimi (HRP; 10 IU / mL) ile rehidrat edin. Çözündürüldükten sonra, gelecekteki deneyler için bu aktive edilmiş HA stoğunun 500 μL'lik alikotunu -4 ° C'de saklayın.
- Folikül deneyleri için, HA stok çözeltisini çözün ve 37 ° C'ye ısıtılmış küresel bir ortamda 3 mg / mL'lik bir konsantrasyona seyreltin. Tüm gömme adımlarını, tezgah yüzeyi 37 °C'ye ısıtılmış bir laminer akış başlığında gerçekleştirin. Gömme ve ardından folikül kültürü için sekiz adet 100 μL'lik kuyucuklu 60 mm'lik bir tabak kullanın.
- Kültür ortamından durulamak için FCM kabından gömülecek folikülleri veya FL kümelerini bir damla HA jele taşıyın. İzleme ortamı jel oluşumuna müdahale edecektir. FCM kabını gaza getirmek için fıskiyenin altına geri yerleştirin.
NOT: İzole edilmiş foliküller, deneye bağlı olarak tek tek veya gruplar halinde gömülebilir. Genellikle boncuk başına 2-4 folikül ekmeyi tercih ederiz. - Bir Petri kabına 1 μL %0.03 hidrojen peroksit (H2O2) yerleştirin. Hidrojen peroksit damlasına 25 μL 3 mg/mL HA jel ekleyin ve çapraz bağlamayı başlatmak için pipetleme ile karıştırın (bkz. Şekil 2).
- Bir P20 pipetleyici kullanarak, HA-H2O2 karışımını hazırlayın ve bir damla (~ 8-10 μL) 8 oyuklu kültür kabının iki ayrı kuyucuğuna pipetleyin. Baloncuk yapmaktan kaçının.
- 200 μm'lik bir mikropipet kullanarak, folikülleri veya bir FL-C'yi her damlanın merkezine hızlı bir şekilde aktarın (Şekil 3). HA katalizöre (peroksit) maruz kaldığında 1-2 dakika içinde jelleşmeye başlayacağı için hız önemlidir. Tohumlama sırasında kabarcık oluşturmamaya dikkat edin.
NOT: Tek tek folikül büyümesini izlemek için, folikülleri birbirinden belli bir mesafede konumlandırın. Folikülleri jel tabanına çok yakın yerleştirmeyin, aksi takdirde IVC sırasında tutunacak kadar inebilirler. - Jelleşme işlemini tamamlamak için ~ 3 dakika bekleyin ve ardından her oyuğa 100 μL önceden dengelenmiş FCM ekleyin. Bu işlemi tekrarlayın ve folikülleri sekiz kuyucuğun tümüne yükleyin. Ilık, önceden dengelenmiş mineral yağ ile kaplayın ve tabağı bir inkübatöre yerleştirin.
5. Foliküllerin ve FL kümelerinin vitrifikasyonu
NOT: Vitrifikasyon, açık bir taşıyıcı (Cryoloop; CL), sıvı nitrojen ile doğrudan temasa izin verir veya kapalı bir taşıyıcı (Rapid I; RI), numunenin bir dış pipet içinde kapatıldığı ve bu nedenle asla sıvı nitrojen ile temas etmediği yer. Şekil 4 , iki vitrifikasyon sisteminin cihazlarını ve kontrastlarını göstermektedir. Her iki cihazda da vitrifikasyonun embriyo kriyoprezervasyonu için etkili olduğu gösterilmiştir35.
- Kapalı taşıyıcı RI vitrifikasyonu
- Isıtılmış bir blokta 2 mL VS çözeltilerini 37 ° C'ye önceden ısıtın. Folikülü ve taşıyıcıyı görselleştirmek için bir diseksiyon mikroskobu kullanarak laminer akış başlığının ısıtılmış yüzeyi üzerinde tüm vitrifikasyon adımlarını gerçekleştirin.
- İzoleli kriyo kutusunu sıvı nitrojen (LN2) ile doldurun. Cihazın dış pipetini, kısmen sıvı nitrojene daldırılacak şekilde kutu içindeki bir tutma yuvasına yerleştirin. Yüklemeye hazırlanırken iç plastik çubuğu bir Petri kabının kapağına küçük bir delik açacak şekilde yerleştirin.
- Üst kısımdaki bir Petri kabına iki damla VS1'i yan yana koyun. İlk damlaya iki folikül yerleştirmek için 200 μm'lik bir mikropipet kullanın. Durulayın ve hızlı bir şekilde ikinci VS1 damlasına geçin. 5 dakika inkübe edin. FL kümelerini vitrifiye ediyorsanız, bir seferde tek bir kümeyi işleyin.
- İlk inkübasyon neredeyse tamamlandığında aynı tabağa üç damla VS2'yi yan yana koyun. Ardından, folikülleri 60 saniye içinde üç VS2 damlası boyunca sırayla hızlı bir şekilde hareket ettirin ve taşıyıcıya yükleyin. Ortamı bir damladan diğerine izlemekten kaçınmak için foliküllerle minimum miktarda sıvı çekmeye dikkat edin.
- Taşıyıcıyı yüklemek için iki folikül alın ve plastik çubuktaki küçük deliğe minimum sıvı ile bırakın. Delikteki son sıvı hacmi çok küçüktür < 0,5 μL'dir. Sıvının delikten dışarı çıkmasına ve plastik çubuğun üzerine dökülmesine neden olan aşırı doldurmadan kaçının.
- Çubuğu önceden soğutulmuş dış pipetin içine bırakın. Pipeti kapatmak ve mühürlemek için ultrasonik sızdırmazlık maddesini kullanın. Pipeti kriyokana bağlı bir kadehin içine yerleştirin. Aynı kadehe en fazla 4 pipet yerleştirilebilir.
- Bastonu plastik bir koruyucu kılıfla örtün. Bastonu bir sıvı nitrojen depolama (LN2) tankına daldırın.
- Açık taşıyıcı CL vitrifikasyonu
- 37 °C'ye kadar ön ısıtma VS çözümleri. Laminer akış başlığının ısıtılmış yüzeyinde tüm vitrifikasyon adımlarını gerçekleştirin. İhtiyaç duyulan CL açık taşıyıcı sayısını önceden hazırlayın. Metal CL gövdesini mıknatıslanmış flakon kapağına yerleştirin ve sıkıca tuttuğundan emin olun (gerekirse küçük bir yapışkan parçası kullanın).
- İzoleli kriyokutuyu sıvı nitrojen (LN2) ile doldurun. Kriyoviyalleri, LN2 şişenin üst kısmının altında olacak şekilde tutmak için kriyo kutusuna bir raf yerleştirin.
- Özel manyetize edilmiş ve havalandırılmış şişeyi LN2 ile doldurun. Rafa yerleştirin. Vitrifikasyon adımlarını 6.1.3 ila 6.1.5 adımlarında açıklandığı gibi gerçekleştirin. Tek fark, tipik olarak bir seferde beş folikülü işlememizdir. Bir kez daha, izleme sıvısını damladan damlaya en aza indirmeye dikkat edin.
- Folikülleri yüklemek için, metal çubuğu kullanarak CL açık taşıyıcısını takılı manyetik kapağından kavrayın. Bir kriyoprotektan filmi oluşturmak için CL açık taşıyıcıyı ayrı bir VS2 damlasına batırın.
- Bir mikropipet kullanarak tüm folikülleri veya FL-Cluster'ı alın ve minimum sıvı ile filmin üzerine yerleştirin. Film kurumaya başlamadan önce foliküllerin yüklenmesi gerektiğinden hızlı çalışın.
- Numuneyi vitrifiye etmek için CL'yi hemen LN2 ile doldurulmuş kriyoviyalin içine daldırın. Şişeyi kapatın ve kriyokanın üzerine yerleştirin. Plastik bir kılıf ile örtün. Bastonu sıvı nitrojen depolama tankına daldırın.
6. Vitrifiye foliküllerin ve FL kümelerinin ısınması
- RI kapalı taşıyıcı ısınması
- Dış kuyucukta 3 mL ve orta kuyuda 1 mL önceden dengelenmiş FCM içeren bir merkez kuyu kabı hazırlayın. Yağ ile kaplayın ve inkübatöre yerleştirin.
- 0,5 mL önceden ısıtılmış WS1 ve WS2'yi etiketli iki merkez kuyu kabına yerleştirin. Numunelerin bulunduğu bastonları depolama tankından LN2 ile dolu bir kriyobox'a taşıyın.
- Plastik baston kapağını çıkarın. Pipeti kadehten çıkarın, daldırın ve kriyo kutusundaki tutma yuvasına kaydırın.
- İnce makas kullanarak, foliküllü iç RI taşıyıcısının üst kısmını gösteren siyah noktanın hemen üzerinde dış pipeti kesin.
- İnce forseps kullanarak, iç plastik çubuğu dış pipetten hafifçe kaldırın. Cihazı kavrayın ve çubuğu hızlı bir şekilde WS1'e daldırın, folikülleri boşaltmak için hafifçe döndürün. Hız çok önemlidir. Foliküllerin 10 saniye içinde WS1'e boşaltılması gerekir.
- Folikülleri görselleştirmek ve hepsinin taşıyıcıdan boşaltıldığından emin olmak için bir diseksiyon mikroskobu kullanın. WS1'de 2 dakika sonra, ortamı izlememeye dikkat ederek tüm folikülleri (veya FL-Cluster'ı) WS2'ye taşımak için bir mikropipet kullanın.
- 3 dakika sonra, folikülleri FCM kabının dış kuyucuğunda durulayın ve ardından merkez kuyucuğuna hareket ettirin. Yerleştirmeden önce 1-2 saat inkübatöre geri koyun.
- CL Açık taşıyıcı ısınma
- FCM ve WS yemeklerini yukarıda anlatıldığı gibi hazırlayın. Foliküllü kamışı bir depolama tankından LN2 ile doldurulmuş bir kriyo kutusuna taşıyın. Plastik baston kapağını çıkarın.
- CL'nin metal gövdesi görünene kadar kriyoviyal kapağı kaldırmak için manyetik çubuğu kullanın.
- Forseps kullanarak metal gövdeyi kavrayın. CL'yi şişeden çıkarın ve çok hızlı bir şekilde WS 1'e daldırın, folikülleri boşaltmak için hafifçe döndürün. 10 saniye içinde WS1'e boşaltın. Bir diseksiyon kapsamı kullanarak, tüm foliküllerin boşaltıldığını doğrulayın
- Isınma için kalan tüm adımlar, adım 7.1.6'dan başlayarak RI kapalı taşıyıcı adımlarıyla aynıdır.
7. Folikül ve FL kümesi görüntüleme ve ortam değişimi
- 10-12 günlük kültür aralığı sırasında Hoffman kontrast modülasyon optikli ve yüksek çözünürlüklü bir kamera ile donatılmış ters çevrilmiş bir ışık mikroskobu kullanarak kuyucuklardaki folikülleri ve FL kümelerini izleyin. Boyuta bağlı olarak 40x ve 100x veya 200x toplam büyütme ile görüntü yakalamak için görüntüleme yazılımı kullanın.
- Foliküllerin görüntülenmesi ve değerlendirilmesi
- Kültür Günü 1'de, gömdükten sonra, temel morfoloji ve boyutu belirlemek için ters çevrilmiş bir mikroskop kullanarak tüm kültür kuyularını 40x ve 200x büyütmede görüntüleyin. Çanağı inkübatöre geri koyun.
- Görüntüleri görüntüleyin ve her bir jel boncuktaki tamamen gömülü foliküllerin sayısını kaydedin. FL-C için, kültürün başlangıcında folikül sayısının bir tahminini yapın.
- Görüntüleme yazılımı kullanarak, bazal membranın kenarından dikey ve yatay düzlemler boyunca folikül çapını ölçün. Oosit boyutunu benzer şekilde zonanın dış kenarından ölçün. Ortalama değerleri kaydedin. Küme çapının dikey ve yatay bir ölçüsünü alın.
- Her 2-3 günde bir kültürleri görüntülemeye devam edin. Birbiriyle temas etmeyen foliküllerin çaplarını ölçün. FL-C ile, kümeler IVC sırasında toplanır, böylece tüm küme dikey ve yatay düzlemde ölçülebilir.
NOT: Birbirine yakın gruplanmış foliküller için, tek tek folikül sınırları kültürün 4. gününden sonra fark edilemeyebilir, bu nedenle ölçüm yapılmaz. - Koyu veya apoptotik hale gelen foliküllerin yanı sıra oositin artık granüloza hücreleri ile çevrili olmadığı veya cansız olarak ekstrüde edildiği folikülleri sınıflandırın. Çanak yüzeyine yapışmış folikülleri veya FL-C'yi takip edin (bkz. Şekil 5).
- 8. günden itibaren antrum oluşumu için folikülleri dikkatlice gözlemleyin. Antrumlu foliküller, içlerinde bir açıklık veya daha hafif bir boşluk varmış gibi görünecektir (Şekil 6).
- Her 2 günde bir yarım kültür ortamı değişikliği yapın. 50 μL'ye ayarlanmış bir P200 pipetleyici kullanın. Ucu yağ tabakasının altına iyice yerleştirin ve jel boncuktan uzağa yerleştirin. Kültür ortamının 50 μL'sini yavaşça çekin. Yağ tabakasının altına 50 μL taze FCM'yi yavaşça pipetleyerek ortamı değiştirin. Baloncuk yapmaktan kaçının.
8. Kapsüllenmiş foliküllerde oositlerin olgunlaşması
NOT: Son olgunlaşma aşaması tipik olarak, toplam tohumlanmış (ve canlı) foliküller arasında antrum oluşumu %40'ın üzerine çıktığında başlatılır. Bununla birlikte, antrum oluşumunun düşük olması veya görünür olmaması durumunda, kültürün 12. gününe kadar tetiklemenizi öneririz. Daha fazla beklemenin bir faydası olmadığını gözlemledik. FL-C kültürleri için, olgunlaşma tipik olarak oyukların %40'ında veya en geç 12. günde antrumlar gözlendiğinde tetiklenir.
- FCM'yi 1.5 IU / mL insan koryonik gonadotropin (hCG) ve 5 ng / mL epidermal büyüme faktörü (EGF) ile takviye ederek in vitro olgunlaşma ortamı (IVM) hazırlayın.
- Her bir oyuktaki FCM'yi öğleden sonra 5 civarında 100 μL IVM ortamı ile değiştirerek olgunlaşmayı tetikleyin. Gece boyunca olgunlaşmadan sonra (tetiklemeden 16-18 saat sonra), HA jel boncuğundan yumurtlayan kümülüs-oosit kompleksleri (COC'ler) için her kültürü iyi incelemek için 40x büyütmede bir diseksiyon mikroskobu kullanın. COC'ler genellikle jel boncuğun hemen üzerinde veya yakın bir yerde bulunur.
- Yumurtlanmış COC'leri, yağ ile kaplanmış 1 mL önceden dengelenmiş FCM içeren bir merkez kuyu kabına toplayın ve çanağı tekrar inkübatöre yerleştirin.
- Yumurtlanmamış COC'leri serbest bırakmak için HA boncuğunu bir P200 pipetleyici kullanarak nazikçe pipetleyerek hala gömülü olan foliküllerden oositleri toplayın. Bunları FCM ile ayrı bir tabakta toplayın.
- Dış duvarda 1 mL hyaluronidaz (10 IU / mL) ve 3 mL FCM ortamı içeren bir orta kuyu yemeği hazırlayın.
- Yumurtlanmış COC'leri hyaluronidaz çözeltisine aktarın ve oosit nükleer durumunu görselleştirmek için granüloza hücrelerinin oositini yok etmek için enzime (30-45 s) kısaca maruz bırakın. Ayrıntılı değerlendirme için yağ altında 5 μL damla taze ortama koymadan önce enzimi çıkarmak için oositleri durulayın. Çanağı kuluçka makinesine yerleştirin. Yumurtlanmamış COC'ler için bu işlemi tekrarlayın.
- Geri kazanılan yumurtlayan ve yumurtlamayan yumurtaların toplam sayısını kaydedin. Kurtarılan her oositin nükleer durumunu (GV, metafaz I veya metafaz II) fotoğraflayın ve değerlendirin. Çapı ölçün ve kaydedin.
- Toplam canlı foliküllere (hCG tetikleme gününe ulaşanlar) ve geri kazanılan toplam yumurtalara dayalı olarak IVC sağkalım oranını hesaplayın. Yumurtlanan COC'lerden metafaz II oositlerinin yüzdesini hesaplayın. Yumurtlanmamış COC'lerden geri kazanılan oositler için bunu tekrarlayın.
- FL-C için aynı şekilde metafaz II'ye olgunlaşma oranını belirleyin.
Sonuçlar
Bu makale, fare preantral foliküllerinin in vitro kültürü için yeni bir tiramin bağlantılı hyaluronan jelin kullanımına ilişkin metodolojiyi detaylandırmaktadır36,37. Şekil 6, konvansiyonel bir 2 boyutlu kültür sistemine yerleştirildiğinde preantral folikül büyümesi ile 3 boyutlu kültür için HA jeli içinde kapsüllenmiş tek bir folikül arasındaki farkları göstermektedir. Doğal folikül mimarisi, büyümenin son gününde açıkça görülebilen bir antrum ile 12 günlük kültür boyunca korunur.
HA jeli çok yönlüdür, izole edilmiş foliküllerin tek tek veya gruplar halinde büyümesine izin verir ve ayrıca yumurtalık dokusu mekanik olarak küçük folikül kümelerine ayrılır. Jel şeffaftır, bu da foliküllerin farklı derinliklerde bile olsa görselleştirilmesini mümkün kılar. Kapsüllenmiş foliküller ve FL-C, devam eden granüloza hücre proliferasyonundan radyal genişleme gösterir (Şekil 7). Başlangıç folikül çapları ortalama 139.8 ± 28 μm ve GV oosit çapı 63.5 ± 4.6 μm arasındadır. Tek başına kültürlenmiş foliküllerde, nihai çaplar yaklaşık 385.6 ± 36.7 μm'dir, bu da boyutta kabaca 3 kat artıştır. Yumurtlanmış metafaz II oositler 84.8 ± 3.8 μm civarındadır. Kültürlenmiş FL kümeleri içinde folikül boyutu oldukça çeşitlidir (Şekil 5, Şekil 7). HCG tetiklendikten sonra yumurtlayan oositler folikülün yakınında bulunur (Şekil 8). Metafaz II oositlerin çoğu yumurtlanan COC'lerden alınacaktır. Tetiklemeden sonra hala gömülü olan foliküller genellikle GV ve metafaz I oositleri içerir.
Tablo 1 , izole edilmiş foliküller ile taze veya donmuş yumurtalıklardan elde edilen FL kümeleri arasındaki olgunlaşma oranlarını karşılaştırır. Dondurularak saklanmış yumurtalıklardan elde edilen FL-C, önemli ölçüde daha düşük olgunlaşma oranlarına sahipti. Mikroskobik gözlemler, sıklıkla kırık bazal laminalara sahip olduklarını gösterdi ve bu da onları erken oosit ekstrüzyonuna karşı oldukça duyarlı hale getirdi. Folikül kümelerinin kırılgan doğası, kapsülleme ile bir şekilde karşılandı. Dondurularak saklanmış yumurtalıkların kollajenaz tedavisinden, özellikle düşük sağkalım ve düşük sağlam folikül verimi ile zarar verdiği için kaçınılmıştır.
İzole edilmiş foliküllerin dondurularak saklanması, tüm yumurtalığın korunmasından çok daha etkilidir. İncelenen her iki vitrifikasyon yöntemi ile yüksek olgunlaşma oranları elde edilebilir (Tablo 2). Soğutma hızlarındaki büyük farklılıklara rağmen, IVC sonrası oosit olgunlaşması farklılık göstermedi. CL açık taşıyıcı, tek bir CL açık taşıyıcıya on adede kadar folikül yüklenebildiğinden daha fazla verimlilik sağlar. Bu aynı zamanda birden fazla kriyoprezerve folikülün kurtarılması için toplam süreyi kısaltır. Bununla birlikte, insan folikülleri için vitrifikasyonun herhangi bir nihai klinik uygulaması için kapalı sızdırmaz sistem tercih edilebilir.
GV oositinin nükleolus etrafındaki kromatin düzenlemesi, yumurtlamadan sonra döllenme ve blastosistlere38 gelişme olasılığı en yüksek olan oositleri tanımlamak için kullanılabilir. Şekil 9 , kromatin dağılım modelini görselleştirmek için oositlerin canlı boyanmasını göstermektedir.
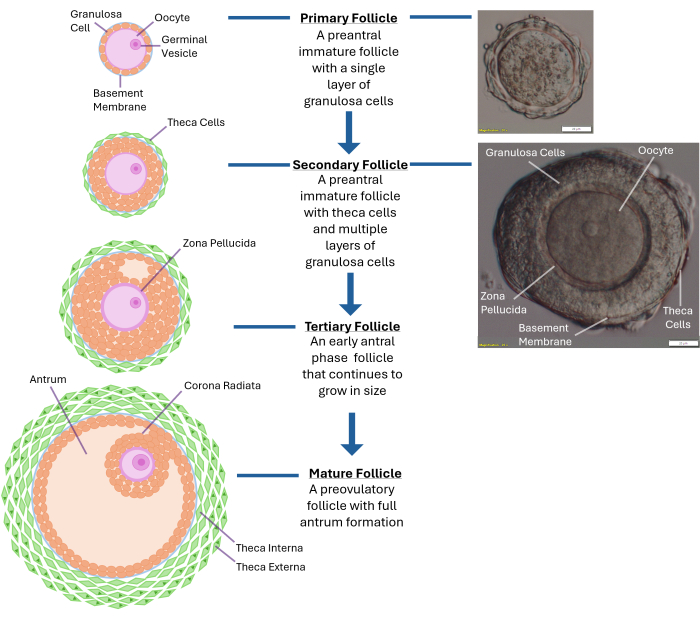
Şekil 1: Folikül büyümesinin şeması. Bu diyagram, birincil folikülden ikincil preantral aşamaya ve son olarak yumurtlamaya hazır tamamen olgun bir üçüncül foliküle kadar folikül gelişiminin farklı aşamalarını göstermektedir. Tipik bir preantral folikülün mikroskobik görüntüsü de farklı morfolojik özellikleri ile gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
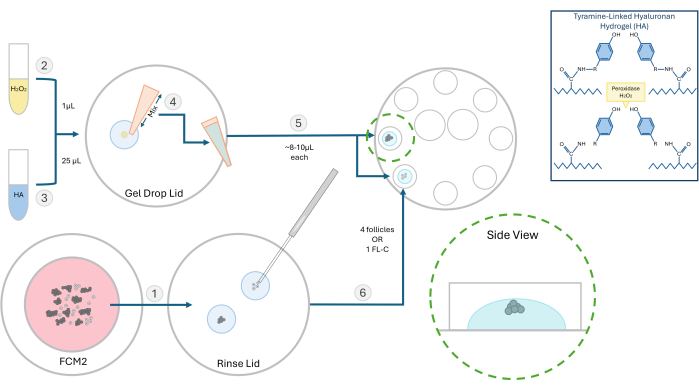
Şekil 2: HA kapsülleme yönteminin şeması. Hyaluronan jelin yapısı ve folikül gömme için farklı adımlar bu şemada gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
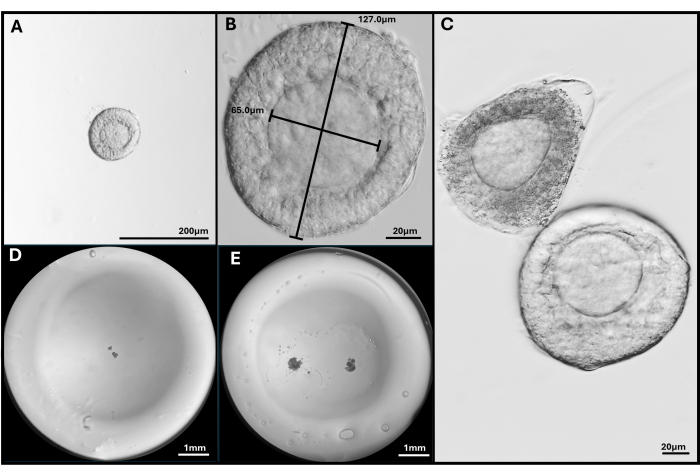
Şekil 3: Folikül izolasyonu ve kapsülleme. (A, B) Preantral folikül, 40x ve 200x büyütmede gömülmek üzere seçilmiştir. (C) Apoptotik folikül, oositin tam olarak merkezi olmadığı sağlıklı preantral folikül ile gösterilmiştir. (D) Folikül ile ekilmiş HA jel boncuğunun görüntüsü ve (E) iki FL-C ile. Jel boncuğun tamamını göstermek için stereomikroskop ile çekilen görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: İzole edilmiş foliküllerin dondurularak saklanması için vitrifikasyon cihazları. CL açık taşıyıcı cihaz ile vitrifikasyon adımı, foliküllerin doğrudan sıvı nitrojene daldırılmasıyla gerçekleştirilir. Bu nedenle soğutma hızı -20.000 °C/dk'nın üzerinde son derece yüksektir. Buna karşılık, RI kapalı taşıyıcı ile, foliküller iç plastik çubuğa yüklenir ve sıvı nitrojene batırılmış bir dış pipete bırakılır. Bu kapalı vitrifikasyon yöntemi, sıvı nitrojen ile doğrudan teması önler. Bununla birlikte, soğutma hızı -1220 °C/dk'da önemli ölçüde daha düşüktür. Foliküllerin her iki taşıyıcıdan da yüklenmesi ve geri kazanılması kolaydır. CL açık taşıyıcı, RI kapalı taşıyıcıyla sadece iki foliküle kıyasla, cihaz başına on foliküle kadar yüklemeyi barındırıyordu. Bu rakam35'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
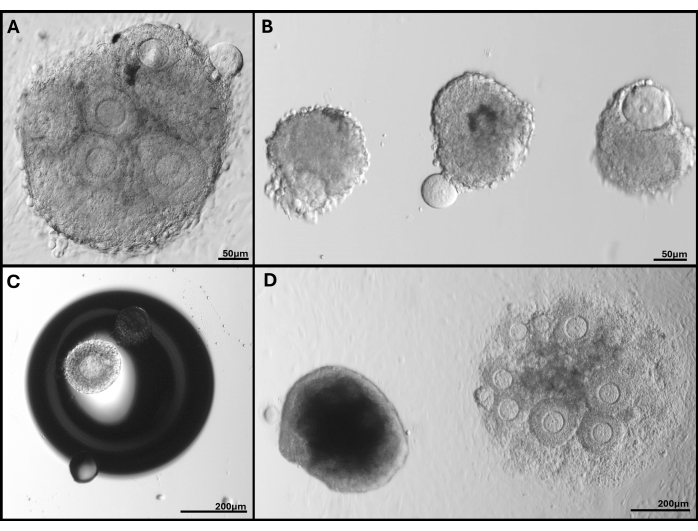
Şekil 5: Karşılaşılan sorunların temsili görüntüleri. (A) Oositin ekstrüde edildiği folikül kümesi. (B) Kırık bazal lamina membranı olan izole foliküller ve ekstrüde oositli foliküller. (C) Jeldeki bir kabarcığın altına gömülü folikül. (D) Jel içinde kalan folikül kümesi (solda), çok derine gömülü kümeye kıyasla sonunda tabağa yapışır. FL-C'deki çok çeşitli folikül boyutları açıkça görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
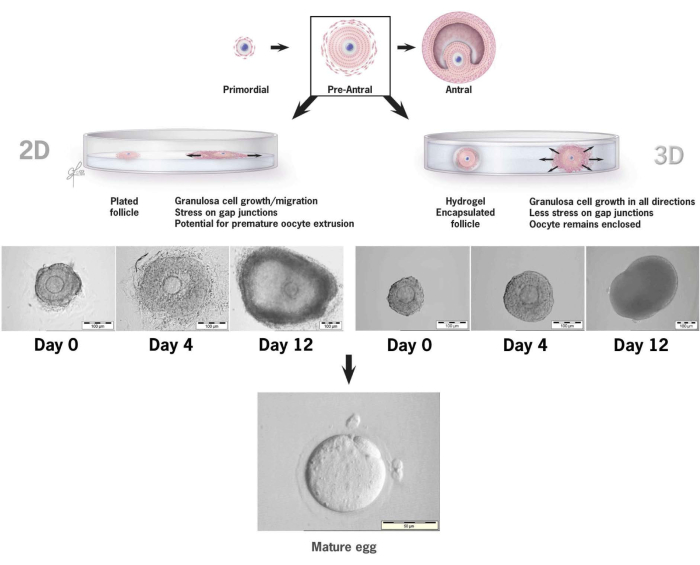
Şekil 6: HA'da 2 boyutlu ve 3 boyutlu kültür konvansiyonlarında folikül büyümesinin karşılaştırılması. 2 boyutlu büyüme ile, folikülün düzleşmesi ve granüloza hücrelerinin doku kültürü kabına bağlanması 4. güne kadar gözlemlendi ve oositi granüloza hücre göçüne, boşluk bağlantılarının bozulmasına ve erken oosit ekstrüzyonuna karşı savunmasız bıraktı. HA kapsüllenmiş folikül, kültür aralığı boyunca bağlanmadan kaldı. Granüloza hücre genişlemesi, oositi sararak ve 3 boyutlu mimariyi koruyarak her yöne meydana geldi. Bu rakam36'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
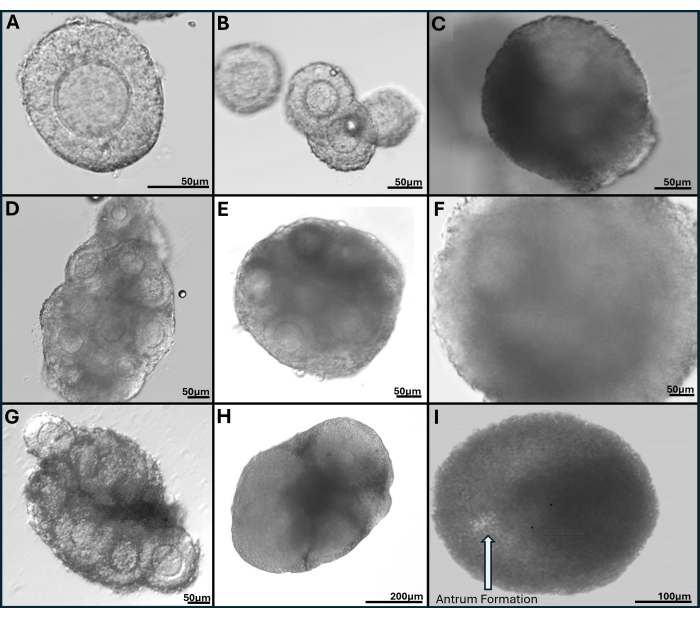
Şekil 7: Tiramin bağlantılı hyaluronan jel içinde kapsüllenmiş foliküllerin temsili görüntüleri. (A) 1. günde taze yumurtalığın kollajenaz sindiriminden sonra toplanan preantral folikül. (B) Kültürün 1. ve (C) 4. gününde görüntülenen dört preantral folikül ile tohumlanan jel damlası; (D) 2. günde taze yumurtalıktan folikül kümesi; 6. günde (E) ve kültürün 9. gününde (F). (G) Vitrifiye tüm yumurtalıktan mekanik olarak diseke edilen folikül kümesi, kültürün 2. gününde ve (H) 6. gününde gösterilmiştir. (I) Antrum oluşumu ile folikül, kültürün 9. gününde açıkça görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
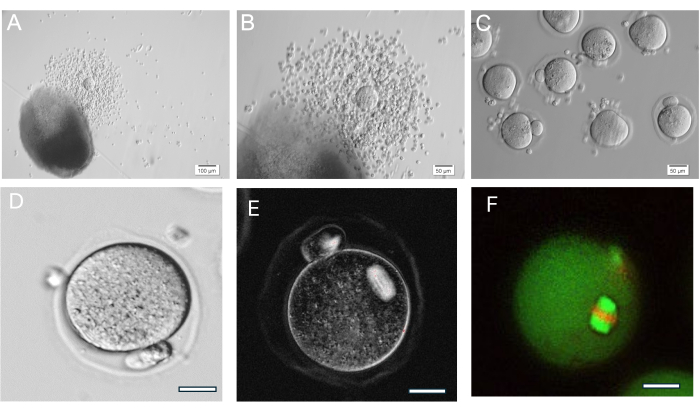
Şekil 8: Oosit yumurtlaması. (A, B) Yumurtlanmış kümülüs-oosit kompleksi (COC) bir sonraki HA-jel boncuğu gösterilmiştir. (C) Oositler, çevredeki kümülüs hücrelerini uzaklaştırmak için COC'lerin hyaluronidaz ile enzimatik muamelesinden sonra görüntülendi. Çok sayıda metafaz II oosit. (D) Belirgin polar gövdeli metafaz II oosit. Büyütme 400x. (E) Polarize ışık ve mayotik iği görselleştirmek ve organizasyonu değerlendirmek için bir görüntüleme sistemi kullanılarak metafaz II oositin canlı görüntülenmesi,37'de açıklandığı gibi yapılır. Büyütme 400x. Normal çift kırılmalı iş mili görünür. (F) Metafaz II oosit, mayotik iğ organizasyonunu görselleştirmek için anti-alfa / beta-tubulin ve propidyum iyodür ile sabitlenmiş ve boyanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
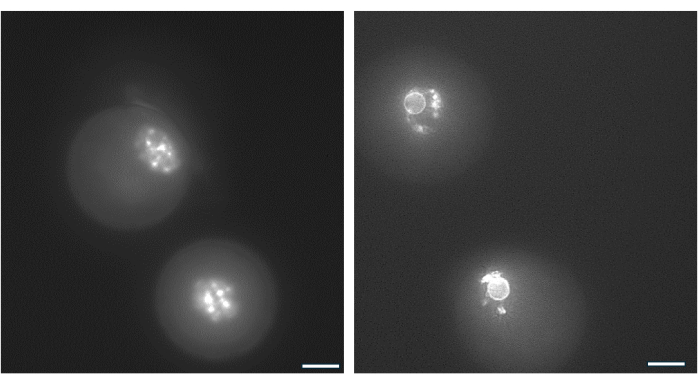
Şekil 9: GV oositlerinde kromatin yeniden düzenlenmesi. Antrum oluşumundan sonra GV oositlerindeki kromatin dizilimi, DNA'nın Hoechst 33342 (50 ng/mL) ile boyanması ile incelendi. Temsili foliküller, HA boncuklarından nazik pipetleme ile hasat edildi. Granulosa hücreleri hyaluronidaz kullanılarak uzaklaştırıldı. GV oositleri daha sonra 15 dakika süreyle boyandı (Monti ve ark.38'in protokolüne bakınız). Görüntüler 40x büyütme ile çekilmiştir. (A) Kültür başlangıcında 1. günde gösterilen ve çevrelenmemiş kromatin (NSN) boyama paterni sergileyen GV oosit. (B) HCG tetikleyicisinin olduğu gün gösterilen antrum ile büyüyen folikülden GV oosit. Kromatin yoğunlaştı ve nükleolün etrafında perinükleer bir halka oluşturdu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Parametre | Taze Yumurtalık | Donmuş Yumurtalık | |
| FL-İzole | FL-Kümesi | FL-Kümesi | |
| IVC Sırasında Gözlenen Foliküller | 130 | 154 | 69 |
| HCG sonrası yumurtlama (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| MII oosit oluşumu (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tablo 1: Taze ve vitrifiye yumurtalıklardan HA gömülü foliküller ile sonuçlar. Taze yumurtalıklardan elde edilen foliküller ve FL-C, HA jeli içinde kapsüllendikten sonra in vitro olarak olgunlaştırıldı. HA jeli ayrıca bir EG / DMSO protokolü39 kullanılarak vitrifiye edilen yumurtalıklardan alınan foliküller üzerinde test edildi. Taze yumurtalıklarla, kollajenaz sindiriminden sonra hem bireysel foliküller (FL) hem de folikül kümeleri (FL-C) toplandı. Vitrifiye yumurtalıklar için, kollajenaza maruz kalmak aslında foliküllere zarar veriyordu. Dondurularak saklanmış yumurtalıklar için en iyi yaklaşım, tek tek foliküller yerine FL kümelerini izole etmek ve sadece iğnelerle mekanik diseksiyon kullanmaktı. Tablo, 4-6'lık gruplar halinde foliküllerle ekilen HA boncukları ile 6-10 folikül içeren tek bir FL-C'ye sahip boncuklar arasındaki sonuçları karşılaştırır. * Dondurularak saklanmış yumurtalıklardan FL-C ile olgunlaşma oranı anlamlı derecede düşüktü (p = 0.008; Anlamlılığı test etmek için Ki-Kare analizi).
| Taşıyıcı | Rİ | CL |
| (Kapalı) | (Açık) | |
| Hayatta kalma (%) | 100% (24/24) | 100% (41/41) |
| Antrum oluşumu* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Yumurtlama oranı (%) | 66.7% (16/24) | 87.8% (36/41) |
| Olgunlaşma oranı (% MIIs) | 81.3% (13/16) | 69.4% (25/36) |
Tablo 2: İzole foliküllerin iki farklı vitrifikasyon cihazında dondurularak saklanması sonrası sonuçlar. Hem açık CL cihazı hem de daha düşük soğutma hızı ile kapalı RI taşıyıcısı ile yüksek olgunlaşma oranları elde edildi. Antrum oluşumu, anlamlı olduğu gözlenen ancak genel olgunlaşma oranını etkilemeyen tek sonuç ölçütü idi (p < 0.05; Anlamlılığı test etmek için ki-kare analizi).
Tartışmalar
Tiramin bağlantılı HA hidrojelin mekanik özelliklerini ve biyolojik olarak parçalanabilirliğini kontrol etme yeteneği, doku mühendisliği uygulamaları için birçok avantaj sunar. Laboratuvarımız, yumurtalık folikülü büyümesi için bu özel HA jelini ilk uygulayan kişidir. Bu patentli tiramin ikameli sodyum hyaluronat jel (TS-NAHY), Cleveland Clinic'te geliştirilen yeni bir hyaluronan bazlı hidrojel sistemidir. Jelin çapraz bağlanması, aktive edilmiş jel karışımındaki peroksidazın bir oksitleyici maddeye maruz kalmasıyla tahrik edilir. Bu hem in vitro hem de in vivo olarak yapılabilir. Şekillendirilmiş TS-NAHY hidrojeller, jel40 konsantrasyonuna bağlı olarak zayıf jelden, bir macundan kırılgan bir katıya kadar geniş bir spektrum gösterir.
Yumurtalık folikül kültüründeki hayal kırıklığı yaratan ilerleme, yeni kültür modelleri tasarlama ihtiyacını vurgulamaktadır. Sadece doğal ekstraselüler matriks bileşenlerine dayalı bir kültür sisteminin oluşturulması daha avantajlı bir yaklaşım olabilir. Açıklanan HA kültür modelinin, ek ECM bileşenlerine gerek kalmadan fizyolojik bir şekilde kullanımı kolaydır. Jel şeffaftır ve foliküllerin ayrıntılı olarak görselleştirilmesini sağlar. HA jelin viskoelastik özellikleri, sertliğin yanı sıra kalıplanabilirliğin ayarlanmasını da kolaylaştırır. Bu özellik, bu biyomatrisin çok yönlülüğünü artırır. Bir biyomatrisin sertliği, granüloza hücre proliferasyonunu ve antrum oluşumunu etkileyebilir 30,41,42. Antrum oluşumuna izin veren kültür ortamlarından türetilen foliküllerin, destekleyici olmayan bir kültür sistemindekilerden farklı gen ekspresyon profillerine sahip olduğu bildirilmiştir43. Primat folikülleri daha sert bir matris gerektiriyor gibi görünmektedir44. Biyomatrisi, insanlar da dahil olmak üzere farklı hayvan türlerinin gereksinimlerini karşılayacak şekilde uyarlamak, başarılı in vitro olgunlaşma için muhtemelen önemli olacaktır.
Fare preantral folikül büyümesi için 2-5 mg / mL36 arasında değişen jel konsantrasyonlarını test ettik. Oosit maturasyon oranları %44 ile %58 arasında değişmektedir. HA jelinin daha yüksek konsantrasyonları, 3 boyutlu bir yapının daha fazla kalıplanabilirliğine ve tutulmasına izin verdi, ancak folikül genişlemesi etkilendi. Daha düşük HA konsantrasyonları, folikülün daha fazla radyal genişlemesine izin verdi, ancak folikülün IVC'nin bitiminden önce kendiliğinden ekstrüde edilme riskini artırdı. 3-3.5 mg / mL HA konsantrasyonu, fare preantral folikülleri için en iyi sonucu verdi. Jel damlasını küçük tutmak, folikülleri IVC boyunca 3 boyutlu bir konfigürasyonda tutmak için yeterli derinliğe sahip HA jel boncukları oluşturmak için çok önemliydi. Daha büyük damlalar düzleşir, bu da foliküllerin jelden inmesine ve plaka yüzeyine bağlanmasına neden olur. Bu biyomateryalin gömme için kullanımının bir sınırlaması, son derece hızlı jelleşme süresidir. Bir seferde ikiden fazla HA jel boncuğunun tohumlanmasını zorlaştırır. HA jeline folikül tohumlamanın verimliliğini artırmak, geliştirmeye çalıştığımız bir alandır.
HA kullanılarak 3 boyutlu bir ortamda folikül kümelerinin kültürü büyük bir potansiyele sahiptir. Normal yumurtalık mimarisi, farklı büyüklükteki foliküllerin birbiriyle temas halinde olması ve destekleyici stroma ile korunur. LH, erken farklılaşan tekal hücrelerde değişiklikleri indükleyerek FL-C'deki daha küçük preantral foliküllerin büyümesine yardımcı olabilir, bu nedenle FCM ortamına45 dahil edildi. HCG tetikleyicisinden sonra hala gömülü olan daha küçük foliküllerin herhangi birinde yeni bir büyüme dalgasının başlatılıp başlatılamayacağını görmek için FL-C kültürüne son 12 gün devam etmek daha fazla çalışmaya ihtiyaç duyar. Kültür ortamının daha fazla optimizasyonu, bir doku parçasında farklı boyut aralıklarındaki foliküllerin yetiştirilmesi için bir ön koşul olabilir. FL-C ile bu 3 boyutlu HA kültür modelinin bir avantajı, in vivo foliküler düzenleme ve etkileşimlerin yakından taklit edilmesine izin vermesidir. Bir diğer önemli özellik, kalsiyum aljinat ve diğer polimer sistemlerinden farklı olarak, folikülleri dokudan veya jel matrisinden fiziksel olarak çıkarmadan yumurtlama ve olgunlaşmanın indüklenebilmesidir.
İn vitro folikül kültürü ve dondurma için olgun oositlerin elde edilmesi için gereken süre, özellikle büyük memelilerde uzundur. Hasat edilen folikülleri veya folikül kümelerini kriyoprezervasyon yeteneği, bu adımı daha sonraki ve muhtemelen daha uygun bir zamana kadar geciktirmenin bir yolunu sunar. Böyle bir teknoloji bir gün yumurtalık hasadı sırasında insan foliküllerine uygulanabilirse, faydalı olabilir. Doğurganlığın korunması için tüm yumurtalık kriyoprezervasyonu şu anda hastalar için tek seçenektir. Ama aslında, en iyi yöntem olup olmadığı belirlenmeye devam ediyor. Bu yazıda, preantral folikül kriyoprezervasyonu için 3 boyutlu kültürden sonra mükemmel ısınma sonrası sağkalım ve olgunlaşma oranları sağlayan bir vitrifikasyon metodolojisi sunuyoruz.
Sonuç olarak, yerel ECM'nin bir bileşeni olan hyaluronan kullanarak yeni bir 3 boyutlu kültür modeli tanımladık. HA kapsülleme tekniği, trofik faktörlerin gelişmekte olan foliküllere yakın bir yerde tutulmasına izin verir. Biyomatriste kapsülleme metodolojisi basittir ve izole edilmiş foliküllerin yanı sıra folikül kümelerini de barındırabilir. İkincisi, yeni araştırma yolları açabilir ve folikülojenezin temel biyolojisi ve düzenlenmesi hakkında fikir verebilir. HA kapsüllenmiş foliküllerden elde edilen oositlerin fonksiyonel olarak yetkin olduğu gösterilmiştir37. Bu oositler döllenebilir, in vitro blastosistler oluşturabilir ve yalancı hamile farelere transfer edildikten sonra implante edilebilir. Bu veriler, tiramin bağlantılı hyaluronanın 3 boyutlu folikül kültürü ve in vitro oosit olgunlaşması için bir biyomatris olarak kullanımını doğrulamaktadır. Bu protokol, insanlar da dahil olmak üzere diğer hayvan modellerinde yumurtalık folikül kültürüne potansiyel olarak uygulanabilir. Bu 3 boyutlu HA jel sistemi için diğer olası uygulamalar embriyoid cisimci ve organoid kültür olabilir.
Açıklamalar
Çıkar çatışması veya açıklama olmaması.
Teşekkürler
Cleveland Clinic'teki tüm embriyoloji ekibine yardımları için, REI departmanına ve özellikle Dr. Falcone'a destekleri için teşekkür etmek istiyoruz. Bu proje, Cleveland Clinic'teki bir araştırma fonu aracılığıyla finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Referanslar
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır