Method Article
Applicazione di un nuovo idrogel di acido ialuronico per la coltura tridimensionale dei follicoli e metodologia per la crioconservazione dei follicoli ovarici di topo
In questo articolo
Riepilogo
Questo protocollo descrive un nuovo modello di coltura tridimensionale (3D) che utilizza un idrogel di acido ialuronico legato alla tiramina per incapsulare e coltivare follicoli preantrali dall'ovaio di topo. Descriviamo anche due approcci alla crioconservazione del follicolo ovarico mediante vitrificazione.
Abstract
L'architettura 3D del follicolo ovarico e le complesse interazioni tra i componenti delle cellule somatiche e l'ovocita, necessarie per la maturazione citoplasmatica e nucleare, sono difficili da mantenere nei sistemi di coltura bidimensionali (2D) convenzionali. Descriviamo un nuovo modello di coltura 3D utilizzando un idrogel di acido ialuronico legato alla tiramina per l'incapsulamento e la coltura dei follicoli ovarici di topo. La tecnica di incapsulamento con acido ialuronico consente la crescita 3D dei follicoli e la ritenzione dei fattori trofici in prossimità dei follicoli in via di sviluppo. Questo idrogel è altamente versatile e può essere applicato su follicoli isolati e frammenti di tessuto ovarico. Le proprietà viscoelastiche del gel HA consentono di regolare la rigidità e la modellabilità in base alla concentrazione del gel. I follicoli preantrali che si sviluppano in questo modello di coltura sono in grado di completare la maturazione meiotica entro 10-12 giorni dalla coltura e di ovulare un ovocita in metafase II dopo l'attivazione con hCG. Questo articolo descrive anche due approcci alla crioconservazione del follicolo ovarico mediante vitrificazione.
Introduzione
La follicologenesi umana in vitro rimane una sfida anche quattro decenni dopo la prima nascita dalla fecondazione in vitro. Ad oggi, manca ancora una metodologia per la coltura del follicolo ovarico umano che supporti la produzione di un embrione vitale che porti a un bambino sano1. Restano da determinare le proprietà fisiche ottimali necessarie per la crescita dei follicoli umani in vitro. L'ovaio intatto è popolato da migliaia di follicoli in vari stadi di sviluppo e la regolazione della loro crescita è un processo complesso (Figura 1)2. Gli ovociti allo stadio di vescicola germinale (GV) provenienti da follicoli preantrali umani impiegano fino a 30 giorni in coltura per diventare meioticamente maturi e raggiungere lo stadio3 della metafase II. La comunicazione bidirezionale tra l'ovocita e le cellule della granulosa circostanti attraverso giunzioni gap è fondamentale per la maturazione citoplasmatica e nucleare 4,5,6.
I sistemi di coltura 2D convenzionali non sono ideali per la coltura dei follicoli, specialmente nei modelli di mammiferi più grandi che richiedono un tempo prolungato in coltura. I follicoli si attaccano alla piastra e il legame tra le cellule della granulosa e l'ovocita diventa più tenue man mano che le cellule della granulosa migrano via. I sistemi di coltura tridimensionali (3D) per i follicoli sono quindi emersi come mezzo per imitare più da vicino la fisiologia in vivo 7,8.
L'incapsulamento dei follicoli all'interno di una matrice per promuovere la crescita 3D è stato un approccio per preservare l'architettura follicolare durante la coltura in vitro (IVC). Sono state testate biomatrici da polimeri naturali (come collagene, agarosio, fibrina, alginato e acido ialuronico), nonché polimeri sintetici (come polietilenglicole, alcol polivinilico e acido poliglicolico) 7,9,10,11,12,13. È stato dimostrato che le proprietà meccaniche di una biomatrice influenzano la diffusione dei nutrienti, la differenziazione delle cellule tecali, la formazione degli antri e la secrezione ormonale14. Il collagene, come parte della matrice extracellulare naturale (ECM) della cellula, è una delle prime matrici testate ed era inizialmente promettente 15,16,17. Tuttavia, la logistica della standardizzazione dei preparati di collagene, le scarse proprietà meccaniche e la stabilità ne hanno limitato l'uso18. L'agarosio è stato testato sui complessi cumuli-ovociti (COC) rilasciati dai follicoli antrali e sui follicoli primordiali19,20. Più recentemente, uno stampo 3D stampato in agarosio si è dimostrato promettente per la coltura del follicolo senza scaffold21. L'incapsulamento dell'alginato di calcio, riportato per la prima volta nel 2003, è stato, fino ad oggi, il sistema più studiato per IVC22. È stato testato su topi, bovini, scimmie e follicoli umani 23,24,25,26,27. Con l'alginato di calcio, i follicoli vengono caricati singolarmente in micro gocce del polimero ed esposti al cloruro di calcio per generare una perlina di gel. L'estrazione dei follicoli dalla perlina richiede un trattamento con un agente chelante. Tuttavia, questa matrice presenta alcuni inconvenienti. L'alginato è un polisaccaride isolato dalle alghe e, sebbene fornisca supporto, non fa parte della matrice extracellulare naturale del follicolo. I dati suggeriscono una maggiore incidenza di difetti del fuso dopo IVC nell'alginato28. Successive modifiche del sistema combinando l'alginato con la fibrina o altri componenti della matrice extracellulare (ECM) hanno contribuito a rendere il sistema dell'alginato di calcio più efficace29,30.
Prove crescenti indicano che la matrice extracellulare è un modulatore chiave nella crescita cellulare 10,31,32 . Non solo fornisce supporto, ma svolge un ruolo fondamentale nell'attaccamento, nella funzione, nella crescita e nella comunicazione cellulare. Uno dei componenti principali della MEC è lo ialuronano, un glicosaminoglicano presente in natura. Nel follicolo ovarico, l'acido ialuronico è prodotto dalle cellule della granulosa e contribuisce all'integrità strutturale e alla funzione del follicolo in via di sviluppo33,34. L'integrazione dello ialuronano in un modello di coltura follicolare può quindi aiutare a creare un ambiente più fisiologico e migliorare la produzione di ovociti funzionalmente competenti.
Questo lavoro descrive la nuova applicazione di uno ialuronano legato alla tiramina come biomatrice per la coltivazione di follicoli ovarici freschi e congelati e la maturazione in vitro di ovociti (IVM). Descriviamo anche le tecniche per la crioconservazione dei follicoli mediante vitrificazione su due tipi di dispositivi. Un metodo prevede l'immersione diretta in azoto liquido, mentre nel secondo metodo i follicoli sono racchiusi in una cannuccia prima dell'immersione. L'obiettivo principale è dimostrare che, nonostante le differenze, sia le metodologie che i dispositivi possono essere utilizzati in modo affidabile per la crioconservazione dei follicoli.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti secondo i protocolli istituzionali di uso e cura degli animali della Cleveland Clinic e seguendo le linee guida e i regolamenti del National Institutes of Health for Care and Use of Laboratory Animals.
1. Preparazione media
NOTA: I terreni descritti di seguito verranno utilizzati per le diverse fasi di questa procedura: manipolazione del tessuto ovarico (OT), digestione della collagenasi OT, coltura follicolare (FCM) e vitrificazione. Preparare tutto il terreno in una cappa per coltura tissutale utilizzando una tecnica sterile.
- Mezzo di trattamento del tessuto ovarico
- Integrare 20 mL di terreno di Leibovitz (L-15) con 0,1% di siero fetale bovino (FBS) in un pallone di coltura tissutale da 50 mL (T-50).
- Tappare ermeticamente e mettere il pallone nell'incubatrice per una notte per riscaldarlo a 37 °C prima dell'uso. Questo terreno viene utilizzato per la manipolazione del tessuto ovarico e dei follicoli al di fuori dell'incubatrice e non richiede CO2 per mantenere un pH compreso tra 7,2 e 7,4
ATTENZIONE: Non esporre le stoviglie al gas CO2 o il fluido diventerà acido.
- Mezzo di digestione della collagenasi
- La mattina del prelievo dei follicoli, aggiungere 1 mg di collagenasi di tipo I (295 U/mg) alla provetta con 2,2 ml di terreno di coltura OT preriscaldato. La concentrazione finale desiderata di collagenasi è di 134 U/mL Sterilizzare con filtro per siringa da 0,22 μm. Tappare bene e mettere nel blocco riscaldante.
- Terreno di coltura follicolare e olio
- Preparare 30 ml di Minimum Essential Medium alfa integrati con il 5% di siero fetale bovino in un pallone T-50. Integrare con 100 mIU/mL di FSH, 10 mIU/mL di LH, 10 μg/mL di insulina, 5 μg/mL di transferrina e 5 ng/m di selenio.
- Pre-equilibrare la FCM a 37 °C con il 6% di CO2 e aria per una notte nell'incubatore prima dell'uso.
- Mettere 50 ml di olio minerale in un pallone, tappare senza stringere ed equilibrare per una notte in incubatrice.
- Terreni di vetrificazione per FL e FL-Clusters
- Il terreno basale per tutte le soluzioni è Global-Hepes integrato con il 20% di sostituto proteico sintetico. Preparare 20 mL di soluzione VS1 con glicole etilenico (EG) al 7,5% e dimetilsolfossido (DMSO) al 7,5% in terreno basale.
- Preparare 20 mL di VS2 con il 15% di EG, il 15% di DMSO e 0,5 M di saccarosio in terreno basale. Sterilizzare tutte le soluzioni con un filtro per siringa da 0,22 μm e conservare a 4 °C fino al momento dell'uso. Le soluzioni possono essere utilizzate per un massimo di 4 settimane.
- Mezzi riscaldanti per follicoli vitrificati e FL-Clusters
- Il terreno basale per tutte le soluzioni è Global-Hepes integrato con il 20% di sostituto proteico sintetico. Preparare 20 ml di terreno basale con 0,25 M di saccarosio. Etichetta come WS1.
- Preparare 20 mL di terreno basale con saccarosio 0,125 M ed etichettare come WS2. Filtro sterilizzare con filtro a siringa da 0,22 μm. Conservare le soluzioni a 4 °C per un massimo di 4 settimane.
2. Prelievo delle ovaie
- Eutanasia dei cuccioli di B6D2F1 di 10-14 giorni mediante lussazione cervicale (senza anestesia). Usa 3-4 cuccioli per ottenere 250-300 follicoli preantrali intatti per la sperimentazione.
- Stendere l'animale sulla schiena e tamponare la pancia con alcol isopropilico al 70%. Fai un piccolo taglio orizzontale sulla linea mediana usando le forbici pulite. Afferrare la pelle sopra e sotto il taglio con una pinza fine e tirare in entrambe le direzioni (verso la testa e i piedi) per esporre l'addome.
- Usando un secondo set di forbici pulite e pinze sottili, taglia la parete addominale. Solleva le spire intestinali. Individua le corna uterine, gli ovidotti e le ovaie. Asciugare le ovaie e metterle in una bacinella centrale contenente 1 mL di terreno di trattamento OT riscaldato a 37 °C.
- Utilizzando un microscopio da dissezione, tagliare via il grasso e il tessuto oviduttale. Dividere in due le ovaie.
3. Isolamento del follicolo e del cluster FL (FL-C)
- Utilizzare una cappa a flusso laminare con una superficie riscaldata a 37 °C per l'isolamento e la manipolazione dei follicoli. Lavorare in modo asettico nella cappa. Fai attenzione con la parabola FCM. Utilizzare il gorgogliatore per mantenere la parabola gassata con il 5% di CO2 quando si lavora nella cappa a flusso laminare.
NOTA: Tutte le soluzioni devono essere preriscaldate a 37 °C. Il mezzo MCA, così come l'olio minerale, devono essere pre-equilibrati per una notte in un incubatore a 37 °C con il 6% di CO2 prima dell'uso. Il pH del mezzo si sposta quando si è fuori dall'incubatrice per più di 10 minuti. - Versare 6 mL di FCM pre-bilanciato in due piastre da 60 mm e sovrapporle con olio minerale. Rimetti nell'incubatrice.
- Pipet 1 mL di collagenasi in un piatto a pozzetto centrale e 3 mL di terreno OT nella parete esterna. Spostare le ovaie in soluzione di collagenasi utilizzando una micropipetta di vetro (1000 μm). Incubare la capsula per 30-40 minuti sulla superficie riscaldata della cappa a flusso laminare.
- Al termine dell'incubazione della collagenasi, versare 6 mL di terreno OT in due piastre di coltura tissutale da 60 mm etichettate 1 e 2. Posizionare sulla superficie calda della cappa.
- Usando una micropipetta, spostare le ovaie trattate con collagenasi verso il pozzetto esterno per risciacquare senza collagenasi. Sostituire le micropipette e quindi spostare le ovaie sulla piastra OT 1.
- Prelevare i follicoli da ciascuna ovaia utilizzando un pipettatore P200. Rilasciare i follicoli mediante aspirazione ed espulsione ripetute dell'ovaio trattato con enzima attraverso la punta della pipetta tagliata a diverse dimensioni. Anche la separazione meccanica del tessuto in frammenti con due aghi da 27 G prima del pipettaggio è utile per rilasciare i singoli follicoli. Ogni cucciolo di topo dovrebbe produrre 60-75 follicoli intatti della dimensione desiderata.
- Se necessario, rimettere i pezzi non dissociati di ovaio nella collagenasi per altri 5-10 minuti, risciacquare e ripetere il pipettaggio per rilasciare più follicoli.
NOTA: La sovraesposizione alla collagenasi provocherà la rottura degli strati cellulari della granulosa che circondano l'ovocita. Non cercare di rompere l'intera ovaia. Fermati una volta raccolti 250-300 follicoli. - Esamina i follicoli rilasciati utilizzando un microscopio da dissezione con un ingrandimento di 40x. Identificare i follicoli pre-antrali secondari (~120 -140 μm di diametro) con un ovocita situato centralmente racchiuso all'interno di una membrana basale intatta (lamina basale). Il follicolo di queste dimensioni avrà tipicamente 2-4 strati di cellule della granulosa che circondano l'ovulo (vedi Figura 1).
NOTA: Confrontare i follicoli con l'apertura di una punta per micropipetta da 175 μm per approssimare le dimensioni del follicolo. Il follicolo deve essere dimensionato a circa 3/4 del diametro della pipetta. Questo è il metodo più rapido per selezionare i follicoli della dimensione desiderata. - Utilizzando una micropipetta da 175 μm, spostare i follicoli selezionati sul piatto OT2. Al termine della raccolta, sciacquare tutti i follicoli nella piastra FCM1 per rimuovere eventuali tracce del mezzo OT. Quindi trasferire nel piatto FCM2.
- Mettere il piatto in un'incubatrice per 60 minuti prima di iniziare il processo di inclusione.
- Per l'isolamento del cluster follicolare, eseguire i passaggi da 3.1 a 3.5. Utilizzare due siringhe di tubercolina (27 G) per separare l'ovaia in frammenti e poi in piccoli gruppi di 6-10 follicoli.
NOTA: La coltura dei cluster follicolari (FL-C) è un'alternativa alla coltura dei singoli follicoli. Questo metodo mantiene l'architettura follicolare nativa insieme alle componenti stromali. La dimensione del follicolo in FL-C non è uniforme. I follicoli mantengono la loro configurazione in vivo con la presenza di follicoli primordiali, primari e secondari. - Raccogliere questi ammassi di follicoli (FL-C) con una micropipetta da 200 μm nel piatto OT2. Al termine della raccolta, sciacquare tutto il FL-C e trasferirlo in FCM2 per attendere l'inclusione.
4. Inclusione di follicoli e gruppi di follicoli
- Preparare una soluzione madre da 10 mg/mL di idrogel di acido ialuronico (HA) attivato legato alla tiramina. Reidratare 250 mg di polvere di ialuronato di sodio sostituito con tiramina con 25 mL di enzima perossidasi di rafano (HRP; 10 UI/mL) in soluzione salina tamponata con fosfato. Una volta solubilizzato, conservare 500 μL di aliquote di questo stock di HA attivato a -4 °C per esperimenti futuri.
- Per gli esperimenti sui follicoli, scongelare la soluzione madre di HA e diluirla a una concentrazione di 3 mg/mL in un mezzo globale riscaldato a 37 °C. Eseguire tutte le fasi di inclusione in una cappa a flusso laminare con una superficie del banco riscaldata a 37 °C. Utilizzare una piastra da 60 mm con otto pozzetti da 100 μL per l'inclusione e la successiva coltura dei follicoli.
- Spostare i follicoli o i cluster FL da incorporare dalla piastra FCM in una goccia di gel HA per risciacquare il terreno di coltura. Il mezzo di tracciamento interferirà con la formazione del gel. Riposizionare la parabola FCM sotto il gorgogliatore per gassare.
NOTA: I follicoli isolati possono essere incorporati, singolarmente o in gruppi a seconda dell'esperimento. In genere preferiamo seminare 2-4 follicoli per perlina. - Mettere 1 μl di perossido di idrogeno allo 0,03% (H2O2) su una piastra di Petri. Aggiungere 25 μL di gel di HA da 3 mg/mL sulla goccia di perossido di idrogeno e miscelare mediante pipettaggio per avviare la reticolazione (vedere la Figura 2).
- Utilizzando un pipettatore P20, aspirare la miscela HA-H2O2 e pipettare una goccia (~8-10 μL) in due pozzetti separati della piastra di coltura a 8 pozzetti. Evita di fare bolle.
- Utilizzando una micropipetta da 200 μm, trasferire rapidamente i follicoli o un FL-C al centro di ogni goccia (Figura 3). La velocità è importante in quanto una volta che l'acido ialuronico è esposto al catalizzatore (perossido) inizierà a gelificare entro 1-2 minuti. Fare attenzione a non introdurre bolle durante la semina.
NOTA: Per monitorare la crescita dei singoli follicoli, posizionare i follicoli a una certa distanza l'uno dall'altro. Non posizionare i follicoli troppo vicino al fondo del gel, altrimenti durante l'IVC potrebbero scendere abbastanza da attaccarsi. - Attendere ~ 3 minuti per completare il processo di gelificazione e quindi aggiungere 100 μl di FCM pre-bilanciato a ciascun pozzetto. Ripeti questo processo e carica i follicoli in tutti e otto i pozzetti. Sovrapporre con olio minerale caldo pre-bilanciato e posizionare il piatto in un'incubatrice.
5. Vitrificazione di follicoli e FL-cluster
NOTA: La vitrificazione può essere eseguita utilizzando un supporto aperto (Cryoloop; CL), che consente il contatto diretto con l'azoto liquido, oppure un vettore chiuso (Rapid I; RI), in cui il campione è sigillato all'interno di una cannuccia esterna e, pertanto, non viene mai a contatto con l'azoto liquido. La Figura 4 mostra i dispositivi e i contrasti dei due sistemi di vetrificazione. La vitrificazione su entrambi i dispositivi si è dimostrata efficace per la crioconservazione degli embrioni35.
- Vitrificazione RI a vettore chiuso
- Preriscaldare 2 mL di aliquote di soluzioni VS a 37 °C in un blocco riscaldato. Eseguire tutte le fasi di vetrificazione sulla superficie riscaldata della cappa a flusso laminare utilizzando un microscopio da dissezione per visualizzare il follicolo e il vettore.
- Riempire la scatola criogenica isolata con azoto liquido (LN2). Posizionare la cannuccia esterna del dispositivo in una fessura di fissaggio all'interno della scatola in modo che sia parzialmente immersa nell'azoto liquido. Appoggia il bastoncino di plastica interno con un piccolo foro sul coperchio di una capsula di Petri in preparazione per il caricamento.
- Metti due gocce di VS1 una accanto all'altra su una capsula di Petri vicino alla parte superiore. Utilizzare una micropipetta da 200 μm per posizionare due follicoli nella prima goccia. Risciacquare e passare rapidamente alla seconda goccia di VS1. Incubare per 5 min. Se si vitrificano cluster FL, elaborare un singolo cluster alla volta.
- Mettere tre gocce di VS2 fianco a fianco sullo stesso piatto quando la prima incubazione è quasi completa. Quindi, spostare rapidamente i follicoli in sequenza attraverso le tre gocce VS2 entro 60 s e caricare sul vettore. Fare attenzione ad aspirare una quantità minima di liquido con i follicoli per evitare di tracciare il terreno da una goccia all'altra.
- Per caricare il supporto, prelevare due follicoli e depositarli con una quantità minima di liquido nel minuscolo foro del bastoncino di plastica. Il volume finale del fluido nel foro è minuscolo < 0,5 μl. Evitare un riempimento eccessivo, che provoca la fuoriuscita del fluido dal foro e sul bastoncino di plastica.
- Immergi il bastoncino nella cannuccia esterna pre-raffreddata. Utilizzare il sigillante ad ultrasuoni per chiudere e sigillare la cannuccia. Metti la cannuccia in un calice attaccato al criocane. È possibile inserire fino a 4 cannucce nello stesso calice.
- Coprire il bastone con una guaina protettiva di plastica. Immergere la canna in un serbatoio di stoccaggio dell'azoto liquido (LN2).
- Vitrificazione CL a portante aperto
- Preriscaldare le soluzioni VS a 37 °C. Eseguire tutte le fasi di vetrificazione sulla superficie riscaldata della cappa a flusso laminare. Preparare in anticipo il numero di portanti aperti CL necessari. Inserire lo stelo metallico CL nel tappo magnetizzato della fiala, assicurandosi che sia ben saldo (utilizzare una piccola quantità di adesivo se necessario).
- Riempire la criocassetta isolata con azoto liquido (LN2). Posizionare una rastrelliera nella criocassetta per contenere i crioviali in modo che LN2 si trovi sotto la parte superiore della fiala.
- Riempire l'apposita fiala magnetizzata e ventilata con LN2. Posizionarlo sulla griglia. Eseguire le fasi di vetrificazione come descritto nei passaggi da 6.1.3 a 6.1.5. L'unica differenza è che in genere elaboriamo cinque follicoli alla volta. Ancora una volta, fai attenzione a ridurre al minimo il fluido di tracciamento da una goccia all'altra.
- Per caricare i follicoli, afferrare il supporto aperto CL per il cappuccio magnetico attaccato utilizzando la bacchetta metallica. Immergere il supporto aperto CL in una goccia separata di VS2 per creare un film di crioprotettore.
- Utilizzando una micropipetta, prelevare tutti i follicoli o FL-Cluster e posizionarli sulla pellicola con una quantità minima di liquido. Lavora rapidamente, poiché i follicoli devono essere caricati prima che la pellicola inizi ad asciugarsi.
- Immergere immediatamente il CL nel crioviale riempito con LN2 per vitrificare il campione. Tappare e posizionare la fiala sul criocano. Coprire con una guaina di plastica. Immergere la canna in un serbatoio di stoccaggio dell'azoto liquido.
6. Riscaldamento di follicoli vitrificati e FL-clusters
- Riscaldamento del portatore chiuso RI
- Preparare un piatto a pozzetto centrale con 3 mL di FCM pre-bilanciato nel pozzetto esterno e 1 mL nel pozzetto centrale. Coprire con olio e riporre nell'incubatrice.
- Mettere 0,5 mL di WS1 e WS2 preriscaldati in due piatti a pozzetto con l'etichetta. Spostare le canne con i campioni dal serbatoio di stoccaggio in una crioscatola riempita con LN2.
- Rimuovere il coperchio della canna di plastica. Togliete la cannuccia dal calice, tenendola immersa, e fatela scivolare nella fessura di tenuta della scatola criogenica.
- Usando le forbici sottili, taglia la cannuccia esterna appena sopra il punto nero che indica la parte superiore del portatore interno dell'RI con i follicoli.
- Usando una pinza fine, solleva leggermente il bastoncino di plastica interno dalla cannuccia esterna. Afferrare il dispositivo e immergere rapidamente lo stick in WS1, roteando delicatamente per scaricare i follicoli. La velocità è fondamentale. I follicoli devono essere scaricati in WS1 entro 10 s.
- Utilizzare un microscopio da dissezione per visualizzare i follicoli e assicurarsi che tutti siano stati scaricati dal vettore. Dopo 2 minuti in WS1, utilizzare una micropipetta per spostare tutti i follicoli (o FL-Cluster) su WS2, facendo attenzione a non tracciare il terreno.
- Dopo 3 minuti, sciacquare i follicoli nel pozzetto esterno della capsula FCM e poi spostarli al centro del vaso. Rimettere nell'incubatrice per 1-2 ore prima di incorporare.
- CL Riscaldamento del marsupio aperto
- Preparare i piatti FCM e WS come descritto sopra. Sposta la canna con i follicoli da un serbatoio di stoccaggio in una scatola criogenica riempita con LN2. Togliete il coperchio della canna di plastica.
- Utilizzare la bacchetta magnetica per sollevare il cappuccio crioviale fino a quando lo stelo metallico del CL non è visibile.
- Usando una pinza, afferra lo stelo di metallo. Rimuovere il CL dal flaconcino e immergerlo molto rapidamente in WS 1, agitando delicatamente per scaricare i follicoli. Scaricare in WS1 entro 10 s. Utilizzando un cannocchiale da dissezione, verificare che tutti i follicoli siano stati scaricati
- Tutti i passaggi rimanenti per il riscaldamento sono gli stessi dei passaggi del portatore chiuso RI a partire dal passaggio 7.1.6.
7. Imaging del follicolo e del cluster FL e modifica dei media
- Monitorare i follicoli e i cluster FL nei pozzetti durante l'intervallo di coltura di 10-12 giorni utilizzando un microscopio a luce invertita con ottica a modulazione di contrasto Hoffman e dotato di una telecamera ad alta definizione. Utilizza il software di imaging per acquisire immagini con un ingrandimento totale di 40x e 100x o 200x, a seconda delle dimensioni.
- Imaging e valutazione dei follicoli
- Il giorno 1 della coltura, dopo l'inclusione, visualizzare tutti i pozzetti di coltura con un ingrandimento di 40x e 200x utilizzando un microscopio invertito per stabilire la morfologia e le dimensioni della linea di base. Rimetti il piatto nell'incubatrice.
- Visualizza le immagini e registra il numero di follicoli completamente incorporati in ciascuna perlina di gel. Per FL-C, fare una stima del numero di follicoli all'inizio della coltura.
- Utilizzando il software di imaging, misurare il diametro del follicolo lungo i piani verticali e orizzontali dal bordo della membrana basale. Misurare le dimensioni degli ovociti in modo simile dal bordo esterno della zona. Registra i valori medi. Prendi una misura verticale e orizzontale del diametro del grappolo.
- Continuare con le impostazioni cultura dell'immagine ogni 2-3 giorni. Misurare i diametri dei follicoli non a contatto tra loro. Con FL-C, i cluster si sollevano durante l'IVC, in modo che l'intero cluster possa essere misurato sul piano verticale e orizzontale.
NOTA: Per i follicoli raggruppati strettamente insieme, i bordi dei singoli follicoli potrebbero non essere distinguibili dopo il 4° giorno di coltura, quindi non vengono effettuate le misurazioni. - Classificare i follicoli che diventano scuri o apoptotici, così come quelli in cui l'ovocita non è più circondato da cellule della granulosa o è stato estruso come non vitali. Tenere traccia di eventuali follicoli o FL-C che si sono attaccati alla superficie del piatto (vedere la Figura 5).
- Osservare attentamente i follicoli per la formazione degli antri dal giorno 8 in poi. I follicoli con antri sembreranno avere uno spazio più chiaro o più leggero al loro interno (Figura 6).
- Eseguire un mezzo cambio di terreno di coltura ogni 2 giorni. Utilizzare un pipettatore P200, impostato per 50 μl. Inserire la punta nel pozzetto sotto la copertura dell'olio e lontano dal cordone di gel. Estrarre lentamente 50 μl del terreno di coltura. Sostituire il terreno pipettando lentamente 50 μl di FCM fresco sotto il rivestimento dell'olio. Evita di fare bolle.
8. Maturazione degli ovociti in follicoli incapsulati
NOTA: La fase finale di maturazione viene in genere avviata quando la formazione di antro tra i follicoli totali seminati (e vitali) raggiunge oltre il 40%. Tuttavia, nel caso in cui la formazione di antro sia bassa o non visibile, si consiglia di innescare entro il 12° giorno di coltura. Non abbiamo notato alcun vantaggio nell'aspettare ancora. Per le colture FL-C, la maturazione viene in genere attivata quando si osservano formiche nel 40% dei pozzetti o al più tardi entro il giorno 12.
- Preparare il terreno di maturazione in vitro (IVM) integrando la MCA con 1,5 UI/mL di gonadotropina corionica umana (hCG) e 5 ng/mL di fattore di crescita epidermico (EGF).
- Innescare la maturazione sostituendo la FCM in ciascun pozzetto con 100 μL di terreno IVM intorno alle 17:00. Dopo la maturazione notturna (16-18 ore dopo l'innesco), utilizzare un microscopio da dissezione con ingrandimento 40x per esaminare bene ogni coltura alla ricerca di complessi cumulo-ovociti (COC) che hanno ovulato dalla perlina di gel HA. I COC si trovano solitamente appoggiati appena sopra la perlina di gel o nelle immediate vicinanze.
- Raccogliere i COC ovulati in una capsula a pozzetto centrale con 1 ml di FCM pre-bilanciato sovrapposto a olio e rimettere la capsula nell'incubatore.
- Raccogliere gli ovociti dai follicoli ancora incorporati pipettando delicatamente la perlina di HA utilizzando un pipettatore P200 per rilasciare COC non ovulati. Raccoglili in un piatto separato con FCM.
- Preparare un piatto centrale con 1 mL di ialuronidasi (10 UI/mL) e 3 mL di terreno FCM nella parete esterna.
- Trasferire i COC ovulati in una soluzione di ialuronidasi ed esporre brevemente all'enzima (30-45 s) per denudare l'ovocita delle cellule della granulosa al fine di visualizzare lo stato nucleare dell'ovocita. Sciacquare gli ovociti per rimuovere l'enzima prima di immergere 5 μL di gocce di terreno fresco sotto l'olio per una valutazione dettagliata. Metti il piatto nell'incubatrice. Ripeti questo processo per i COC non ovulati.
- Registrare il numero totale di ovuli ovulati e non ovulati recuperati. Fotografare e valutare lo stato nucleare (GV, metafase I o metafase II) di ogni ovocita recuperato. Misura e registra il diametro.
- Calcola il tasso di sopravvivenza IVC in base ai follicoli vitali totali (quelli che arrivano al giorno dell'innesco dell'hCG) e agli ovuli totali recuperati. Calcolare la percentuale di ovociti di metafase II dai COC ovulati. Ripetere l'operazione per tutti gli ovociti recuperati dai COC non ovulati.
- Determinare il tasso di maturazione alla metafase II allo stesso modo per FL-C.
Risultati
Questo articolo descrive in dettaglio la metodologia per l'utilizzo di un nuovo gel di acido ialuronico legato alla tiramina per la coltura in vitro di follicoli preantrali di topo36,37. La Figura 6 illustra le differenze tra la crescita del follicolo preantrale quando viene inserito in un sistema di coltura 2D convenzionale rispetto a un singolo follicolo incapsulato in gel HA per la coltura 3D. L'architettura del follicolo nativo viene mantenuta durante i 12 giorni di coltura con un antro chiaramente visibile l'ultimo giorno di crescita.
Il gel HA è molto versatile, consente la crescita di follicoli isolati singolarmente o in gruppi e anche il tessuto ovarico viene spezzato meccanicamente in piccoli gruppi di follicoli. Il gel è trasparente, rendendo possibile la visualizzazione dei follicoli anche se a profondità diverse. I follicoli incapsulati e FL-C mostrano un'espansione radiale dovuta alla continua proliferazione delle cellule della granulosa (Figura 7). I diametri iniziali dei follicoli sono in media di 139,8 ± 28 μm con il diametro dell'ovocita GV che misura 63,5 ± 4,6 μm. Nei follicoli coltivati singolarmente, i diametri finali misurano circa 385,6 ± 36,7 μm, un aumento di circa 3 volte delle dimensioni. Gli ovociti ovulati in metafase II misurano circa 84,8 ± 3,8 μm. All'interno dei cluster FL in coltura, la dimensione dei follicoli è abbastanza varia (Figura 5, Figura 7). Gli ovociti ovulati dopo l'innesco dell'hCG si trovano vicino al follicolo (Figura 8). La maggior parte degli ovociti della metafase II sarà recuperata dai COC ovulati. I follicoli ancora incorporati dopo l'attivazione di solito contengono ovociti GV e metafase I.
La Tabella 1 mette a confronto i tassi di maturazione tra follicoli isolati e cluster FL da ovaie fresche o congelate. La FL-C delle ovaie crioconservate aveva tassi di maturazione significativamente più bassi. Le osservazioni microscopiche hanno mostrato che hanno spesso la lamina basale rotta, rendendoli abbastanza suscettibili all'estrusione prematura degli ovociti. La natura fragile dei cluster follicolari è stata in qualche modo contrastata dall'incapsulamento. Il trattamento con collagenasi delle ovaie crioconservate è stato evitato in quanto era particolarmente dannoso con bassa sopravvivenza e bassa resa di follicoli intatti.
La crioconservazione dei follicoli isolati è molto più efficace della conservazione dell'ovaio intero. Elevati tassi di maturazione possono essere raggiunti con entrambi i metodi di vitrificazione esaminati (Tabella 2). Nonostante le grandi differenze nelle velocità di raffreddamento, la maturazione degli ovociti dopo l'IVC non differiva. Il supporto aperto CL consente una maggiore efficienza in quanto è possibile caricare fino a dieci follicoli su un singolo supporto aperto CL. Ciò riduce anche il tempo complessivo per il recupero di più follicoli crioconservati. Tuttavia, per qualsiasi eventuale applicazione clinica della vitrificazione per i follicoli umani, può essere preferibile il sistema chiuso e sigillato.
La disposizione della cromatina attorno al nucleolo dell'ovocita GV può essere utilizzata per identificare gli ovociti che hanno maggiori probabilità di fecondare dopo l'ovulazione e svilupparsi in blastocisti38. La Figura 9 illustra la colorazione in tempo reale degli ovociti per visualizzare il modello di distribuzione della cromatina.
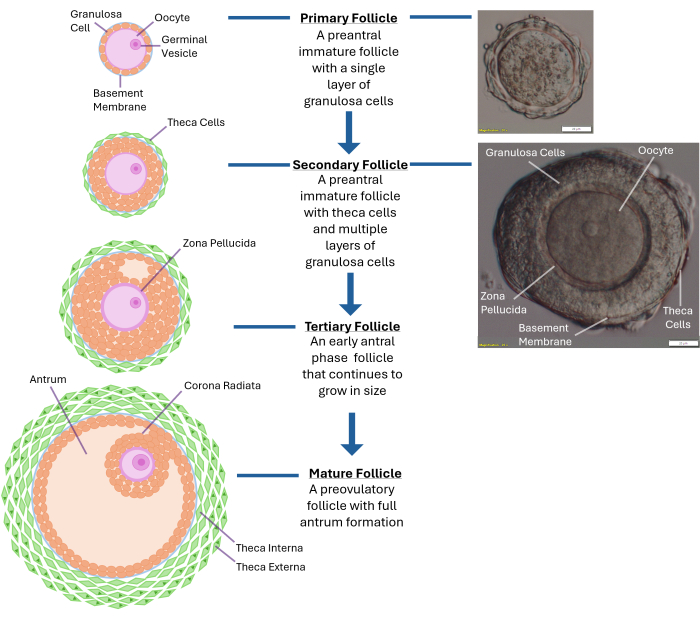
Figura 1: Schema della crescita dei follicoli. Questo diagramma illustra le diverse fasi dello sviluppo del follicolo, da un follicolo primario allo stadio preantrale secondario e infine a un follicolo terziario completamente maturo pronto per l'ovulazione. Viene anche mostrata un'immagine microscopica di un tipico follicolo preantrale con le sue diverse caratteristiche morfologiche. Clicca qui per visualizzare una versione più grande di questa figura.
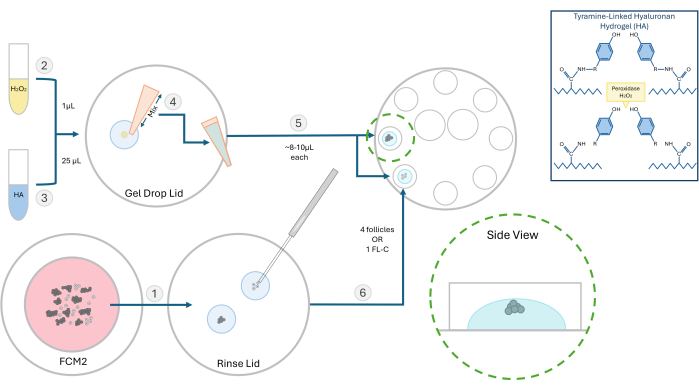
Figura 2: Schema del metodo di incapsulamento HA. La struttura del gel di acido ialuronico e le diverse fasi per l'inclusione dei follicoli sono illustrate in questo diagramma. Clicca qui per visualizzare una versione più grande di questa figura.
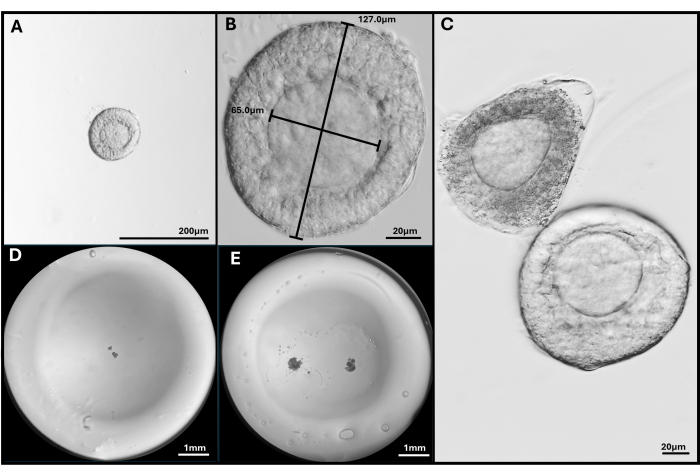
Figura 3: Isolamento e incapsulamento del follicolo. (A, B) Follicolo preantrale selezionato per l'inclusione con ingrandimento 40x e 200x. (C) Il follicolo apoptotico è mostrato con follicolo preantrale sano con ovocita non del tutto centrale. (D) Immagine di una perlina di gel HA seminata con follicoli e (E) con due FL-C. Immagini scattate con uno stereomicroscopio per mostrare l'intera perlina di gel. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Dispositivi di vetrificazione per la crioconservazione di follicoli isolati. Con il dispositivo a supporto aperto CL, la fase di vetrificazione viene condotta mediante immersione diretta dei follicoli in azoto liquido. La velocità di raffreddamento è quindi estremamente elevata, oltre i -20.000 °C/min. Al contrario, con il vettore chiuso del RI, i follicoli vengono caricati sul bastoncino di plastica interno e lasciati cadere in una cannuccia esterna immersa in azoto liquido. Questo metodo di vetrificazione chiuso evita il contatto diretto con l'azoto liquido. Tuttavia, la velocità di raffreddamento è significativamente inferiore a -1220 °C/min. Il carico e il recupero dei follicoli da entrambi i vettori è facile. Il supporto aperto CL è in grado di caricare fino a dieci follicoli per dispositivo, rispetto ai soli due del supporto chiuso RI. Questa cifra è stata modificata da35. Clicca qui per visualizzare una versione più grande di questa figura.
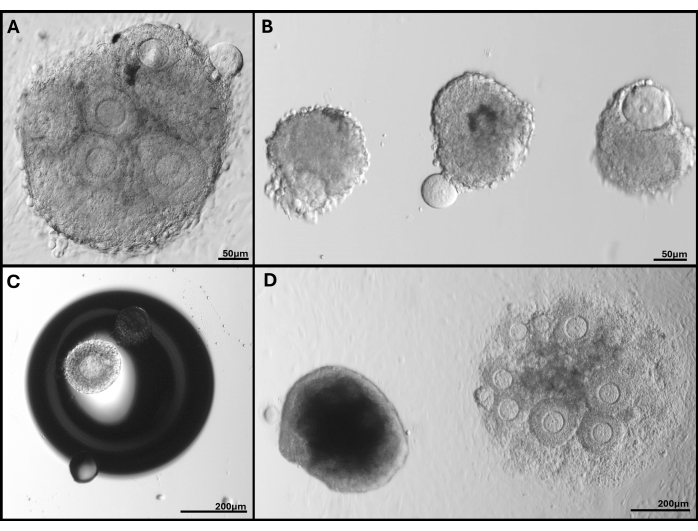
Figura 5: Immagini rappresentative dei problemi riscontrati. (A) Ammasso di follicoli con ovocita estruso. (B) Follicoli isolati con membrana della lamina basale rotta e uno con un ovocita estruso. (C) Follicolo incorporato sotto una bolla nel gel. (D) Ammasso di follicoli che è rimasto in gel (a sinistra) rispetto a un grappolo incorporato troppo in profondità che alla fine si è attaccato al piatto. L'ampia gamma di dimensioni dei follicoli in FL-C è chiaramente visibile. Clicca qui per visualizzare una versione più grande di questa figura.
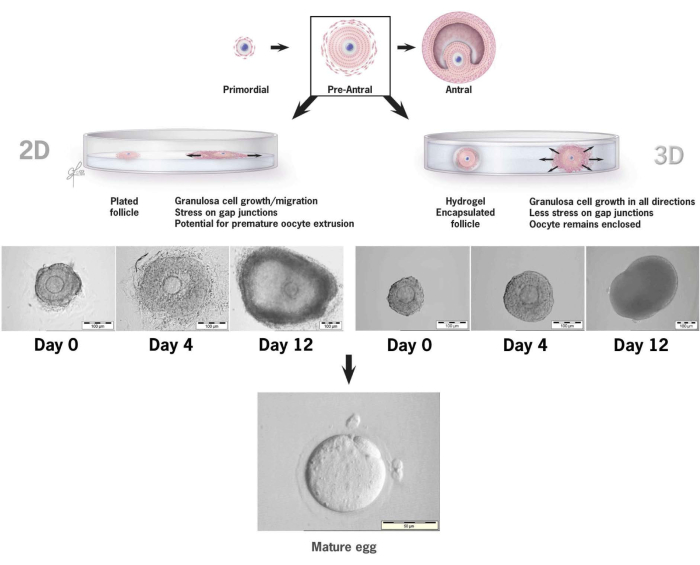
Figura 6: Confronto della crescita dei follicoli nelle convenzioni 2-D rispetto alla coltura 3-D nell'HA. Con la crescita 2-D, l'appiattimento del follicolo e l'attaccamento delle cellule della granulosa alla piastra di coltura tissutale sono stati osservati entro il giorno 4, lasciando l'ovocita vulnerabile alla migrazione delle cellule della granulosa, all'interruzione delle giunzioni gap e all'estrusione prematura dell'ovocita. Il follicolo incapsulato in HA è rimasto non attaccato per tutto l'intervallo di coltura. L'espansione delle cellule della granulosa si è verificata in tutte le direzioni, racchiudendo l'ovocita e mantenendo l'architettura 3D. Questa cifra è stata modificata da36. Clicca qui per visualizzare una versione più grande di questa figura.
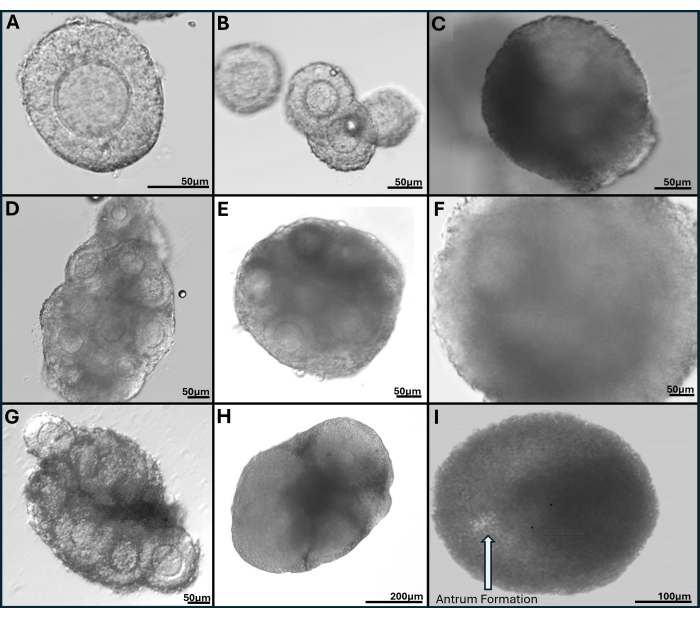
Figura 7: Immagini rappresentative dei follicoli incapsulati in gel di acido ialuronico legato alla tiramina. (A) Follicolo preantrale raccolto dopo la digestione della collagenasi dell'ovaio fresco il giorno 1. (B) Goccia di gel seminata con quattro follicoli preantrali visualizzati il giorno 1 e (C) Giorno 4 di coltura (D) Ammasso di follicoli da ovaio fresco il giorno 2 (E) il giorno 6 e (F) il giorno 9 di coltura. (G) Ammasso di follicoli sezionato meccanicamente da ovaio intero vitrificato mostrato il giorno 2 e (H) il giorno 6 di coltura. (I) Il follicolo con formazione di antro è chiaramente visibile il 9° giorno di coltura. Clicca qui per visualizzare una versione più grande di questa figura.
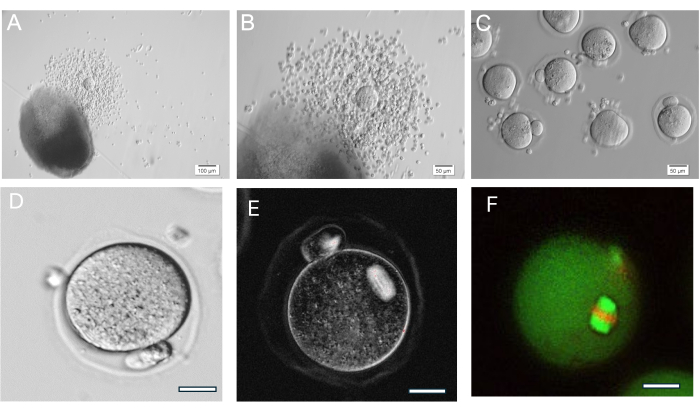
Figura 8: Ovulazione dell'ovocita. (A, B) Complesso cumulo-ovocita ovulato (COC) mostrato accanto alla perlina di HA-gel. (C) Gli ovociti sono stati sottoposti a imaging dopo il trattamento enzimatico dei COC con ialuronidasi per rimuovere le cellule del cumulo circostanti. Numerosi ovociti di metafase II. (D) Ovocita in metafase II con globulo polare prominente. Ingrandimento 400x. (E) Imaging dal vivo dell'ovocita della metafase II utilizzando luce polarizzata e un sistema di imaging per visualizzare il fuso meiotico e valutare l'organizzazione, eseguito come descritto in37. Ingrandimento 400x. Normale fuso birifrangente visibile. (F) Ovocita di metafase II fissata e colorata con anti-alfa/beta-tubulina e ioduro di propidio per visualizzare l'organizzazione del fuso meiotico. Clicca qui per visualizzare una versione più grande di questa figura.
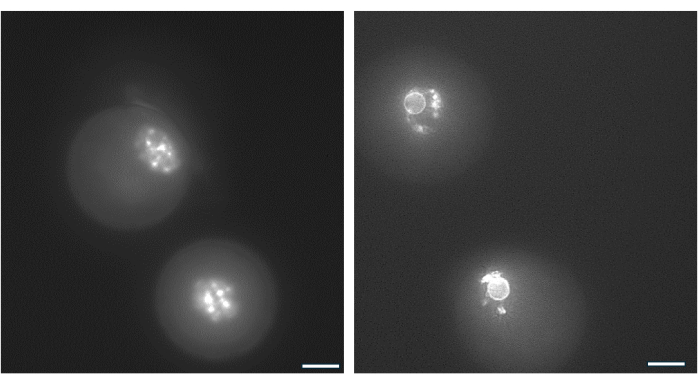
Figura 9: Riorganizzazione della cromatina negli ovociti GV. La disposizione della cromatina negli ovociti GV dopo la formazione dell'antro è stata esaminata mediante colorazione del DNA con Hoechst 33342 (50 ng/mL). I follicoli rappresentativi sono stati raccolti da perle di HA mediante pipettaggio delicato. Le cellule della granulosa sono state rimosse utilizzando la ialuronidasi. Gli ovociti GV sono stati poi colorati per 15 minuti (Vedi protocollo di Monti et al.38). Le immagini sono state scattate con un ingrandimento di 40x. (A) Ovocita GV mostrata il giorno 1 all'inizio della coltura che mostra il pattern di colorazione della cromatina non circondata (NSN). (B) Ovocita GV dal follicolo in crescita con antro mostrato il giorno dell'innesco dell'hCG. La cromatina si condensò e formò un anello perinucleare attorno al nucleolo. Clicca qui per visualizzare una versione più grande di questa figura.
| Parametro | Ovaio fresco | Ovaio congelato | |
| FL-Isolato | FL-Cluster | FL-Cluster | |
| Follicoli osservati durante l'IVC | 130 | 154 | 69 |
| Ovulazione dopo HCG (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| GVBD (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| Formazione di ovociti MII (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Tabella 1: Risultati con follicoli inclusi in HA da ovaie fresche e vitrificate. I follicoli e l'FL-C provenienti da ovaie fresche sono stati maturati in vitro dopo l'incapsulamento in gel di acido ialuronico. Il gel HA è stato testato anche su follicoli di ovaie vitrificate utilizzando un protocollo EG/DMSO39. Con le ovaie fresche, dopo la digestione della collagenasi sono stati raccolti sia i singoli follicoli (FL) che i cluster di follicoli (FL-C). Per le ovaie vitrificate, l'esposizione alla collagenasi era, infatti, dannosa per i follicoli. L'approccio migliore con le ovaie crioconservate è stato quello di isolare i cluster FL piuttosto che i singoli follicoli e di utilizzare solo la dissezione meccanica con aghi. La tabella mette a confronto i risultati tra le perle di HA seminate con follicoli in gruppi di 4-6 rispetto alle perle con un singolo FL-C contenente 6-10 follicoli. *Il tasso di maturazione con FL-C da ovaie crioconservate è stato significativamente inferiore (p = 0,008; Analisi del chi-quadrato per verificare la significatività).
| Trasportatore | RI | CL |
| (Chiuso) | (Aperto) | |
| Sopravvivenza (%) | 100% (24/24) | 100% (41/41) |
| Formazione di antro* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Tasso di ovulazione (%) | 66.7% (16/24) | 87.8% (36/41) |
| Tasso di maturazione (% MII) | 81.3% (13/16) | 69.4% (25/36) |
Tabella 2: Risultati dopo crioconservazione di follicoli isolati su due diversi dispositivi di vitrificazione. Elevate velocità di maturazione sono state raggiunte sia con il dispositivo CL aperto che con il portatore RI chiuso, con la sua velocità di raffreddamento inferiore. La formazione di antro è stata l'unica misura di esito osservata per essere significativa, ma non ha influenzato il tasso di maturazione complessivo (p < 0,05; Analisi del chi-quadrato per verificare la significatività).
Discussione
La capacità di controllare le proprietà meccaniche e la biodegradabilità dell'idrogel di acido ialuronico legato alla tiramina offre molti vantaggi per le applicazioni di ingegneria tissutale. Il nostro laboratorio è il primo ad applicare questo gel specifico di acido ialuronico per la crescita del follicolo ovarico. Questo gel brevettato di ialuronato di sodio sostituito con tiramina (TS-NAHY) è un nuovo sistema di idrogel a base di acido ialuronico sviluppato presso la Cleveland Clinic. La reticolazione del gel è guidata dall'esposizione della perossidasi nella miscela di gel attivata a un agente ossidante. Questo può essere fatto sia in vitro che in vivo. Gli idrogel TS-NAHY formati mostrano un ampio spettro di proprietà, dal gel debole, una pasta a un solido fragile, a seconda della concentrazione di gel40.
I deludenti progressi con la coltura del follicolo ovarico evidenziano la necessità di progettare nuovi modelli di coltura. La creazione di un sistema di coltura basato esclusivamente su componenti nativi della matrice extracellulare può essere un approccio più vantaggioso. Il modello di coltura HA descritto è facile da usare in modo fisiologico e non richiede componenti ECM aggiuntivi. Il gel è trasparente, consentendo una visualizzazione dettagliata dei follicoli. Le proprietà viscoelastiche del gel HA facilitano la regolazione della rigidità e della modellabilità. Questa caratteristica aumenta la versatilità di questa biomatrice. La rigidità di una biomatrice può influire sulla proliferazione cellulare della granulosa e sulla formazione di antro 30,41,42. È stato riportato che i follicoli derivati da ambienti di coltura permissivi alla formazione di antri hanno profili di espressione genica diversi rispetto a quelli di un sistema di coltura non di supporto43. I follicoli dei primati sembrano richiedere una matrice più rigida44. Adattare la biomatrice per soddisfare le esigenze di diverse specie animali, compreso l'uomo, sarà probabilmente importante per il successo della maturazione in vitro.
Per la crescita del follicolo preantrale di topo, abbiamo testato concentrazioni di gel comprese tra 2 e 5 mg/mL36. I tassi di maturazione degli ovociti variavano dal 44% al 58%. Concentrazioni più elevate del gel di HA hanno consentito una maggiore modellabilità e ritenzione di una struttura 3D, ma l'espansione del follicolo è stata influenzata. Concentrazioni più basse di HA hanno permesso una maggiore espansione radiale del follicolo, ma hanno aumentato il rischio che il follicolo venisse estruso spontaneamente prima della fine dell'IVC. La concentrazione di 3-3,5 mg/mL di HA funzionato meglio per i follicoli preantrali di topo. Mantenere la goccia di gel piccola era essenziale per formare perle di gel HA con una profondità sufficiente per mantenere i follicoli in una configurazione 3D durante l'IVC. Le gocce più grandi si appiattivano, con conseguente discesa dei follicoli attraverso il gel e attaccamento alla superficie della piastra. Un limite dell'uso di questo biomateriale per l'inclusione è il tempo di gelificazione estremamente rapido. Rende difficile la semina di più di due perle di gel HA alla volta. Aumentare l'efficienza della semina dei follicoli nel gel HA è un'area in cui stiamo cercando di migliorare.
La coltura di cluster follicolari in un ambiente 3D utilizzando l'HA ha un grande potenziale. Viene mantenuta la normale architettura ovarica, con follicoli di dimensioni diverse in contatto tra loro e con lo stroma di supporto. L'LH può aiutare la crescita di follicoli preantrali più piccoli nel FL-C inducendo cambiamenti nelle cellule tecali differenzianti precoci, quindi è stato incluso nel terreno FCM45. Continuare la coltura di FL-C oltre i 12 giorni per vedere se una nuova ondata di crescita può essere avviata in uno qualsiasi dei follicoli più piccoli ancora incorporati dopo l'innesco dell'hCG richiede ulteriori studi. Un'ulteriore ottimizzazione dell'ambiente di coltura può essere un prerequisito per la coltura di follicoli di diverse dimensioni in un frammento di tessuto. Un vantaggio di questo modello di coltura 3D di HA con FL-C è che consente di imitare da vicino la disposizione e le interazioni follicolari in vivo . Un altro attributo importante è che, a differenza dell'alginato di calcio e di altri sistemi polimerici, l'ovulazione e la maturazione possono essere indotte senza rimuovere fisicamente i follicoli dal tessuto o dalla matrice di gel.
Il tempo necessario per la coltura in vitro dei follicoli e l'ottenimento di ovociti maturi per il congelamento è lungo, soprattutto nei grandi mammiferi. La capacità di crioconservare i follicoli raccolti o i gruppi di follicoli presenta un modo per ritardare questo passaggio fino a un momento successivo e possibilmente più favorevole. Se un giorno tale tecnologia potrà essere applicata ai follicoli umani durante il prelievo ovarico, potrebbe essere utile. La crioconservazione dell'ovaio intero per la preservazione della fertilità è, al momento, l'unica opzione per i pazienti. Ma se lo sia, in effetti, il metodo migliore resta da determinare. In questo articolo, presentiamo una metodologia di vitrificazione per la crioconservazione dei follicoli preantrali che offre eccellenti tassi di sopravvivenza e maturazione post-riscaldamento dopo la coltura 3D.
In conclusione, abbiamo descritto un nuovo modello di coltura 3D utilizzando acido ialuronico, un componente della ECM nativa. La tecnica di incapsulamento HA consente la ritenzione di fattori trofici in prossimità dei follicoli in via di sviluppo. La metodologia per l'incapsulamento nella biomatrice è semplice e può ospitare follicoli isolati e gruppi di follicoli. Quest'ultimo potrebbe aprire nuove strade di ricerca e fornire informazioni sulla biologia fondamentale della follicologenesi e sulla sua regolazione. È stato dimostrato che gli ovociti dei follicoli incapsulati con HA sono funzionalmente competenti37. Questi ovociti possono essere fecondati, formare blastocisti in vitro e impiantarsi al momento del trasferimento in topi pseudo-gravidi. Questi dati convalidano l'uso dello ialuronano legato alla tiramina come biomatrice per la coltura di follicoli 3D e la maturazione degli ovociti in vitro. Questo protocollo potrebbe potenzialmente essere applicato alla coltura del follicolo ovarico in altri modelli animali, compreso l'uomo. Altre possibili applicazioni per questo sistema di gel 3D HA potrebbero essere la coltura di corpi embrioidi e organoidi.
Divulgazioni
Nessun conflitto di interessi o divulgazione.
Riconoscimenti
Vogliamo ringraziare l'intero team di embriologia della Cleveland Clinic per la loro assistenza, così come il dipartimento REI e in particolare il Dr. Falcone per il supporto. Questo progetto è stato finanziato attraverso un fondo di ricerca presso la Cleveland Clinic.
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Riferimenti
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon