Method Article
Применение нового гиалуронового гидрогеля для трехмерной культуры фолликулов и методология криоконсервации фолликулов яичников мышей
В этой статье
Резюме
Этот протокол описывает новую трехмерную (3D) культуральную модель с использованием связанного с тирамином гиалуронового гидрогеля для инкапсуляции и культивирования преантральных фолликулов из яичника мыши. Мы также подробно описываем два подхода к криоконсервации фолликулов яичников путем витрификации.
Аннотация
Трехмерная архитектура фолликула яичника и сложные взаимодействия между компонентами соматической клетки и ооцитом, которые необходимы для цитоплазматического и ядерного созревания, трудно поддерживать в обычных двумерных (2-D) культуральных системах. Мы описываем новую 3D-модель культуры с использованием тирамин-связанного гиалуронового гидрогеля для инкапсуляции и культивирования фолликулов яичников мыши. Техника инкапсуляции гиалуроновой кислоты позволяет обеспечить трехмерный рост фолликулов и удержание трофических факторов в непосредственной близости от развивающихся фолликулов. Этот гидрогель очень универсален и может применяться как к изолированным фолликулам, так и к фрагментам ткани яичников. Вязкоупругие свойства геля HA позволяют регулировать жесткость, а также формуемость в зависимости от концентрации геля. Преантральные фолликулы, развивающиеся в этой модели культуры, способны завершать мейотическое созревание в течение 10-12 дней после культивирования и овулировать ооцит метафазы II при запуске ХГЧ. В этой статье также подробно описаны два подхода к криоконсервации фолликулов яичников путем витрификации.
Введение
Фолликулогенез человека in vitro остается проблемой даже спустя четыре десятилетия после первого рождения после экстракорпорального оплодотворения. На сегодняшний день методика культивирования фолликулов яичников человека, поддерживающая производство жизнеспособного эмбриона, в результате которого рождается здоровый ребенок, все еще отсутствует1. Оптимальные физические свойства, необходимые для роста фолликулов человека in vitro, еще предстоит определить. Интактный яичник населен тысячами фолликулов на разных стадиях развития, и регуляция их роста является сложным процессом (Рисунок 1)2. Ооциты стадии зародышевых везикул (GV) из преантральных фолликулов человека занимают до 30 дней в культуре, чтобы стать мейотически зрелыми и достичь метафазы II стадии3. Двунаправленная коммуникация между ооцитом и окружающими гранулезными клетками через щелевые соединения имеет решающее значение для цитоплазматического и ядерного созревания 4,5,6.
Обычные двухмерные системы культивирования не идеальны для культивирования фолликулов, особенно в более крупных моделях млекопитающих, которые требуют длительного времени в культивировании. Фолликулы прикрепляются к чашке, и связь между гранулезными клетками и ооцитом становится более тонкой по мере того, как гранулезные клетки мигрируют. Таким образом, трехмерные (3D) системы культивирования фолликулов появились как средство более точной имитации физиологии in vivo 7,8.
Инкапсуляция фолликулов в матрикс для стимулирования трехмерного роста была одним из подходов к сохранению фолликулярной архитектуры во время культивирования in vitro (IVC). Биоматрицы из природных полимеров (таких как коллаген, агароза, фибрин, альгинат и гиалуроновая кислота), а также синтетических полимеров (таких как полиэтиленгликоль, поливиниловый спирт и полигликолевая кислота) были протестированы 7,9,10,11,12,13. Было показано, что механические свойства биоматрицы влияют на диффузию питательных веществ, дифференцировку клеток, формирование антрального отдела, а также на гормональную секрецию14. Коллаген, как часть естественного внеклеточного матрикса клетки (ECM), является одной из самых ранних протестированных матриц и первоначально был многообещающим. Однако логистика нормализующих препаратов коллагена, плохие механические свойства и стабильность ограничивают его использование18. Агароза была протестирована на кумулюс-ооцитарных комплексах (КОК), высвобождаемых из антральных фолликулов, а также из примордиальных фолликулов19,20. Совсем недавно напечатанная 3D-форма из агарозы показала многообещающие возможности для культуры фолликулов без каркаса21. Инкапсуляция альгината кальция, впервые зарегистрированная в 2003 году, на сегодняшний день является наиболее широко изученной системой для IVC22. Он был протестирован на мышах, быках, обезьянах, а также на человеческих фолликулах 23,24,25,26,27. С альгинатом кальция фолликулы по отдельности загружаются в микрокапли полимера и подвергаются воздействию хлорида кальция для получения гелевой бусины. Извлечение фолликулов из бусины требует лечения хелатирующим средством. Однако у этой матрицы есть и некоторые недостатки. Альгинат представляет собой полисахарид, выделенный из водорослей, и, хотя он обеспечивает поддержку, он не является частью естественного внеклеточного матрикса фолликула. Данные свидетельствуют о более высокой частоте дефектов веретена после НПВ в альгинате28. Более поздние модификации системы путем объединения альгината с фибрином или другими компонентами внеклеточного матрикса (ВКМ) помогли сделать систему альгината кальцияболее эффективной.
Все больше данных указывают на внеклеточный матрикс как на ключевой модулятор в росте клеток 10,31,32 . Он не только обеспечивает поддержку, но и играет решающую роль в прикреплении, функционировании, росте и коммуникации клеток. Одним из основных компонентов ВКМ является гиалуронан, природный гликозаминогликан. В фолликуле яичника гиалуронан вырабатывается клетками гранулезы и способствует структурной целостности и функции развивающегося фолликула33,34. Таким образом, интеграция гиалуронана в модель культуры фолликулов может помочь в создании более физиологичной среды и увеличении производства функционально компетентных ооцитов.
В данной работе описывается новое применение тирамин-связанного гиалуронана в качестве биоматрицы для культивирования фолликулов свежих и замороженных яичников и созревания ооцитов (IVM) in vitro . Мы также подробно описываем методы криоконсервации фолликулов путем витрификации на двух типах устройств. Один метод предполагает прямое погружение в жидкий азот, тогда как во втором методе фолликулы перед погружением заключаются в соломинку. Основная цель работы состоит в том, чтобы показать, что, несмотря на различия, как методологии, так и устройства могут быть надежно использованы для криоконсервации фолликулов.
протокол
Все эксперименты на животных проводились в соответствии с протоколами использования и ухода за животными Кливлендской клиники и в соответствии с рекомендациями и правилами Национальных институтов здравоохранения по уходу и использованию лабораторных животных.
1. Подготовка среды
ПРИМЕЧАНИЕ: Описанные ниже среды будут использоваться для различных этапов этой процедуры: обработка ткани яичника (ОТ), расщепление ОТ-коллагеназы, культивирование фолликулов (ФКМ) и витрификация. Подготовьте всю среду в вытяжке для культуры тканей с использованием стерильной техники.
- Среда для работы с тканью яичника
- Добавьте 20 мл среды Лейбовица (L-15) с 0,1% фетальной бычьей сывороткой (FBS) в колбе для культуры тканей объемом 50 мл (T-50).
- Перед использованием плотно закупорьте крышку и поместите колбу в инкубатор на ночь, чтобы она нагрелась до 37 °C. Эта среда используется для обработки ткани яичников и фолликулов за пределами инкубатора и не требуетCO2 для поддержания pH от 7,2 до 7,4
ВНИМАНИЕ: Не подвергайте посуду воздействию газа CO2, иначе среда станет кислой.
- Питательная среда коллагеназы
- Утром в день забора фолликулов добавьте 1 мг коллагеназы I типа (295 ЕД/мг) в пробирку с 2,2 мл предварительно подогретой рабочей среды. Конечная желаемая концентрация коллагеназы составляет 134 ед/мл Фильтр стерилизовать с помощью шприцевого фильтра 0,22 мкм. Плотно закройте крышкой и поместите в блок для утепления.
- Среда для культивирования фолликулов и масло
- Приготовьте 30 мл альфа-среды Minimum Essential Medium с добавлением 5% фетальной бычьей сыворотки в колбе Т-50. Добавка содержит 100 мМЕ/мл ФСГ, 10 мМЕ/мл ЛГ, 10 мкг/мл инсулина, 5 мкг/мл трансферрина и 5 нг/м селена.
- Перед использованием предварительно уравновесить FCM при 37 °C с 6%CO2 и проветрить в течение ночи в инкубаторе.
- Поместите 50 мл минерального масла в колбу, плотно закройте крышкой и уравновесьте на ночь в инкубаторе.
- Среды для витрификации для FL и FL-кластеров
- Базальной средой для всех растворов является Глобал-Хепес с добавлением 20% синтетического заменителя белка. Приготовьте 20 мл раствора VS1 с 7,5% этиленгликолем (EG) и 7,5% диметилсульфоксидом (DMSO) в базальной среде.
- Приготовьте 20 мл VS2 с 15% EG, 15% ДМСО и 0,5 М сахарозой в базальной среде. Стерилизуйте все растворы с помощью шприцевого фильтра 0,22 мкм и храните при температуре 4 °C до использования. Растворы можно использовать до 4 недель.
- Согревающие среды для витрифицированных фолликулов и FL-кластеров
- Базальной средой для всех растворов является Глобал-Хепес с добавлением 20% синтетического заменителя белка. Приготовьте 20 мл базальной среды с 0,25 М сахарозы. Метка WS1.
- Приготовьте 20 мл базальной среды с 0,125 М сахарозой и пометьте как WS2. Фильтр простерилизовать с помощью шприцевого фильтра 0,22 мкм. Хранить растворы при температуре 4 °C до 4 недель.
2. Заготовка завязей
- Усыпить 10-14-дневных детенышей B6D2F1 путем вывиха шейки матки (без анестезии). Используйте 3-4 щенка, чтобы получить 250-300 интактных преантральных фолликулов для экспериментов.
- Уложите животное на спину и промокните брюхо 70% изопропиловым спиртом. Сделайте небольшой горизонтальный разрез по средней линии с помощью чистых ножниц. Возьмитесь за кожу сверху и снизу разреза тонкими щипцами и потяните в обоих направлениях (к голове и ногам), чтобы обнажить живот.
- С помощью второго набора чистых ножниц и тонких щипцов разрежьте брюшную стенку. Поднимите кишечные спирали. Располагают маточные рога, яйцеводы и яичники. Вырежьте яичники и поместите в центральную лунку чашку, содержащую 1 мл рабочей среды ОТ, подогретой до 37 °С.
- С помощью препарирующего микроскопа обрежьте весь жир и яйцеводную ткань. Рассекают завязи пополам.
3. Выделение фолликулов и кластера FL (FL-C)
- Используйте колпак с ламинарным потоком и нагреваемой поверхностью 37 °C для изоляции фолликулов и их обработки. Работайте асептически в вытяжке. Будьте осторожны с блюдом FCM. Используйте барботер, чтобы поддерживать газообразование в чашке с 5%CO2 при работе в колпаке с ламинарным потоком.
ПРИМЕЧАНИЕ: Все растворы должны быть предварительно подогреты до 37 °C. Перед использованием среду FCM, а также минеральное масло необходимо предварительно отбалансировать в течение ночи в инкубаторе при температуре 37 °C с 6%CO2 . pH среды будет смещаться при нахождении вне инкубатора более 10 минут. - Пипетку 6 мл предварительно уравновешенного FCM в две 60 мм чашки и покрыть минеральным маслом. Поместите обратно в инкубатор.
- Пипетируйте 1 мл коллагеназы в центральной лунке и 3 мл среды OT в наружную стенку. Переместите яичники в раствор коллагеназы с помощью стеклянной микропипетки (1000 мкм). Выдержать чашку в течение 30-40 минут на нагретой поверхности ламинарного вытяжного шкафа.
- В конце инкубации коллагеназы пипетируют 6 мл среды OT в две 60 мм чашки для культуры тканей, помеченные 1 и 2. Поместите на теплую поверхность вытяжки.
- С помощью микропипетки переместите обработанные коллагеназой яичники во внешнюю лунку, чтобы промыть их без коллагеназы. Поменяйте микропипетки, а затем переместите яичники в чашку OT 1.
- Соберите фолликулы из каждого яичника с помощью пипеттора P200. Высвобождение фолликулов путем повторной аспирации и изгнания обработанного ферментами яичника через кончик пипетки, обрезанный до разных размеров. Механическое разделение ткани на фрагменты с помощью двух игл 27G перед пипетированием также полезно для высвобождения отдельных фолликулов. Каждый детеныш мыши должен дать 60-75 неповрежденных фолликулов желаемого размера.
- При необходимости верните недиссоциированные кусочки яичника обратно в коллагеназу еще на 5-10 минут, промойте и повторите пипетирование для высвобождения большего количества фолликулов.
ПРИМЕЧАНИЕ: Чрезмерное воздействие коллагеназы приведет к разрушению слоев гранулезных клеток, окружающих ооцит. Не пытайтесь разбить весь яичник. Остановитесь после того, как будет собрано 250-300 фолликулов. - Исследуйте высвободившиеся фолликулы с помощью препарирующего микроскопа при 40-кратном увеличении. Идентификация вторичных преантральных фолликулов (~120 -140 мкм в диаметре) с центрально расположенным ооцитом, заключенным в интактную базальную мембрану (базальную пластинку). Фолликул такого размера обычно имеет 2-4 слоя гранулезных клеток, окружающих яйцеклетку (см. Рисунок 1).
ПРИМЕЧАНИЕ: Сравните фолликулы с отверстием наконечника микропипетки размером 175 мкм до приблизительного размера фолликула. Размер фолликула должен составлять примерно 3/4 диаметра пипетки. Это самый быстрый метод для подбора фолликулов нужного размера. - С помощью микропипетки 175 мкм переместите выбранные фолликулы в чашку OT2. По завершении сбора промойте все фолликулы в чашке FCM1, чтобы удалить любые следы среды OT. Затем переложите в тарелку FCM2.
- Поместите чашку в инкубатор на 60 минут до начала процесса закладки.
- Для выделения скопления фолликулов выполните шаги с 3.1 по 3.5. С помощью двух туберкулиновых шприцев (27 г) раздразните яичник на фрагменты, а затем на небольшие скопления по 6-10 фолликулов.
ПРИМЕЧАНИЕ: Культивирование скоплений фолликулов (FL-C) является альтернативой культивированию отдельных фолликулов. Этот метод сохраняет нативную фолликулярную архитектуру вместе со стромальными компонентами. Размер фолликулов при FL-C неоднороден. Фолликулы сохраняют свою конфигурацию in vivo с присутствием первичных, первичных и вторичных фолликулов. - Соберите эти скопления фолликулов (FL-C) с помощью микропипетки 200 мкм в чашку OT2. По завершении сбора промойте весь FL-C и переложите в FCM2 в ожидании внедрения.
4. Встраивание фолликулов и скоплений фолликулов
- Приготовьте стоковый раствор активированного гиалуронового гидрогеля (ГК) в концентрации 10 мг/мл. Регидратируйте 250 мг тираминзамещенного порошка гиалуроната натрия с 25 мл фермента пероксидазы хрена (HRP; 10 МЕ/мл) в фосфатно-солевом буфере. После растворения храните 500 мкл аликвот этого активированного запаса ГК при температуре -4 °C для будущих экспериментов.
- Для экспериментов с фолликулами разморозьте стоковый раствор ГК и разведите его до концентрации 3 мг/мл в глобальной среде, нагретой до 37 °C. Выполните все этапы заделки в вытяжку с ламинарным потоком и поверхностью скамейки, нагретой до 37 °C. Используйте чашку диаметром 60 мм с восемью лунками объемом 100 мкл для встраивания и последующего культивирования фолликулов.
- Переместите вводимые фолликулы или FL-кластеры из чашки FCM в каплю геля ГК для промывки без питательной среды. Отслеживающая среда будет препятствовать образованию геля. Поместите тарелку FCM обратно под барботер для получения газа.
Примечание: Изолированные фолликулы могут быть встроены, поодиночке или группами в зависимости от эксперимента. Обычно мы предпочитаем засеивать 2-4 фолликула на бусину. - Поместите 1 мкл 0,03% перекиси водорода (H2O2) на чашку Петри. Добавьте 25 мкл геля с гиалуроновой кислотой 3 мг/мл на каплю перекиси водорода и перемешайте с помощью пипетирования, чтобы инициировать сшивание (см. Рисунок 2).
- С помощью пипеттора P20 наберите смесь HA-H2O2 и отпипируйте одну каплю (~8-10 мкл) в две отдельные лунки 8-луночной чашки для культивирования. Избегайте образования пузырей.
- С помощью микропипетки 200 мкм быстро перенесите фолликулы или FL-C в центр каждой капли (рис. 3). Скорость имеет важное значение, так как после того, как гиалуроновая кислота подвергнется воздействию катализатора (перекиси), она начнет желеть в течение 1-2 минут. Будьте осторожны, чтобы не занести пузырьки во время посева.
ПРИМЕЧАНИЕ: Чтобы отслеживать рост отдельных фолликулов, расположите фолликулы на расстоянии друг от друга. Не размещайте фолликулы слишком близко к гелевому дну, иначе во время IVC они могут опуститься настолько, чтобы прикрепиться. - Подождите ~ 3 минуты для завершения процесса гелеобразования, а затем добавьте 100 μL предварительно уравновешенного FCM в каждую лунку. Повторите этот процесс и загрузите фолликулы во все восемь лунок. Облейте теплым предварительно уравновешенным минеральным маслом и поместите чашку в инкубатор.
5. Витрификация фолликулов и FL-кластеров
ПРИМЕЧАНИЕ: Витрификация может быть выполнена с использованием либо открытого носителя (Cryoloop; CL), допускающий прямой контакт с жидким азотом, или же закрытый носитель (Rapid I; RI), где образец запечатывается во внешнюю соломинку и, следовательно, никогда не вступает в контакт с жидким азотом. На рисунке 4 показаны устройства и контрасты двух систем витрификации. Было показано, что витрификация на обоих устройствах эффективна для криоконсервацииэмбрионов35.
- Закрытая витрификация носителя RI
- Предварительно подогрейте 2 мл аликвот растворов VS до 37 °C в нагреваемом блоке. Выполните все этапы витрификации на нагретой поверхности ламинарного проточного колпака с помощью препарирующего микроскопа для визуализации фолликула и носителя.
- Заполните изолированный криобокс жидким азотом (LN2). Поместите внешнюю соломинку устройства в отверстие для удержания внутри коробки, чтобы она была частично погружена в жидкий азот. Положите внутреннюю пластиковую палочку с крошечным отверстием поперек крышки чашки Петри, готовясь к загрузке.
- Поместите две капли VS1 рядом друг с другом на чашку Петри наверху. С помощью микропипетки 200 мкм поместите два фолликула в первую каплю. Промойте и быстро перейдите ко второй капле VS1. Выдерживать в течение 5 минут. При витрификации кластеров FL обрабатывайте по одному кластеру за раз.
- Поместите три капли VS2 рядом друг с другом на одну и ту же миску, когда первая инкубация будет почти завершена. Затем быстро переместите фолликулы последовательно через три капли VS2 в течение 60 с и загрузите носитель. Будьте осторожны, чтобы набрать минимальное количество жидкости вместе с фолликулами, чтобы избежать отслеживания среды от одной капли к другой.
- Чтобы загрузить носитель, возьмите два фолликула и залейте с минимальным количеством жидкости в крошечное отверстие в пластиковой палочке. Конечный объем жидкости в отверстии ничтожно мал < 0,5 мкл. Избегайте переполнения, в результате которого жидкость может вылиться из отверстия на пластиковую палочку.
- Опустите палочку в предварительно охлажденную внешнюю соломинку. Используйте ультразвуковой запайщик, чтобы закрыть и запечатать соломинку. Поместите соломинку в бокал, прикрепленный к криокану. В один кубок можно поместить до 4 соломинок.
- Накройте трость пластиковым защитным чехлом. Опустите тростник в бак для хранения жидкого азота (LN2).
- Витрификация CL с открытым носителем
- Предварительный нагрев растворов VS до 37 °C. Все этапы витрификации выполняйте на нагретой поверхности ламинарного проточного колпака. Заранее подготовьте необходимое количество открытых носителей CL. Вставьте металлический стержень CL в намагниченную крышку флакона, убедившись, что она надежно держится (при необходимости используйте небольшое количество клея).
- Заполните изолированный криобокс жидким азотом (LN2). Поместите в криобокс штатив для хранения криоконтейнеров так, чтобы LN2 находился ниже верхней части флакона.
- Наполните специальный намагниченный и вентилируемый флакон LN2. Поставьте его на решетку. Выполните этапы витрификации, как описано в шагах с 6.1.3 по 6.1.5. Единственное отличие заключается в том, что мы обычно обрабатываем пять фолликулов за раз. Опять же, будьте осторожны, чтобы свести к минимуму слежение жидкости от капли к капле.
- Чтобы нагрузить фолликулы, захватите открытый держатель CL за прикрепленный к нему магнитный колпачок с помощью металлической палочки. Окуните открытый держатель CL в отдельную каплю VS2, чтобы создать пленку криопротектора.
- С помощью микропипетки захватите все фолликулы или FL-кластер и поместите их на пленку с минимальным количеством жидкости. Работайте быстро, так как фолликулы должны быть нагружены до того, как пленка начнет высыхать.
- Немедленно погрузите CL в криовиал, заполненный LN2, для витрификации образца. Закройте крышкой и поместите флакон на криокан. Накрыть пластиковым рукавом. Опустите трость в резервуар для хранения жидкого азота.
6. Прогревание витрифицированных фолликулов и FL-кластеров
- RI Утепление закрытого носителя
- Приготовьте чашку для центральной лунки с 3 мл предварительно уравновешенного FCM во внешней лунке и 1 мл в центральной лунке. Залейте маслом и поместите в инкубатор.
- Поместите по 0,5 мл предварительно подогретых сортов WS1 и WS2 в две промаркированные центральные чашки. Переместите трости с образцами из резервуара для хранения в криобокс, наполненный LN2.
- Снимите пластиковую крышку трости. Извлеките соломинку из бокала, не опуская ее в воду, и вставьте ее в отверстие для удержания в криобоксе.
- С помощью тонких ножниц разрежьте внешнюю соломинку чуть выше черной точки, обозначающей верхнюю часть внутреннего носителя RI с фолликулами.
- С помощью тонких щипцов слегка приподнимите внутреннюю пластиковую палочку из внешней соломинки. Возьмитесь за устройство и быстро погрузите палочку в WS1, аккуратно вращая, чтобы разгрузить фолликулы. Скорость имеет решающее значение. Фолликулы должны быть выгружены в WS1 в течение 10 секунд.
- Используйте микроскоп для препарирования, чтобы визуализировать фолликулы и убедиться, что все они были выгружены из носителя. Через 2 минуты в WS1 с помощью микропипетки переместите все фолликулы (или FL-кластер) в WS2, стараясь не отслеживать среду.
- Через 3 минуты промойте фолликулы во внешней лунке чашки FCM, а затем переместите в центральную лунку. Поместите обратно в инкубатор на 1-2 часа перед закладкой.
- CL Открытый подогрев носителя
- Готовьте блюда FCM и WS, как описано выше. Переместите трость с фолликулами из резервуара для хранения в криобокс, наполненный LN2. Снимите пластиковую крышку трости.
- С помощью магнитной палочки поднимите криовиальный колпачок до тех пор, пока не станет виден металлический стержень CL.
- С помощью щипцов возьмитесь за металлический стержень. Извлеките CL из флакона и очень быстро погрузите в WS 1, аккуратно покручивая, чтобы разгрузить фолликулы. Выгрузка в WS1 в течение 10 секунд. Используя эндоскоп для препарирования, убедитесь, что все фолликулы были выгружены
- Все остальные шаги по прогреванию такие же, как и при закрытых шагах RI, начиная с шага 7.1.6.
7. Визуализация фолликулов и FL-кластеров и изменение среды
- Мониторинг фолликулов и FL-кластеров в лунках в течение 10-12-дневного интервала культивирования с помощью микроскопа инвертированного света с оптикой контрастной модуляции Хоффмана и камеры высокой четкости. Используйте программное обеспечение для обработки изображений для получения изображений с 40-кратным и 100-кратным или 200-кратным увеличением, в зависимости от размера.
- Визуализация и оценка фолликулов
- В 1-й день культуры, после встраивания, визуализируйте все лунки культуры с 40-кратным и 200-кратным увеличением с помощью инвертированного микроскопа, чтобы установить базовую морфологию и размер. Верните блюдо в инкубатор.
- Просматривайте изображения и записывайте количество полностью внедренных фолликулов в каждой гелевой бусине. Для FL-C сделайте оценку количества фолликулов в начале посева.
- С помощью программного обеспечения для визуализации измерьте диаметр фолликула по вертикальной и горизонтальной плоскостям от края базальной мембраны. Измерьте размер ооцитов аналогично от внешнего края зоны. Записывайте средние значения. Возьмем вертикальное и горизонтальное измерение диаметра кластера.
- Продолжайте делать снимки культур каждые 2-3 дня. Измерьте диаметры фолликулов, не соприкасающихся друг с другом. При использовании FL-C кластеры сворачиваются вверх во время IVC, поэтому весь кластер может быть измерен в вертикальной и горизонтальной плоскости.
Примечание: Для фолликулов, сгруппированных близко друг к другу, отдельные границы фолликулов могут быть неразличимы после 4-го дня посева, поэтому измерения не проводятся. - Классифицируйте фолликулы, которые становятся темными или апоптотическими, а также те, в которых ооцит больше не окружен гранулезными клетками или был выдавлен, как нежизнеспособные. Следите за фолликулами или FL-C, которые прикрепились к поверхности чашки (см. рисунок 5).
- Внимательно наблюдайте за фолликулами на предмет образования антрума с 8-го дня и далее. Фолликулы с антрумами будут выглядеть так, как будто внутри них есть просветленное или более светлое пространство (рисунок 6).
- Проводите половинную смену питательной среды каждые 2 дня. Используйте пипетку P200, рассчитанную на 50 μл. Вставьте наконечник в лунку под масляной накладкой и подальше от гелевой бусины. Медленно вытяните 50 мкл питательной среды. Замените среду, медленно пипетируя 50 мкл свежего FCM под масляную накладку. Избегайте образования пузырей.
8. Созревание ооцитов в инкапсулированных фолликулах
ПРИМЕЧАНИЕ: Заключительный этап созревания обычно начинается, когда образование антрального отдела среди общего количества засеянных (и жизнеспособных) фолликулов достигает более 40%. Однако, в случае, если образование антрального отдела низкое или не заметно, мы рекомендуем запустить его на 12-й день культивирования. Мы не заметили никакой пользы в том, чтобы ждать дальше. Для культур FL-C созревание обычно запускается, когда антры наблюдаются в 40% лунок или, самое позднее, к 12-му дню.
- Приготовьте среду для созревания in vitro (IVM) путем добавления FCM 1,5 МЕ/мл хорионического гонадотропина человека (ХГЧ) и 5 нг/мл эпидермального фактора роста (EGF).
- Запустите созревание путем замены FCM в каждой лунке на 100 мкл среды IVM около 5 часов вечера. После ночного созревания (через 16-18 ч после запуска) используйте препарирующий микроскоп с 40-кратным увеличением для исследования каждой культуры на предмет кумулюс-ооцитарных комплексов (КОК), которые овулировали из гелевой бусины ГК. КОК обычно находятся прямо над гелевой бусиной или в непосредственной близости.
- Соберите овулированные КОК в центральную лунку с 1 мл предварительно уравновешенного КОК, покрытого маслом, и поместите чашку обратно в инкубатор.
- Соберите ооциты из фолликулов, которые все еще внедрены, осторожно пипетируя бусину ГК с помощью пипетки P200 для высвобождения неовулированных КОК. Соберите их в отдельную посуду с помощью FCM.
- Приготовьте чашку для центральной лунки с 1 мл гиалуронидазы (10 МЕ/мл) и 3 мл среды FCM во внешней стенке.
- Перенесите овулированные КОК в раствор гиалуронидазы и кратковременно подвергните воздействию фермента (30-45 с) для обнажения яйцеклеток гранулезы с целью визуализации ядерного статуса ооцитов. Промойте ооциты для удаления фермента перед помещением в капли свежей среды по 5 мкл под маслом для детальной оценки. Поместите блюдо в инкубатор. Повторите этот процесс для неовулированных КОК.
- Запишите общее количество овулированных и неовулированных яйцеклеток. Сфотографируйте и оцените ядерный статус (GV, метафаза I или метафаза II) каждого восстановленного ооцита. Измерьте и запишите диаметр.
- Рассчитайте выживаемость НПВ на основе общего количества жизнеспособных фолликулов (тех, которые дожили до дня запуска ХГЧ) и общего количества восстановленных яйцеклеток. Рассчитайте процент ооцитов метафазы II из овулированных КОК. Повторите это для любых ооцитов, извлеченных из неовулированных КОК.
- Определяйте скорость созревания до метафазы II таким же образом для FL-C.
Результаты
В данной статье подробно описана методология использования нового гиалуронового геля, связанного с тирамином, для культивирования in vitro преантральных фолликулов мышей 36,37. На рисунке 6 показаны различия между ростом преантрального фолликула при помещении в обычную 2-D культуральную систему и один фолликул, инкапсулированный в гель ГК для 3-D культуры. Архитектура нативного фолликула сохраняется в течение 12 дней культивирования, а антрум отчетливо виден в последний день роста.
Гель с гиалуроновой кислотой очень универсален, что позволяет выращивать изолированные фолликулы поодиночке или группами, а также ткань яичников механически разбивается на небольшие скопления фолликулов. Гель прозрачный, что дает возможность визуализировать фолликулы, даже если они находятся на разной глубине. Инкапсулированные фолликулы и FL-C демонстрируют радиальное расширение за счет продолжающейся пролиферации гранулезных клеток (Рисунок 7). Исходный диаметр фолликулов в среднем составляет от 139,8 ± 28 мкм, а диаметр ооцитов GV составляет от 63,5 ± 4,6 мкм. В одиночных культивируемых фолликулах конечный диаметр составляет около 385,6 ± 36,7 мкм, что примерно в 3 раза больше по размеру. Ооциты овулярной метафазы II имеют размер около 84,8 ± 3,8 мкм. В культивируемых FL-кластерах размер фолликулов довольно разнообразен (рис. 5, рис. 7). Овулированные ооциты после запуска ХГЧ обнаруживаются вблизи фолликула (Рисунок 8). Большинство ооцитов метафазы II будет получено из овулированных КОК. Фолликулы, все еще внедренные после запуска, обычно содержат ооциты GV и метафазы I.
В таблице 1 сравниваются скорости созревания между изолированными фолликулами и FL-кластерами из свежих или замороженных яичников. FL-C из криоконсервированных яичников имел значительно более низкие темпы созревания. Микроскопические наблюдения показали, что у них часто ломаются базальные пластинки, что делает их весьма восприимчивыми к преждевременной экструзии ооцитов. Хрупкая природа скоплений фолликулов в некоторой степени компенсировалась инкапсуляцией. Лечения криоконсервированных яичников коллагеназой удалось избежать, так как оно было особенно вредным с низкой выживаемостью и низким выходом интактных фолликулов.
Криоконсервация изолированных фолликулов намного эффективнее, чем сохранение целых яичников. Высокие темпы созревания могут быть достигнуты при использовании обоих рассмотренных методов витрификации (Таблица 2). Несмотря на большие различия в скоростях охлаждения, созревание ооцитов после НПВ не отличалось. Открытый носитель CL обеспечивает большую эффективность, так как на один открытый носитель CL можно загрузить до десяти фолликулов. Это также сокращает общее время восстановления нескольких криоконсервированных фолликулов. Тем не менее, для любого возможного клинического применения витрификации для фолликулов человека закрытая герметичная система может быть предпочтительной.
Расположение хроматина вокруг ядрышка ооцита GV может быть использовано для идентификации ооцитов, которые с наибольшей вероятностью оплодотворятся после овуляции и разовьются до бластоцист38. На рисунке 9 показано окрашивание ооцитов в реальном времени для визуализации схемы распределения хроматина.
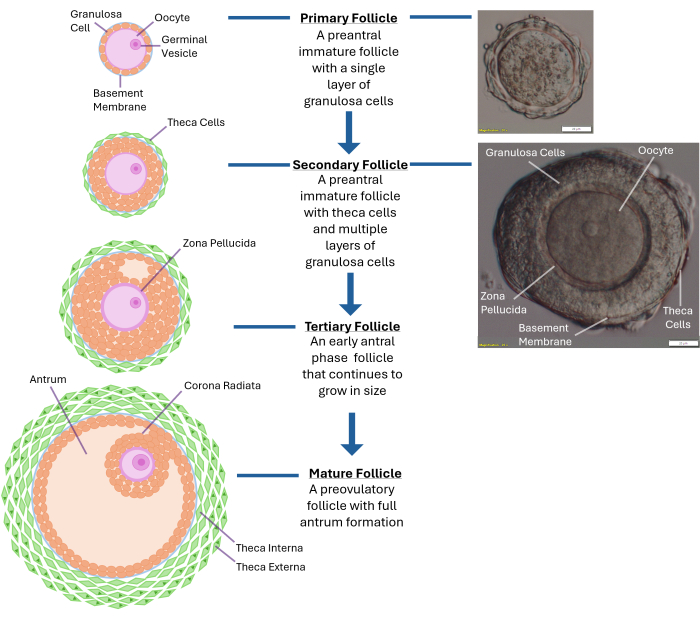
Рисунок 1: Схема роста фолликулов. Эта диаграмма иллюстрирует различные стадии развития фолликула от первичного фолликула до вторичной преантральной стадии и, наконец, до полностью зрелого третичного фолликула, готового к овуляции. Также показано микроскопическое изображение типичного преантрального фолликула с различными морфологическими особенностями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
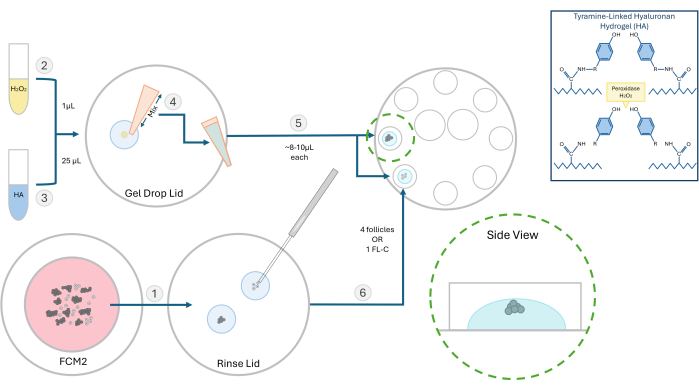
Рисунок 2: Схема метода инкапсуляции HA. Структура гиалуронового геля и различные этапы встраивания фолликулов проиллюстрированы на этой диаграмме. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
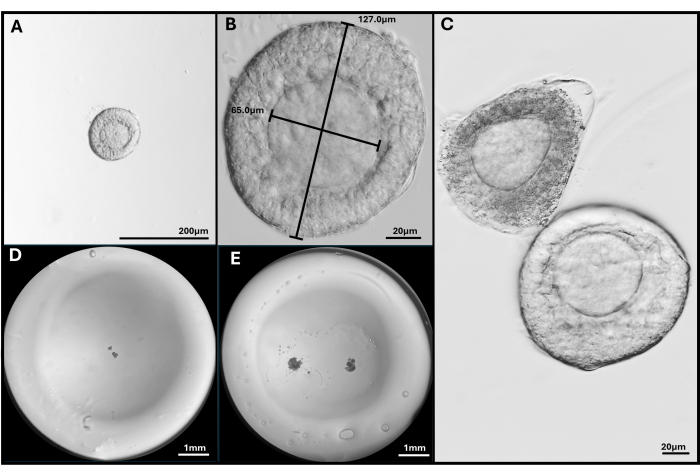
Рисунок 3: Выделение и инкапсуляция фолликула. (A, B) Преантральный фолликул выбран для встраивания при увеличении 40x и 200x. (C) Апоптотический фолликул показан со здоровым преантральным фолликулом с ооцитом не совсем в центре. (D) Изображение гелевой бусины HA, засеянной фолликулами и (E) двумя FL-C. Изображения, сделанные с помощью стереомикроскопа, показывают всю гелевую бусину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Устройства для витрификации для криоконсервации изолированных фолликулов. С помощью устройства CL open carrier этап витрификации проводится путем прямого погружения фолликулов в жидкий азот. Таким образом, скорость охлаждения чрезвычайно высока и составляет более -20 000 °C/мин. В отличие от закрытого носителя RI, фолликулы загружаются на внутреннюю пластиковую палочку и опускаются во внешнюю соломинку, погруженную в жидкий азот. Этот метод закрытой витрификации позволяет избежать прямого контакта с жидким азотом. Однако скорость охлаждения значительно ниже при -1220 °C/мин. Загрузка и извлечение фолликулов из любого носителя не вызывает особых усилий. Открытый носитель CL вмещал нагрузку до десяти фолликулов на устройство по сравнению с двумя при закрытом носителе RI. Эта цифра была изменена с35. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
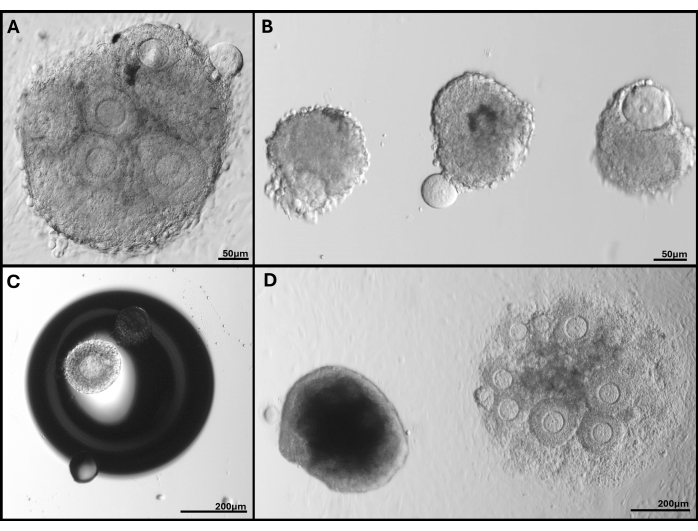
Рисунок 5: Репрезентативные изображения возникших проблем. (A) Скопление фолликулов с экструдируемым ооцитом. (B) Изолированные фолликулы с поврежденной мембраной базальной пластинки и один с экструдированной ооцитом. (В) Встроенный фолликул под пузырь в геле. (D) Скопление фолликулов, оставшееся в геле (слева), по сравнению с скоплением, застрявшим слишком глубоко, которое в конечном итоге прикрепилось к чашке. Хорошо виден широкий диапазон размеров фолликулов при FL-C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
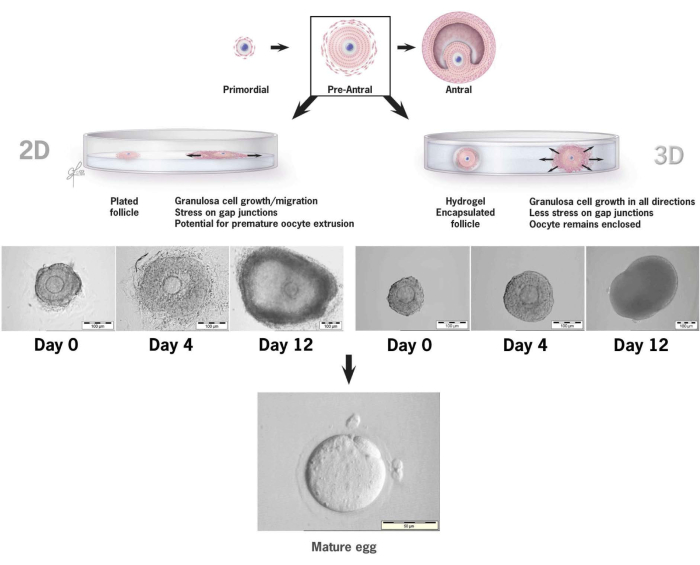
Рисунок 6: Сравнение роста фолликулов в конвенциях 2-D и 3-D культуре при ГА. При двумерном росте к 4-му дню наблюдалось уплощение фолликула и прикрепление гранулезных клеток к чашке для тканевой культуры, что делало ооцит уязвимым к миграции гранулезных клеток, нарушению щелевых соединений и преждевременной экструзии ооцитов. Инкапсулированный ГК фолликул оставался неприкрепленным на протяжении всего интервала между культуральными культурами. Экспансия гранулезных клеток происходила во всех направлениях, окутывая ооцит и поддерживая трехмерную архитектуру. Эта цифра была изменена с36. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
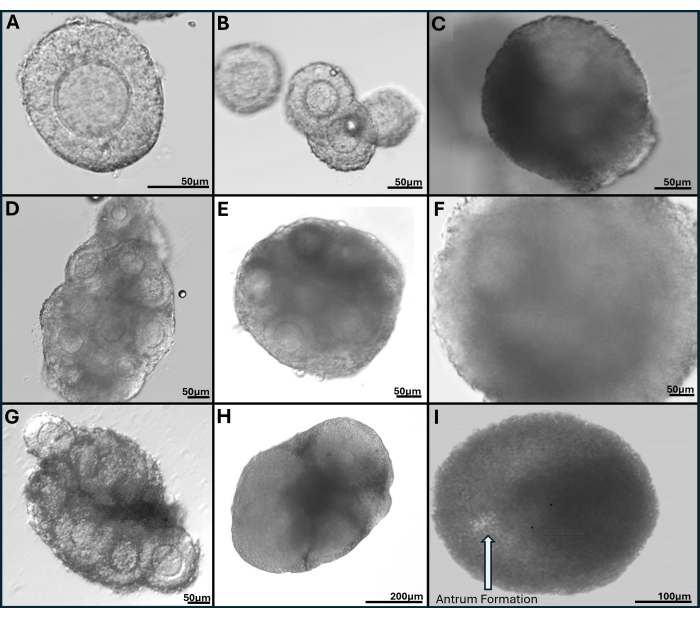
Рисунок 7: Репрезентативные изображения фолликулов, инкапсулированных в тирамин-связанный гиалуроновый гель. (A) Преантральный фолликул, собранный после расщепления коллагеназы свежих яичников в 1-й день. (B) Капля геля, засеянная четырьмя преантральными фолликулами, визуализированы в 1-й и (C) 4-й день посева, (D) скопление фолликулов из свежего яичника на 2-й день, (E) на 6-й день и (F) на 9-й день посева. (G) Скопление фолликулов, механически рассеченное из витрифицированного целого яичника, показано на 2-й день и (H) на 6-й день посева. (I) Фолликул с образованием антрального отдела хорошо виден на 9-й день посева. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
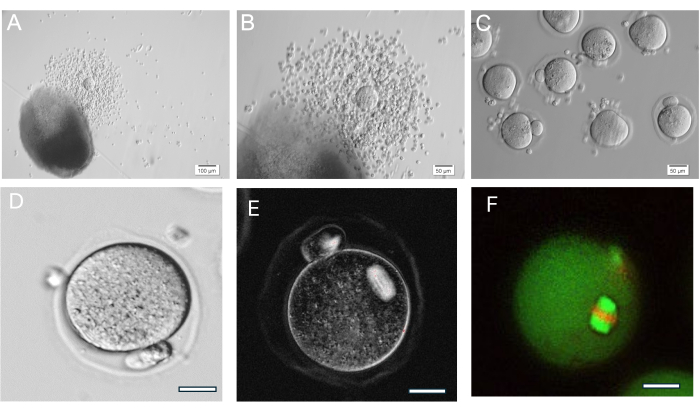
Рисунок 8: Овуляция ооцитов. (A, B) Овулированный кумулюс-ооцитарный комплекс (COC) показан рядом с бусиной HA-геля. (C) Ооциты были визуализированы после ферментативной обработки КОК гиалуронидазой для удаления окружающих кумулюсных клеток. Многочисленные ооциты метафазы II. (D) Яйцеклетка метафазы II с выступающим полярным тельцем. Увеличение в 400 раз. (E) Визуализация ооцита метафазы II в реальном времени с использованием поляризованного света и системы визуализации для визуализации мейотического веретена и оценки организации, выполненная в соответствии с описанием впункте 37. Увеличение 400x. Виден нормальный двулучепреломляющий шпиндель. (F) Ооцит метафазы II фиксирован и окрашен анти-альфа/бета-тубулином и йодидом пропидия для визуализации мейотической веретенообразной организации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
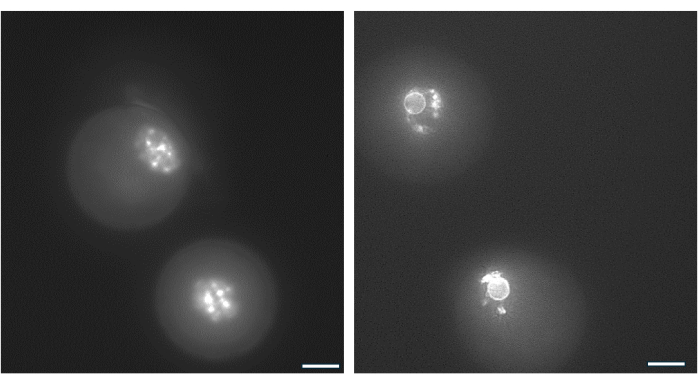
Рисунок 9: Реорганизация хроматина в ооцитах GV. Расположение хроматина в ооцитах GV после формирования антрального отдела изучали путем окрашивания ДНК препаратом Hoechst 33342 (50 нг/мл). Репрезентативные фолликулы были собраны из гранул ГК с помощью щадящего пипетирования. Гранулезные клетки удаляли с помощью гиалуронидазы. Затем ооциты GV окрашивали в течение 15 мин (см. протокол Monti et al.38). Снимки были сделаны с 40-кратным увеличением. (А) Яйцеклетка GV, показанная в 1-й день при инициации культивирования, демонстрирует картину окрашивания неокруженным хроматином (NSN). (B) Ооцит GV из растущего фолликула с антральным отделением, показанный в день запуска ХГЧ. Хроматин конденсировался и образовал перинуклеарное кольцо вокруг ядрышка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Параметр | Свежая завязь | Замороженный яичник | |
| FL-изоляция | FL-кластер | FL-кластер | |
| Фолликулы, наблюдаемые во время НПВ | 130 | 154 | 69 |
| Овуляция после ХГЧ (%) | 71% | 66% | 93% |
| (92/130) | (101/154) | (64/69) | |
| РТСД (%) | 30% | 28% | 52% |
| (28/92) | (28/101) | (33/64) | |
| Образование ооцитов MII (%) | 59% | 55% | *34% |
| (54//92) | (56/101) | (22/64) | |
Таблица 1: Исходы с фолликулами, встроенными в ГК, из свежих и витрифицированных яичников. Фолликулы и FL-C из свежих яичников созревали in vitro после инкапсуляции в гель HA. Гель ГК также был протестирован на фолликулах яичников, витризованных с использованием протокола EG/DMSO39. При свежих яичниках после расщепления коллагеназы собирали как отдельные фолликулы (ФЛ), так и фолликулярные кластеры (ФЛ-С). Для витрифицированных яичников воздействие коллагеназы было, по сути, вредным для фолликулов. Лучшим подходом к криоконсервированным яичникам было выделение FL-кластеров, а не отдельных фолликулов, и использование только механического рассечения иглами. В таблице сравниваются результаты между бусинами ГК, засеянными фолликулами в группах по 4-6 фолликулов, и бусинами с одним FL-C, содержащим 6-10 фолликулов. *Скорость созревания при использовании FL-C из криоконсервированных яичников была достоверно ниже (p = 0,008; Анализ хи-квадрат для проверки значимости).
| Носитель | РИ | КЛ |
| (Закрыто) | (Открыть) | |
| Выживаемость (%) | 100% (24/24) | 100% (41/41) |
| Образование антрального отдела* (%) | 25.0% (6/24) | 75.6% (31/41)* |
| Частота овуляции (%) | 66.7% (16/24) | 87.8% (36/41) |
| Скорость созревания (% MII) | 81.3% (13/16) | 69.4% (25/36) |
Таблица 2: Результаты после криоконсервации изолированных фолликулов на двух разных витрификационных устройствах. Высокие скорости созревания были достигнуты как при использовании открытого устройства CL, так и при использовании закрытого носителя RI с более низкой скоростью охлаждения. Образование антрума было единственным показателем исхода, который был признан значимым, но не влиял на общую скорость созревания (p < 0,05; Анализ хи-квадрат для проверки значимости).
Обсуждение
Способность контролировать механические свойства и биоразлагаемость гидрогеля HA, связанного с тирамином, дает множество преимуществ для применения в тканевой инженерии. Наша лаборатория первой применила этот специфический гель с гиалуроновой кислотой для роста фолликулов яичников. Этот запатентованный гель гиалуроната натрия, замещенный тирамином (TS-NAHY) представляет собой новую гидрогелевую систему на основе гиалуронана, разработанную в клинике Кливленда. Сшивание геля обусловлено воздействием окислителя на пероксидазу в активированной гелевой смеси. Это можно сделать как in vitro , так и in vivo. Сформированные гидрогели TS-NAHY проявляют широкий спектр свойств от слабого геля, пасты до хрупкого твердого вещества, в зависимости от концентрации геля40.
Разочаровывающий прогресс в области культуры фолликулов яичников подчеркивает необходимость разработки новых моделей культуры. Более выгодным подходом может быть создание культуральной системы, основанной исключительно на компонентах нативного внеклеточного матрикса. Описанная модель культуры ГК проста в использовании физиологическим способом и не требует дополнительных компонентов ВКМ. Гель прозрачный, что позволяет детально визуализировать фолликулы. Вязкоупругие свойства геля HA облегчают регулировку жесткости, а также формуемости. Эта особенность повышает универсальность данной биоматрицы. Жесткость биоматрицы может влиять на пролиферацию гранулезных клеток и формирование антрального отдела 30,41,42. Сообщалось, что фолликулы, полученные из культуральной среды, допускающей образование антрального отдела, имеют профили экспрессии генов, отличные от профилей экспрессии генов в неподдерживающей культуральной системе43. Фолликулы приматов, по-видимому, нуждаются в более жесткой матрице44. Адаптация биоматрицы к требованиям различных видов животных, включая человека, вероятно, будет иметь важное значение для успешного созревания in vitro.
Для роста преантральных фолликулов мышей мы тестировали концентрации геля в диапазоне от 2-5 мг/мл36. Скорость созревания ооцитов колебалась от 44% до 58%. Более высокие концентрации геля HA обеспечивали большую формуемость и удержание трехмерной структуры, но это влияло на расширение фолликулов. Более низкие концентрации ГК позволяли увеличить радиальное расширение фолликула, но увеличивали риск спонтанной экструдации фолликула до окончания НПВ. Концентрация ГК в 3-3,5 мг/мл лучше всего работала для преантальных фолликулов мышей. Сохранение небольшой капли геля было важно для формирования гелевых шариков ГК с достаточной глубиной для удержания фолликулов в трехмерной конфигурации на протяжении всего IVC. Более крупные капли сплющиваются, в результате чего фолликулы опускаются через гель и прикрепляются к поверхности пластины. Одним из ограничений использования этого биоматериала для встраивания является чрезвычайно быстрое время гелеобразования. Это затрудняет посев более двух гелевых бусин с гиаловой кислотой за один раз. Повышение эффективности посева фолликулов в гель с гиалуроновой кислотой является одной из областей, которую мы пытаемся улучшить.
Культивирование скоплений фолликулов в 3-D среде с использованием ГК имеет большой потенциал. Нормальная архитектура яичников сохраняется, фолликулы разного размера контактируют друг с другом и поддерживающей стромой. ЛГ может способствовать росту меньших преантральных фолликулов в FL-C, вызывая изменения в ранних дифференцировочных клетках, поэтому он был включен в среду FCM45. Продолжение культивирования FL-C в течение более 12 дней, чтобы увидеть, может ли быть инициирована новая волна роста в любом из более мелких фолликулов, все еще встроенных после триггера ХГЧ, требует дальнейшего изучения. Дальнейшая оптимизация среды культуры может быть предпосылкой для культивирования фолликулов разного диапазона размеров в фрагменте ткани. Преимущество этой 3-D модели культуры ГК с FL-C заключается в том, что она позволяет точно имитировать расположение фолликулов и взаимодействий in vivo . Еще одним важным признаком является то, что в отличие от альгината кальция и других полимерных систем, овуляцию и созревание можно индуцировать без физического удаления фолликулов из ткани или гелевого матрикса.
Время, необходимое для культивирования фолликулов in vitro и получения зрелых ооцитов для замораживания, велико, особенно у крупных млекопитающих. Возможность криоконсервации собранных фолликулов или скоплений фолликулов представляет собой способ отложить этот шаг на более позднее и, возможно, более благоприятное время. Если такая технология когда-нибудь сможет быть применена к человеческим фолликулам во время забора яичников, это может быть полезно. Криоконсервация цельных яичников для сохранения фертильности в настоящее время является единственным вариантом для пациентов. Но является ли он, на самом деле, лучшим методом, еще предстоит определить. В этой статье мы представляем методологию витрификации для криоконсервации преантральных фолликулов, которая обеспечивает превосходные показатели выживаемости и созревания после нагревания после 3D-культуры.
В заключение мы описали новую 3D-модель культуры с использованием гиалуронана, компонента нативной ВКМ. Методика инкапсуляции ГК позволяет удерживать трофические факторы в непосредственной близости от развивающихся фолликулов. Методология инкапсуляции в биоматрице проста и может вместить как изолированные фолликулы, так и кластеры фолликулов. Последнее может открыть новые направления исследований и дать представление о фундаментальной биологии фолликулогенеза и его регуляции. Было показано, что ооциты из инкапсулированных ГК фолликулов функционально компетентны37. Эти ооциты могут быть оплодотворены, образовывать бластоцисты in vitro и имплантироваться при переносе псевдобеременным мышам. Эти данные подтверждают использование тирамин-связанного гиалуронана в качестве биоматрицы для трехмерного культивирования фолликулов и созревания яйцеклеток in vitro. Этот протокол потенциально может быть применен к культуре фолликулов яичников на других животных моделях, включая человека. Другими возможными областями применения этой 3-D гелевой системы ГК могут быть эмбриоидное тело и органоидная культура.
Раскрытие информации
Отсутствие конфликта интересов или разглашения информации.
Благодарности
Мы хотим выразить признательность всей эмбриологической команде Кливлендской клиники за их помощь, а также отделению REI и особенно доктору Фальконе за поддержку. Этот проект финансировался через исследовательский фонд Кливлендской клиники.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-alpha tubulin-FITC labelled | Sigma-Aldrich | F2168 | |
| Anti-beta tubulin-FITC labelled | Sigma-Aldrich | F2043 | |
| BZ-X700 | Keyence | ||
| Center well dish | Fisher Scientific | 08-772-12 | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Crycap vial-vented | Hampton Research | HR4-904 | |
| Cryoloop | Hampton Research | HR4-974 | |
| Crystal cap | Hampton Research | HR4-733 | |
| Culture dish 60mm | Fisher Scientific | 08-772B | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Epidermal growth factor (EGF) | R &D Systems | 236-EG | |
| Ethylene Glycol (EG) | Sigma-Aldrich | 293237 | |
| Fetal Bovine Serum-Heat Inactivated | ThermoFisher Scientific | 10082-147 | |
| Follicle Stimulating Hormone (FSH) | Sigma-Aldrich | F4021 | |
| Global-Hepes medium | CooperSurgical | LGGH-100 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Human chorionic gonadotrophin (hCG) | Sigma-Aldrich | CG10 | |
| Human serum albumin | CooperSurgical | GHSA-125 | |
| Hyaluronidase | CooperSurgical | ART-4007-A | |
| Hydrogen Peroxide | CVS Pharmacy Inc. | 372441 | |
| Insulin-transferrin-selenium (ITS) | ThermoFisher Scientific | 41400-045 | |
| Leibovitz medium (L-15) | ThermoFisher Scientific | 11415-064 | |
| Luteinizing hormone | Sigma-Aldrich | L9773 | |
| Magnetic wand | Hampton Research | HR4-729 | |
| Micropipettes (1000 µm) | Minitube | 19025/0050 | |
| Micropipettes (175 , 200, and 275µm) | CooperSurgical | MXL3-175, MXL3-200, MXL3-275 | |
| Millex GV filter 0.22 µm | Millipore | SLGU033RS | |
| Mineral oil | CooperSurgical | LGOL-500 | |
| Minimum Essential Medium alpha (MEM) | ThermoFisher Scientific | 32561-037 | |
| Oocyte Imaging System-Spindleview | Hamilton Thorne | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | 10010-023 | |
| Propidium iodide | Sigma-Aldrich | P4170 | |
| Rapid i | VitroLife | 14406 | |
| SmartBox | VitroLife | 14423 | |
| Synthetic Protein Substitute (SPS) | CooperSurgical | ART-3011 | |
| Tyramine -linked Hyaluronan Biohydrogel Kit | LifeCore | ENG-00151 | |
| Ultrasonic sealer | VitroLife | 14415 | |
| Universal GPS Culture dish 8x 100 µl wells | CooperSurgical | UGPS-010 |
Ссылки
- Telfer, E. E., Andersen, C. Y. In vitro growth and maturation of primordial follicles and immature oocytes. Fertil Steril. 115 (5), 1116-1125 (2021).
- Telfer, E. E., McLaughlin, M. Natural history of the mammalian oocyte. Reprod Biomed Online. 15 (3), 288-295 (2007).
- Xiao, S., et al. In vitro follicle growth supports human oocyte meiotic maturation. Sci Rep. 5, 17323 (2015).
- Carabatsos, M. J., Sellitto, C., Goodenough, D. A., Albertini, D. F. Oocyte-granulosa cell heterologous gap junctions are required for the coordination of nuclear and cytoplasmic meiotic competence. Dev Biol. 226 (2), 167-179 (2000).
- Diaz, F. J., Wigglesworth, K., Eppig, J. J. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol. 305 (1), 300-311 (2007).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod. 73 (2), 351-357 (2005).
- Dadashzadeh, A., Moghassemi, S., Shavandi, A., Amorim, C. A. A review on biomaterials for ovarian tissue engineering. Acta Biomater. 135, 48-63 (2021).
- Simon, L. E., Kumar, T. R., Duncan, F. E. In vitro ovarian follicle growth: a comprehensive analysis of key protocol variablesdagger. Biol Reprod. 103 (3), 455-470 (2020).
- Belli, M., et al. Towards a 3D culture of mouse ovarian follicles. Int J Dev Biol. 56 (10-12), 931-937 (2012).
- Berkholtz, C. B., Shea, L. D., Woodruff, T. K. Extracellular matrix functions in follicle maturation. Semin Reprod Med. 24 (4), 262-269 (2006).
- Desai, N., et al. Three-dimensional in vitro follicle growth: overview of culture models, biomaterials, design parameters and future directions. Reprod Biol Endocrinol. 8, 119 (2010).
- Shea, L. D., Woodruff, T. K., Shikanov, A. Bioengineering the ovarian follicle microenvironment. Annu Rev Biomed Eng. 16, 29-52 (2014).
- Paulini, F., et al. Survival and growth of human preantral follicles after cryopreservation of ovarian tissue, follicle isolation and short-term xenografting. Reprod Biomed Online. 33 (3), 425-432 (2016).
- West, E. R., Xu, M., Woodruff, T. K., Shea, L. D. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials. 28 (30), 4439-4448 (2007).
- Joo, S., et al. The effect of collagen hydrogel on 3D culture of ovarian follicles. Biomed Mater. 11 (6), 065009 (2016).
- Telfer, E., Torrance, C., Gosden, R. G. Morphological study of cultured preantral ovarian follicles of mice after transplantation under the kidney capsule. J Reprod Fertil. 89 (2), 565-571 (1990).
- Torrance, C., Telfer, E., Gosden, R. G. Quantitative study of the development of isolated mouse pre-antral follicles in collagen gel culture. J Reprod Fertil. 87 (1), 367-374 (1989).
- Dong, C., Yonggang, L. V. Application of collagen scaffold in tissue engineering: recent advances and new perspectives. Polymers. 8 (2), 42 (2016).
- Le, B. A. M., et al. Agarose-based 3D culture improved the developmental competence of oocyte-granulosa complex isolated from porcine preantral follicle. Theriogenology. 223, 11-21 (2024).
- Park, J. E., et al. In vitro maturation on an agarose matrix improves the developmental competence of porcine oocytes. Theriogenology. 157, 7-17 (2020).
- Zaniker, E. J., et al. Three-dimensionally printed agarose Micromold supports scaffold-free mouse ex vivo follicle growth, ovulation, and luteinization. Bioengineering. 11 (7), 719 (2024).
- Pangas, S. A., Saudye, H., Shea, L. D., Woodruff, T. K. Novel approach for the three-dimensional culture of granulosa cell-oocyte complexes. Tissue Eng. 9 (5), 1013-1021 (2003).
- West, E. R., Shea, L. D., Woodruff, T. K. Engineering the follicle microenvironment. Semin Reprod Med. 25 (4), 287-299 (2007).
- Xu, J., et al. Survival, growth, and maturation of secondary follicles from prepubertal, young, and older adult rhesus monkeys during encapsulated three-dimensional culture: effects of gonadotropins and insulin. Reproduction. 140 (5), 685-697 (2010).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12 (10), 2739-2746 (2006).
- Amorim, C. A., Van Langendonckt, A., David, A., Dolmans, M. M., Donnez, J. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod. 24 (1), 92-99 (2009).
- Converse, A., Zaniker, E. J., Amargant, F., Duncan, F. E. Recapitulating folliculogenesis and oogenesis outside the body: encapsulated in vitro follicle growth dagger. Biol Reprod. 108 (1), 5-22 (2023).
- Mainigi, M. A., Ord, T., Schultz, R. M. Meiotic and developmental competence in mice are compromised following follicle development in vitro using an alginate-based culture system. Biol Reprod. 85 (2), 269-276 (2011).
- Kreeger, P. K., Deck, J. W., Woodruff, T. K., Shea, L. D. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials. 27 (5), 714-723 (2006).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. Interpenetrating fibrin-alginate matrices for in vitro ovarian follicle development. Biomaterials. 30 (29), 5476-5485 (2009).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Irving-Rodgers, H. F., Rodgers, R. J. Extracellular matrix of the developing ovarian follicle. Semin Reprod Med. 24 (4), 195-203 (2006).
- Salustri, A., Camaioni, A., Di Giacomo, M., Fulop, C., Hascall, V. Hyaluronan and proteoglycans in ovarian follicles. Hum Reprod Update. 5, 293 (1999).
- Rashki Ghaleno, L., Cristian, P. P., Shahverdi, A., Dardmeh, F., Alipour, H., Valojerd, M. R. Exploring the role of hyaluronic acid in reproductive biology and beyond: Applications in assisted reproduction and tissue engineering. Adv. Biology. 8 (6), e202300621 (2024).
- Desai, N. N., Goldberg, J. M., Austin, C., Falcone, T. The new Rapid-i carrier is an effective system for human embryo vitrification at both the blastocyst and cleavage stage. Reprod Biol Endocrinol. 11, 41 (2013).
- Desai, N., Abdelhafez, F., Calabro, A., Falcone, T. Three dimensional culture of fresh and vitrified mouse pre-antral follicles in a hyaluronan-based hydrogel: a preliminary investigation of a novel biomaterial for in vitro follicle maturation. Reprod Biol Endocrinol. 10 (1), 29 (2012).
- Desai, N., Spangler, M., Nanavaty, V., Gishto, A., Brown, A. New hyaluronan-based biomatrix for 3-D follicle culture yields functionally competent oocytes. Reprod Biol Endocrinol. 20 (1), 148 (2022).
- Monti, M., Redi, C. A. Isolation and characterization of mouse antral oocytes based on nucleolar chromatin organization. J Vis Exp. (107), e53616 (2016).
- Huang, L., et al. Cryopreservation of human ovarian tissue by solid-surface vitrification. Eur J Obstet Gynecol Reprod Biol. 139 (2), 193-198 (2008).
- Chan, J., Darr, A., Alam, D., Calabro, A. Investigation of a novel cross-linked hyaluronan hydrogel for use as a soft-tissue filler. Am J Cosmetic Sur. 22, 105-108 (2005).
- Shikanov, A., Xu, M., Woodruff, T. K., Shea, L. D. A method for ovarian follicle encapsulation and culture in a proteolytically degradable 3-dimensional system. J Vis Exp. (49), e2695 (2011).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75 (6), 916-923 (2006).
- West-Farrell, E. R., et al. The mouse follicle microenvironment regulates antrum formation and steroid production: alterations in gene expression profiles. Biol Reprod. 80 (3), 432-439 (2009).
- Xu, M., et al. Encapsulated three-dimensional culture supports development of nonhuman primate secondary follicles. Biol Reprod. 81 (3), 587-594 (2009).
- Wu, J., Nayudu, P. L., Kiesel, P. S., Michelmann, H. W. Luteinizing hormone has a stage-limited effect on preantral follicle development in vitro. Biol Reprod. 63 (1), 320-327 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены