Case Report
Abzüge und Laminar-Flow-Schränke
Not Published
In diesem Artikel
Zusammenfassung
Entitäten hier eingegebenen Degrees: Micro: μ-Zeichen: & Warenzeichen: PRÜFUNG ∂ Σ Ω ≈ γ γδ γδ γδ-Test
Zusammenfassung
Robert M. Rioux & William A. Elliott, Pennsylvania State University, University Park, PA
Rauch Hauben und Laminar-Flow-Schränke sind engineering-Steuerelemente, die unter ähnlichen Prinzipien funktionieren. Beide verwenden einen konstanten Luftstrom um die Laborumgebung und seine Bewohner zu verhindern. Abzüge zu verhindern, dass Gefahrstoffe aus den Haube Arbeitsbereich verlassen während Laminar-Flow Schränke verhindern, dass Verunreinigungen in den Schrank Arbeitsbereich.
Rauch Hauben sind Lüftungsanlagen entwickelt, um gefährliche Dämpfe, Gase und Partikel minimieren. Ein konstanten Luftstrom zieht es in die Haube öffnen, die Flucht der Dämpfe, Gase und Partikel zu begrenzen, und dann durch den Auspuff herausgezogen ist. Laminar-Flow-Schränke werden verwendet, um eine sterile/saubere Umgebung zu pflegen, indem ständig fließenden Hocheffizienz Partikel Arrestance (HEPA)-gefilterte Luft nach außen, kontaminierten Luft, die in den Schrank Arbeitsbereich zu minimieren. Die HEPA-gefilterte Luft verringert die Möglichkeit für schädliche Chemikalien oder Partikel vom Labor betreten. Ein HEPA-Filter entfernt 99,97 % oder größer 0,3 µm Partikel.
Einleitung
Rauch Hauben und Laminar-Flow-Schränke sind engineering-Steuerelemente, die darauf abzielen, die Exposition gegenüber Gefahren und Verunreinigung zu verringern. Abzüge reduzieren Exposition gegenüber gefährlichen Dämpfe, Rauch und Partikel für den Benutzer während Laminar-Flow Schränke Arbeitsbereich Belastung durch Schadstoffe reduzieren. Turbulente Strömung folgt eine unregelmäßige Strömungsmuster mit lokalen Strom bewegt sich in alle Richtungen im Verhältnis zu der Masse fließen. Laminare Strömung bewegt sich in parallelen Stromlinien, die sich nicht kreuzen. Laminar-Flow Schränke erhalten einen laminaren Luftstrom, Kreuzkontamination innerhalb des Arbeitsbereichs zu vermeiden und Rückfluss von kontaminierter Luft von außen die Haube zu verhindern, die mit turbulente Strömung auftreten würde.
Protokoll
1. Rauch Hauben
- benutzt
- Abzüge werden verwendet, wenn ein Material schädliche Dämpfe, Rauch oder Schwebeteilchen, wie feine Kieselerde Pulver oder flüchtige Karzinogene wie Benzol erzeugt.
- Operation
- Luft wird angesaugt, obwohl die Öffnung Gesicht der Haube, wo der Benutzer arbeitet, und heraus durch den Auspuff. Die konstanten Fluss der Luft nach innen in Richtung Gesicht verhindert gefährliche Dämpfe, Gase und Partikel entweichen durch die Haube Öffnung, Sicherheit für den Benutzer und andere Laboranten.
- Gesichts Fließgeschwindigkeit muss hoch genug für die Motorhaube effektiv zu sein. Eine niedrige Strömungsgeschwindigkeit kann schädliche Gase, Dämpfe oder Partikel durch die Öffnung der Motorhaube in Richtung der Benutzer zu entkommen. Eine Ursache für geringe Strömungsgeschwindigkeit hat verstellbare Fenster bei der Haube-Eröffnung, genannt eine Schärpe, zu hoch. Es ist üblich, dass Rauch Hauben, niedrige Geschwindigkeit Alarmen zu fließen und Schärpe Höhe Alarme zu haben. Typische Strömungsgeschwindigkeiten sind zwischen 0,41 und 0,51 m/s (ANSI/AIHA/ASSE Z9.5). Hauben sollte die maximale sichere Arbeitshöhe des Flügels deutlich gekennzeichnet haben.
- Es gibt einige Regeln für die sichere Verwendung von Rauch Hauben.
- Nie setzen Sie Ihren Kopf in der Haubenraum da einfügen Ihren Kopf in der Kapuze Sie schädliche Materialien aussetzen kann. Die Haube soll Nutzer vor Exposition gegenüber chemischen Stoffen nur dann, wenn richtig genutzt zu schützen. Nur der Benutzer ' Arme in der Haube vorhanden sein sollte. Tragen Sie geeigneten persönlichen Schutzausrüstung (PSA) zu allen Zeiten, unabhängig von den Schutzbereich der Dunstabzugshaube. Beraten Sie sich mit Ihrer Organisation ' s Environmental Health & Sicherheit (EHS) Amt für ordnungsgemäße PSA Empfehlungen, wenn sie unbekannt sind.
- Arbeiten Sie immer mit der Schärpe an oder unterhalb der maximalen sicheren Höhe.
- Wenn nicht in Gebrauch, die Schärpe geschlossen werden sollte. Schließen des Flügels sorgt für eine sichere Arbeitsumgebung für alle Labor-Insassen. Darüber hinaus sind die Energiekosten, die unsachgemäße Dunstabzugshaube Vorgang zugeordnete immens. Aufrechterhaltung der Flügelhöhe mindestens, nicht Arbeitsebene ist energieeffizienter.
- Verwenden Sie die Haube nicht für die Lagerung von Chemikalien. An geeigneten Stellen, wie ein Schrank, brennbaren Chemikalien zu speichern und in der Dunstabzugshaube nur bei Bedarf bringen.
- Setzen alle Materialien in der Dunstabzugshaube mindestens 6 Zoll vom Rand des Gesichts Dunstabzugshaube. Bei der Arbeit erfolgt innerhalb von 6 Zoll von der Kante, Dämpfe, Rauch und Partikel sind eher zu entkommen.
- Ebenso gute Haushaltsführung zur Arbeit Labor Bänke Grundsätze, die gleichen Prinzipien innerhalb Abzüge praktiziert werden sollte.
- Regelmäßige Wartungsarbeiten an einem Abzug zu gewährleisten, ist es sicher in Betrieb. Wartung sollte auch Tests von Alarmen und Strömungsgeschwindigkeit an der Schärpe Betriebsstellung Design testen. Viele Faktoren beeinflussen die Strömungsgeschwindigkeit, einschließlich Fließstrukturen innerhalb des Raumes befindet sich die Haube und Hindernisse am Auspuff zu entlüften. Wenn die Strömungsgeschwindigkeit an der Schärpe Betriebsstellung Design niedrig ist, senken des Flügels bis die Strömungsgeschwindigkeit auf die erforderliche Geschwindigkeit ist. Viele moderne Rauch Hauben haben Luft Geschwindigkeit Strömungswächter, die die Strömungsgeschwindigkeit in Echtzeit zu überwachen. Wenn der Flügel zu niedrig für eine effektive Arbeit an der Dunstabzugshaube durchgeführt werden wird, nicht mehr Betrieb bis die Wurzel des Problems gerichtet ist.
- Fume Haube Variationen
- gibt Anzahl der Arten von spezielleren Rauch-Hauben, die angetroffen werden können. Dazu gehören Perchlorsäure Hauben, Radioisotopen Hauben und ductless Hauben. Mehr über die Anforderungen für diese Hauben in ANSI/AIHA/ASSE Z9.5.
2. Laminar-Flow-Schränke
- Gebrauch
- Laminar-Flow-Schränke werden verwendet, wenn eine saubere Umwelt, frei von Partikeln oder biologischen Verunreinigungen erforderlich ist. Typische Beispiele sind Arbeiten mit Zellkulturen oder Halbleiter Wafer. Laminar-Flow-Schränke in der Luft Verunreinigung vom Betreten des Schrank Arbeitsbereichs verhindern. Die laminare Strömung (im Gegensatz zur turbulenten Strömung) der Luft minimiert Cross-Kontamination der Proben innerhalb des Kabinetts.
- Luft durch einen HEPA-Filter gefiltert und über den Arbeitsbereich heraus in Richtung der Benutzer geblasen. Einen ständigen Abfluss von saubere Luft unterhält einen unberührten Arbeitsbereich. Einige Laminar-Flow-Kabinette sind ausgestattet mit einer UV-C Lampe das Arbeitsbereich vor dem Gebrauch zu desinfizieren.
- Es gibt zwei Arten von Laminar-Flow-Schränke: horizontale und vertikale ( Abbildung 1). Horizontale Strömung Schränke sauber Luft von der Rückseite Gesicht des Kabinetts horizontal in Richtung der Benutzer während vertikale Strömung Hauben bläst sauberen Luft von der Decke des Gehäuses in Richtung Boden des Arbeitsbereichs, wo es dann die Basis und fließt in eine horizontale hits Richtung der Benutzer. Vertikale Strömung Schränke dienen mit der Schärpe abgerissen. Horizontale Strömung Schränke haben keine Schärpe. Beide Arten von Laminar-Flow Schränke haben ihre vor- und Nachteile.
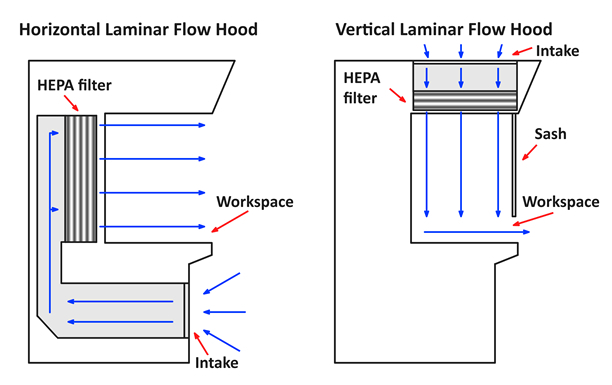
Abbildung 1 . Diagramme von horizontalen und vertikalen Laminar-Flow Hauben.
| horizontale Laminar-Flow Hood | |
| Vorteile | Nachteile |
| Hände/Handschuhe verschmutzen weniger, da sie in der Regel Abwind der Elemente im Kabinett | Luftstrom bläst in Benutzer ’ s Gesicht |
| reduzierte Luftverwirbelungen Fluss | große Objekte auf Worksp Ass kann sauber Luftstrom, Verringerung der Wirksamkeit behindern |
| Vertikale Laminar-Flow Hood | |
| Vorteile | Nachteile |
| Luft Stream bläst nicht in Benutzer ’ s Gesicht | Hände und Arme über Objekte positionieren kann nicht |
| weniger Kreuzkontamination von Element im Arbeitsbereich | erhöhte Strömung Luftverwirbelungen |
Tabelle 1. Vor- und Nachteile der horizontale und vertikale Laminar-Flow Hauben.
- Tipps zum effektiven Einsatz von Laminar-Flow-Schränke zu gewährleisten.
- Immer darauf achten, nicht dass Elemente stromabwärts der Elemente setzen, die führen können, um Kontamination zu überqueren. Dies gilt insbesondere bei der Verwendung von biologischer Proben.
- Minimieren Unordnung. Je mehr Elemente, die in der Ablage, die wahrscheinlicher Kontamination stattfinden soll. Große Gegenstände können Fluss gestört.
- Sorgen dafür, dass die Hände/Handschuhe und alle Elemente, die in den Schrank gestellt werden, frei von Verunreinigungen vor dem Eintritt in das Kabinett sind.
- Alle Elemente müssen 6 Zoll platziert werden oder vom Rand des die Schranköffnung weiter. Die Luft innerhalb von 6 Zoll von der Kante ist wahrscheinlicher, mit der Außenluft zu mischen, Bedeutung Objekte innerhalb von 6 Zoll sind eher verunreinigt werden.
- Regelmäßige Wartung sollte durchgeführt werden, auf eine laminare Strömung Kabinett um sicherzustellen, dass es sicher in Betrieb ist. Wartung sollte umfassen, Überprüfung und Austausch des HEPA-Filters, Überprüfung auf Dichtheit im Kabinett und Luftstrom Geschwindigkeit testen. Die Integrität der HEPA-Filter sollte geprüft, durch die Prüfung der Anzahl der Partikel, die durch den Filter passieren. Entfernen des Filters sollte 99,97 % oder größer 0,3 µm Partikel. Wenn die Strömungsgeschwindigkeit zu niedrig ist, wird das Gehäuse halten sich Verunreinigungen unwirksam sein. Wenn die Strömungsgeschwindigkeit zu groß ist, die Strömung werden turbulent, mit Verunreinigungen immer wahrscheinlicher.
Rauch Hauben und Laminar-Flow-Schränke sind wesentliche Teile von Laborgeräten, die Gefahrensituationen und Verschmutzung zu verhindern.
In Rauch Hauben und Laminar-Flow-Schränke, Gefahren oder Verunreinigungen sinken mit Luftstrom. Rauch-Hauben zeichnen in Luft über einen Arbeitsbereich zu entfernen schädliche Dämpfe und feinen Partikeln, während Laminar-Flow Schränke Schlag Luft durch einen Filter und Vermeidung von Kontamination der Proben durch Staub oder biologische Materialien heraus.
Dieses Video wird veranschaulichen wie Rauch Hauben und Laminar-Flow Schränke arbeiten, wie man sie benutzt und Wartung.
Rauch Hauben und Laminar-Flow-Schränke mit laminarer Luftströmung, eine Strömung, die in parallelen Stromlinien, verläuft die nicht kreuzen betrieben. Laminar-Flow, im Gegensatz zur turbulenten Strömung verhindert Querkontamination zwischen Proben durch Objekte entfernen gefährliche Partikel umströmenden.
Rauch Hauben haben drei Hauptteile: die Eröffnung Gesicht mit einer Schärpe, den Arbeitsbereich und den Auspuff. Der Lüfter im Abgas saugt Luft durch die Öffnung Gesicht, über den Arbeitsbereich, und durch den Auspuff. Diese Strömung zieht wiederum Dämpfe und Partikel aus dem Abgas und vom Labor.
In der richtigen Höhe des Flügels beschränkt die Größe der Öffnung, die wiederum einen hohen Luftstrom unterhält. Dieses high-Flow ist notwendig, um das Entweichen von Rauch zu verhindern.
Mittlerweile gibt es zwei Arten von Laminar-Flow-Schränke, horizontale und vertikale. In beiden Fällen Luft ist gezeichnet durch eine Aufnahme und reinigenden Filter wo es kleine Partikel wie Staub und Bakterien entfernt.
A horizontale Kabinett leitet Luft horizontal durch den Arbeitsbereich. Diese Art von Schrank vermindert Verunreinigung durch Hände und Handschuhe, wie sie stromabwärts der Proben sind. Jedoch die Airstream brennt direkt auf die Benutzer durch, und große Objekte können den Fluss behindern.
In einer vertikalen Ablage die Luft richtet sich von oben auf den Arbeitsbereich dann vorbei an einer Schärpe. Da diese Art der Strömung direkt die Fläche des Arbeitsbereichs Materialien kommt, hilft es um Cross-Kontamination zu verhindern. Jedoch die Schärpe kann Handbewegung beschränken und der Luftstrom ist unruhiger als in einem horizontalen Schrank.
Nun, wir zeigen Ihnen wie diese Arbeitsbereiche in einem Labor Einstellung verwenden und grundlegende Wartung.
mit einem Abzug sicher, immer tragen geeigneten persönlichen Schutzausrüstung. Die Schärpe nur für die angegebene maximale sichere Arbeitshöhe Sicherstellung ausreichenden Luftstrom durch die Haube aufrichten.
Zur Vermeidung der Exposition zu schädlichen Dämpfe oder Partikel, mit nur Ihre Arme im Inneren der Haube arbeiten, und lassen Sie niemals Ihren Kopf, den Arbeitsbereich zu geben. Auch, um sicherzustellen, dass die Geschwindigkeit in der Haube ausreicht, den Arbeitsbereich übersichtlich zu halten, und verschieben Sie alle Elemente mindestens sechs Zoll weg vom Gesicht Kapuze.
Wenn Sie fertig sind Arbeiten in der Haube, alle Materialien herausnehmen. Speichern Sie keine Chemikalien in der Haube, sondern in einem dedizierten Speicherort wie ein Schrank entzündliche Stoffe. Zu guter Letzt schließen des Flügels zur Gewährleistung sichereren Laborumgebung und Energieverbrauch zu reduzieren.
Regelmäßige Wartung durch das Testen Alarme und Strömungsgeschwindigkeit an der maximalen Flügelhöhe.
Wenn die Geschwindigkeit niedrig ist, senken des Flügels bis es mit der erforderlichen Geschwindigkeit ist. Wenn die Schärpe zu niedrig für die Arbeit an der Haube erfolgen wird, Betrieb einstellen, bis die Wurzel des Problems gerichtet ist.
Laminar-Flow Schränke sind weit verbreitet in Orten, wo Verschmutzung ein Anliegen, wie ein Biologie-Labor, so Sie von sich selbst und Labor Verunreinigungen vorsichtig sein müssen. Um Verunreinigungen zu vermeiden, verwenden Sie Ethanol, um Handschuhe und alle Geräte vor der Verwendung des Schranks oder das Öffnen des Flügels zu sterilisieren.
Stellen sicher, dass der Flügel nicht über die maximal zulässige Höhe, um eine ausreichende Luftzirkulation zu gewährleisten. Halten Sie das Gehäuse frei von Unordnung, und sicherstellen Sie, dass Objekte mindestens 6 Zoll von der Kante platziert werden, denn das ist das Gebiet am ehesten durch Labor Luft verunreinigt werden. Außerdem legen Sie Gegenstände nicht in Gefahr der Kreuzkontamination flussabwärts von einander.
Wenn Sie fertig sind, entfernen Sie alle Elemente aus dem Arbeitsbereich zu verhindern, dass Unordnung und Schließen des Flügels um Verunreinigungen zu verhindern. Dann, wenn der Schrank mit einem UV-C Licht ausgestattet ist, einschalten, um den Arbeitsbereich zu desinfizieren.
Führen Sie regelmäßige Wartung auf die laminare Strömung Kabinett. Überprüfen Sie auf Lecks durch die Beschichtung sensible Bereiche wie die Schärpe Kanten mit einer Seifenlösung, die am Ort der Flucht Luft Blase wird.
Sie haben beobachtete, wie Jupiters Einführung in die Hauben und Laminar-Flow Schränke Rauch. Sie sollten jetzt verstehen wie sie funktionieren, wie man sie benutzt und wie um Wartungsarbeiten durchzuführen. Vielen Dank für das Ansehen von!
Ergebnisse
Die transuroepithelial Neutrophilenmigration Assay ermöglicht die quantitative Erfassung des menschlichen PMN Migration in kultivierten Blase Epithelzellschichten in Reaktion auf verschiedene Stimuli (1B). Während das Protokoll ist einfach, gibt es eine Reihe von Variablen, die PMN Migration beeinflussen können und damit die Reproduzierbarkeit der Ergebnisse hervorrufen. Es sollten Maßnahmen ergriffen, während der Vorbereitung der durchlässigen Träger und die PMN an Variabilität zwischen technischen und biologischen Replikate zu reduzieren. Zum Beispiel unterstützt nur durchlässig, die ausreichend konfluenten 5637 Zellschichten in einem Versuch verwendet werden. Confluence der 5637 Zellen wird mit Hilfe eines funktionellen Assays, die Undurchlässigkeit Maßnahmen zur Flüssigkeit. Wenn Medium hinzugefügt, um den oberen Reservoir ins Gleichgewicht über den durchlässigen Träger, dann die 5637 Zellen sind nicht ausreichend, um die konfluenten Experiment durchzuführen. Wenn das Volumen in dem oberen Behälter aufrechterhalten wird,dann die durchlässige Träger kann verwendet werden, um PMN Migration zu beurteilen. Wir haben transepithelialen elektrische Widerstand in diesem System, das nach oben steigt bescheiden Zusammenfluss der Zellen gemessen, ob diese Methode gewählt wird, sollte darauf geachtet werden, dass die ansonsten sterile Setup verseuchen werden. Zusammenfluss von 5637 Zellen 7 Tage nach der Aussaat kann von mehreren Faktoren, einschließlich der Passage Anzahl der Zellen und die Anzahl der Zellen auf der durchlässigen Träger ausgesät beeinflusst werden. Darüber hinaus sollte die Menge an Zeit, die die 5637 Zellen auf dem durchlässigen Träger in der umgekehrten Position während der Aussaat inkubiert nicht größer als 16 h (Abb. 1A). Für eine optimale Reproduzierbarkeit, sollte das Protokoll genau beachtet werden. Schließlich unterstützt die permeable konfluenten 5637 Zellschichten in 1-2 Tagen verwendet werden, und die Membranen der Träger sollte niemals während entweder das Wachstum der Zellen 5637 oder während der transuroepithelial Neutrophilenmigration Assay berührt werden.
Zusätzlich zu den 5637-Zellen können auch Schwankungen in PMN Herstellung eingeführt werden. Mit dem Protokoll über den PMN isolieren detailliert, 1 ml von menschlichem Blut liefert typischerweise etwa 10 6 PMN, obwohl diese Zahl variiert von Individuum zu Individuum. Sobald die typische Ausbeute eines Individuums Spenderblut bekannt ist, kann die Isolation Protokoll skaliert werden oder entsprechend nach unten. PMN von ungesunden oder kranke Menschen sollten vermieden werden, und verschiedene PMN Spendern verwendet für die biologische Replikate, um sicherzustellen, dass die Ergebnisse reproduzierbar sind beobachtet werden. PMN sollte vorsichtig und steril behandelt werden, um die Aktivierung während der Isolierung zu vermeiden. Schließlich ist das Timing der experimentellen Verfahren entscheidend, wie PMN nicht für längere Zeit einmal aus dem Körper entfernt überleben. Wir nutzen PMN innerhalb 1 Stunde nach Beendigung der Isolation Verfahren. Angesichts dieser Überlegungen, mindestens 3 technische Replikate sind in jedem biologischen Replikat einbezogen werden.
Die Anzahl von PMN in dem unteren Reservoir nach 1 Stunde wird in 2 normalisiert auf 10 6 PMN-Eingang gezeigt. Alternativ können PMN Zahlen eines internen Kontrollsystems nach der Normalisierung werden zur Eingabe PMN, die Variation reduzieren kann zwischen biologischen Replikate verglichen. Einhaltung des Protokolls über mit Liebe zum Detail skizziert ermöglicht die Aufzählung der PMN Migration in Reaktion auf Reize wie Bakterien (2A) und Lockstoff Substanzen (Abbildung 2B).
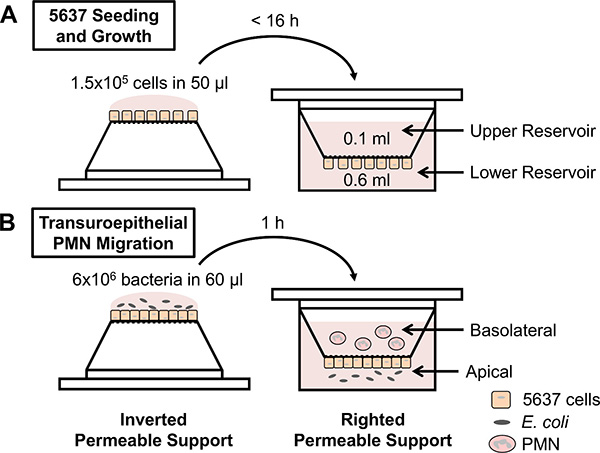
Abbildung 1. Schematische Darstellung der Versuchsanordnung. (A) 5637 Blase Epithelzellen auf invertierte durchlässigen Träger ausgesät werden die Träger in eine 24-Well-Platte aufgerichtet, und die Zellen werden bis zur Konfluenz gezüchtet. (B) Permeable supHäfen mit konfluenten 5637 Zellen werden invertiert und mit E. infiziert coli auf der apikalen Seite der Epithelzellen Schichten. Alternativ können Lockstoffe im unteren Reservoir platziert werden. Die durchlässigen Träger werden in einem low-Befestigungsplatte aufgerichtet und frisch isolierten menschlichen PMN sind in den oberen Stausee (als Vertreter der basolateralen Seite der epithelialen Schichten) aufgebracht. PMN über das Epithel einwandern und der aus dem unteren Reservoir unter Verwendung eines Hämozytometers gezählt.
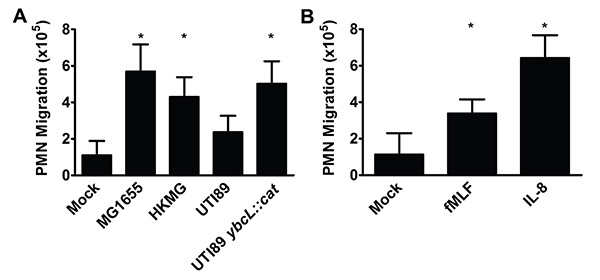
Abbildung 2. PMN über Blase wandern Epithelien als Reaktion auf verschiedene Reize. (A) Infektion mit pathogenen E. coli-Stamm MG1655, MG1655 wärmegetöteten (HKMG) oder UPEC Mutante UTI89 YbCl :: cat entlockt deutlich mehr PMN Migration als mock Infektion oder eine Infektion mit dem Wildtyp-Stamm UPEC UTI89, isolieren eine Blasenentzündung (*, P <0,001). (B) Die Zugabe von fMLF (100 nm) oder IL-8 (100 ng / ml) auf die untere Reservoir Ergebnisse in deutlich mehr PMN Migration als Mock Behandlung (*, P <0,001). Die Daten repräsentieren den Mittelwert und die Standardabweichung von mindestens 3 biologischen repliziert. Statistisch signifikante Unterschiede wurden mit einem ungepaarten Student-t-Test.
Diskussion
Rauch Hauben und Laminar-Flow-Schränke sind nützliche Werkzeuge im Labor um Schaden von gefährlichen Stoffen zu verhindern und eine sauber zu halten Arbeitsraum bei empfindliche Materialien Verwendung. Jedoch Rauch Hauben und Laminar-Flow-Schränke sind nur wirksam, wenn Sie richtig eingesetzt. Nach einfachen Bedienungsanleitung und die regelmäßige Wartung, Rauch Hauben und Laminar-Flow-Schränke können wirksame Instrumente im Labor werden.
Offenlegungen
Bekanntgabe
Danksagungen
Materialien
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Referenzen
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function. in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), 1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72. , 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 1 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. 176, 60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132 (Pt. 1, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. Chapter 13, Unit13.4. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. a. e. l. a. L., Monika Huss, ., Smith, J. e. n. n. i. f. e. r. C., Patrick Sharp, . . James O Marx, Cholawat Pacharinsak, Mouse Anesthesia: The Art and Science, ILAR Journal. 62, 1-2 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447 (2010).
- Matsumiya LC, ., Sorge RE, . Sotocinal SG, Tabaka JM, Wieskopf JS, Zaloum A, King OD, Mogil JS. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. 69, (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. 122, 54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. Chapter 10., Uni10.17. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Kyba Lowe, D. A., M, Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. , 55-81 (1989).
- Frimand, Z., Das Barman, ., Kjær, S., R, T., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. 190, 64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. Chapter. 8, 11-18 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten