Method Article
Eukaryotische Polyribosome Profile Analysis
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ein Protokoll für die Extraktion des Übersetzens Ribosomen aus eukaryotischen Zellen. Sobald extrahiert, Ribosomen in monosomes und Polyribosomen durch Saccharose-Gradienten Fraktionierung getrennt, um verschiedene ribosomale Populationen analysiert werden. Als solche ist diese Methode der Goldstandard für die Untersuchung der Regulation der Translation.
Zusammenfassung
Protein-Synthese ist ein komplexer zellulärer Prozess, der auf vielen Ebenen reguliert wird. Zum Beispiel kann global Übersetzung in der Anfangsphase oder die Dehnung Phase durch eine Vielzahl von zellulären Belastungen wie Aminosäure Hunger oder Wachstumsfaktorentzug gehemmt werden. Alternativ kann die Übersetzung der einzelnen mRNAs von mRNA Lokalisierung oder das Vorhandensein von verwandten microRNAs reguliert werden. Studien der Proteinsynthese häufig nutzen polyribosome Analyse, um Licht auf die Mechanismen der Übersetzung Regulierung oder Mängel bei der Proteinsynthese zu vergießen. In diesem Test werden mRNA / Ribosom-Komplexen aus eukaryotischen Zellen isoliert. Eine Saccharose-Dichtegradienten trennt mRNAs gebunden an mehrere Ribosomen als Polyribosomen von mRNAs gebunden an ein einzelnes Ribosom oder monosome bekannt. Die Fraktionierung des Gradienten erlaubt die Isolierung und Quantifizierung der verschiedenen ribosomalen Bevölkerung und die damit verbundenen mRNAs oder Proteine. Unterschiede im Verhältnis von Polyribosomen zu monosomes unter definierten Bedingungen kann ein Hinweis auf Mängel in entweder Übersetzung Einleitung oder Verlängerung / Kündigung. Die Untersuchung der mRNAs in der polyribosome Fraktionen können zeigen, ob die Kohorte der einzelnen mRNAs wird Änderungen mit experimentellen Bedingungen übersetzt. Darüber hinaus können Ribosom Montage durch eine Analyse der kleinen und großen ribosomalen Untereinheit Peaks, die auch durch den Gradienten getrennt überwacht werden. In diesem Video stellen wir eine Methode zur Herstellung von Roh-ribosomalen Extrakte aus Hefezellen, die Trennung des Extrakts durch Saccharose-Gradienten und Interpretation der Ergebnisse. Dieses Verfahren ist leicht an Säugetierzellen.
Protokoll
1. Vorbereitung von 7-47% Saccharose-Gradienten
- Bereiten Saccharosegradienten 1 Tag vor der Verwendung zu ermöglichen Gradienten zu werden kontinuierlich. Machen Sie sterile 7% und 47% Saccharose-haltigen Lösungen 50mM NH 4 Cl, 50 mM Tris-Acetat pH 7,0 und 12 mm MgCl 2 und lagern bei 4 ° C 1.
- Für 6 Gradienten-Mix von 7% und 47% Saccharose-Stammlösungen zu 48 mL von jeder der folgenden Saccharose-Konzentrationen zu machen. Add DTT (1M Lager) zu jedem Saccharose-Lösung auf eine Endkonzentration von 1 mM.
Endkonzentration 7% Saccharose 47% Saccharose 7% 48 ml 0 17% 36 ml 12 mL 27% 24 mL 24 mL 37% 12 mL 36 ml 47% 0 48 ml - Um den Gradienten zu gießen, legen einer Pasteurpipette zu einer 20 ml-Spritze durch die Sicherung und Abdichtung mit Parafilm oder verwenden Sie eine lange Nadel. 7 ml 7% Saccharose auf den Boden einer 1 x 3,5 "Polyallomer Ultrazentrifuge Röhre. Nächste 7 ml 17% Saccharose-Lösung unter der 7%-Lösung, indem der Pasteur Pipette in der Nähe Boden des Röhrchens und Pipettieren nicht schneller als 0,3 ml / sec. Repeat mit 7 ml jeweils 27%, 37% und 47% Saccharose-Lösungen. Sie sollten beobachten, klare Linien zwischen den Schichten, was darauf hinweist, dass minimale Durchmischung hat. Shop Gradienten bei 4 ° C über Nacht aufgetreten zusammen mit den Rotoren, Flaschen und Röhren, die verwendet werden, um Proben der Ernte werden.
2. Vorbereitung der Hefe-Extrakt
- Wachsen Sie 125 ml Hefekultur auf eine OD 600 von 0,8-1,0. Add Cycloheximid, um die Kultur zu einer Endkonzentration von 100 ug / mL und weiter unter Schütteln bei 30 ° C für 15 min.
- In der Zwischenzeit bereiten Lysepuffer mit 80 ug / ml Cycloheximid, 200 ug / mL Heparin, 0,2% DEPC und 10 mM Tris-HCl pH 7,5, 0,1 M NaCl, 30 mM MgCl 2. Halten Sie alles auf Eis von diesem Punkt an.
- Gießen Sie die Kultur in einen 250 mL Zentrifuge Flasche füllen und mit Eis. Zentrifuge bei 8.000 xg (7.250 rpm in einem SLA-1500 Rotor) für 5 min bei 4 ° C. Waschen des Pellets einmal mit 10 ml eiskaltem Lysepuffer und Transfer bis 15 mL Polypropylen-Röhrchen. Zentrifuge bei 5.900 xg (6.000 rpm in einem SLA-600TC Rotor) für 3 min bei 4 ° C. Das Pellet in 0,5 ml Lysepuffer, Transfer zum 1,5 ml Röhrchen mit 0,5 ml gekühlt, gebacken acid-washed Glasperlen. Vortex die Zellen für vier 30 Sekunden-Intervallen, die Kühlung der Röhre auf Eis für 30 sec zwischen den einzelnen Intervallen. Fügen Sie ein weiteres 0,5 ml Lysepuffer in das 1,5-ml-Tube. Zentrifuge bei maximaler Geschwindigkeit in einer Mikrozentrifuge (14.000 rpm in einer Eppendorf 5417R Mikrozentrifuge) für 10 min bei 4 ° C. Überstand in ein neues 1,5 ml Reaktionsgefäß. Entfernen 10 pl in ein separates Röhrchen auf die OD 260 / OD 280-Verhältnis (siehe Schritt 3.1) zu bestimmen. Shop-Extrakte bei -80 ° C.
3. Aufbereitung von Extrakten aus Säugerzellen
- Für adhärente Zellen, in 100 mm-Schale auf ~ 70% Konfluenz wachsen. Sie benötigen einen 100 mm Teller pro 11 ml Gradienten (typische Ausbeute ist ~ 20 OD 260 Einheiten). Skalieren Sie die Menge linear für größere oder kleinere Steigung Größen. Für Nicht-adhärente Zellen sind etwa 1 x 10 7 Zellen pro 11 ml Gradienten benötigt.
- Vor der Lyse, fügen Cycloheximid auf 100 pg / mL. Bei 37 ° C für 15 min. Transfer-Platten auf Eis und spülen Sie die Zellen zweimal in eiskaltem PBS. Alle künftigen Schritte müssen bei 0-4 ° C durchgeführt werden
- Entfernen Sie alle Spuren von PBS durch Aspiration (let Platten auf einer abgewinkelten Bett aus Eis drain) und 1 ml Lysepuffer, kratzen und Transfer zum vorgekühlte 1,5 ml Tube. Lysepuffer Komponenten müssen auf den jeweiligen Zelltyp und Wachstumsbedingungen optimiert werden. Ein guter Ausgangspunkt wäre Puffer 20 mM HEPES-KOH, pH 7,4, 15 mM MgCl 2, 200 mM KCl, 1% Triton X-100 (v / v), 100 ug / ml Cycloheximid, 2 mM DTT und 1 mg / mL Heparin. Die wichtigsten Variablen sind die Konzentrationen von Magnesium und Kalium-Chlorid sowie die Aufnahme oder Ausschluss von nicht-ionischen Detergenzien zur Gewinnung von Zytoskelett-oder Membran-gebundenen Polysomen zu verbessern. Lyse-Zellen, indem sie durch 27-Gauge-Kanüle zweimal oder um 5-10 Schläge Dounce Homogenisierung mit Typ-B-Pistill. Die Spritze oder Homogenisator sollte vorgekühlte vor dem Gebrauch.
- Spin bei 14.000 xg für 5 min in gekühlten Mikrozentrifugen. Transfer frischen Lysats auf die Saccharose-Gradienten (für Säugetierzellen ist dies bis in Lysepuffer fehlt Triton X-100 und Heparin gemacht, aber sonst wie in 1.2 und 1.3 beschrieben) oder Flash-Freeze in flüssigem Stickstoff für die spätere Verwendung.
4. Zentrifugation von Gradienten
- Thaw polyribosome Lysate auf Eis. Bestimmen Sie die Konzentration der Nukleinsäure in das Lysat, indem Sie die reservierten 10 ul Probe in 1 ml Wasser und dem Lesen der OD 260 / OD 280-Verhältnis mit einem Spektralphotometer. Typische Ausbeute aus einer Hefe gezüchtet wie beschrieben beträgt 50 OD-Einheiten.
- Mit einer Pipette mit der Spitze gegen die Wand der Röhre in der Nähe der Oberfläche des Gradienten, sanft Schicht 25 OD 260 Einheiten des Lysats auf der Oberseite des Gradienten gelegt. Für eine 35 ml Gradienten 500 pl Lysat wird in der Regel geladen. Lysepuffer verwendet, um sicherzustellen, alle Steigungen sind mit dem gleichen Volumen geladen werden. Geringere Mengen an Material liefern eine bessere Auflösung. Mit einer Pinzette vorsichtig niedriger die Gradienten in Eimern von einem Ausschwingrotor.
- Centrifuge die Gradienten bei 100.000 xg (23.000 rpm in einem Surespin 630 Rotor) für 4 h bei 4 ° C. Dieses Protokoll kann für kleinere Volumen Gradienten angepasst werden.
5. Sammlung von Daten und Fraktionen
- Etwa 30 min vor der Fertigstellung der 4 Std. Spin bringen Sie die Nadel, um das Modell 184 Schlauch Piercer. Befestigen Sie den Stift, um die Online-Isco Modell UA-5 Extinktion / Fluoreszenz-Monitor. Schalten Sie den Monitor Absorption, damit eine stabile Basislinie vor der Analyse von Proben erreicht werden. Elektronische Erfassung der Polysom Profil kann leicht durch die Anbringung eines DI-148U Datenerfassungseinheit (DATAQ Instruments), die Schreiber gewonnen werden. Profile können dann in Echtzeit gesammelt werden und für eine spätere Anmerkung mit dem mitgelieferten WinDaq Software.
- Füllen Sie die Spritze Pumpe mit 50 ml Fluorinert mit dem Rücklauf, schnelle Einstellung. Stellen Sie sicher, dass es keine Luftblasen vorhanden. Schließen Sie den Schlauch von der Spritze, um das Rohr Piercer und kurz auf den Fluss der Fluorinert wiederum bei 3 ml / min in Fahrtrichtung, um den Schlauch von Luftblasen klar.
- Legen Sie eine Verschwendung Becher oder eine Reihe von Röhren, wenn Sammeln von Fraktionen unter den Schlauch am Ende der Messzelle sammeln, um ablaufen.
- Entfernen Sie vorsichtig die Polyallomer Zentrifugenröhrchen mit der Saccharose-Gradienten von Zentrifugenrotor und legen sie auf Eis (Vorform der Brunnen in das Eis mit einem Leerrohr zu stören Steigungen zu vermeiden).
- Zur Analyse Zellextrakten, platzieren Sie den Gradienten Rohr auf dem Schlauch Piercer. Verbinden Sie das obere Ende des Rohres mit dem Auslass und sicher. Heben Sie den untersten Stufe der Zentrifugenröhrchen, so dass die Nadel den Boden des Röhrchens. Sobald die Nadel durch den unteren Rand des Zentrifugenröhrchen ragte hat, beginnen den Fluss der Fluorinert in Vorwärtsrichtung bei 6mL/min.
- Sobald die Fluorinert wieder fließt in die Röhre, überwachen die Bewegung der Nadel auf dem Online-Absorption zu überwachen. Sobald die Nadel zu bewegen beginnt, schalten Sie auf dem Chart Bewegung zu einer Geschwindigkeit Einstellung von 60 Jahren. Der Monitor zeichnet die OD 254, beginnend mit dem freien Material von 40S ribosomalen Untereinheit Erkennung und Weiterbildung bis hin zu polyribosome Komplexe gefolgt. Wenn Sie Sammeln von Fraktionen für die RNA-oder Protein-Analyse sind, werden typischerweise 0,2 min Fraktionen genommen (1 mL). Für die RNA-Analyse sollte Fraktionen direkt in Röhrchen mit Trizol (Invitrogen), Phenol oder SDS / Proteinase K gesammelt werden, abhängig von der bevorzugten Methode der Extraktion.
- Wenn das Ende des polyribosome Profil erreicht ist, schalten Sie den Strom von Fluorinert die Zentrifugenröhrchen und stoppen Sie die Tabelle Bewegung der Absorption / Fluoreszenz-Monitor.
- Ziehen Sie die Fluorinert aus dem Zentrifugenröhrchen in die Spritze von Anfang an die Strömung in umgekehrter Richtung mit einer schnellen Rate darf dabei nicht Saccharose aus der Röhre zu ziehen in die Spritze. Lösen Sie die Zentrifugenröhrchen aus der Tube Piercer, senken Sie die Nadel, und entfernen Sie das Rohr.
- Wiederholen Sie die Schritte 5.5 bis 5.8 für jede Sucrosegradienten.
- Wenn alle Saccharosegradienten analysiert wurden, einfahren Fluorinert aus dem Schlauch zurück in die Spritze. Nehmen Sie jedes Teil Fraktionator (Rohr Piercer und Durchflusszelle) einschließlich der Ablaufschlauch an der Spitze gelegen und sofort mit Wasser.
6. Repräsentative Ergebnisse
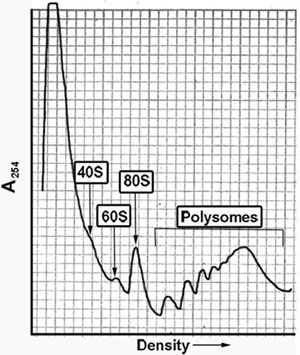
Abbildung 1. Representative Spur von Ribosomen Auszug aus Hefestamm BY4741 (Matte eine his3 Δ 1 leu2 Δ 0 met15 Δ 0 ura3 Δ 0) in Gegenwart von Cycloheximid vorbereitet. Die ribosomale Extrakt wurde fraktioniert unter Verwendung eines 7 47% Saccharose-Gradienten und analysiert mit Hilfe einer Pumpe Spritze Apparat an einem UV-Detektor. Peaks mit Polyribosome und 80S, 60S und 40S Ribosomen sind angegeben.
Diskussion
Die Informationen aus dem polyribosome Profil erhalten wertvolle Einblicke in die translatorische Status der Zelle liefern. Darüber hinaus kann der Status der Montage der ribosomalen Untereinheiten sich 2 bestimmt werden. Zum Beispiel das Vorhandensein von halfmers oder 80S und größere Peaks mit einer leichten Schulter nach rechts auf das Profil zeigt eine gebundene 40S-Untereinheit erwartet 60S-Untereinheit Beitritt. Durchführung des Experiments in das Fehlen jeglicher hinzugefügt Cycloheximid oder andere Hemmer der Dehnung erlaubt die Analyse der Geschwindigkeit der ablaufen, die, ob Dehnung 3 ist verändert zeigt. Die Fraktionen selbst sind eine reiche Quelle von Reagenzien für die anschließende Bestimmung der Assoziation eines spezifischen mRNA oder Protein mit ribosomalen Subpopulationen von Nord-oder Western-Blot der Fraktionen. Die Gesamtanzahl der mRNAs mit aktiven Ribosomen verbunden sind, können über eine zugehörige Microarray-4 oder tiefer Sequenzierung 5 ermittelt werden. Die Protein-Assoziationen können auch durch die entsprechende Zugabe einer Vernetzung Reagens 6 stabilisiert werden.
Polyribosome Analyse von Säugetierzellen ist auch erwähnenswert, als eine eigene Protokoll in Bezug auf die offensichtlichen Schwierigkeiten bei der Festlegung der Voraussetzungen für eine stabile Polysomen zu erhalten. Der Puffer-Systeme in der Literatur berichtet werden häufig variable 7-10, dadurch kann es zu einer Voraussetzung für die Zelltyp-spezifische Optimierung der Lyse-Puffer sein, oder es ist ebenso plausibel, dass die Puffer-System ist nicht so wichtig, wie viel Liebe zum Umgang mit frische Lysaten gehalten bei niedrigen Temperaturen. Nach unserem Kenntnisstand eine systematische Auswertung der Parameter, die von Säugetieren Polysom Bildung wurde nicht berichtet.
Offenlegungen
Danksagungen
Die Autoren bedanken sich bei John Woolford für die erste Grundlage dieser Methode erkennen, ist TGK von NIH GM057483 und AI076245 unterstützt und PRC wird von GM77073 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| polyallomer ultracentrifuge tube | Beckman Coulter Inc. | 326823 | 1 x 3.5 in. (25x89mm) |
| Fluorinert | Sigma-Aldrich | F9755 | |
| Cycloheximde | Sigma-Aldrich | C-7698 | |
| Heparin | Sigma-Aldrich | H3393 | |
| BY4741 | Open Biosystems | YSC1048 | Other strains work equally well |
Referenzen
- Baim, S. B., Pietras, D. F., Eustice, D. C., Sherman, F. A mutation allowing an mRNA secondary structure diminishes translation of Saccharomyces cerevisiae iso-1-cytochrome C. Mol. Cell. Biol. 5, 1839-1846 (1985).
- Ripmaster, T. L., Vaughn, G. P., Woolford, J. L. DRS1 to DRS7, novel genes required for ribosome assembly and function in Saccharomyces cerevisiae. Mol. Cell. Biol. 13, 7901-7912 (1993).
- Anand, M., Chakraburtty, K., Marton, M. J., Hinnebusch, A. G., Kinzy, T. G. Functional interactions between yeast translation eukaryotic elongation factor (eEF) 1A and eEF3. J Biol Chem. 278, 6985-6991 (2003).
- Serikawa, K. A. The transcriptome and its translation during recovery from cell cycle arrest in Saccharomyces cerevisiae. Mol Cell Proteomics. 2, 191-204 (2003).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324, 218-223 (2009).
- Valasek, L., Szamecz, B., Hinnebusch, A. G., Nielsen, K. H. In vivo stabilization of preinitiation complexes by formaldehyde cross-linking. Methods Enzymol. 429, 163-183 (2007).
- Fletcher, J. E., Copeland, P. R., Driscoll, D. M. Polysome distribution of phospholipid hydroperoxide glutathione peroxidase mRNA: evidence for a block in elongation at the UGA/selenocysteine codon. Rna. 6, 1573-1584 (2000).
- Ruan, H. J., Brown, C. Y., Morris, D. R., Richter, J. D. . Analysis of mRNA formation and function. , 305-321 (1997).
- Martin, G. W., Berry, M. J. Selenocysteine codons decrease polysome association on endogenous selenoprotein mRNAs. Genes Cells. 6, 121-129 (2001).
- Lee, Y. Y., Cevallos, R. C., Jan, E. An upstream open reading frame regulates translation of GADD34 during cellular stresses that induce eIF2alpha phosphorylation. J Biol Chem. 284, 6661-6673 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten