Method Article
Analyse großer Proteinkomplexe von Structural-Massenspektrometrie
In diesem Artikel
Zusammenfassung
Die Massenspektrometrie hat sich als wertvolles Tool für die Analyse großer Proteinkomplexe werden. Diese Methode ermöglicht Einblicke in die Zusammensetzung, Stöchiometrie und Gesamtarchitektur des Multi-Untereinheit Baugruppen. Hier beschreiben wir, Schritt-für-Schritt, wie man ein strukturelles Massenspektrometrie-Analyse durchzuführen, und Charakterisierung makromolekularen Strukturen.
Zusammenfassung
Lebende Zellen steuern und regeln ihre biologische Prozesse durch die koordinierte Aktion von einer großen Anzahl von Proteinen, die sich versammeln in ein Array von dynamischen, multi-Protein-Komplexe 1. Um ein mechanistische Verständnis der verschiedenen zellulären Prozessen, ist es wichtig, die Struktur eines solchen Protein-Komplexe zu bestimmen, und zeigen, wie ihre strukturelle Organisation ihre Funktion bestimmt. Viele Aspekte der Multi-Protein-Komplexe sind jedoch schwer zu charakterisieren, die aufgrund ihrer heterogenen Natur, asymmetrische Struktur und Dynamik. Daher sind neue Ansätze für die Erforschung der tertiären Protein Organisation erforderlich.
Einer der aufstrebenden Strukturbiologie Werkzeuge zur Analyse von makromolekularen Komplexen ist die Massenspektrometrie (MS) 2-5. Diese Methode liefert Informationen über die komplexen Protein-Zusammensetzung, Untereinheit Stöchiometrie und strukturelle Topologie. Die Macht der MS ergibt sich aus seiner hohen Empfindlichkeit und, als Folge, geringe Probenvolumina nötig, die Untersuchung von Protein-Komplexen an endogenen Ebenen zum Ausdruck ermöglicht. Ein weiterer Vorteil ist die Geschwindigkeit der Analyse, die Überwachung von Reaktionen ermöglicht in Echtzeit. Darüber hinaus kann die Technik die gleichzeitige Messung der Eigenschaften der getrennten Populationen koexistierenden in einer Mischung.
Hier beschreiben wir ein detailliertes Protokoll für die Anwendung von Struktur-MS zur Analyse von großen Protein-Baugruppen. Das Verfahren beginnt mit der Herstellung von Gold-beschichteten Kapillaren für nanoflow Elektrospray-Ionisation (NESI). Es fährt dann mit Probenvorbereitung, betont die Puffer-Bedingungen, die kompatibel sein NESI auf der einen Seite sollte und damit zu Komplexen intakt auf der anderen Seite zu halten. Wir haben dann zu erklären, Schritt-für-Schritt, wie man die experimentellen Bedingungen für die hohe Masse Messungen zu optimieren und zu erwerben MS und Tandem-MS-Spektren. Schließlich, ein Diagramm wir die Datenverarbeitung und-analysen, die folgen. Statt zu versuchen, jeden Aspekt des Protein-Baugruppen zu charakterisieren, stellt dieses Protokoll grundlegende MS-Verfahren, wodurch die Leistung der MS und MS / MS-Experimente auf nichtkovalente Komplexe. Insgesamt ist es unser Ziel, den Forschern auf dem Gebiet der strukturellen MS unbekannt, mit der Kenntnis der wichtigsten experimentellen Werkzeuge bieten.
Protokoll
Teil 1: Herstellung von Gold-beschichteten Kapillaren für nanoflow Elektrosprayionisation
Die Analyse der nicht-kovalenten Komplexen ist in der Regel durch nanoflow Elektrospray-Ionisation (NESI) 6 durchgeführt, unter Verwendung von Glas-oder Quarz-Kapillaren, die zu einer feinen Spitze (~ 1 um Innendurchmesser) und beschichtet mit leitfähigem Material gezogen wurden (meist Gold) . Solche Kapillaren sind aus kommerziellen Quellen erhältlich (New Objective oder Proxeon) ready-to-use, aber es kann kostengünstiger, sie im eigenen Haus vorbereitet:
- Stick zwei Streifen eines doppelseitigen Klebe-Pad auf der Unterseite einer Petrischale, 2 cm voneinander entfernt. Legen Sie einen Glasstab (8 cm x 5 mm) in der Mitte eines der Pads. Die Klebe-Pad wird die Kapillaren in Position zu halten, und der Glasstab wird die vorbereitete Kapillaren zu unterstützen, und halten die Spitzen zu brechen (Abb. 1).
- Verwenden Sie Borosilikatglas Kapillaren, 1,0 mm OD x 0,78 mm ID (wir verwenden Packungen von 500 dünnwandigen Kapillaren aus Borosilikatglas Warner Instruments, cat. Nr. G100TF-4). Stecken Sie ein in die Nadel Abzieher (wir benutzen Modell P-97 aus der Sutter Instrument Co.) Kapillare. Klemmen Sie die Kapillare vorsichtig in Kraft, und stellen Sie ihre Position so, dass es in der Mitte der Nadel puller ist Heizdraht liegt. Ziehen Sie die Klemmen vorsichtig, bis die Kapillare gehalten Firma an beiden Enden.
- Ziehen Sie die Kapillare mit einem vorgegebenen Programm. Jede Kapillare gezogen wird zu zwei letzten, geformt Kapillaren geben. Der Prozess der Programmierung der Abzieher ist eine Trial-and-error, bis eine akzeptable Form der Spitze erreicht ist. Wir verwenden das folgende Programm:
Schritt Wärme Ziehen Vell Zeit 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Entfernen Sie die gezogen Kapillaren aus dem Gerät und überprüfen Sie die Tipps, verwirft alle, die verformt oder gebrochen sind. Verwenden Sie stumpfen Pinzette (wir verwenden Bestückungspinzetten von CK Precision), um die Kapillaren in der Petrischale Platz. Die Basis der Kapillare sollte der Klebestreifen befestigt werden und der obere Teil sollte auf dem Glasstab schlank, mit der Spitze nach oben zeigt.
- Sobald der Petrischale voll ist (etwa 80 Kapillaren passen in einen 10 cm-Durchmesser Teller), legen Sie die Platte in die Gold-Sputter-Coater (wir benutzen Modell-Nr. EMS550 von EMS). Stellen Sie sicher, dass die Gaszufuhr nach den Anweisungen des Herstellers gewählt wird, und aktivieren Sie eine vordefinierte Beschichtung Zyklus (wir verwenden Argon Druck 4 bar, bei einem Vakuum von 5 x 10 -2 mbar, einen Strom von 45mA und einer Beschichtung Zeit 1 min, für 3-6 Zyklen, bis die Kapillaren sind gleichmäßig golden).
Teil 2: Probenvorbereitung
- Low mikromolaren Konzentrationen der Probe erforderlich sind (1 bis 20 uM). Wenn nötig, konzentrieren die Probe mittels Zentrifugalkraft Ultrafiltration Geräte (z. B. Vivaspin von Sartorius oder Nanosep von Pall Corporation). Es wird empfohlen, dass Sie die Adsorption der Protein-Komplex zu überprüfen, um das Gerät Membran, vor dem Gebrauch.
- Oft sind die Aufreinigung Puffer oder Storage-Lösungen der Protein-Komplex nicht kompatibel mit NESI, für die nur flüchtige Lösungen verwendet werden können. Daher ist Pufferaustausch notwendig. Dieser entscheidende Schritt, in dem alle Spuren von Salzen, Puffer-Moleküle oder andere nicht-flüchtigen Addukte wie Glycerin, DTT oder EDTA entfernt werden, bestimmt die Qualität der Spektren. Normalerweise ist wässriger Ammoniumacetat-Lösung verwendet, bei einer Konzentration von zwischen 5 mm und 1 m, und bei 6-8 pH-Wert. Buffer Austausch kann mit einer Mikrozentrifuge Gelfiltrationssäule (zB Micro Bio-Spin 6 Chromatographiesäulen von Bio-Rad) werden. Dieser Schritt kann 1-3 mal mit minimaler Verdünnung (weniger als einen Faktor von 1,3 pro Gerät 5) wiederholt werden, bis maximal Austausch erreicht. Wenn beide Konzentration und Puffer Austausch erforderlich sind, kann diese zusammen durchgeführt werden, wobei Zentrifugalkraft Ultrafiltration (e, g, Vivaspin von Sartorius oder Nanosep von Pall Corporation).
Teil 3: Kalibrierung des Massenspektrometers für hohe Masse-Messungen
Die meisten der Experimente auf Multi-Protein-Komplexen durchgeführt werden unter Verwendung eines Nano-Elektrospray-Quadrupol-Time-of-flight (Q-TOF)-Instrument. Es wird empfohlen, dass Sie ein Quadrupolmassenfilter angepasst werden, um tiefe Frequenzen zu verwenden, um die Übertragung und die Masse Analyse von Ionen mit hoher m / z-Werte 7,8 zu ermöglichen. Es istauch empfohlen, dass Gaseinlässe 7,8 oder Hülsen 9, das Instrument in der ersten Ionenleitsystems hinzugefügt werden, um den Druck steuern bei der ersten Vakuum-Phase zu ermöglichen. Letzteres ermöglicht eine Optimierung des Getriebes, und Desolvatation von sehr großen Ionen 7-9. Derzeit sind kommerzielle ESI-TOF-und Q-ToF Instrumenten verschiedener Hersteller (z. B. Wasser, SCIEX, Bruker, oder Agilent), die relativ leicht und kostengünstig angepasst werden können, für die native MS-Anwendungen 7,8 zur Verfügung. Es ist jedoch möglich, Standard-ToF oder QTof Konfigurationen auf Instrumente wie die LCT oder QToF1 (Waters) verwenden, um Massenspektren der Komplexe bis zu 1 MDa zu erwerben, ohne die Notwendigkeit für Änderungen an der Hardware 5.
Das Protokoll unten beschrieben wurde auf einem SYNAPT Instrument (Waters) durchgeführt.
- Es werden 100 mg / ml Lösung von CsI in gereinigtem Wasser. CsI ist für hohe Masse Kalibrierung als einfach geladene Salz-Clustern (CsI) n Cs verwendet + erstrecken sich über einen weiten Massenbereich von 393 m / z auf deutlich über 10.000 (Abb. 2).
- Mit stumpfen Pinzette, einen beschichteten Kapillare aus der Petrischale und laden 2μL der CsI-Lösung in die Kapillare mit Hilfe eines Eppendorf GELoader Spitze.
- Legen Sie die Kapillare in die Kapillarenhalter, und passen Sie die Kapillare in der Weise, dass die Spitze etwa 10 mm vom Rand entfernt von der Halterung befindet.
- Schieben Sie die Lösung auf die Spitze der Kapillare entweder manuell oder mittels eines Spin-Down-Adapter.
- Legen Sie die Kapillare unter einem optischen Mikroskop und schneiden Sie die Spitze, mit der scharfen AA-Pinzette.
- Schließen Sie das Kapillarenhalter die nanoflow ES-Schnittstelle. Drehen Sie die XYZ-Bühne zurück, um eine Beschädigung der Kapillare und drücken Sie die Bühne in ihrer aktivierten Position. Die Kapillare sollte 1 platziert werden - 10 mm aus dem Konus Öffnung.
- Bewerben Kapillar-Spannung (1050-1400 V) und geringer nanoflow Druck (0,00 bis 0,03 bar) bis spray eingeleitet wird, dann versuchen, die nanoflow Druck auf minimale Werte reduzieren.
- Optimieren Sie die Signalintensität durch Verstellen der Position der XYZ-Bühne, die kapillare Spannung, die nanoflow Druck, und der zugeführten Gases fließen.
- Zur Erkennung eines breiten Massenbereich von CsI Peakserie, sollte die beschleunigende Spannungen optimiert (wir verwenden die folgenden Parameter: Kapillare 1,3-1,7 kV, Probe Kegel 80-150V, Extraktion Kegel 1-3 V) werden.
- Zur Optimierung der Übertragung von hohen Masse-Ionen, die sanfte Desolvatation Bedingungen, die Unterstützung Druck in der ersten Vakuum-Phase, zwischen der Quelle und der Analysator erforderlich, angehoben werden sollten. Dies kann durch eine sorgfältige Reduktion der Leitfähigkeit von der Quelle Vakuumleitung die Scroll-Pumpe, durch teilweises Schließen Sie das Absperrventil (SpeediValve) erreicht werden. Um den optimalen Punkt zu definieren, sollte letzteres getan, während die Überwachung der Wirkung auf die Signalintensität (verwenden wir im allgemeinen 3,0-6,5 mBar) werden.
- Sammeln Sie ca. 30 Scans bei 1 Scan / sec, bei einem m / z Bereich zwischen 1.000 bis 15.000 m / z
- Nach dem Erwerb, kalibrieren Sie die TOF mit der entsprechenden Kalibrier-Tabelle.
Teil 4: MS-Analyse von intaktem Protein-Komplexen
- Legen Sie Ihre Probe, wie beschrieben (Teil 3, § § 2-5), und initiieren sprühen.
- Beginnen Sie mit der ersten Optimierung der Spray (Teil 3, § § 6-9), bis das Signal erkannt wird. Die genaue Position der Ladung Staaten Protein-abhängige, aber es kann vorhergesagt werden, mit der Beziehung zwischen Ionen-Masse und mittlere Ladezustand, also: (Z av) 10: Z av = 0,0778 √ (m), in denen m ist die Masse des Komplexes in Dalton. Um zu verhindern, komplexe Dissoziation, nicht Wärme der Ionenquelle: Entweder schalten die Heizung aus, oder halten Sie die Temperatur unter 40 ° C.
- Variieren Sie die Kapillare Position Probe Kegel und Extraktor Spannungen Ionentransmission zu maximieren, und überprüfen Sie die daraus resultierende Veränderung in den Spektren. 1 V; Kapillar-Spannung 1,5 kV: Abzug Kegel; Ein möglicher Ansatzpunkt könnte Konusspannung 100 V sein. Optimieren Sie diesen Parameter in Kombination mit dem nanoflow Druck.
- Zur Verbesserung Desolvatation und ausziehen Restwasser und Puffer-Komponenten, erhöhen Sie die Vorspannung und der Gasdruck in der Stoßzelle. Dieser Schritt sollte sorgfältig durchgeführt werden, Dissoziation des Komplexes zu verhindern. Typische Bias-Spannungen liegen im Bereich von 10-100 V, mit einer Falle Gasfluss von 1-10 ml / min (Abb. 3). Die manuelle Einstellung der HF-Umgebung und Quadrupol-Profil verbessern kann die Übertragung von hohen Masse-Ionen.
- Passen Sie Trap-und Transfer Kollisionsenergien. Oft sind höhere Spannungen für die Übertragung von hohen Masse-Ionen (in der Regel im Bereich von 10-30 V) erforderlich. An dieser Stelle ist es wichtig, Kollisions-induzierte Dissoziation des Komplexes zu vermeiden.
- Nach ein stabiles Signal wird reached, empfiehlt es sich, dass die nanoflow Druck und Kapillar-Spannung auf minimale Werte reduziert werden, bei stabiler Spray.
Teil 5: Tandem-Massenspektrometrie: distanziert Protein-Komplexe
- Sobald ein optimales und stabiles Signal erhalten worden ist, wählen Sie ein Vorläufer-Ion. Setzen Sie den Massenmittelpunkt und Isolation Breite (wir verwenden in der Regel eine LM Auflösung von 12 und eine HM Auflösung zwischen 13 und 15). Verwenden Sie einen weiten Massenbereich der hohen Masse / geringe Gebühr Dissoziation Produkte zu erkennen. Es wird empfohlen, dass Sie die m / z-Bereich eingerichtet, um die maximale Höhe, und dann reduzieren sie auf die gewünschten Werte. Wir empfehlen des weiteren die Überlagerung der MS und MS / MS-Spektren, um die Isolation des gewählten Precursor-Ionen zu validieren.
- Um MS / MS, distanzieren Vorläufer-Ionen durch die Erhöhung der Aufprallenergie (CE) und der Druck auf die Kollision Zelle. Erhöhen Sie entweder Trap-oder Transfer-CE allmählich in Schritten von 10-20V, und hebt sie die Kollision Gasdruck auf 0-5 ml / min (gemeinsame Werte). Überwachen von Änderungen in den Spektren, bis eine optimale Aktivierung Bedingungen erreicht sind. Hohe Aktivierungsenergie kann induzieren die Dissoziation von einem oder mehreren Untereinheiten von der intakten komplex, und klären die Interaktion Affinitäten der verschiedenen Untereinheiten. Wir verwenden in der Regel Argon als Stoßgas in der Trap-/ Transfer-Zellen, obwohl Vorteile der Verwendung einer schwereren Gas (z. B. Xe oder SF 6) berichtet worden, jedoch sind diese Gase wesentlich teurer 11 (Abb. 3).
- Es wird empfohlen, mehr als ein Ladezustand für MS / MS-Analyse ausgewählt werden. Im Fall von überlappenden Komponenten, wird den Erwerb einer Reihe von Tandem-MS-Spektren in Lösung die Ladung Reihe der verschiedenen Bevölkerungsgruppen zu unterstützen. Darüber hinaus werden höhere Ladezustände leichter distanzieren, im Vergleich zu niedrigeren Ladungszustand 12.
- Neben der Charakterisierung der intakten Komplex, wird vorgeschlagen, dass kleinere Subkomplexe in Lösung generiert werden, unter milden denaturierenden Bedingungen. Die MS-und MS / MS-Analysen von Subkomplexe bilden die Grundlage für die Definition der Untereinheit Architektur des Komplexes 13. Für partielle Unterbrechung der Untereinheit-Untereinheit Interaktionen, allmählich fügen organischen Lösungsmitteln (zB Methanol, Isopropanol oder Acetonitril) bis zu einer Konzentration von 50%, oder ändern Sie den pH-Wert der Lösung durch Zugabe von Ammoniak oder Ameisensäure (bis zu einer Konzentration von 4 %).
- Zur Bestimmung der Massen der einzelnen Untereinheiten, dass der Komplex bilden, ist es wichtig, ein Spektrum unter denaturierenden Bedingungen zu erwerben. Dies kann durchgeführt werden Zip-Tip C 4 (Millipore) mit einer 25:75 Wasser / Acetonitril-Verhältnis, mit 1% Ameisensäure als Elutionsmittel.
Teil 6: Datenverarbeitung und-analyse
- Die Daten werden analysiert offline, mit einer spektralen Analyse-Programme für MS-Spektren. Wir benutzen normalerweise die MassLynx Programm (Waters).
- Für Spektren, die eine breite m / z-Bereich umfassen, empfehlen wir, dass unterschiedliche Regelungen zur Glättung und Schwerpunkt-Parameter für den hohen und niedrigen m / z Regionen angewendet werden, um den Unterschied in Peak-Auflösung dieser Regionen Rechnung zu tragen.
- So identifizieren Sie kostenlos Serie und berechnen Ladungszustände und Massen "zu finden Handbuch" die Funktion des MassLynx angewendet werden können. In Fällen von komplexen Massenspektren mit überlappenden Komponenten, kann die manuelle Berechnung der Massen einfacher sein.
- Zur Erleichterung dieser Aufgabe werden, könnten sich zusätzliche Software verwendet werden, zum Beispiel: MaxEnt für Peakentfaltung 14. SOMMS für Peak Fitting und Simulation 15 und SUMMIT für die Zuordnung der Zusammensetzung und Stöchiometrie von Protein Subkomplexe und Erzeugung Protein-Interaktion Netze 13,16,17 .
Teil 7: Repräsentative Ergebnisse

Abbildung 1. Vorbereitung gold-beschichteten Nano-Elektrospray Kapillaren.
A. Befestigen Sie zwei doppelseitigen Klebestreifen auf einer Petrischale, 2 cm voneinander entfernt. Zur Unterstützung der vorbereiteten Kapillaren, statt einem Glasstab (8 cm x 5 mm) in der Mitte eines der Pads. B. Kleben Sie das stumpfe Ende des vorbereiteten Kapillaren der Klebepad, und lehnen die Spitze auf dem Glasstab. C. Nach der Petrischale wird mit dem vorbereiteten Kapillaren, überziehen sie mit Gold gefüllt, bis eine dünne Schicht aus Gold gleichmäßig auf der äußeren Oberfläche der Kapillaren abgelagert.
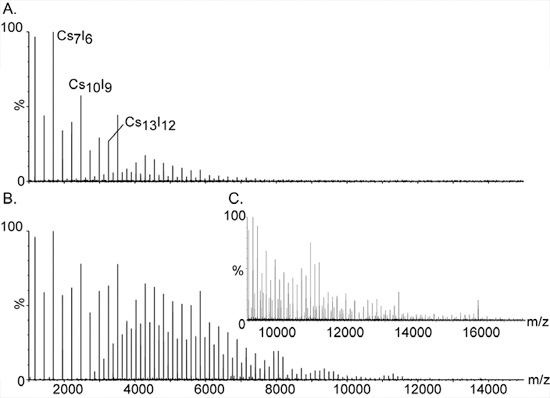
Abbildung 2. Hochamt Kalibrierung mit Cäsium-Jodid-Ionen.
Die großen und monisotopic Cluster von CsI haben es die Verbindung der Wahl für die Kalibrierung von Massenspektrometern für hohe Masse Analyse. Die Reihe der gleichen Abständen Gipfel über einen weiten Bereich erstrecken, von m / z 393 bis weit über 10.000. Sie sind Assigned zu einfach Salz-Cluster der allgemeinen Zusammensetzung (CsI) n Cs + berechnet. Zusätzliche Signale zwischen den großen Gipfeln werden durch Doppel-und Dreifach-geladenen Spezies der Serie entstanden sind; [(CsI) n Cs2] 2 + und [(CsI) n Cs3] 3 +, jeweils. Erhöhung des Drucks in der ersten Vakuum-Phase ist die Voraussetzung zur Erkennung der hohen Masse Cluster. Die Wirkung des Drucks auf die hohe Masse Gipfel wird in Panels A nachgewiesen. und B. mit Druck readbacks von 1,2 und 5,3 bzw.. C. Expansion des Massenspektrums bei B dargestellt.
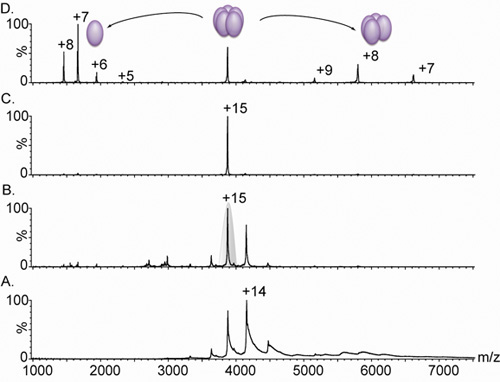
Abbildung 3. Nanoflow Elektrospray-Massenspektren einer pentameren Lektin.
A. Die Massenspektrometrie eines Lektin-Variante komplexe (abgeleitet von lib1-B7 durch gerichtete Evolution 18) führt zu einem Ladezustand Verteilungen zwischen 3.000 und 5.000 m / z, jedoch aufgrund unzureichender Desolvatation der Ionen, sind die Spitzen breit. Vergleich von Panel A. und B. zeigen die Wirkung der Erhöhung der Bias-Spannung von 4V (A). Bis 15V (B.) Auf die Peakbreite. Dieser Anstieg der beschleunigenden Bedingungen wird das Strippen von Restwasser und Puffer-Komponenten, was zu einem hochaufgelösten Spektrum. Die gemessene Masse (60.240 ± 38 Da) entspricht einer pentameren komplex. C. die +15 Ladezustand damals für Tandem-MS-Analyse (grau schattiert in Panel B). D ausgewählt. Die Erhöhung der Stoßenergie verursacht die Freisetzung eines hoch geladenen Monomer, bei 1.664 m / z zentriert, und eine abgespeckte tetrameren Komplex, in dem Bereich von 5.000 - 8.000 m / z Alle Spektren wurden von einer Probe mit 20 uM Lösung in 0,5 M Ammoniumacetat erhalten.
Diskussion
Zum Erwerb hochwertiger Spektren Augenmerk sollte auf die Probenvorbereitung, die Konzentration der Probe und Puffer Austausch beinhalten gegeben werden. In verdünnten Proben ergeben ein Low-Signal, während hochkonzentrierte Proben kann ziemlich zähflüssig, und blockieren die Elektrospray Nadel. Darüber hinaus Lösung Additive wie Salze, Glycerin, Wasch-, Metall-Ionen und Reduktionsmittel (DTT oder β-Mercaptoethanol), neigen dazu, an der äußeren Oberfläche der Proteine haften und verursachen Verbreiterung der Peaks. Deshalb, um gut aufgelöste Peaks zu erreichen, sollten diese Komponenten auf dem niedrigsten Konzentrationen möglich aufgenommen werden.
Ein weiterer wichtiger Parameter ist die Position des nanoflow Kapillare, bezogen auf das Massenspektrometer Öffnung. Das Finden der "sweet spot" könnte eine Herausforderung sein für unerfahrene Benutzer, trotzdem sie beeinflusst maßgeblich die Qualität der Spektren. Es ist auch wichtig zu untersuchen, die nanoflow vor Beginn der Spraykapillare. Die Tröpfchengröße ist eine Funktion der Spitze Durchmesser, die ~ 1 &mgr; werden soll. Kleine Tröpfchen für effizientere Ionisation führen und wäre daher von Vorteil sein. Es ist auch wichtig, um zu überprüfen, dass es keine Luftblasen in der Kapillare, die den Fluss versperren könnte, und dass die Gold-Beschichtung ist nicht aus der Kapillare während der Akquisition entkleidet und wenn ja, weiter schneiden Sie die Spitze. Beachten Sie, dass eine übermäßige Menge an Probe wird die Möglichkeit der Optimierung MS-Bedingungen wie die Kapillare Spannung, beschleunigenden Spannungen, Druck und Aufprallenergie zu erhöhen.
Insgesamt haben sich die Verfahren in das Protokoll erklärt worden, um die Zusammensetzung, Stöchiometrie und Architektur der zahlreichen Protein-Komplexe (siehe Bewertungen 2,3,4) zu bestimmen. Analyse großer MDa Komplexe wie das Ribosom 19 und hochgeordnete Viruskapside 20-22, in der Definition Substratbindung zu molekularen Maschinen 23-25, oder die Charakterisierung der Untereinheit Interaktion Netzwerke 26,17,16,17,27,28 dienen als aber ein paar Beispiele für den Mehrwert dieses Ansatzes.
Offenlegungen
Danksagungen
Die Autoren danken der Sharon Gruppenmitglieder für die kritische Durchsicht und für ihre Beiträge zu dem Manuskript. Wir sind dankbar für die Unterstützung der Morasha und Bikura Programme, die Israel Science Foundation (Grant Nr. 1823-1807 und 378/08), das Josef Cohn Minerva Center for Biomembrane Research, die Chais Familie Fellows Program für New Scientists, die Abraham und Sonia Rochlin Stiftung, die Familie Wolfson Charitable Trust, die Helen und Milton A. Kimmelman Zentrums für Biomolekulare Struktur und Montage; dem Nachlass von Shlomo und Sabine Beirzwinsky; Meil de Botton Aynsley, und Karen Siem, UK. Wir danken Dan Tawfik und Itamar Yadid, dass er uns das Lektin Variante Probe.
Materialien
Anforderungen an die Probe:
| Probe | Anforderung | Kommentare |
| Volumen | 1-2 ul | Per Kapillare |
| Konzentration | 1-20 um | Per komplexen |
| Puffer | Aquanos flüchtigen Puffer wie Ammoniumacetat bei pH = 6 bis 8 | In der Regel 5 mM-1M |
| Reinigungsmittel | Minimal | Cluster von Wasch-Moleküle produzieren breite und Hauptpeaks |
| Glycerol | Minimal (bis zu 5%) | Haftet unspezifisch an Proteine und damit sind breite Peaks beobachtet |
| Organische Lösungsmittel | Bis zu 50% | Might Proteine denaturieren Komplexe |
| Acids | Bis zu 4% | Denaturieren Protein-Komplexe |
| Salze | Minimal | Salzaddukte um eine breite und offene Gipfel führen |
| DTT | Minimal | 1-2 um vorhanden sein können |
| Chelatbildner | Minimal | Über 250 um umfangreiche Adduktbildung führen |
Referenzen
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, dela, J, Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. vander Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten