Method Article
Analizzando complessi proteici mediante spettrometria di massa di grandi dimensioni strutturali
In questo articolo
Riepilogo
Spettrometria di massa ha dimostrato di essere uno strumento prezioso per l'analisi dei complessi proteici di grandi dimensioni. Questo metodo consente intuizioni l'architettura composizione, stechiometria e in generale di multi-subunità assemblee. Qui, descriviamo, passo per passo, come effettuare una analisi strutturale spettrometria di massa, e caratterizzare le strutture macromolecolari.
Abstract
Cellule viventi controllare e regolare i loro processi biologici attraverso l'azione coordinata di un gran numero di proteine che si assemblano in un array di dinamica e multi-proteina complessi 1. Per ottenere una comprensione meccanicistica dei vari processi cellulari, è fondamentale per determinare la struttura di tali complessi proteici, e rivelano come la loro organizzazione strutturale impone la loro funzione. Molti aspetti della multi-proteina complessi, tuttavia, sono difficili da caratterizzare, a causa della loro natura eterogenea, la struttura asimmetrica e dinamica. Pertanto, sono necessari nuovi approcci per lo studio dei livelli di organizzazione terziaria delle proteine.
Uno degli strumenti emergenti biologia strutturale per l'analisi di complessi macromolecolari è la spettrometria di massa (MS) 2-5. Questo metodo fornisce informazioni sulla composizione proteica complessa, stechiometria subunità, e la topologia strutturale. Il potere del MS deriva dalla sua elevata sensibilità e, come, requisito campione conseguenza bassa, che consente l'esame di complessi proteici espressi a livelli endogeni. Un altro vantaggio è la velocità di analisi, che permette il monitoraggio delle reazioni in tempo reale. Inoltre, la tecnica può misurare contemporaneamente le caratteristiche di popolazioni separate che coesistono in una miscela.
Qui, descriviamo un protocollo dettagliato per l'applicazione della strutturali MS per l'analisi di assiemi di grandi dimensioni delle proteine. La procedura inizia con la preparazione di oro rivestite capillari per la ionizzazione elettrospray nanoflussi (NESI). Si prosegue poi con la preparazione del campione, sottolineando le condizioni di buffer che dovrebbe essere compatibile con NESI da un lato, e permettono di mantenere intatta complessi dall'altro. Abbiamo poi spiegare, passo per passo, come ottimizzare le condizioni sperimentali per misure di massa elevata e acquisire MS e MS tandem spettri. Infine, la tabella di elaborazione dati e le analisi che seguono. Piuttosto che tentare di caratterizzare ogni aspetto delle assemblee proteine, questo protocollo introduce le procedure di base di MS, che consente l'esecuzione di esperimenti MS e MS / MS di non covalenti complessi. Nel complesso, il nostro obiettivo è quello di fornire ai ricercatori che non conosce con il campo di MS strutturale, con conoscenza dei principali strumenti sperimentali.
Protocollo
Parte 1: Preparazione di oro rivestite capillari per la ionizzazione elettrospray nanoflussi
Analisi di complessi non covalenti è di solito eseguita per mezzo di ionizzazione elettrospray nanoflussi (NESI) 6, con vetro o quarzo capillari che sono stati tirati a punta fine (diametro ~ 1 micron interno), e rivestiti con materiale conduttivo (di solito oro) . Tali capillari sono disponibili pronti per l'uso-da fonti commerciali (Nuovo obiettivo o Proxeon), tuttavia, può essere più conveniente per prepararli in casa:
- Bastone due strisce di una doppia faccia pad adesivo al fondo di una capsula di Petri, 2 cm di distanza. Inserire una bacchetta di vetro (8 cm x 5 mm) al centro di una delle pastiglie. Il pad adesivo terrà i capillari in posizione, e la bacchetta di vetro sosterrà il preparato capillari, e tenere le punte di rottura (Fig. 1).
- Usa vetro borosilicato capillari, 1,0 mm x 0,78 mm di diametro (usiamo confezioni da 500 a pareti sottili capillari in borosilicato da Warner Instruments, cat. No. G100TF-4). Inserire una capillare nel estrattore ago (usiamo il modello P-97 dello strumento Sutter Co.). Bloccare il capillare dolcemente in posizione, e regolarne la posizione in modo che si trova nel centro del filamento di riscaldamento dell'ago di estrattore. Serrare i morsetti delicatamente, fino a quando il capillare è tenuto fermo alle due estremità.
- Tirare il capillare, utilizzando un programma predefinito. Ogni capillare tirato darà luogo a due finali, a forma di capillari. Il processo di programmazione l'estrattore è uno dei tentativi ed errori, fino a una forma accettabile punta si ottiene. Noi usiamo il seguente programma:
Passo Calore Tirare Vell Tempo 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Rimuovere la tirato capillari dallo strumento e controllare le punte, scartando quelle che vengono deformati o rotti. Usa smussato pinzette (usiamo pinzette di precisione di posizionamento da CK), al posto dei capillari nella scatola di Petri. La base del capillare deve essere allegata al pad adesivo e la parte superiore deve appoggiarsi la bacchetta di vetro, con la punta rivolta verso l'alto.
- Una volta che la capsula di Petri è pieno (circa 80 in forma capillari in un cm di diametro 10 piatto), inserire la piastra in oro sputter verniciatore (usiamo il modello no. EMS550, da EMS). Assicurarsi che il gas viene scelto in base alle istruzioni del produttore, e attivare un ciclo predefinito rivestimento (che usano la pressione Argon 4 PSI, ad una pressione di vuoto di 5 x 10 -2 mbar, una corrente di 45 mA, e un tempo di rivestimento di 1 min, per 3-6 cicli, fino a quando i capillari sono uniformemente dorate).
Parte 2: Preparazione dei campioni
- Micromolari basse concentrazioni di campione sono tenuti (1 - 20 micron). Se necessario, concentrare l'esempio utilizzando dispositivi di ultrafiltrazione centrifugo (per esempio, Vivaspin Sartorius, o NanoSep da Pall Corporation). Si consiglia di verificare l'assorbimento del complesso proteina alla membrana dispositivo, prima dell'uso.
- Spesso, i buffer di purificazione o di soluzioni di storage del complesso di proteine non sono compatibili con Nesi, per cui solo soluzioni volatili possono essere utilizzati. Pertanto, buffer di scambio è necessario. Questa fase critica, in cui vengono rimosse tutte le tracce di sali, molecole tampone o qualsiasi altro non volatili addotti come il glicerolo, DTT, o EDTA, determina la qualità degli spettri. Di solito, soluzione acquosa di acetato di ammonio è usato, ad una concentrazione compresa tra 5 mm e 1 M, a 6-8 e pH. Buffer di scambio può essere eseguito utilizzando un gel colonna microcentrifuga filtrazione (ad esempio, Micro Bio-Spin 6 colonne cromatografiche da Bio-Rad). Questa operazione può essere ripetuta 1-3 volte con la diluizione minima (meno di un fattore pari a 1,3 per dispositivo 5), fino a quando lo scambio massimo è raggiunto. Se entrambi concentrazione e lo scambio di buffer sono necessari, questi possono essere fatto insieme, utilizzando ultrafiltrazione centrifuga (e, g., Vivaspin Sartorius, o NanoSep da Pall Corporation).
Parte 3: Calibrazione lo spettrometro di massa per misure di massa ad alta
La maggior parte degli esperimenti condotti su multi-proteina complessi vengono eseguite utilizzando un electrospray nano quadrupolo-tempo di volo (Q-TOF) strumento. Si consiglia di utilizzare un filtro quadrupolo di massa regolare alle basse frequenze, per consentire l'analisi e la trasmissione di massa di ioni ad alta m / z valori 7,8. E 'raccomanda inoltre di ingressi gas 7,8 o 9 maniche essere aggiunte allo strumento nella guida agli ioni di prima, per permettere il controllo della pressione nella fase di vuoto per primo. Quest'ultimo consente l'ottimizzazione della trasmissione, e desolvatazione di ioni molto grande 7-9. Attualmente, commerciale ESI-TOF e Q-ToF strumenti sono disponibili presso diversi produttori (per esempio, Waters, SCIEX, Bruker, o Agilent) che possono essere modificate in modo relativamente semplice e conveniente, per le applicazioni native di MS 7,8. E 'possibile, tuttavia, di utilizzare configurazioni standard o ToF QTof su strumenti come LCT o QToF1 (Waters) per acquisire spettri di massa per i complessi fino a 1 MDA, senza la necessità di modifiche hardware 5.
Il protocollo descritto di seguito è stata condotta su uno strumento Synapt (Waters).
- La preparazione di 100 mg / ml soluzione di CsI in acqua purificata. CsI è utilizzato per la calibrazione di massa elevata come i grappoli sale singolarmente carica, (CSI) n Cs + si estendono su una vasta gamma di massa, da 393 m / z a oltre 10.000 (Fig. 2).
- Utilizzando le pinzette smussato, prendere un capillare rivestito dalla capsula di Petri e 2μL carico della soluzione di CsI nel capillare, utilizzando una punta GeLoader Eppendorf.
- Inserire il capillare nel supporto capillare, e regolare il capillare in modo che la punta è di circa 10 mm dal bordo del titolare.
- Far scorrere la soluzione verso la punta del capillare sia manualmente, o usando un adattatore spin down.
- Mettere il capillare sotto un microscopio ottico e tagliare la punta, con il forte AA-tipo pinzette.
- Collegare il supporto capillare per l'interfaccia ES nanoflussi. Ruotare la fase xyz all'indietro per evitare di danneggiare i capillari, e spingere il palco nella sua posizione attivata. Il capillare deve essere collocato 1-10 mm dal cono orifizio.
- Applicare la tensione capillare (1050-1400 V) e la pressione nanoflussi bassa (0,00-0,03 bar) fino a spruzzo è iniziata, quindi provare a ridurre la pressione nanoflussi ad un valore minimo.
- Ottimizzare l'intensità del segnale, regolando la posizione del palco xyz, la tensione capillare, la pressione nanoflussi, e il flusso di gas desolvatazione.
- Per rilevare una vasta gamma di massa di CsI picco di serie, le tensioni di accelerazione deve essere ottimizzata (usiamo i seguenti parametri: capillare 1,3-1,7 kV, cono di campione 80-150V, estrazione cono 1-3 V).
- Per ottimizzare la trasmissione di ioni di massa elevata, quando le condizioni desolvatazione gentile, la pressione di sostegno nella fase di vuoto iniziale, tra la sorgente e l'analizzatore, dovrebbe essere aumentato. Ciò può essere ottenuto con attenzione riducendo la conduttanza della linea di vuoto di origine alla pompa di scorrimento, con la parziale chiusura della valvola di isolamento (SpeediValve). Al fine di definire il punto ottimale, il secondo dovrebbe essere fatto durante il monitoraggio l'effetto sulla intensità del segnale (di solito uso 3,0-6,5 mBar).
- Raccogliere circa 30 scansioni a 1 scan / sec, con un m / z intervallo compreso tra 1.000 e 15.000 m / z.
- Dopo l'acquisizione, calibrare il TOF usando la tabella di calibrazione.
Parte 4: analisi MS di complessi proteici integri
- Caricare il campione, come descritto (Parte 3, sezioni 2-5), e avviare spray.
- Inizia l'ottimizzazione iniziale del getto (parte 3, sezioni 6-9), fino a quando il segnale viene rilevato. L'esatta posizione degli stati di carica è la proteina-dipendente, tuttavia, può essere previsto, utilizzando la relazione tra la massa di ioni e stato di carica media, in questo modo: (Z av) 10: Z av = 0,0778 √ (m), in cui m è la massa del complesso di Dalton. Per evitare complesso dissociazione, non scaldano il sorgente di ioni: o spegnere il riscaldatore, o mantenere la temperatura sotto i 40 ° C.
- Variare la posizione capillare, cono campione e tensioni di aspirazione per massimizzare la trasmissione di ioni, e verificare con conseguente cambiamento di spettri. Un possibile punto di partenza potrebbe essere cono tensione di 100 V; estrattore cono: 1 V, la tensione capillare 1,5 kV. Ottimizzare questi parametri, in combinazione con la pressione nanoflussi.
- Per migliorare desolvatazione e spogliano l'acqua residua e componenti tampone, aumentare la tensione di polarizzazione e la pressione del gas nella cella di collisione. Questa operazione deve essere eseguita con attenzione, per evitare che la dissociazione del complesso. Tensioni di polarizzazione tipiche sono nel range di 10-100 V, con un flusso di gas trappola di 1-10 ml / min (Fig. 3). Regolazione manuale della regolazione RF e il profilo quadrupolo può migliorare la trasmissione degli ioni di massa elevata.
- Regolare il Trap e le energie di collisione di trasferimento. Spesso, tensioni superiori sono necessari per la trasmissione di ioni di massa elevata (di solito all'interno della gamma di 10-30 V). A questo punto, è importante per evitare la collisione indotta dissociazione del complesso.
- Dopo un segnale stabile è reached, si raccomanda che la pressione e la tensione capillare nanoflussi essere ridotta a valori minimi, pur mantenendo stabile a spruzzo.
Parte 5: la spettrometria di massa tandem: complessi proteici dissociare
- Una volta che un segnale ottimale e stabile è stato ottenuto, selezionare uno ione precursore. Impostare il centro di massa e la larghezza di isolamento (generalmente usiamo una risoluzione LM di 12 anni, e una risoluzione di HM tra 13 e 15). Utilizzare una vasta gamma di massa per individuare la massa alto / basso costo prodotti dissociazione. Si consiglia di impostare la m / z gamma al massimo livello, e poi ridurre a valori desiderati. Vi proponiamo la sovrapposizione di MS e MS / MS spettri, per convalidare l'isolamento dello ione precursore selezionato.
- Per eseguire MS / MS, dissociare lo ione precursore, aumentando l'energia di collisione (CE) e la pressione sulla cella di collisione. Aumentare sia Trappola o Bonifico CE gradualmente, con incrementi di 10-20V, ed elevare la pressione del gas di collisione a 0-5 ml / min (valori comuni). Monitorare i cambiamenti negli spettri fino a condizioni di attivazione ottimali si raggiungono. Energia di attivazione elevata può indurre la dissociazione di una o più subunità dal complesso intatto, e chiarire le affinità interazione di diverse subunità. Usiamo tipicamente Argon come gas di collisione nella trappola / trasferimento cellule, anche se i benefici di utilizzare un gas più pesante (ad esempio, Xe o SF 6) sono stati segnalati, tuttavia, questi gas sono sostanzialmente più costose 11 (Fig. 3).
- Si raccomanda che più di uno stato di carica essere selezionato per MS / MS. Nel caso di componenti sovrapposte, acquisendo una serie di tandem MS spettri aiuterà a risolvere la serie di carica delle diverse popolazioni. Inoltre, stati di carica più alta si dissociano più facilmente, rispetto a stati di carica inferiore 12.
- Oltre alla caratterizzazione del complesso intatto, si suggerisce che i piccoli subcomplessi in soluzione verrà generato, in condizioni di lieve denaturazione. Le analisi MS e MS / MS di subcomplessi costituiscono la base per definire l'architettura subunità del complesso 13. Per l'interruzione parziale della subunità-subunità interazioni, aggiungere gradualmente solventi organici (ad esempio metanolo, isopropanolo o acetonitrile) fino ad una concentrazione del 50%, o modificare il pH della soluzione con l'aggiunta di ammoniaca o acido formico (fino ad una concentrazione di 4 %).
- Per determinare le masse delle singole unità che compongono il complesso, è importante acquisire uno spettro in condizioni di denaturazione. Questo può essere effettuata con Zip-Tip C 4 (Millipore) con 25:75 acqua / acetonitrile rapporto, con 1% di acido formico come solvente di eluizione.
Parte 6: L'elaborazione dei dati e analisi
- I dati vengono analizzati in linea, con un programmi di analisi spettrale per MS spettri. Noi di solito utilizzare il programma MassLynx (Waters).
- Per spettri che abbracciano un ampio m / z gamma, si consiglia di diversi regimi di levigatura e centroide parametri da applicare per l'alta e bassa m / z regioni, per riflettere la differenza di risoluzione di punta di queste regioni.
- Per identificare serie di carica e di calcolare gli stati di carica e le masse, il "Manuale di trovare" la funzione di MassLynx può essere applicata. In caso di spettri di massa complessi con componenti sovrapposti, calcolo manuale delle masse può essere più facile.
- Per facilitare questi processi di assegnazione, software aggiuntivo può essere utilizzato, ad esempio: Maxent per deconvoluzione spettri 14, SOMMS per il montaggio e la simulazione di picco 15 e SUMMIT per assegnare la composizione e la stechiometria di subcomplessi proteine e la generazione di reti di interazione proteina 13,16,17 .
Parte 7: Risultati Rappresentante

Figura 1. Preparazione di oro rivestite nano-elettrospray capillari.
A. Fissare due su due lati strisce adesive di una capsula di Petri, 2 cm di distanza. Per supportare la preparazione capillari, posto una bacchetta di vetro (8 cm x 5 mm) al centro di una delle pastiglie. B. Stick l'estremità piatta del preparato capillari al pad adesivo, e appoggiarsi sulla punta sulla bacchetta di vetro. C. Una volta che la piastra di Petri è riempito con il preparato capillari, cappotto d'oro fino a un sottile strato di oro è depositato in modo uniforme sulla superficie esterna dei capillari.
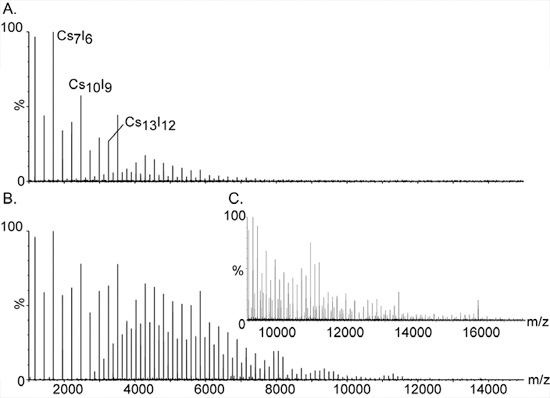
Figura 2. Calibrazione di massa ad alta utilizzando ioni ioduro di cesio.
I cluster di grandi dimensioni e monisotopic di CSI hanno reso il composto di scelta per la calibrazione di spettrometri di massa per l'analisi di massa elevata. La serie di picchi equidistanti si estendono su una vasta gamma, da m / z 393 a ben oltre 10.000. Sono ASSIGned singolarmente a carico cluster sale della composizione generale (CSI) n Cs +. Segnali supplementari tra le cime principali sono causati da specie a doppia e tripla carica della serie, [(CSI) n CS2] 2 + e [(CSI) n Cs3] 3 +, rispettivamente. Aumentando la pressione nella fase di vuoto iniziale è essenziale per rilevare il cluster di massa elevata. L'effetto della pressione sui picchi di massa elevata è dimostrato in pannelli A. e B. con readback pressione di 1,2 e 5,3, rispettivamente. C. Espansione dello spettro di massa mostrato in B.
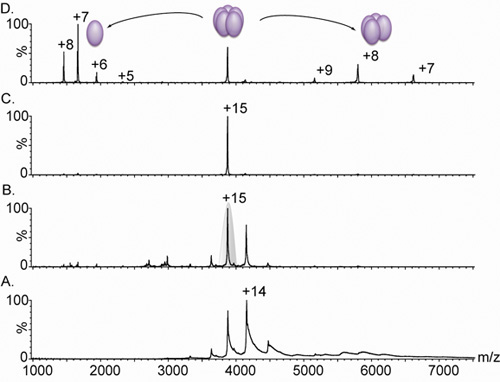
Figura 3. Nanoflussi elettrospray spettri di massa di una lectina pentamerica.
A. Spettrometria di massa di una complessa variante lectina (derivato da Lib1-B7 dall'evoluzione diretto 18) dà luogo a distribuzioni stato una carica tra 3.000 e 5.000 m / z, tuttavia, a causa di desolvatazione inadeguata degli ioni, i picchi sono ampie. Confronto di gruppo A. e B. mostrare l'effetto di aumentare la tensione di polarizzazione da 4V (A). A 15 V (B). Sulla larghezza del picco. Questo aumento in condizioni di accelerazione provoca la rimozione dei residui di acqua e componenti di buffer, producendo uno spettro estremamente risolto. La massa misurata (60.240 ± 38 Da) corrisponde ad un complesso pentamerica. C. Il 15 dello stato di carica è stato poi selezionato per il tandem MS (in grigio nel pannello B). D. L'aumento di energia di collisione provoca il rilascio di un monomero altamente carica, centrata a 1.664 m / z, e un complesso spogliato tetramerica, nella gamma di 5.000 - 8.000 m / z. Tutti gli spettri sono stati ottenuti da un campione contenente 20 mM di soluzione in acetato di ammonio 0,5 M.
Discussione
Per acquisire gli spettri di alta qualità l'attenzione dovrebbe essere data alle fasi di preparazione del campione, tra cui la concentrazione del campione e lo scambio di buffer. Oltre campioni diluiti darà un segnale basso, mentre i campioni ad alta concentrazione può essere piuttosto viscoso, e bloccare l'ago elettrospray. Inoltre, additivi soluzione come sali, glicerina, detergenti, ioni metallici, e agenti riducenti (DTT o β-mercaptoetanolo), tendono ad aderire alla superficie esterna delle proteine, e la causa allargamento dei picchi. Pertanto, al fine di raggiungere picchi ben risolti, questi componenti dovrebbe essere aggiunto al minor concentrazione possibile.
Un altro parametro chiave è la posizione del nanoflussi capillare, rispetto al foro spettrometro di massa. Trovare il "sweet spot" potrebbe essere difficile per gli utenti meno esperti, tuttavia, influenza in modo significativo la qualità degli spettri. E 'anche importante esaminare la nanoflussi capillare prima di iniziare a spruzzo. La dimensione delle gocce è una funzione del diametro della punta, che dovrebbe essere ~ 1μm. Piccole gocce portare a ionizzazione più efficiente, e sarebbe quindi vantaggioso. E 'anche importante per verificare che non vi siano bolle d'aria all'interno del capillare che potrebbero bloccare il flusso, e che il rivestimento d'oro non è spogliato dal capillare durante l'acquisizione, in caso affermativo, ulteriormente tagliare la punta. Tenete presente che una eccessiva quantità di campione aumenta la possibilità di ottimizzare le condizioni di SM come la tensione capillare, tensioni di accelerazione, pressione, e l'energia di collisione.
Nel complesso, le procedure spiegate nel protocollo sono stati utilizzati per determinare la composizione, stechiometria e l'architettura di complessi proteici diversi (vedi recensioni 2,3,4). Analisi dei grandi complessi MDA come il ribosoma 19 e capsidi virus altamente ordinato 20-22, nella definizione del substrato legame con macchine molecolari 23-25, o la caratterizzazione delle reti di interazione subunità 26,17,16,17,27,28 servire come solo alcuni esempi del valore di questo approccio.
Divulgazioni
Riconoscimenti
Gli autori ringraziano i membri del gruppo di Sharon per la loro revisione critica e per il loro contributo al manoscritto. Siamo grati per il sostegno dei Programmi Morasha e Bikura, la Israel Science Foundation (Grant numeri 1823-1807 e 378/08), Josef Cohn Minerva Centro per la Ricerca Biomembrane, il Programma per la Famiglia Chais Fellows nuovi scienziati, Abramo e Sonia Rochlin Fondazione, la famiglia Wolfson Charitable Trust, la Helen e Milton A. Kimmelman Centro per la Struttura Biomolecolari e dell'Assemblea, la tenuta di Shlomo e Sabine Beirzwinsky; Meil de Botton Aynsley, e Karen Siem, Regno Unito. Siamo grati a Dan Tawfik e Itamar Yadid per averci dato l'esempio lectina variante.
Materiali
Esempio di requisiti:
| Campione | Requisito | Commenti |
| Volume | 1-2 microlitri | Per capillare |
| Concentrazione | 1-20μM | Per complessi |
| Buffer | Tampone Aquanos volatili come ammonio acetato a pH = 6-8 | Tipicamente 5 mM-1M |
| Detergente | Minimo | Gruppi di molecole detergenti produrre picchi ampio e irrisolto |
| Glicerina | Minima (massimo 5%) | Aderisce non specifico alle proteine e, di conseguenza, vette largo vengono osservati |
| Solventi organici | Fino al 50% | Potrebbe denaturare le proteine complessi |
| Acidi | Fino al 4% | Denaturare complessi proteici |
| Sali | Minimo | Addotti sale portare a picchi di ampio e irrisolto |
| DTT | Minimo | MM 1-2 possono essere presenti |
| Agenti chelanti | Minimo | Superiori a 250 mM portare alla formazione di addotti ampia |
Riferimenti
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, dela, J, Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. vander Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon