Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von biologisch abgeleiteten Injizierbare Materialien für Myocardial Tissue Engineering
In diesem Artikel
Zusammenfassung
Verfahren zur Herstellung eines injizierbaren Matrix-Gel aus dezellularisierte Gewebe und Injektion in Ratten-Myokard In vivo Beschrieben sind.
Zusammenfassung
Dieses Protokoll bietet Methoden für die Herstellung eines injizierbaren extrazellulären Matrix (ECM)-Gel für myokardiale Tissue Engineering-Anwendungen. Kurz gesagt, ist dezellularisierte Gewebe lyophilisiert, gefräst, enzymatisch verdaut und anschließend auf physiologischen pH-Wert gebracht. Die Gefriertrocknung entfernt alle Wassergehalt aus dem Gewebe, was zu trockenen ECM, die in ein feines Pulver mit einer kleinen Mühle gemahlen werden. Nach dem Mahlen wird die ECM-Pulver mit Pepsin verdaut, um eine injizierbare Form einer Matrix. Nach Einstellung auf pH 7,4, kann die Flüssigkeit Matrix-Material in den Herzmuskel injiziert werden. Die Ergebnisse der bisherigen Charakterisierung Tests haben gezeigt, dass Matrix Gele aus dezellularisierte Perikarderguss und Herzmuskelgewebe produziert nativen ECM-Komponenten, darunter verschiedene Proteine, Peptide und Glykosaminoglykanen behalten. Bei der Verwendung dieses Materials für das Tissue Engineering, in vivo Charakterisierung ist besonders nützlich, hier ein Verfahren zur Durchführung eines intramuralen Injektion in den linken Ventrikel (LV) frei an der Wand wird als Mittel zur Analyse der Host-Reaktion auf die Matrix-Gel in vorgestellt ein kleines Tier-Modell. Der Zugang zu den Brustraum wird durch die Membran gewonnen und die Injektion ist leicht über die Spitze in der LV freien Wand gemacht. Die biologisch abgeleiteten Gerüst visualisiert werden durch Biotin-Markierung vor der Injektion und dann Färbung Gewebeschnitte mit einem Meerrettichperoxidase-konjugierten Neutravidin und Visualisieren über Diaminobenzidin (DAB) Färbung. Die Analyse der Injektion Region kann auch mit histologischen und immunhistochemischen Färbung durchgeführt werden. Auf diese Weise wurden die bisher untersuchten Herzbeutel und Herzmuskel-Matrix-Gelen gezeigt, faserige, poröse Netzwerke zu bilden und zu fördern Gefäßbildung innerhalb der Injektion Region.
Protokoll
1. Pre-processing Tissue Vorbereitung
- Bevor Sie dieses Protokoll, muss man schon dezellularisierte das Gewebe der Wahl. Für dieses Beispiel sind frisch vom Schwein und Mensch Herzbeutel Proben dezellularisierte mit hypotonischen und hypertonischen spült in deionisiertem Wasser (DI) und Natriumdodecylsulfat (SDS).
- Insbesondere ersten Waschen der Schweine Herzbeutel in DI-Wasser für 30 Minuten, dann kontinuierlich rühren in 1% SDS in Phosphat-gepufferter Kochsalzlösung (PBS) für 24 Stunden, gefolgt von einer 5-stündigen DI Wasser abspülen. Für Menschen pericardia, zuerst in DI Wasser spülen für 30 Minuten, dann rühren kontinuierlich in 1% SDS in PBS für 60-65 Stunden, gefolgt von einer Nacht DI spülen. Entfernen Sie alle Proben aus ihrer endgültigen Lösung und spülen Sie wieder unter fließendem Wasser 1 DI.
- Um zu überprüfen, Dezellularisierung, entfernen Sie ein kleines Stück, frisch einfrieren in OCT Einfriermedium, und nehmen 10 pm Gewebeschnitten alle 100 um während der Probe für die Untersuchung über die histologische Analyse, wie bereits berichtet 34-36.
- Verwenden Sie Hämatoxylin und Eosin (H & E) Flecken des Gewebes für das Fehlen von Kernen zu untersuchen. Man könnte auch eine fluoreszierende Hoechst 33342-Färbung (1,0 ug / ml) für die DNA, die H & E-Ergebnisse zu überprüfen; kurz, fixieren Sie die Abschnitte, rehydrieren und in Wasser abspülen, Fleck für 10 Minuten, und dann gut ausspülen und dunkel lagern. Alternativ kann man ein Set wie das Qiagen DNeasy Blood and Tissue Kit, das entwickelt, um die Gesamt-DNA einer Probe zu quantifizieren ist.
2. Herstellung von injizierbaren ECM
- Gefriertrocknung
- Nach entsprechender Vorbereitung, frieren die dezellularisierte Proben mit flüssigem Stickstoff oder durch Lagerung bei -80 ° C. Lyophilisieren die Proben bis es komplett trocken. Abhängig von Ihrem System und der Wassergehalt der Proben, kann dies dauern 12 bis 72 Stunden.
- Mahlen
- Einmal vollständig trocken ist, ist eine Wiley Mini Mill verwendet werden, um die trockene ECM zu einem feinen Pulver zermahlen. Wählen Sie die entsprechende Maschenweite für Ihre Zwecke, hier die 40 Gauge Mesh verwendet wird. Nachdem die Mehrheit der Probe durch den Filter gelangt ist, entfernen Sie die Sammelbüchse mit der gefrästen ECM Pulver. Wenn es nur eine kleine Probe, kann der Rest der Probe aus der Mühle in eine Vielzahl von Möglichkeiten extrahiert werden, hier ein Q-Tip wird verwendet, um die ECM hinter den Leitschaufeln der Mühle stecken zu entfernen.
- Achten Sie immer darauf, dass die Mühle sauber und frei von Ablagerungen ist. Es ist auch wichtig, um sicherzustellen, dass sowohl die Mühle und Ihre Probe vollständig getrocknet sind, verbliebene Feuchtigkeit wird die ECM zu aggregieren und zu verklumpen Ursache, Vorbeugung erfolgreichen Fräsen. Das ECM kann abholen Feuchtigkeit aus der Luft und so sollte direkt aus dem Lyophilisator zur Mühle.
- Verdauung
- Zur Bildung des injizierbaren ECM, wird das Pulver Pepsin verdaut. Das folgende Protokoll wurde von Freyetes geändert, et al. (2).
- Es ist wichtig, wie sterile ein Produkt wie möglich zu halten, wie es in vivo injiziert wird und Verunreinigungen können zu Komplikationen führen. So verwenden sterile Fläschchen und wiegen Löffel und Filter alle Lösungen vor dem Einsatz. Eine Lyophilisation Schritt nach dem Fräsen und vor der Verdauung hilft auch der Aufrechterhaltung der Sterilität.
- Wiegen Sie die gewünschte Menge an ECM-Pulver in ein geeignetes Scintillationsfläschchen. Für Gesamtvolumen von weniger als 1 mL, ist es ratsam, mit einem 2-ml-Fläschchen und für größere Mengen, ein 20 ml-Fläschchen. Dadurch wird sichergestellt, dass genügend Flüssigkeit am Boden des Fläschchens, effektiv zu rühren.
- Wiegen Sie die gewünschte Menge von Pepsin in ein Szintillationsfläschchen. Add 0,1 M HCl, so dass die Pepsin in einer Konzentration von 1 mg / mL ist. Stellen Sie sicher, das Pepsin vollständig aufgelöst ist (keine Partikel) vor dem Gebrauch dieser durch Vortexen der Pepsin-Lösung kann beschleunigt werden.
- Fügen Sie die Pepsin / HCl-Lösung, die Scintillationsfläschchen mit dem ECM-Pulver, so dass die ECM in einer Konzentration von 10 mg / mL ist.
- Stir-Lösung kontinuierlich für 60-65 Stunden, in regelmäßigen Abständen Kratzen an den Seiten des Fläschchens mit einem Gewicht von Löffel oder Spatel.
- pH-Regelung
- Dieser Schritt wird durchgeführt, um die Flüssigkeit Matrixmaterial zu physiologischen pH-Wert zu bringen und die Pepsin inaktivieren, halten sie von Spaltung der ECM weiter. Auch sicher sein, zu filternden Lösungen mit Millipore-Wasser zu verwenden.
- 1 M NaOH zugesetzt wird, um 1 / 10 des ursprünglichen Volumens werden. Testen Sie den pH-Wert an diesem Punkt und fügen kleine Mengen (2-10 ul) von NaOH oder HCl, so dass die gewünschten pH (7,4) erreicht wird. Verfolgen Sie alle kleinen Mengen zur Neutralisation hinzugefügt oder entfernt für pH-Test. Sobald die Lösung neutralisiert wurde, fügen 10x PBS auf 1 / 10 werden das Endvolumen (9.1 die aktuelle Lautstärke). Bestimmen Sie die Konzentration der injizierbaren ECM und fügen Sie dann 1x PBS auf die gewünschte endgültige Zusammenarbeit erreichenncentration, hier 6 mg / mL.
- Charakterisierung der injizierbaren ECM können über SDS-PAGE, Blyscan Colorimetric GAG Assay und Massenspektroskopie durchgeführt werden.
- An diesem Punkt kann das Matrixmaterial in vivo injiziert werden, um ein Gerüst für myokardiale Tissue Engineering bilden.
- Biotin-Labeling
- Das ECM kann mit Biotin vor der Injektion zur einfachen Visualisierung der injizierten ECM markiert werden.
- Bereiten Sie eine 10 mM Lösung von Biotin und fügen Sie die injizierbare ECM bei einem Verhältnis von 0.3mg/mg. Die ECM sollte in der gewünschten Konzentration zur Injektion werden. Sollte das Spritzen in einer Konzentration von 6 mg / mL, dann werden 40 ul Biotin pro 1 ml ECM. Vor der Injektion, halten Sie die Biotin-ECM-Lösung auf Eis für mindestens 1 Stunde.
- Alle Bearbeitungsschritte können bei Raumtemperatur durchgeführt werden. Um die injizierbare Matrix aus Geliermittel, kann der pH-Einstellung Schritt auf Eis durchgeführt werden.
3. Myocardial Injektionen
- Injection Vorbereitung
- Für die weiblichen Ratten (225-250 g) verwendet hier wurden 75 uL Injektionen von pH 7,4 injizierbaren ECM in 0,1 ml-Spritzen bestückt mit 30-Gauge-Nadeln vorbereitet. Wenn männliche Ratten (375-400 g) verwendet wurden, konnten 90 &mgr; l injiziert werden.
- Alle chirurgischen Versorgung sollte vor dem Eingriff sterilisiert werden, hier verwenden wir eine autoklaviert chirurgischen Pack, das alle notwendigen Werkzeuge enthält.
- Am Tag der Operation, ist eine Harlan Sprague-Dawley Ratten anästhesiert unter Verwendung von 5% Isofluran, intubiert mit einem Otoskop und dann mit 2,5% Isofluran während des gesamten Verfahrens beibehalten.
- Add künstliche Tränenflüssigkeit Salbe auf die Augen des Tieres gegen Trockenheit und Haar zu schützen. Verwalten 3 ml Ringer-Laktat-Lösung für die Hydratation während der Operation. Dies sollte über eine subkutane Injektion in den unteren Bauchbereich durchgeführt werden.
- Legen Sie das Tier in Rückenlage auf dem OP-Tisch und sanft streifen Gliedmaßen. Verwenden Sie Klipper, um das Haar am Bauch und im Vakuum frei Haar vor dem Waschen entfernen.
- Machen Sie eine Reihe von kleinen Injektionen (etwa 50 ul pro Stück) von 2% Lidocain entlang einer Diagonale von zyphoid Prozess der unteren rechten Seite des Bauches. Dann scheuern dreimal mit betadine, beginnend in der Mitte und nach außen bewegen. Wiederholen Sie mit 70% Ethanol. Decken Sie die Tiere mit ein chirurgisches Abdecktuch mit einem vorgefertigten kreisrundes Fenster, sichere mit Handtuch Klemmen, wenn nötig.
- Mit einem Skalpell Nr. 10 eine 3-4 cm Schnitt von der Schwertfortsatz am unteren rechten Seite des Bauches. Suchen Sie Schwertfortsatz und sezieren senkrecht nach unten durch den Muskel auf der rechten Seite, wobei darauf geachtet, die großen Gefäße auf der rechten Seite zu vermeiden. Sobald Sie durch den Muskel seziert, mit einer Schere geschnitten seitlich durch den Muskel, Freilegung der Membran. Achten Sie darauf, um die Leber zu vermeiden.
- Mit einem 36-Zoll-Länge von 3-0 Vicrile Naht und ein Paar Hämostatika, fahren eine Nadel durch die zyphoid Prozess und ziehen Sie den Faden zur Hälfte. Kleben Sie die Enden der Naht zusammen und befestigen, dass bis zu einem Punkt über und hinter dem Tier im Wesentlichen die Aufhebung des zyphoid und Freilegung der Membran. Mit einem weiteren 36-Zoll-Länge von 3-0 Vicrile Naht, fahren eine Nadel durch den Muskel am nächsten an der Schwertfortsatz und wieder durchziehen und befestigen die Enden zu einem anderen Punkt auf der rechten Seite der OP-Tisch, voll Freilegung der chirurgischen Hohlraum.
- An diesem Punkt sollten Sie in der Lage sein das Herz durch die Membran zu sehen. Mit einem kleinen Paar Ratte Zahn microforceps, greifen die Mitte der Membran, ziehen Sie es in Ihre Richtung heraus und machen einen sehr kleinen Schnitt mit einer stumpfen Schere. Es ist äußerst wichtig, sehr stumpfen Schere benutzen, um zu vermeiden Stossen in die Lunge. Sobald dieses Loch gemacht worden ist, wird die Lunge zurückgezogen, so dass Sie eine 2-3 cm lange Inzision senkrecht zu der durch die Membrane ins Herz zu visualisieren.
- Legen Sie eine 3-Zoll-Q-Tip auf der linken Seite der Kavität in die Lungen drücken aus dem Weg. Verwenden Sie ein Handtuch Haken, um den Q-Tip in Platz zu sichern. Verwenden Sie eine andere Q-Tip auf der rechten Lunge bewegen aus dem Weg, um den Herzbeutel zu finden. Mit einem Paar microforceps und ein Paar große gezackte Pinzetten, durch den Herzbeutel reißen, Freilegung der Herzspitze. Wenn das Tier vorher einen Infarkt Verfahren unterzogen, das Pericardium bereits fehlen.
- Besorgen Sie sich die Herzspitze mit der Ratte Zahn microforceps und injizieren die Flüssigkeit Matrixmaterial ein Drittel des Weges nach oben von der Spitze. Führen Sie die Nadel parallel zur epikardialen Oberfläche und spritzen mit dem abgeschrägten Rand der Nadel auf der linken Seite. Achten Sie darauf, die großen Herzvene zu vermeiden. Warten Sie ein paar Sekunden, bevor Sie die Nadel. Sie sollten eine Aufhellung des Gewebes an der Injektionsstelle zu sehen.
- Clean up Blut in die Kavität und entfernen Sie das Handtuch Klemme und Q-Tipp, hält die rechte Lunge war. Verwenden Sie gebogenen microhemostats und der RatteZahn microforceps um die Membran zu schließen. Machen Sie eine erste Knoten und dann mit dem gezackten Zangen und microhemostats auf die Membran mit einer fortlaufenden Naht und eine konische Nadel zu schließen. Vor dem Schließen vollständig, legen PE160 Saugschlauch und einen 10-ml-Spritze, um den Brustkorb zu evakuieren, als die Naht angezogen wird.
- Wenn sie richtig evakuiert und geschlossen, sollte die Membran konkav sein. Eine konvexe Membran zeigt, dass es noch in den Hohlraum Luft.
- An diesem Punkt der Isofluran kann bis auf 1% gedreht werden.
- Nehmen Sie beide 3-0 Vicrile Nähte halten den Hohlraum offen. Verwenden Sie sterilem Wasser zu Hydrat des Muskels, wischt überschüssiges weg mit einem Q-Tip oder steriler Gaze. Verwenden Sie eine neue Länge von 3-0 Faden auf die Muskelschicht mit Intervallschaltung Nähte schließen.
- An diesem Punkt kann der Isofluran ausgeschaltet werden.
- Den Bereich mit sterilem Wasser und verwenden Sie Klammern, um Haut zu schließen. Wenn Heftklammern mit der Prüfung beeinträchtigen wird, kann 5-0 Prolin Nahtmaterial verwendet werden. In diesem Fall benutzen Sie ein Reverse-Schneiden (RC) Nadel auf der Haut mit Intervallschaltung Nähte schließen. In beiden Fällen vor Ort chirurgische Kleber über den geschlossenen Schnitt.
- Verwenden Sie ein Q-Tip auf die Inzisionsstelle mit einem Triple-antibiotische Salbe salben.
- Lassen Sie das Tier auf unter 100% Sauerstoff zu erholen.
- Wenn die Tiere rund um den Ventilator zu atmen beginnt, entfernen Sie die Luftröhre Röhre.
- Sobald die Tiere sternalen sind, zu verwalten eine subkutane Injektion von 0,05 mg / kg von Buprenorphin-Hydrochlorid und bringt sie zu ihren eigenen Käfig auf einem sterilen Tuch.
- Die Tiere sollten eine postoperative Beobachtung und Pflege.
- Zu der Zeit Points of Interest, werden die Tiere getötet und die Herzen zur Analyse entnommen. Kurze Achse Querschnitte getroffen werden und kann mit Hämatoxylin und Eosin (H & E) für grobe Gewebe-Analyse gefärbt werden. In kurzer Zeit Punkte, wird der eingespritzte Region als rosa, faserigen Netzwerk, interstitiell ausgebreitet hat erscheinen. Zu späteren Zeitpunkten wird man beobachten, einen Zustrom von Zellen und einem eventuellen Abbau des injizierten Matrix nach 2 bis 3 Wochen. Wenn das ECM wurde mit Biotin vor der Injektion bezeichnet, kann es sein, mehr direkt durch Anfärben der Biotin mit HRP-konjugiertem Streptavidin. Immunhistochemische Färbung kann verwendet werden, um bestimmte Zellen oder Strukturen in der Injektion Region zu identifizieren, hier die Folien wurden mit einem FITC-konjugierten isolectin, die Endothelzellen und fluoresziert grün und ein Anti-smooth muscle actin Antikörper bindet mit einem AlexaFluor sekundären co-gefärbt werden Antikörper, der die SMCs in rot Berichte.
4. Repräsentative Ergebnisse
Vorherige Charakterisierung von Matrix-Materialien auf diese Weise hergestellten demonstriert die Retention von einer Vielzahl von Makromolekülen. Konkret wurden mehrere faserige Proteine und Glykoproteine über Massenspektrometrie (Tabelle 1) identifiziert. Wenn die Matrix-Materialien verarbeitet nach diesem Protokoll gefunden werden, nicht mehr enthalten eine komplexe Anordnung von Makromolekülen, könnte es sein, dass die Dezellularisierung verwendete Protokoll zu hart ist. Einmal vollständig lyophilisiert, sieht die getrockneten pericardial ECM wie sehr steif, zerknittertes Papier. Andere Gewebetypen wird ähneln Verpackung Erdnüsse. Wenn gefräst hat, sollte den ECM durch das Sieb fallen und in das Glas am Boden gesammelt werden. Wenn Feuchtigkeit in der Probe wird die ECM verklumpen und in der Mahlkammer stecken. Nach der Verdauung, sollte die ECM-Lösung eine milchige Farbe und völlig frei von sichtbaren Partikeln sein. Es wird auch etwas zäher als die HCl allein. Wenn das ECM nicht gut verdauen, wird es noch große Partikel in der Flasche sein, alternativ das ECM kann abstürzen, aus der Lösung. Nach pH-Einstellung gibt es keine sichtbare Veränderung in der Lösung, und der ECM ist noch eine trübe, homogene Flüssigkeit. Wenn es zu gelieren beginnt, wird die Viskosität zu erhöhen, und es wird schwierig oder unmöglich sein, das Material erarbeiten in eine Spritze. Wenn dies geschieht, führen Sie die pH-Einstellung Schritt auf dem Eis, mit vorgekühlten Lösungen. Nach den Injektionen hergestellt worden sind, halten sie auf dem Eis bis zum Gebrauch. Wenn die Injektion erfolgreich ist, hellt die Region rund um die Nadelspitze und einer kleinen Bolus sichtbar ist. Wird dies nicht beachtet wird, kann die Injektion in die Kammer statt in die Wand gegangen. Wenn Naht das Tier nach der Injektion ist eine sorgfältige Schließen der Membran der wichtigste Schritt. Wenn es richtig gemacht, wird die Membran dicht sein gegen die Lungen und erscheint konkav. Wenn es keine Luft in der Lunge nach links, wird die Membran bleibt konvex oder einen Bereich, wo es Ballons aus. Bei der Prüfung der Histologie der Injektion Region zu einem frühen Zeitpunkt (30 Minuten bis 4 Stunden nach der Injektion), sollte man sehen, eine rosa, faserigen Gebiet, das frei von Zellen ist dies der zusammengesetzt Matrixmaterial nach der Injektion (Abbildung 2) . Das Netzwerk breitet sich oft interstitiell und kann in vielen Bereichen zu präsentieren. Ein evtl.ible Erklärung für das Sehen nur einen sehr kleinen Bereich der Matrix-Gel ist, dass ein Teil der Injektion der intramuralen Ziel verfehlt und war entweder in die LV eingespritzt oder durchgesickert der Injektionsstelle. Darüber hinaus, abhängig von der Gelierzeit, kann die interstitielle Ausbreitung variieren.

Abbildung 1. Polyacrylamid-Gelelektrophorese (PAGE) Ergebnisse. (A) Molekulargewicht Standard. (B) Rattenschwanz Kollagen Typ I (2,5 mg / mL) im Vergleich zu den gelösten menschlichen (C) und Schweinen (D) pericardial ECM (7 mg / mL). Notieren Sie sich die Anwesenheit von Kollagen sowie mehrere andere Proteine und Peptide in den Herzbeutel Matrix Proben.

Tabelle 1. ECM-Komponenten mit Massenspektroskopie identifiziert.
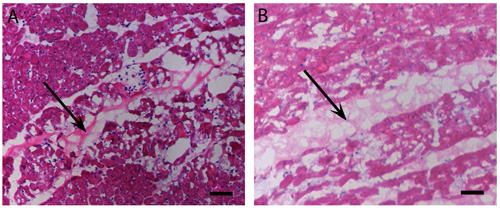
Abbildung 2 Myocardial Injektionen:. In vivo Gelierung. H & E des menschlichen (A) und Schweine-Färbung (B) pericardial Matrix Injektionen, die in vivo nach 45 Minuten haben geliert. Die Pfeile zeigen Matrix Lage, gebeizt hell-lila, als das Myokard. Scale-Bar ist 500 um.
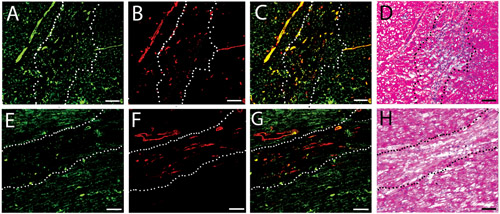
Abbildung 3. Vascular-Zell-Infiltration. Fluoreszierende Farbstoffe für Schiffe in der injizierten menschlichen (AC) und Schweinen (DF)-Matrix Gele bei zwei Wochen. Endothelzellen sind grün gekennzeichnete (A, D), während Zellen der glatten Muskulatur rot (B, E) gekennzeichnet sind. Zusammengeführt Bilder sind in C gezeigt und F. Scale-bar ist 100 um. Die weißen gestrichelten Linien zeigen den Bereich der Matrix Injektion, wie von H & E-Analyse von einem nahe gelegenen Abschnitt bestimmt.
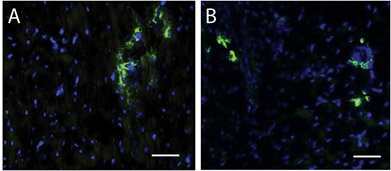
Abbildung 4. Stammzellen innerhalb der Matrix Injektion Region. Ein Hoescht für Kerne Fleck (blau) und c-kit (grün) identifiziert Stammzellen in das menschliche (A) und Schweinen (B)-Matrix Injektion Regionen. Scale-Bar ist 50 pm.
Diskussion
Diese Methode ermöglicht die Generierung von biologisch abgeleitet, injizierbare Gerüste für myokardiale Tissue Engineering. Obwohl diese Methoden wurden ursprünglich für die Herstellung entwickelt und in vivo Tests eines Myokard-Matrix-Gel und hier mit einem Perikarderguss Matrix-Gel vorgestellt, dieses Protokoll für die Verwendung mit einem beliebigen Gewebe angepasst werden, sofern das Gewebe angemessen sein dezellularisierte. Dezellularisierung sollte durchgeführt werden und vor der Anwendung dieser ...
Offenlegungen
Danksagungen
Diese Arbeit wurde teilweise durch New Innovator des NIH Director Award Program, Teil der NIH Roadmap for Medical Research, über Grant-Nummer 1-DP2-OD004309-01 unterstützt. SBS-N. möchte die NSF für ein Graduate Research Fellowship bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents: | |||
| Pepsin | Sigma-Aldrich | p6887-1G | Lyophilized |
| Biotin | Thermo Fisher Scientific, Inc. | 21217 | |
| Neutravidin-HRP | Thomas Scientific | 21130 | |
| Equipment: | |||
| Wiley Mini Mill | Thomas Scientific | 3383L10 | |
| Labconco Lyophilizer | Labconco Corp. | 7670520 | |
| Surgical supplies: | |||
| Betadine | Purdue Products L.P. | 67618-154-16 | |
| Lactated Ringers Solution | MWI Veterinary Supply | 003966 | |
| KY Jelly | MWI Veterinary Supply | 28658 | |
| Lidocaine, 2% | MWI Veterinary Supply | 17767 | |
| Buprenorphine hydrochloride | Reckitt Benckiser | 12496-0757-1 | |
| Artificial tear ointment | Fisher Scientific | NC9860843 | |
| Triple antibiotic ointment | Fisher Scientific | 19082795 | |
| Isoflurane | MWI Veterinary Supply | 60307-120-25 | |
| Otoscope | MWI Veterinary Supply | 008699 | |
| Stop cock | MWI Veterinary Supply | 006245 | |
| 3-0 Vicrile suture | MWI Veterinary Supply | J327H | |
| 5-0 Proline suture | MWI Veterinary Supply | s-1173 | |
| Reverse cutting (RC) needle | Ethicon Inc. | 8684G | |
| Microhemostats | Fine Science Tools | 13013-14 | |
| Rat tooth microforceps | Fine Science Tools | 11084-07 | |
| No. 10 scalpel | Fine Science Tools | 10110-01 | |
| Blunt scissors | Fine Science Tools | 14108-09 | |
| Sharp, curved scissors | Fine Science Tools | 14085-08 | |
| Large, serrated forceps | Fine Science Tools | 1106-12 | |
| PE160 suction tubing | BD Biosciences | 427430 | |
| Clippers | MWI Veterinary Supply | 21608 | |
| Skin staples/stapler | Ethicon Inc. | PRR35 | |
| General supplies: | |||
| Stir plates | |||
| 0.1 M HCl | |||
| 1 M NaOH | |||
| 10x PBS | |||
| 1x PBS | |||
| 70% Ethanol | |||
| 0.1 mL syringes | |||
| 10 mL syringe | |||
| Q-tips | |||
| Surgical glue | |||
| Surgical drape | |||
| Towel clamps | |||
| Small hand-held vacuum |
Referenzen
- Seif-Naraghi, S. B., Salvatore, M. A., Magoffin-Schup, P. J., Hu, D. P., Christman, K. L. Design and characterization of an injectable pericardial matrix gel: A potentially autologous scaffold for cardiac tissue engineering. Tissue Engineering. , (2009).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29, 1630-1630 (2008).
- Gilbert, T. W., Sellaro, T. L., Badylak, S. F. Decellularization of tissues and organs. Biomaterials. 27, 3675-3675 (2006).
- Liao, J., Joyce, E. M., Sacks, M. S. Effects of decellularization on the mechanical and structural properties of the porcine aortic valve leaflet. Biomaterials. 29, 1065-1065 (2008).
- Singelyn, J. M., DeQuach, J. A., Seif-Naraghi, S. B., Littlefield, R. B., Schup-Magoffin, P. J., Christman, K. L. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30, 5409-5409 (2009).
- Christman, K. L., Vardanian, A. J., Fang, Q., Sievers, R. E., Fok, H. H., Lee, R. J. Injectable fibrin scaffold improves cell transplant survival, reduces infarct expansion, and induces neovasculature formation in ischemic myocardium. J Am Coll Cardiol. 44, 654-654 (2004).
- Christman, K. L., Fok, H. H., Sievers, R. E., Fang, Q., Lee, R. J. Fibrin glue alone and skeletal myoblasts in a fibrin scaffold preserve cardiac function after myocardial infarction. Tissue Eng. 10, 403-410 (2004).
- Huang, N. F., Sievers, R. E., Park, J. S., Fang, Q., Li, S., Lee, R. J. A rodent model of myocardial infarction for testing the efficacy of cells and polymers for myocardial reconstruction. Nat Protoc. (1), 1596-1609 (2006).
- Ott, H. C., Matthiesen, T. S., Goh, S. K., Black, L. D., Kren, S. M., Netoff, T. I. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat Med. 14, 213-221 (2008).
- Badylak, S. F. The extracellular matrix as a biologic scaffold material. Biomaterials. 28, 3587-3593 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten