Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La fabrication des matériaux injectables d'origine biologique pour l'ingénierie tissulaire du myocarde
Dans cet article
Résumé
Méthodes de préparation d'une matrice de gel injectable à partir de tissus décellularisé et l'injecter dans le rat myocarde In vivo Sont décrits.
Résumé
Ce protocole fournit des méthodes pour la préparation d'une injection de la matrice extracellulaire (ECM) de gel pour des applications en génie tissulaire du myocarde. En bref, le tissu décellularisé est lyophilisé, broyé, une digestion enzymatique, puis amené à pH physiologique. La lyophilisation supprime tous les contenus de l'eau à partir des tissus, résultant de l'ECM sec qui peut être broyé en poudre fine avec un petit moulin. Après le broyage, la poudre ECM est digéré par la pepsine pour former une matrice injectable. Après ajustement à un pH de 7,4, le matériau de la matrice liquide peut être injecté dans le myocarde. Résultats des tests de caractérisation précédentes ont montré que les gels matrice produite à partir de tissus décellularisé péricardique et myocardique retenir les composants ECM indigènes, y compris des protéines diverses, des peptides et des glycosaminoglycanes. Compte tenu de l'utilisation de ce matériel pour l'ingénierie tissulaire, la caractérisation in vivo est particulièrement utile, ici, un procédé pour effectuer une injection intra-muros dans le ventricule gauche (VG) paroi libre est présenté comme un moyen d'analyser la réponse de l'hôte de la matrice de gel dans les un modèle animal de petite taille. L'accès à la cavité thoracique est acquise à travers le diaphragme et l'injection est faite légèrement au-dessus de l'apex dans le mur BT libre. L'origine biologique échafaudage peuvent être visualisées par la biotine-étiquetage avant l'injection puis coloration des coupes de tissus avec un raifort conjuguée à la peroxydase et la visualisation via neutravidine diaminobenzidine (DAB) coloration. Analyse de la région d'injection peut aussi être fait avec coloration histologique et immunohistochimique. De cette façon, les gels déjà examiné la matrice péricardique et du myocarde ont été montrés à la forme fibreuse, réseaux poreux et de promouvoir la formation des vaisseaux dans la région d'injection.
Protocole
1. Préparation des tissus pré-traitement
- Avant d'utiliser ce protocole, il faut avoir déjà décellularisé le tissu de votre choix. Pour cet exemple, porcine fraîche et échantillons humains sont péricarde décellularisé d'utiliser un rince hypotonique et hypertonique dans déminéralisée (DI) de l'eau et de sodium dodécyl sulfate (SDS).
- Plus précisément, d'abord laver le péricarde porcin dans l'eau DI pendant 30 minutes, puis remuer en permanence dans 1% de SDS dans le tampon phosphate salin (PBS) pendant 24 heures, suivie d'une eau de 5 heures DI rincer. Pour péricardique humaine, d'abord rincer à l'eau DI pendant 30 minutes, puis remuer en permanence dans 1% de SDS dans du PBS pendant 60 à 65 heures, suivie d'une nuit DI rincer. Retirez tous les spécimens de leur solution finale et rincer à nouveau sous l'eau DI 1.
- Pour vérifier décellularisation, enlever un petit morceau, frais le congeler dans de l'OCT milieu de congélation, et prendre 10 coupes de tissus um um tous les 100 à travers l'échantillon pour examen par l'analyse histologique, comme indiqué précédemment 34-36.
- Utilisez l'hématoxyline et l'éosine (H & E) des taches d'examiner les tissus de l'absence de noyaux. On pourrait aussi utiliser une lampe fluorescente Hoescht 33342 tache (1,0 ug / ml) pour l'ADN pour vérifier la H & résultats E; brièvement, fixer les sections, réhydrater et rincer à l'eau, aux taches pendant 10 minutes, puis bien rincer et conserver dans l'obscurité. Alternativement, on peut utiliser un kit comme le sang Qiagen DNeasy et kit de tissu, qui est conçu pour quantifier le contenu en ADN total d'un échantillon.
2. Préparation des injectables ECM
- La lyophilisation
- Après une préparation appropriée, congeler les échantillons décellularisé à l'azote liquide ou par le stockage à -80 ° C. Lyophiliser les échantillons jusqu'au séchage complet. En fonction de votre système et la teneur en eau de vos échantillons, cela peut durer de 12 à 72 heures.
- Fraisage
- Une fois complètement sec, un moulin Wiley Mini est utilisé pour moudre l'ECM à sec en une poudre fine. Choisissez la taille du tamis appropriés à vos besoins; ici, la maille de 40 jauge est utilisée. Une fois que la majorité de l'échantillon est venu à travers le filtre, enlevez le bocal avec de la poudre d'ECM blanchi. S'il ya seulement un petit échantillon, le reste de l'échantillon peut être extrait de l'usine dans une variété de façons, ici, un Q-tip est utilisée pour enlever l'ECM coincé derrière des aubes fixes de l'usine.
- Toujours s'assurer que l'usine est propre et exempt de débris. Il est également important de s'assurer que les deux usines et votre échantillon sont totalement sèches; toute trace d'humidité provoque l'ECM d'agréger et de s'agglutiner, empêchant mouture réussie. L'ECM peut absorber l'humidité de l'air et doivent donc aller directement à partir du lyophilisateur à l'usine.
- La digestion
- Pour former l'ECM injectables, la poudre est digéré par la pepsine. Le protocole suivant a été modifié par Freyetes, et al. (2).
- Il est important de maintenir comme un produit stérile que possible, car il sera injecté in vivo et la contamination peut entraîner des complications. Ainsi, l'utilisation des flacons stériles et peser cuillères et filtre toutes les solutions avant de les utiliser. Une étape de lyophilisation après usinage et avant la digestion aidera également à maintenir la stérilité.
- Peser la quantité désirée de poudre d'ECM dans un flacon à scintillation approprié. Pour les volumes totaux inférieurs à 1 ml, il est recommandé d'utiliser un flacon de 2 mL et pour les grands volumes, un flacon de 20 ml. Ceci garantit qu'il ya suffisamment de liquide dans le fond du flacon pour mélanger efficacement.
- Peser la quantité désirée de la pepsine dans un flacon à scintillation. Ajouter 0,1 M tels que la pepsine est à une concentration de 1 mg / mL de HCl. Assurez-vous que la pepsine est entièrement dissoute (pas de particules) avant d'utiliser ce qui peut être accéléré par vortex la solution de pepsine.
- Ajouter la solution de pepsine / HCl à la fiole à scintillation avec la poudre d'ECM afin que l'ECM est à une concentration de 10 mg / mL.
- Remuer constamment pour les 60-65 solution heure, périodiquement raclant les côtés du flacon avec une cuillère ou une spatule pèsent.
- Ajustement du pH
- Cette étape est réalisée pour amener le matériau de la matrice liquide à pH physiologique et pour inactiver la pepsine, l'empêchant de cliver l'ECM supplémentaires. Encore une fois, soyez sûr d'utiliser des solutions à base d'eau filtrée Millipore.
- NaOH 1 M est ajoutée à 1 / 10 du volume initial. Testez le pH à ce point et ajouter de petites quantités (2-10 pi) de NaOH ou HCl tels que le pH souhaité (7,4) est atteint. Gardez une trace de toutes petites quantités ajouté pour la neutralisation ou enlevés pour les essais du pH. Une fois la solution a été neutralisée, ajouter 10x PBS à 1 / 10 du volume final (1 / 9 du volume actuel). Déterminer la concentration de l'ECM injectables puis ajoutez 1x PBS pour atteindre désiré co finalesncentration, ici 6 mg / ml.
- Caractérisation de l'ECM injectable qui peut être fait par SDS-PAGE, dosage colorimétrique Blyscan GAG, et la spectroscopie de masse.
- À ce stade, le matériau de la matrice peut être injecté in vivo pour former un échafaudage pour l'ingénierie tissulaire du myocarde.
- Biotine-étiquetage
- L'ECM peuvent être marqués par la biotine avant l'injection pour une visualisation aisée de l'ECM injecté.
- Préparer une solution 10mM de biotine et d'ajouter à l'ECM injectable à un ratio de 0.3mg/mg. L'ECM doit être à la concentration désirée pour l'injection. Si l'injection à une concentration de 6 mg / ml, ajouter 40 ul par Biotine 1 mL d'ECM. Avant l'injection, maintenir la solution de biotine-ECM sur la glace pendant au moins 1 heure.
- Toutes les étapes de traitement peuvent être réalisées à température ambiante. Pour garder la matrice injectable de gélifiants, l'étape d'ajustement du pH peut être fait sur la glace.
3. Infarctus injections
- Préparation injectable
- Pour les rats femelles (225-250 g) utilisé ici, 75 uL d'injections de pH 7,4 injectable ECM ont été préparés en seringues 0,1 ml basculé avec 30 aiguilles de calibre. Si les rats mâles (375-400 g) ont été utilisés, 90 uL pourrait être injecté.
- Toutes les fournitures chirurgicales doivent être stérilisés avant la chirurgie; ici, nous utilisons un pack qui contient chirurgicale autoclave tous les outils nécessaires.
- Le jour de la chirurgie, une Harlan Sprague-Dawley rats anesthésiés à l'aide d'isoflurane est à 5%, intubé à l'aide d'un otoscope, puis maintenu à 2,5% d'isoflurane pendant toute la procédure.
- Ajouter une pommade pour les yeux de larmes artificielles de l'animal pour protéger contre le dessèchement et les cheveux. Administrer 3 ml de solution de Ringer lactate pour une hydratation pendant la chirurgie. Cela devrait être fait par injection sous-cutanée dans la partie inférieure de l'abdomen.
- Placez l'animal en décubitus dorsal sur la table de chirurgie et doucement le bas de bandes membres. Utilisez tondeuse pour enlever les poils sur le ventre et les cheveux libres sous vide avant de frotter.
- Faites une série de petites injections (environ 50 ul chacun) de lidocaïne 2% sur une diagonale du processus zyphoid d'abaisser le côté droit de l'abdomen. Puis frottez trois fois avec la bétadine, en commençant au milieu et le déplacement vers l'extérieur. Répétez l'opération avec 70% d'éthanol. Couverture de l'animal en utilisant un champ opératoire avec une fenêtre pré-fait circulaire; sécurisé avec des pinces serviette, si nécessaire.
- L'utilisation d'un bistouri n ° 10 faire une incision de 3-4 cm du processus xiphoïde pour abaisser le côté droit de l'abdomen. Localisez appendice xiphoïde et disséquer à la verticale vers le bas par le muscle à droite, en prenant soin d'éviter le grand navire sur la droite. Une fois que vous avez disséqué à travers le muscle, l'utilisation des ciseaux pour couper latéralement à travers le muscle, ce qui expose le diaphragme. Soyez prudent pour éviter le foie.
- En utilisant une longueur de 36 pouces de 3-0 suture Vicrile et une paire de pinces hémostatiques, conduire une aiguille à travers le processus zyphoid et tirez le fil de suture à mi-parcours. Bande aux extrémités de la suture ensemble et corriger cela à un point au-dessus et derrière l'animal essentiellement soulevant le zyphoid et exposer le diaphragme. Avec une autre longueur de 36 pouces de 3-0 suture Vicrile, conduire une aiguille à travers le muscle le plus proche du processus xiphoïde et, là encore, passer à travers et de fixer les extrémités d'un autre point à la droite de la table d'opération, entièrement exposer la cavité chirurgicale.
- À ce stade, vous devriez être capable de voir le coeur à travers le diaphragme. En utilisant une petite paire de dents microforceps rat, attrapez le centre du diaphragme, tirez-le vers vous et faire une très petite incision avec des ciseaux émoussés. Il est extrêmement important d'utiliser des ciseaux très émoussé, afin d'éviter piquer les poumons. Une fois ce trou a été fait, les poumons se rétracte, vous permettant de faire une incision de 2-3 cm verticalement à travers le diaphragme de visualiser le cœur.
- Insérez un 3 pouces Q-tip à la gauche de la cavité pour pousser les poumons de la route. Utilisez une pince serviette pour sécuriser le Q-tip en place. Utilisez un autre Q-tip pour déplacer le poumon droit de la route afin de localiser le sac péricardique. En utilisant une paire de microforceps et une paire de pinces dentelées grande déchirure à travers le sac péricardique, exposant l'apex du cœur. Si l'animal a déjà subi une procédure de l'infarctus, le péricarde sera déjà absent.
- Prenez la pointe du cœur avec les dents de rat et microforceps injecter le matériau de la matrice liquide tiers de la hauteur de l'apex. Insérez le parallèle aiguille à la surface épicardique et injecter avec le bord biseauté de l'aiguille vers la gauche. Soyez sûr d'éviter la grande veine cardiaque. Attendez quelques secondes avant de retirer l'aiguille. Vous devriez voir un blanchiment des tissus au site d'injection.
- Nettoyer le sang dans la cavité et retirez la pince serviette et Q-tip qui tenait le poumon droit. Utilisez microhemostats courbes et le ratdent microforceps de fermer le diaphragme. Faire un noeud initial et ensuite utiliser les pinces dentelées et microhemostats de fermer le diaphragme avec une suture continue et une aiguille conique. Avant de fermer complètement, insérez PE160 tuyau d'aspiration et de l'utilisation d'une seringue de 10 ml d'évacuer la cavité thoracique que la suture est serrée.
- Lorsqu'il est correctement évacué et fermé, le diaphragme doit être concave. Un diaphragme convexe indique qu'il ya encore de l'air dans la cavité.
- A ce point l'isoflurane peut être refusé à 1%.
- Sortez tous deux 3-0 sutures Vicrile tenant la cavité ouverte. Utilisez de l'eau stérile pour hydrater le muscle, en essuyant l'excès de suite avec un coton-tige ou une gaze stérile. Utilisez une nouvelle longueur de 3-0 de suture pour fermer la couche musculaire avec des sutures intermittente.
- À ce stade, l'isoflurane peut être désactivée.
- Nettoyer la zone avec de l'eau stérile et agrafes utiliser pour fermer la peau. Si des agrafes va interférer avec l'étude, 5-0 proline peuvent également être utilisés. Dans ce cas, utilisez un coupe inversée (RC) de fermer l'aiguille de la peau avec des sutures intermittente. Dans les deux cas, la tache de colle chirurgicale au cours de l'incision fermée.
- Utilisez un coton-tige pour oindre le site d'incision avec un onguent antibiotique triple.
- Permettre à l'animal de récupérer moins de 100% d'oxygène.
- Lorsque les animaux commence à respirer autour du ventilateur, enlever le tube trachée.
- Une fois que les animaux sont sternale, administrer une injection sous-cutanée de 0,05 mg / kg de chlorhydrate de buprénorphine et de les retourner à leur cage d'origine sur une serviette stérile.
- Les animaux doivent recevoir des post-opératoire d'observation et de soins.
- Au niveau des points d'intérêt du temps, les animaux sont euthanasiés et le cœur prélevé pour analyse. Court sections axe sont prises et peuvent être colorées à l'hématoxyline et l'éosine (H & E) pour l'analyse des tissus bruts. Au point de temps, la région injectée apparaîtra comme une rose, réseau fibreux qui s'est propagé interstitielle. Aux points de temps plus tard, on observera un afflux de cellules et une dégradation de finale de la matrice injecté après 2 à 3 semaines. Si l'ECM a été marqué avec la biotine avant l'injection, il peut être plus directement visualisés par coloration de la biotine avec HRP-streptavidine conjuguée. La coloration immunohistochimique peut être utilisé pour identifier des cellules ou des structures dans la région d'injection, voici les diapositives ont été co-colorées avec un isolectine conjuguée au FITC qui se lie à des cellules endothéliales et vert fluorescent et d'un anticorps anti-actine du muscle lisse avec un secondaire AlexaFluor d'anticorps que les rapports du SMC en rouge.
4. Les résultats représentatifs
La caractérisation de matériaux à matrice précédente préparés de cette façon démontré la rétention d'une variété de macromolécules. Plus précisément, plusieurs protéines fibreuses et les glycoprotéines ont été identifiés par spectrométrie de masse (Tableau 1). Si les matériaux à matrice traitée conformément au présent protocole sont trouvés pour ne plus contenir un ensemble complexe de macromolécules, il se pourrait que le protocole employé décellularisation est trop sévère. Une fois entièrement lyophilisé, le sécher péricardique ECM ressemble très rigide, papier froissé. Autres types de tissus ressemblera l'emballage cacahuètes. Si bien moulu, l'ECM devrait tomber à travers le tamis et être recueilli dans le pot au fond. Si l'humidité est laissé dans l'échantillon, l'ECM s'agglutiner et se coincer dans la chambre de broyage. Après la digestion, la solution ECM doit être d'une couleur laiteuse et totalement exempt de particules visibles. Il sera également légèrement plus visqueux que le seul HCl. Si l'ECM ne digère pas bien, il y aura toujours les grosses particules dans le flacon, ou alternativement, l'ECM peut planter de la solution. Après ajustement du pH, il n'ya pas de changement visible dans la solution, et l'ECM est toujours un trouble, liquide homogène. Si elle commence à gel, la viscosité va augmenter et il sera difficile, voire impossible, de tirer le matériel dans une seringue. Si cela se produit, effectuez l'étape d'ajustement du pH sur la glace, avec pré-réfrigérée solutions. Une fois que les injections ont été préparés, les garder sur la glace jusqu'à utilisation. Si l'injection est un succès, la région autour de la pointe de l'aiguille blanchit et un petit bolus est visible. Si cela n'est pas respecté, l'injection peut-être allée dans la chambre plutôt que dans le mur. Lorsque l'animal jusqu'à suture après l'injection, en fermant soigneusement la membrane est l'étape la plus importante. Si fait correctement, le diaphragme sera serré contre les poumons et apparaîtra concave. S'il ya un air gauche à l'intérieur des poumons, le diaphragme restera convexe, ou avoir un endroit où il gonfle. Lorsque l'on examine l'histologie de la région de l'injection à un point de temps au début (30 minutes à 4 heures après l'injection), on devrait voir une rose, zone fibreuse qui est dépourvu de cellules de cette matrice est le matériau remonté après l'injection (figure 2) . Le réseau se propage souvent interstitielle et peut être présent tout au long de nombreuses sections. A possFIL explications pour ne voir que une très petite zone de la matrice de gel est qu'une partie de l'injection intra-muros raté la cible et a été soit injecté dans la chambre LV ou une fuite hors de l'emplacement de l'injection. En outre, selon le temps de gélification, la propagation interstitielle peut varier.

Figure 1. Électrophorèse sur gel de polyacrylamide (PAGE) des résultats. (A) standard de poids moléculaire. (B) du collagène de type I de queue de rat (2,5 mg / mL) par rapport à l'humain solubilisé (C) et porcine (D) péricardique ECM (7 mg / ml). Notez la présence de collagène ainsi que plusieurs autres protéines et de peptides dans les échantillons de matrice péricardique.

Tableau 1. Composants ECM identifié par spectroscopie de masse.
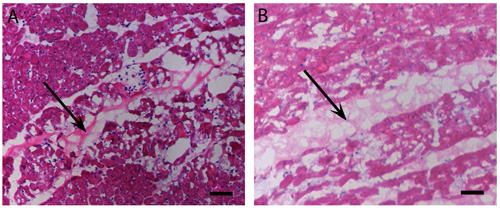
Figure 2 injections du myocarde:. Gélification dans vivo. H & E tache de l'homme (A) et porcine (B) injections de matrice péricardique qui ont gélifié in vivo après 45 minutes. Les flèches indiquent l'emplacement matrice, teinté léger rose que le myocarde. La barre d'échelle est de 500 um.
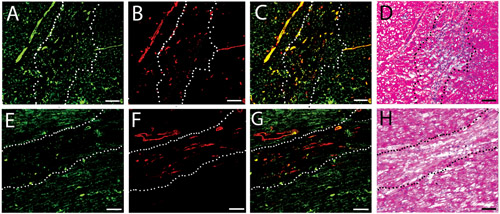
Figure 3. Infiltration des cellules vasculaires. Taches fluorescentes pour les navires dans l'humain injecté (AC) et porcine (DF) des gels matrice à deux semaines. Les cellules endothéliales sont étiquetés verts (A, D), tandis que les cellules musculaires lisses sont marquées rouge (B, E). Des images fusionnées sont affichées en C et F. La barre d'échelle est de 100 um. Les lignes blanches pointillées indiquent la zone d'injection de matrice, tel que déterminé par H & E l'analyse d'une section voisine.
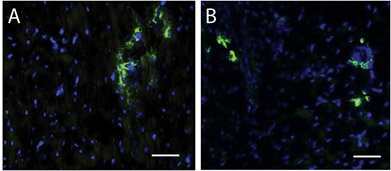
Figure 4. Les cellules souches au sein de la région d'injection matrice. Une tache de Hoescht pour les noyaux (bleu) et c-kit (vert) identifie les cellules souches chez l'homme (A) et porcine (B) les régions d'injection matrice. La barre d'échelle est de 50 um.
Discussion
Cette méthode permet la génération d'origine biologique, les échafaudages injectable pour l'ingénierie tissulaire du myocarde. Bien que ces méthodes ont été initialement développées pour la fabrication et des essais in vivo d'un gel de la matrice du myocarde et présenté ici avec une matrice de gel péricardique, ce protocole peut être adapté pour une utilisation avec n'importe quel tissu, pourvu que le tissu peut être appropriée décellularisé. Décellularisation doit ?...
Déclarations de divulgation
Remerciements
Cette recherche a été financée en partie par le directeur des NIH Programme Innovateur nouveau prix, le cadre de la Feuille de route du NIH pour la recherche médicale, à travers le numéro de subvention 1-DP2-OD004309-01. SBS-N. tiens à remercier la NSF pour une bourse de recherche de deuxième cycle.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents: | |||
| Pepsin | Sigma-Aldrich | p6887-1G | Lyophilized |
| Biotin | Thermo Fisher Scientific, Inc. | 21217 | |
| Neutravidin-HRP | Thomas Scientific | 21130 | |
| Equipment: | |||
| Wiley Mini Mill | Thomas Scientific | 3383L10 | |
| Labconco Lyophilizer | Labconco Corp. | 7670520 | |
| Surgical supplies: | |||
| Betadine | Purdue Products L.P. | 67618-154-16 | |
| Lactated Ringers Solution | MWI Veterinary Supply | 003966 | |
| KY Jelly | MWI Veterinary Supply | 28658 | |
| Lidocaine, 2% | MWI Veterinary Supply | 17767 | |
| Buprenorphine hydrochloride | Reckitt Benckiser | 12496-0757-1 | |
| Artificial tear ointment | Fisher Scientific | NC9860843 | |
| Triple antibiotic ointment | Fisher Scientific | 19082795 | |
| Isoflurane | MWI Veterinary Supply | 60307-120-25 | |
| Otoscope | MWI Veterinary Supply | 008699 | |
| Stop cock | MWI Veterinary Supply | 006245 | |
| 3-0 Vicrile suture | MWI Veterinary Supply | J327H | |
| 5-0 Proline suture | MWI Veterinary Supply | s-1173 | |
| Reverse cutting (RC) needle | Ethicon Inc. | 8684G | |
| Microhemostats | Fine Science Tools | 13013-14 | |
| Rat tooth microforceps | Fine Science Tools | 11084-07 | |
| No. 10 scalpel | Fine Science Tools | 10110-01 | |
| Blunt scissors | Fine Science Tools | 14108-09 | |
| Sharp, curved scissors | Fine Science Tools | 14085-08 | |
| Large, serrated forceps | Fine Science Tools | 1106-12 | |
| PE160 suction tubing | BD Biosciences | 427430 | |
| Clippers | MWI Veterinary Supply | 21608 | |
| Skin staples/stapler | Ethicon Inc. | PRR35 | |
| General supplies: | |||
| Stir plates | |||
| 0.1 M HCl | |||
| 1 M NaOH | |||
| 10x PBS | |||
| 1x PBS | |||
| 70% Ethanol | |||
| 0.1 mL syringes | |||
| 10 mL syringe | |||
| Q-tips | |||
| Surgical glue | |||
| Surgical drape | |||
| Towel clamps | |||
| Small hand-held vacuum |
Références
- Seif-Naraghi, S. B., Salvatore, M. A., Magoffin-Schup, P. J., Hu, D. P., Christman, K. L. Design and characterization of an injectable pericardial matrix gel: A potentially autologous scaffold for cardiac tissue engineering. Tissue Engineering. , (2009).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29, 1630-1630 (2008).
- Gilbert, T. W., Sellaro, T. L., Badylak, S. F. Decellularization of tissues and organs. Biomaterials. 27, 3675-3675 (2006).
- Liao, J., Joyce, E. M., Sacks, M. S. Effects of decellularization on the mechanical and structural properties of the porcine aortic valve leaflet. Biomaterials. 29, 1065-1065 (2008).
- Singelyn, J. M., DeQuach, J. A., Seif-Naraghi, S. B., Littlefield, R. B., Schup-Magoffin, P. J., Christman, K. L. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30, 5409-5409 (2009).
- Christman, K. L., Vardanian, A. J., Fang, Q., Sievers, R. E., Fok, H. H., Lee, R. J. Injectable fibrin scaffold improves cell transplant survival, reduces infarct expansion, and induces neovasculature formation in ischemic myocardium. J Am Coll Cardiol. 44, 654-654 (2004).
- Christman, K. L., Fok, H. H., Sievers, R. E., Fang, Q., Lee, R. J. Fibrin glue alone and skeletal myoblasts in a fibrin scaffold preserve cardiac function after myocardial infarction. Tissue Eng. 10, 403-410 (2004).
- Huang, N. F., Sievers, R. E., Park, J. S., Fang, Q., Li, S., Lee, R. J. A rodent model of myocardial infarction for testing the efficacy of cells and polymers for myocardial reconstruction. Nat Protoc. (1), 1596-1609 (2006).
- Ott, H. C., Matthiesen, T. S., Goh, S. K., Black, L. D., Kren, S. M., Netoff, T. I. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat Med. 14, 213-221 (2008).
- Badylak, S. F. The extracellular matrix as a biologic scaffold material. Biomaterials. 28, 3587-3593 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon