È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fabbricazione di derivazione biologica Materiali iniettabili per l'ingegneria tissutale miocardica
In questo articolo
Riepilogo
Metodi per la preparazione di un gel iniettabile matrice dal tessuto decellularized e iniettarlo nel ratto miocardio In vivo Sono descritti.
Abstract
Questo protocollo fornisce i metodi per la preparazione di un iniettabile matrice extracellulare (ECM) gel per applicazioni di ingegneria dei tessuti del miocardio. In breve, il tessuto decellularized è liofilizzato, macinato, digerito enzimaticamente, e poi portato a pH fisiologico. La liofilizzazione elimina tutto il contenuto di acqua dal tessuto, con conseguente ECM secco che può essere macinato in una polvere fine con un piccolo mulino. Dopo la fresatura, la polvere ECM viene digerito con pepsina per formare una matrice iniettabile. Dopo aggiustamento a pH 7,4, il materiale della matrice liquido può essere iniettato nel miocardio. Risultati dei dosaggi caratterizzazione precedenti hanno dimostrato che i gel matrice prodotta dal tessuto miocardico decellularized pericardico e conservare i componenti nativi ECM, tra cui diverse proteine, peptidi e glicosaminoglicani. Dato l'utilizzo di questo materiale per l'ingegneria tissutale, caratterizzazione in vivo è particolarmente utile, qui, un metodo per eseguire una iniezione intramurale nel ventricolo sinistro (LV) parete libera è presentato come un mezzo per analizzare la risposta dell'ospite al gel matrice un modello animale di piccole dimensioni. L'accesso alla cavità toracica si ottiene attraverso il diaframma e l'iniezione è fatta leggermente sopra l'apice nel muro LV libero. La derivazione biologica impalcatura può essere visualizzata da biotina-etichettatura prima dell'iniezione e poi colorazione sezioni di tessuto con un rafano perossidasi-coniugato neutravidin e la visualizzazione tramite diaminobenzidina (DAB) colorazione. Analisi della regione di iniezione può essere fatto anche con colorazione istologica ed immunoistochimica. In questo modo, i gel già esaminato matrice pericardio e del miocardio hanno dimostrato di forma fibrosa, reti poroso e promuovere la formazione di vasi all'interno della regione di iniezione.
Protocollo
1. Pre-elaborazione del tessuto di preparazione
- Prima di utilizzare questo protocollo, si deve avere già decellularized il tessuto di scelta. Per questo esempio, suina fresca e campioni pericardio umano sono decellularized con risciacqui ipotoniche e ipertoniche in deionizzata (DI) e dodecil solfato di sodio (SDS).
- In particolare, prima lavare il pericardio porcino in acqua deionizzata per 30 minuti, quindi mescolare continuamente in 1% SDS a tampone fosfato (PBS) per 24 ore, seguito da un ore di acqua 5 di risciacquo. Per pericardia umana, primo risciacquo in acqua deionizzata per 30 minuti, quindi mescolare continuamente in SDS 1% in PBS per 60-65 ore, seguito da un giorno all'altro DI risciacquare. Rimuovere tutti i campioni da loro soluzione finale e sciacquare ancora sotto l'acqua deionizzata 1.
- Per verificare decellularization, rimuovere un piccolo pezzo, fresco congelare nel medio Ottobre congelamento, e prendere 10 sezioni di tessuto micron ogni 100 micron in tutto il campione per l'esame mediante analisi istologica, come precedentemente riportato 34-36.
- Usa ematossilina ed eosina (H & E) le macchie di esaminare il tessuto per l'assenza di nuclei. Si potrebbe anche usare un fluorescenti Hoescht 33342 macchia (1,0 mg / ml) per il DNA per verificare la H & risultati e, per breve tempo, fissare le sezioni, reidratare e sciacquare in acqua, macchia per 10 minuti, poi sciacquare bene e conservare al buio. In alternativa, si può utilizzare un kit come il sangue Qiagen DNeasy e kit di tessuti, che ha lo scopo di quantificare il contenuto totale di DNA di un campione.
2. Preparazione di iniettabili ECM
- Liofilizzazione
- Dopo la preparazione del caso, congelare i campioni decellularized con azoto liquido o con l'archiviazione a -80 ° C. Liofilizzare i campioni fino a completa asciugatura. A seconda del sistema e il contenuto d'acqua dei vostri campioni, questo può richiedere da 12 a 72 ore.
- Fresatura
- Una volta completamente asciutto, una Mini Mill Wiley è usato per macinare la ECM asciutto in una polvere finissima. Scegli la dimensione appropriata setaccio per i vostri scopi, qui, il 40 mesh calibro è utilizzato. Una volta che la maggioranza del campione è arrivato attraverso il filtro, rimuovere il vaso insieme con la polvere ECM fresato. Se c'è solo un piccolo campione, il resto del campione può essere estratto dal mulino in una varietà di modi, qui, un Q-tip viene utilizzata per rimuovere l'ECM bloccato dietro le pale fisse del mulino.
- Verificare sempre che il mulino è pulito e privo di detriti. E 'anche importante assicurarsi che sia il mulino e il campione sono completamente asciutti; tutta l'umidità residua farà sì che l'ECM per aggregare e raggrupparsi insieme, evitando di fresatura di successo. L'ECM può raccogliere l'umidità dell'aria e quindi dovrebbe andare direttamente dal liofilizzatore al mulino.
- Digestione
- Per formare l'ECM iniettabili, la polvere viene digerito pepsina. Il seguente protocollo è stato modificato da Freyetes, et al. (2).
- E 'importante mantenere come sterile un prodotto il più possibile, in quanto sarà iniettato in vivo e la contaminazione può causare complicazioni. Così, l'uso fiale sterili e pesano cucchiai e filtrare tutte le soluzioni prima dell'uso. Un passo dopo la liofilizzazione di fresatura e prima che la digestione aiuterà anche a mantenere la sterilità.
- Pesare la quantità desiderata di polvere ECM in una fiala di scintillazione appropriato. Per i volumi totali inferiori a 1 ml, si consiglia di utilizzare un flaconcino da 2 ml e per grandi volumi, a 20 ml fiala. Questo assicura che ci sia abbastanza liquido sul fondo del flacone per mescolare in modo efficace.
- Pesare la quantità desiderata di pepsina in una fiala di scintillazione. Aggiungere 0,1 M tale che la pepsina è ad una concentrazione di 1 mg / mL HCl. Assicurarsi che la pepsina è completamente sciolto (non particolato) prima di utilizzare questo può essere accelerato dalla vortex soluzione di pepsina.
- Aggiungere la pepsina / HCl soluzione al flaconcino scintillazione con la polvere ECM in modo che l'ECM è ad una concentrazione di 10 mg / ml.
- Agitando la soluzione continuamente per 60-65 ore, periodicamente raschiare lungo i lati del flaconcino con un peso cucchiaio o una spatola.
- Regolazione del pH
- Questa operazione viene eseguita per portare il materiale liquido a matrice a pH fisiologico e per inattivare la pepsina, salvandola dalla fende la ECM ulteriormente. Anche in questo caso, assicurarsi di utilizzare soluzioni filtrata fatta con acqua Millipore.
- 1 M NaOH è aggiunto da 1 / 10 del volume originale. Controllare periodicamente il pH a questo punto e aggiungere piccole quantità (2-10 mL) di NaOH o HCl tale che il pH desiderato (7.4) è raggiunto. Tenere traccia di tutti gli importi piccola aggiunta per la neutralizzazione o rimossi per il test del pH. Una volta che la soluzione è stata neutralizzata, aggiungere 10x PBS da 1 / 10 del volume finale (1 / 9 al volume corrente). Determinare la concentrazione della ECM iniettabili e quindi aggiungere 1x PBS raggiungere desiderato co finalencentration, qui 6 mg / mL.
- Caratterizzazione della ECM iniettabili può essere fatto tramite SDS-PAGE, analisi GAG Blyscan colorimetrici, e la spettroscopia di massa.
- A questo punto, il materiale della matrice può essere iniettato in vivo per formare un patibolo per l'ingegneria tissutale del miocardio.
- Biotina-Etichettatura
- L'ECM possono essere contrassegnate con biotina prima dell'iniezione di facile visualizzazione della ECM iniettato.
- Preparare una soluzione 10mM di biotina e aggiungere al ECM iniettabili con un rapporto di 0.3mg/mg. L'ECM deve essere alla concentrazione desiderata per l'iniezione. Se l'iniezione ad una concentrazione di 6 mg / mL, aggiungere 40 microlitri biotina per 1 ml di ECM. Prima dell'iniezione, mantenere la biotina-ECM soluzione in ghiaccio per almeno 1 ora.
- Tutte le fasi di lavorazione possono essere effettuate a temperatura ambiente. Per mantenere la matrice iniettabili di gelificazione, il passo regolazione del pH può essere fatto su ghiaccio.
3. Iniezioni miocardico
- Iniezione di preparazione
- Per i ratti di sesso femminile (225-250 g), qui usato, 75 iniezioni ml di pH 7,4 iniettabili ECM sono stati preparati in 0,1 ml siringhe punta con 30 aghi di calibro. Se ratti maschi (375-400 g) sono stati utilizzati, 90 microlitri potrebbe essere iniettato.
- Tutte le forniture chirurgici devono essere sterilizzati prima dell'intervento chirurgico, qui usiamo un pacchetto di autoclave chirurgica che contiene tutti gli strumenti necessari.
- Il giorno della chirurgia, un Sprague-Dawley Harlan ratto è anestetizzato con isofluorano al 5%, intubato con un otoscopio, e poi mantenuto al 2,5% isoflurano tutta la procedura.
- Aggiungi unguento artificiale lacrime agli occhi dell'animale per la protezione contro l'aridità e capelli. Somministrare 3 ml di soluzione Ringer lattato per l'idratazione durante l'intervento chirurgico. Questo dovrebbe essere fatto per via sottocutanea nella zona addominale inferiore.
- Posto l'animale in posizione supina sul tavolo operatorio e delicatamente il nastro in basso arti. Usa tagliaunghie per rimuovere i peli sull'addome e capelli vuoto libero prima di lavaggio.
- Effettuare una serie di iniezioni di piccole dimensioni (circa 50 microlitri ciascuno) del 2% lidocaina lungo una diagonale dal processo zyphoid per abbassare il lato destro dell'addome. Poi macchia tre volte con Betadine, a partire dal centro e lo spostamento verso l'esterno. Ripetere con etanolo al 70%. Coprire l'animale con un drappo chirurgica con un pre-made finestra circolare; fissarlo con fascette asciugamano, se necessario.
- Usando un bisturi n. 10 fanno un'incisione 3-4 cm dal processo xifoideo per abbassare il lato destro dell'addome. Individuare processo xifoideo e sezionare verticalmente verso il basso attraverso il muscolo a destra, facendo attenzione ad evitare la nave di grandi dimensioni sulla destra. Una volta sezionato attraverso il muscolo, usare le forbici per tagliare lateralmente attraverso il muscolo, esponendo il diaframma. Attenzione ad evitare il fegato.
- Utilizzando una lunghezza di 36 pollici di 3-0 Vicrile sutura e un paio di hemostats, guidare un ago attraverso il processo zyphoid e tirare la sutura a metà. Nastro le estremità della sutura insieme e risolvere che ad un punto sopra e dietro l'animale essenzialmente sollevando il zyphoid e di esporre il diaframma. Con un'altra lunghezza di 36 pollici di 3-0 sutura Vicrile, guidare un ago attraverso il muscolo più vicina al processo xifoideo e, ancora, farcela e fissare le estremità di un altro punto alla destra del tavolo operatorio, esponendo completamente la cavità chirurgica.
- A questo punto, dovreste essere in grado di vedere il cuore attraverso il diaframma. Usando un piccolo paio di microforceps dente topo, afferrare il centro del diaframma, tirarlo verso di sé e fare una piccola incisione con forbici. E 'estremamente importante usare le forbici molto brusco per evitare colpendo i polmoni. Una volta che questo buco è stato fatto, i polmoni si ritrae, consentendo di fare un'incisione di 2-3 cm in verticale attraverso il diaframma per visualizzare il cuore.
- Inserire un 3-pollici Q-tip a sinistra della cavità per spingere i polmoni fuori del modo. Utilizzare un morsetto per fissare il telo Q-tip sul posto. Utilizzare un altro Q-tip per spostare il polmone destro di mezzo al fine di individuare il pericardio. Usando un paio di microforceps e un paio di grandi pinze dentellate, strappo attraverso il pericardio, esponendo l'apice del cuore. Se l'animale ha già subito un infarto del procedimento, il pericardio sarà già assente.
- Afferra l'apice del cuore con microforceps denti il ratto e iniettare il materiale liquidi a matrice attiva un terzo della salita dal vertice. Inserire l'ago parallelo alla superficie epicardico e iniettare con il bordo smussato dell'ago a sinistra. Essere sicuri di evitare la grande vena cardiaca. Aspetta un paio di secondi prima di rimuovere l'ago. Si dovrebbe vedere un sbiancamento dei tessuti nel sito di iniezione.
- Ripulire il sangue nella cavità e rimuovere la pinza asciugamano e Q-tip che teneva il polmone destro. Usa microhemostats curve e il topodente microforceps per chiudere il diaframma. Fai un nodo iniziale e poi usare il forcipe dentato e microhemostats di chiudere il diaframma con una sutura continua e un ago conico. Prima di chiudere del tutto, inserire PE160 tubo di aspirazione e utilizzare una siringa da 10 ml di evacuare la cavità toracica, come la sutura è serrato.
- Se correttamente evacuato e chiuso, il diaframma dovrebbe essere concava. Un diaframma convessa indica che c'è ancora aria nella cavità.
- A questo punto l'isoflurano può essere attivata fino a 1%.
- Estrarre entrambi i 3-0 punti di sutura Vicrile tenendo la cavità aperta. Utilizzare acqua sterile per idratare il muscolo, spazzando via l'eccesso con un cotton fioc o garze sterili. Utilizzare una nuova lunghezza di 3-0 sutura per chiudere la strato muscolare con suture intermittente.
- A questo punto, l'isoflurano può essere disattivata.
- Pulire l'area con acqua sterile e punti metallici utilizzare per chiudere la pelle. Se graffette interferirà con lo studio, 5-0 sutura prolina può anche essere usato. In questo caso, utilizzare una inversione di taglio (RC) l'ago per chiudere la pelle con punti di sutura intermittente. In entrambi i casi, posto colla chirurgica sopra l'incisione chiuso.
- Utilizzare un Q-tip per ungere il sito di incisione con una tripla-pomata antibiotica.
- Permettere agli animali di recuperare sotto ossigeno al 100%.
- Quando gli animali comincia a respirare attorno al ventilatore, rimuovere il tubo tracheale.
- Una volta che gli animali sono sternale, somministrare una iniezione sottocutanea di 0,05 mg / kg di buprenorfina cloridrato e restituirli alla loro gabbia casa su un telo sterile.
- Gli animali devono ricevere post-operatorio di osservazione e cura.
- Al momento i punti di interesse, gli animali sono eutanasia e il cuore rimosso per l'analisi. Brevi sezioni trasversali all'asse sono prese e possono essere colorati con ematossilina e eosina (H & E) per l'analisi dei tessuti lordo. A tempi brevi, la regione iniettato apparirà come una rosa, la rete fibrosa che si è diffusa interstizialmente. Nei punti secondo momento, si osserverà un afflusso di cellule e di un eventuale degrado della matrice iniettato dopo 2 o 3 settimane. Se l'ECM è stato marcato con biotina prima dell'iniezione, può essere più direttamente visibili con la colorazione della biotina con HRP-coniugato streptavidina. La colorazione immunoistochimica può essere utilizzato per identificare cellule specifiche o strutture nella regione di iniezione, qui le diapositive sono state co-tinto con un coniugato FITC isolectin che si lega alle cellule endoteliali e verde fluorescente e un anticorpo anti-actina del muscolo liscio con una secondaria Alexafluor anticorpo che segnala l'SMC in rosso.
4. Rappresentante Risultati
Caratterizzazione di materiali a matrice precedente preparati in questo modo ha dimostrato il mantenimento di una varietà di macromolecole. In particolare, proteine fibrose multiple e glicoproteine sono stati identificati tramite spettrometria di massa (Tabella 1). Se i materiali a matrice trattati in base a questo protocollo si riscontra la presenza non è più una complessa serie di macromolecole, potrebbe essere che il protocollo decellularization impiegata è troppo dura. Una volta completamente liofilizzati, secchi pericardico ECM assomiglia molto rigida, carta stropicciata. Altri tipi di tessuto somiglierà imballaggio arachidi. Se ben fresato, l'ECM deve scendere attraverso il setaccio e da raccogliere nel vaso in basso. Se c'è umidità sinistra nel campione, l'ECM si aggregano insieme e rimane bloccata nella camera di macinazione. Dopo la digestione, la soluzione ECM dovrebbe essere un colore lattiginoso e completamente priva di particelle visibili. Sarà anche un po 'più viscoso rispetto alla sola HCl. Se l'ECM non digerisce bene, ci saranno ancora le particelle di grandi dimensioni nel flacone, in alternativa, l'ECM può bloccare dalla soluzione. Dopo la regolazione del pH, non c'è alcun cambiamento visibile nella soluzione, e l'ECM è ancora una nuvoloso, liquido omogeneo. Se inizia a gel, la viscosità aumenterà e sarà difficile o impossibile per disegnare il materiale in una siringa. Se ciò accade, eseguire il passaggio regolazione del pH su ghiaccio, con pre-raffreddata soluzioni. Una volta che le iniezioni sono state preparate, tenerli in ghiaccio fino al momento dell'uso. Se l'iniezione viene eseguita correttamente, la regione attorno alla punta dell'ago imbianca e un piccolo bolo è visibile. Se questo non viene rispettato, l'iniezione può essere andato nella camera al posto di al muro. Quando l'animale sutura dopo l'iniezione, chiusura attenta del diaframma è il passo più importante. Se fatto correttamente, il diaframma sarà stretta contro i polmoni e apparirà concava. Se c'è l'aria sinistra all'interno dei polmoni, il diaframma resterà convessa, o hanno una zona dove palloncini fuori. Nell'esaminare l'istologia della regione di iniezione in un punto temporale iniziale (30 minuti a 4 ore post-iniezione), si dovrebbe vedere una rosa, area fibrosa che è privo di cellule di questo è il materiale di matrice riassemblati post-iniezione (figura 2) . La rete si diffonde spesso interstizialmente e possono essere presenti molte sezioni in tutto. Un possspiegazione ne che dovrà vedere solo una piccola area di matrice gel è che una parte dell'iniezione mancato l'obiettivo ed è stato intramurale sia iniettato nella camera di LV o trapelato dal luogo di iniezione. Inoltre, a seconda del tempo di gelificazione, la diffusione interstiziale possono variare.

Figura 1. Poliacrilammide gel elettroforesi (PAGE) risultati. (A) standard di peso molecolare. (B) Rat collagene di tipo I coda (2,5 mg / mL) rispetto ai umano solubilizzato (C) e suina (D) pericardica ECM (7 mg / mL). Si noti la presenza di collagene così come diverse altre proteine e peptidi in campioni di matrice pericardica.

Tabella 1. Componenti ECM identificato con la spettroscopia di massa.
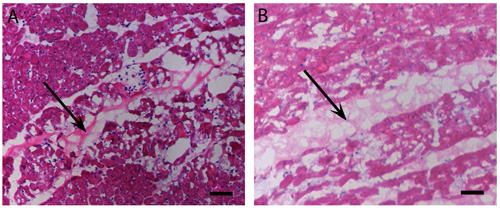
Figura 2 miocardica iniezioni. Gelificazione in vivo. H & E macchia umana (A) e suina (B), iniezioni di matrice pericardico che hanno gelificato in vivo dopo 45 minuti. Le frecce indicano posizione matrice, macchiato leggero rosa rispetto al miocardio. Barra di scala è di 500 micron.
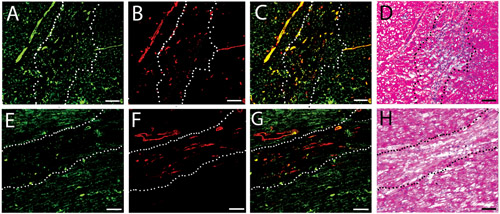
Figura 3. Infiltrazione delle cellule vascolari. Macchie fluorescenti per le navi nella umano iniettato (AC) e suina (DF) gel matrice a due settimane. Le cellule endoteliali sono etichettati verde (A, D), mentre le cellule muscolari lisce sono etichettati rosso (B, E). Immagini fuse sono mostrati in C e F. Scala bar è di 100 micron. Le linee bianche tratteggiate indicano l'area di iniezione matrice, come determinato da H & E l'analisi di una sezione nelle vicinanze.
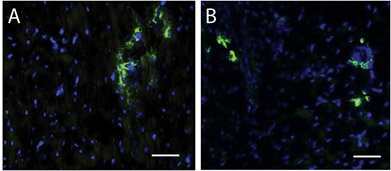
Figura 4. Cellule staminali nella regione di iniezione matrice. Un Hoescht macchia per nuclei (blu) e c-kit (verde) identifica le cellule staminali nell'uomo (A) e suina (B) le regioni iniezione matrice. Barra di scala è di 50 micron.
Discussione
Questo metodo consente la generazione di derivazione biologica, scaffold iniettabili per l'ingegneria tissutale del miocardio. Anche se questi metodi sono stati inizialmente sviluppati per la fabbricazione e la sperimentazione in vivo di un gel matrice del miocardio e presentato qui con un gel matrice pericardico, questo protocollo può essere adattato per essere utilizzato con qualsiasi tessuto, a condizione che il tessuto può essere opportunamente decellularized. Decellularization deve essere es...
Divulgazioni
Riconoscimenti
Questa ricerca è stata sostenuta in parte dal Programma New Innovator il direttore NIH Award, parte del NIH Roadmap per la ricerca medica, attraverso il numero di concedere 1-DP2-OD004309-01. SBS-N. Desideriamo ringraziare la NSF per una borsa di studio Graduate Research.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents: | |||
| Pepsin | Sigma-Aldrich | p6887-1G | Lyophilized |
| Biotin | Thermo Fisher Scientific, Inc. | 21217 | |
| Neutravidin-HRP | Thomas Scientific | 21130 | |
| Equipment: | |||
| Wiley Mini Mill | Thomas Scientific | 3383L10 | |
| Labconco Lyophilizer | Labconco Corp. | 7670520 | |
| Surgical supplies: | |||
| Betadine | Purdue Products L.P. | 67618-154-16 | |
| Lactated Ringers Solution | MWI Veterinary Supply | 003966 | |
| KY Jelly | MWI Veterinary Supply | 28658 | |
| Lidocaine, 2% | MWI Veterinary Supply | 17767 | |
| Buprenorphine hydrochloride | Reckitt Benckiser | 12496-0757-1 | |
| Artificial tear ointment | Fisher Scientific | NC9860843 | |
| Triple antibiotic ointment | Fisher Scientific | 19082795 | |
| Isoflurane | MWI Veterinary Supply | 60307-120-25 | |
| Otoscope | MWI Veterinary Supply | 008699 | |
| Stop cock | MWI Veterinary Supply | 006245 | |
| 3-0 Vicrile suture | MWI Veterinary Supply | J327H | |
| 5-0 Proline suture | MWI Veterinary Supply | s-1173 | |
| Reverse cutting (RC) needle | Ethicon Inc. | 8684G | |
| Microhemostats | Fine Science Tools | 13013-14 | |
| Rat tooth microforceps | Fine Science Tools | 11084-07 | |
| No. 10 scalpel | Fine Science Tools | 10110-01 | |
| Blunt scissors | Fine Science Tools | 14108-09 | |
| Sharp, curved scissors | Fine Science Tools | 14085-08 | |
| Large, serrated forceps | Fine Science Tools | 1106-12 | |
| PE160 suction tubing | BD Biosciences | 427430 | |
| Clippers | MWI Veterinary Supply | 21608 | |
| Skin staples/stapler | Ethicon Inc. | PRR35 | |
| General supplies: | |||
| Stir plates | |||
| 0.1 M HCl | |||
| 1 M NaOH | |||
| 10x PBS | |||
| 1x PBS | |||
| 70% Ethanol | |||
| 0.1 mL syringes | |||
| 10 mL syringe | |||
| Q-tips | |||
| Surgical glue | |||
| Surgical drape | |||
| Towel clamps | |||
| Small hand-held vacuum |
Riferimenti
- Seif-Naraghi, S. B., Salvatore, M. A., Magoffin-Schup, P. J., Hu, D. P., Christman, K. L. Design and characterization of an injectable pericardial matrix gel: A potentially autologous scaffold for cardiac tissue engineering. Tissue Engineering. , (2009).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29, 1630-1630 (2008).
- Gilbert, T. W., Sellaro, T. L., Badylak, S. F. Decellularization of tissues and organs. Biomaterials. 27, 3675-3675 (2006).
- Liao, J., Joyce, E. M., Sacks, M. S. Effects of decellularization on the mechanical and structural properties of the porcine aortic valve leaflet. Biomaterials. 29, 1065-1065 (2008).
- Singelyn, J. M., DeQuach, J. A., Seif-Naraghi, S. B., Littlefield, R. B., Schup-Magoffin, P. J., Christman, K. L. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30, 5409-5409 (2009).
- Christman, K. L., Vardanian, A. J., Fang, Q., Sievers, R. E., Fok, H. H., Lee, R. J. Injectable fibrin scaffold improves cell transplant survival, reduces infarct expansion, and induces neovasculature formation in ischemic myocardium. J Am Coll Cardiol. 44, 654-654 (2004).
- Christman, K. L., Fok, H. H., Sievers, R. E., Fang, Q., Lee, R. J. Fibrin glue alone and skeletal myoblasts in a fibrin scaffold preserve cardiac function after myocardial infarction. Tissue Eng. 10, 403-410 (2004).
- Huang, N. F., Sievers, R. E., Park, J. S., Fang, Q., Li, S., Lee, R. J. A rodent model of myocardial infarction for testing the efficacy of cells and polymers for myocardial reconstruction. Nat Protoc. (1), 1596-1609 (2006).
- Ott, H. C., Matthiesen, T. S., Goh, S. K., Black, L. D., Kren, S. M., Netoff, T. I. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat Med. 14, 213-221 (2008).
- Badylak, S. F. The extracellular matrix as a biologic scaffold material. Biomaterials. 28, 3587-3593 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon