Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Intrakranielle Injektion von Adeno-assoziierte virale Vektoren
In diesem Artikel
Zusammenfassung
Hier präsentieren wir die intrakranielle Injektion von AAV-Vektoren für die Fluoreszenzmarkierung von Neuronen und Gliazellen in der Sehrinde.
Zusammenfassung
Intrakranielle Injektion von viralen Vektoren entwickelt, um ein fluoreszierendes Protein exprimieren ist eine vielseitige Kennzeichnung Technik zur Visualisierung von bestimmten Untergruppen von Zellen in verschiedenen Hirnregionen in vivo und in Hirnschnitten. Anders als die Injektion von Fluoreszenzfarbstoffen, bietet virale Kennzeichnung der gezielten Förderung einzelner Zelltypen und ist weniger teuer und zeitaufwendig ist als Einführung transgener Mauslinien. Bei dieser Technik wird ein Adeno-assoziierte Viren (AAV) Vektor injiziert intrakraniell mit stereotaktischen Koordinaten einer Mikropipette und eine automatische Pumpe für präzise Lieferung von AAV auf den gewünschten Bereich mit minimaler Schädigung des umliegenden Gewebes. Injection-Parameter können auf einzelne Experimente durch Anpassung der Tier-Alter an der Injektionsstelle, Injektion Lage, Injektionsvolumen, die Rate der Injektion, AAV-Serotyp und der Promotor, der die Genexpression zugeschnitten werden. Je nach den gewählten Bedingungen kann viral-induzierter Transgenexpression erlauben die Visualisierung von Gruppen von Zellen, einzelne Zellen oder feinen zelluläre Prozesse, bis auf die Ebene von dendritischen Dornen. Die hier gezeigten Experiment zeigt eine Injektion von doppelsträngiger AAV, die grün fluoreszierendes Protein für die Kennzeichnung von Neuronen und Gliazellen in der Maus primären visuellen Kortex.
Protokoll
1. Virus Handhabung und Lagerung
- Richtiger Schutz und Umgang mit Techniken sollten auf der Grundlage der biologischen Sicherheit des Virus verwendet werden gewählt werden. Diese Praktiken können in Biosafety in Microbiological and Biomedical Laboratories 5. Auflage, auf der CDC-Website gefunden werden
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm ). Die Verwendung von AAV-Vektoren für Biosafety Level 1 (BSL-1) genehmigt. Für das Experiment hier gezeigt, wird ein Laborkittel und Handschuhe bei der Handhabung des Virus sein, in Übereinstimmung mit Verfahren für den Umgang mit BSL-1-Agenten. - Zur Wahrung der Aktivität des Virus ist es am besten, um sie in kleinen Portionen zu teilen, um wiederholtes Einfrieren und Auftauen zu vermeiden.
- Bereiten Sie eine Biosicherheitswerkbank (BSC) Klasse II für Aliquotierung Virus durch das Löschen des BSC von unnötigen Gegenständen und Sterilisieren der Oberfläche mit 70% EtOH. Legen Sie ein Becherglas mit 10% Bleichmittel-Lösung in der Haube zum Sammeln AAV-kontaminierten Abfällen. Auch in der BSC gesetzt sind sterile 0,5 ml Röhrchen und einen Behälter mit Trockeneis.
- Thaw virale Lager auf Eis außerhalb des BSC.
- Vortex-Virus und öffnen Sie den Schlauch in die BSC.
- Pipette die gewünschte aliquoten Volumen (zB 5 ul) in ein 0,5 ml Röhrchen, in der Nähe der Röhre und legen Sie sie in das Trockeneis zur flash-freeze des Virus.
- Wenn alle Virus wurde aliquotiert, des Virus Rohr und Pipettenspitzen in den Abfallbehälter mit 10% Bleichmittel zu entsorgen.
- Entfernen Sie die Abfallbehälter von der Motorhaube und fügen Sie zusätzliche 10% Bleichmittel, gießen Sie dann das Bleichmittel in den Ausguss. Entsorgen von Kunststoffabfällen in einem Behälter für biologischen wie von Ihrem Institut die Biologische Sicherheit angewiesen.
- Reinigen Sie alle Geräte oder Oberflächen, die in Kontakt mit dem Virus mit 10% Bleiche kam. Entsorgen Sie Handschuhe.
- Shop-Aliquots in -80 ° C Gefrierschrank.
2. Chirurgie
- Bedecken Sie den OP-Bereich mit einem saugfähigen Labortisch Papier. Chirurgische Instrumente sollten sterilisiert werden und Chirurgie erfolgen unter aseptischen Bedingungen in Einklang mit Ihrer Einrichtung Biosicherheit und Nutzung von Tieren Richtlinien.
- Wählen Sie einen Bereich neben dem chirurgischen Bereich, gewidmet dem Laden der Mikropipetten mit Virus werden, und decken Sie es mit einem saugfähigen Labortisch Papier. Einen aliquoten Teil-Virus in einen Behälter mit Eis in diesem Bereich und damit das Virus auf Eis auftauen, wie die Operation durchgeführt wird.
- Einrichten eines Abfallbehälters von 10% Bleichmittel in den dedizierten Virus Handling-Bereich für die Entsorgung von Pipettenspitzen, etc., die in Kontakt mit dem Virus kommen.
- Ziehen Sie ein Glas Wiretrol Mikropipette zu einer Spitze Durchmesser von etwa 20 Mikrometern. Setzen Sie einen kleinen Tropfen Mineralöl auf dem stumpfen Ende der Mikropipette und legen Sie den Draht Kolben mit den Mikropipetten zur Verfügung gestellt.
- Sichern Sie die Mikropipette in die Klemme der Mikropumpe Arm.
- Inject eine Maus subkutan mit Buprenorphin bei einer Dosis von 0,5 mg / kg. Anesthetize die Maus mit Avertin durch intraperitoneale Injektion mit einer Dosis von 200 mg / kg und entfernen Sie die Haare von der Spitze des Kopfes mit chirurgischer Schere, achten Sie darauf, die Margen groß genug, um Haare aus der Eingabe der Schnitt verhindern lassen.
- Bringen Sie eine Heizdecke auf der Basis eines stereotax eine Körpertemperatur von 37 ° C während der Operation zu erhalten und sichern Sie die Maus in die stereotax.
- Bathe den Kopf mit drei wechselnden scrubs von Ethanol und betadine, um den Bereich zu sterilisieren.
- Geben Sie einen Tropfen Tobradex Augensalbe an jedem Auge zu halten die Augen feucht während der Operation.
- Machen Sie einen Schnitt nach der Mittellinie des Kopfes und ziehen die Haut zurück zu den Schädel freizulegen.
- Entfernen Sie vorsichtig die Faszie vom Schädel spitzen Pinzette.
- Suchen Sie den Bereich injiziert mit stereotaktischen Koordinaten werden und markieren den Schädel mit einem chirurgischen Stift.
- Mit einem zahnärztlichen Bohrer mit 1,4 mm Grat, dünne einer Fläche des Schädels ca. 2mm im Durchmesser, bis der Schädel Risse, indem die verdünnte Bereich in mehrere Segmente.
- In diesem Verfahren behalten die Schädel feucht mit Anwendungen von steriler Kochsalzlösung.
- Führen Sie eine Kraniotomie durch sanftes Entfernen der ausgedünnt Schädel Segmente mit extra-feinen Spitzen einer Pinzette.
3. Injection Vorbereitung
- Mit einem Kimwipe über den Deckel gelegt, öffnen Sie das Rohr des Virus und Pipette 1.5uL (für eine 1UL Injektion) des Virus auf einem kleinen Stück Parafilm.
- Setzen Sie die Spitze der Mikropipette in das virale Lager und manuell zurückzuziehen den Kolben. Wenn Schwierigkeit besteht darin, erfahrene Zeichnung virale Lager in der Mikropipette kann die Spitze vergrößert leicht sein piercing einem Kimwipe mit der Mikropipette auf einen kleinen Teil des Glases zu brechen.
- Lower Mikropumpe Arm auf Kolben, bis eine kleine Menge des Virus von der Spitze der Mikropipette ausgeräumt. Entfernen Sie diese kleinen Tropfen mit einem Wattestäbchen und verwerfen Applikator in waste-Container.
- Tragen Sie einen Tropfen Mineralöl auf die Spitze der Mikropipette zur Vermeidung von Verstopfungen, wie die Mikropipette in das Gehirn gesenkt wird.
4. Virus Injection
- Mit X-und Y-Koordinaten stereotaktischen, Position der Mikropipette über den Bereich injiziert werden. In diesem Experiment koordiniert die stereotaktische zur primären visuellen Kortex zu finden sind 2,7 mm posterior zu Bregma und 2,5 mm lateral der Mittellinie. Sehr langsam niedriger die Mikropipette (mit einer ungefähren Rate von 1mm/1minute) auf die richtige Z-Position.
- Geben Sie die gewünschte Einspritzparameter in die SYS Micro4 Mikropumpe Controller-Box und starten Sie die Injektion. Für dieses Experiment wird 1 Mikroliter über 10 Minuten als einer Rate von Injektion verwendet werden.
- Wenn die Injektion beendet ist, verlassen Sie die Pipette für 1-2 Minuten auf Efflux von Viren bei der Entnahme zu verhindern ruhen. Nach diesem Zeitraum sehr langsam entfernen Sie die Mikropipette aus dem Gehirn (gleiche Geschwindigkeit wie oben).
- Suture der Kopfhaut und verschließen Sie diese mit Gewebekleber. Spritzen Sie das Tier subkutan mit Buprenorphin bei einer Dosis von 0,1 mg / kg alle 8-12 Stunden in den nächsten 72 Stunden oder so lange wie das Tier Anzeichen von Schmerz. Lassen Sie das Tier unter einer Wärmelampe erholen, bis es ambulating ist und bereit, in seinen Käfig zurückgebracht werden. Imaging Experimente können nach der gewünschten Inkubationszeit (Tage bis Wochen nach einer viralen Injektion) eingeleitet werden.
5. Cleanup
- Spülen Sie die Mikropipette mit 10% Bleichmittel und entsorgen Sie sie in einem für spitze Gegenstände aufbewahren.
- Entsorgen von Abfall-Container in der gleichen Weise wie Abschnitt 1.
- Discard Labortisch Papier in biohazard bin und wischen Sie alle Oberflächen und Instrumente, die in Kontakt mit dem Virus mit 10% Bleichmittel kommen kann.
- Ungenutzte Virus kann wieder eingefroren werden, wenn man bedenkt, dass die wiederholte Frost / Tau-Zyklen Abbau des Virus führen.
6. Repräsentative Ergebnisse
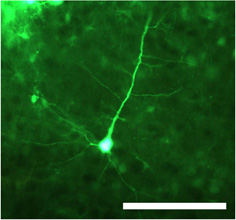
Abbildung 1. Transduzierten Neuron nach der Injektion von doppelsträngiger Adeno-assoziierten Virus Serotyp 1 (dsAAV S1) trägt grün fluoreszierende Protein (GFP) unter Kontrolle des CMV-Promotor. Der Zellkörper sowie proximalen und distalen Dendriten sind deutlich sichtbar in festen Abschnitten aufgenommen mit einer epifluoreszenten Mikroskop. Maßstab = 100 um.
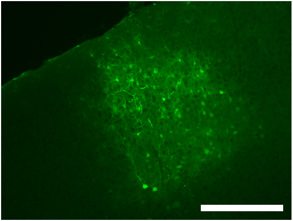
Abbildung 2. Labeling typisch für eine intrakranielle Virus Injektion in primären visuellen Kortex mittels dsAAV S1 zeigt das Ausmaß der viralen Verbreitung sowie markierten Neuronen, Glia und Prozesse. Maßstab = 250 pm.
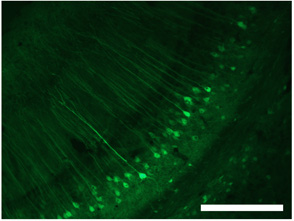
Abbildung 3. Labeling der Zellen im Hippokampus mit dsAAV S1. Maßstab = 250 pm. Diese Zahlen stammen aus Lowery et al angepasst. 2009 1
Diskussion
Viral-vermittelte Gentransfer birgt ein großes Potenzial für die Untersuchung der neurologischen Prozesse und Behandlung von Störungen des Gehirns 1,2,3. Die große Vielseitigkeit dieser Technik kann auch genutzt werden, um Fluoreszenz-Label-Zellen für die Bildgebung sowohl in vitro und in vivo 4 sein. Hier zeigen wir ein detailliertes Verfahren für die Transduktion von Neuronen und Gliazellen in Maus visuellen Kortex mit einer doppelsträngigen Adeno-Verein Virus, das Enhanc...
Offenlegungen
Danksagungen
Diese Arbeit wurde ermöglicht durch Zuschüsse aus dem NIH (EY012977), ein Career Award in der Biomedizin von der Burroughs Wellcome Fund, der Whitehall-Stiftung, und die Sloan Foundation (AKM).
Materialien
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
Referenzen
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten