Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección intracraneal de adeno-asociado vectores virales
En este artículo
Resumen
Aquí presentamos la inyección intracraneal de vectores AAV de marcaje fluorescente de las neuronas y la glía en la corteza visual.
Resumen
Inyección intracraneal de vectores virales para expresar una proteína fluorescente es una técnica de etiquetado versátil para la visualización de grupos específicos de células en diferentes regiones del cerebro, tanto en vivo y en secciones de cerebro. A diferencia de la inyección de colorantes fluorescentes, etiquetado viral ofrece focalización de los tipos de células y es menos costoso y consume mucho tiempo que el establecimiento de líneas de ratones transgénicos. En esta técnica, un virus adeno-asociados (AAV) vector se inyecta por vía intracraneal mediante coordenadas estereotáxica, una micropipeta y una bomba automática para la entrega precisa de AAV en la zona deseada con el mínimo daño a los tejidos circundantes. Los parámetros de inyección se pueden adaptar a los distintos experimentos mediante el ajuste de la edad del animal a una velocidad de inyección, la ubicación de la inyección, el volumen de la inyección, la inyección, el serotipo AAV y el promotor dirige la expresión de genes. Dependiendo de las condiciones elegidas, de forma viral inducida por la expresión del transgén puede permitir la visualización de grupos de células, las células individuales o bien los procesos celulares, hasta el nivel de las espinas dendríticas. El experimento que se muestra aquí muestra una inyección de doble cadena AAV que expresa la proteína verde fluorescente para el etiquetado de las neuronas y la glía en la corteza visual primaria del ratón.
Protocolo
1. Virus Manipulación y almacenamiento
- Protección adecuada y técnicas de manejo deben ser elegidos con base en el nivel de bioseguridad de los virus que se utilizarán. Estas prácticas se pueden encontrar en Seguridad de la Biotecnología en la edición de los laboratorios microbiológicos y biomédicos º 5, disponible en el sitio web de CDC
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm ). El uso de vectores AAV está aprobado para un nivel de bioseguridad (BSL-1). Para el experimento se muestra aquí, una bata de laboratorio y guantes durante el manejo del virus, de acuerdo con los procedimientos para la manipulación de agentes BSL-1. - A fin de preservar la actividad de los virus es mejor dividirlo en pequeñas alícuotas para evitar la congelación y descongelación repetida.
- Preparar un gabinete de bioseguridad (BSC) de Clase II de alícuotas de virus en la limpieza de los BSC de los objetos innecesarios y esterilización de la superficie con un 70% EtOH. Coloque un vaso que contiene el 10% de solución de cloro en la campana de recogida de residuos contaminados con AAV. También se colocan en el BSC son tubos estériles de 0,5 ml y un recipiente con hielo seco.
- Descongele stock viral en el hielo fuera de la BSC.
- Vortex virus y abrir el tubo dentro del BSC.
- Pipeta el volumen de la alícuota que desee (por ejemplo, 5 l) en un tubo de 0,5 ml, cerrar el tubo y colocarlo en el hielo seco para congelar el flash-virus.
- Cuando todos los virus ha sido alícuotas, de desechar el tubo virus y puntas de pipeta en el recipiente de residuos que contienen cloro al 10%.
- Retire el contenedor de residuos de la campana y añadir cloro adicional del 10%, luego verter el cloro en el fregadero. Elimine los residuos de plástico en un contenedor de riesgo biológico como se indica por el oficial de su institución en materia de bioseguridad.
- Limpie cualquier equipo o las superficies que estuvieron en contacto con el virus con lejía al 10%. Deseche los guantes.
- Almacenar en alícuotas de -80 ° C congelador.
2. Cirugía
- Cubra el área quirúrgica con papel absorbente mesa de laboratorio. Los instrumentos quirúrgicos deben ser esterilizados y al cabo la cirugía en condiciones asépticas, de acuerdo con la bioseguridad de su institución y las directrices el uso de animales.
- Elija un área adyacente a la zona de la cirugía que se dedica a la carga de las micropipetas con el virus, y se cubre con papel absorbente mesa de laboratorio. Introducir una alícuota del virus en un contenedor de hielo en esta zona, y permiten que el virus de descongelar el hielo que la cirugía se está realizando.
- Configuración de un contenedor de residuos de cloro al 10% en el área de virus dedicado a tratar de deshacerse de puntas de pipeta, etc, que entran en contacto con el virus.
- Tire de una micropipeta de vidrio a una Wiretrol diámetro de la punta de aproximadamente 20 micras. Coloque una pequeña gota de aceite mineral en el extremo romo de la micropipeta e inserte el émbolo cable suministrado con la micropipeta.
- Asegurar la micropipeta en la abrazadera del brazo microbomba.
- Se inyecta por vía subcutánea con un ratón de la buprenorfina en dosis de 0,5 mg / kg. Anestesiar el ratón con Avertin través de una inyección intraperitoneal con una dosis de 200 mg / kg y eliminar el vello de la parte superior de la cabeza con unas tijeras quirúrgicas, asegurándose de dejar un amplio margen suficiente para evitar que el pelo de entrar en la incisión.
- Coloque una manta de calefacción a la base de un stereotax para mantener una temperatura corporal de 37 ° C durante toda la cirugía y seguro con el ratón en la stereotax.
- Bañe a la cabeza con tres matorrales alterna de etanol y betadine para esterilizar la zona.
- Coloque una gota de pomada en cada ojo Tobradex para mantener los ojos húmedos durante la cirugía.
- Hacer una incisión en la línea media de la cabeza y tirar de la piel para exponer el cráneo.
- Retire con cuidado la fascia del cráneo con unas pinzas de punta fina.
- Busque el área a ser inyectada usando coordenadas estereotáxica y marca el cráneo con un rotulador quirúrgico.
- El uso de un taladro dental con una fresa de 1,4 mm, una delgada zona del cráneo de aproximadamente 2 mm de diámetro hasta que las grietas del cráneo, que divide la zona adelgazada en varios segmentos.
- A lo largo de este proceso, mantén el cráneo húmedo con aplicaciones de solución salina estéril.
- Realizar una craneotomía removiendo suavemente los segmentos del cráneo diluir con extra-fino con punta de pinzas.
3. Preparación de la inyección
- Con un KIMWIPE coloca sobre la tapa, abra el tubo del virus de la pipeta y 1.5uL (por una inyección de 1 ul) del virus en un pequeño trozo de parafilm.
- Coloque la punta de la micropipeta en la cepa viral y retirar manualmente el émbolo. Si hay dificultades de dibujo stock viral en la micropipeta, la punta puede ser ligeramente más grande que un piercing KIMWIPE con la micropipeta para romper una pequeña parte de la copa.
- Parte inferior del brazo microbomba en émbolo hasta que una pequeña cantidad de virus que se disipe de la punta de la micropipeta. Eliminar esta pequeña gota con un hisopo de algodón y el aplicador de descarte en las erascontenedor e.
- Aplique una gota de aceite mineral en la punta de la micropipeta para evitar la obstrucción de la micropipeta se introduce en el cerebro.
4. Virus de la inyección
- Uso de X e Y estereotáxica coordenadas, la posición de la micropipeta sobre el área a ser inyectada. En este experimento, el estereotáxica coordenadas que se utilizan para localizar la corteza visual primaria es de 2,7 mm posterior a bregma y 2,5 mm lateral a la línea media. Muy baja lentamente la micropipeta (a una tasa aproximada de 1mm/1minute) a la posición adecuada Z.
- Introduzca los parámetros de inyección deseado en la caja SYS Micro4 controlador microbomba e iniciar la inyección. Para este experimento, un microlitro de más de 10 minutos se puede utilizar como una tasa de inyección.
- Cuando se acabe la inyección, deje la pipeta para descansar de uno hasta dos minutos para evitar el flujo de salida del virus durante la extracción. Después de este período, muy lentamente quitar la micropipeta en el cerebro (tasa igual al anterior).
- Sutura en el cuero cabelludo y el sello con adhesivo tisular. Inyectar el animal por vía subcutánea con buprenorfina en dosis de 0,1 mg / kg cada 8-12 horas durante las próximas 72 horas, o hasta que el animal está mostrando signos de dolor. Que el animal pueda recuperarse bajo una lámpara de calor hasta que se deambular y listo para ser devuelto a su jaula. Experimentos de imagen puede ser iniciado después de que el tiempo de incubación deseado (días o semanas después de la inyección viral).
5. Limpieza
- Enjuague la micropipeta con lejía al 10% y desechar en un contenedor de objetos punzantes.
- Disponga de los contenedores de residuos en la misma forma que la sección 1.
- Deseche el papel del laboratorio en el banco de bin riesgo biológico y limpie todas las superficies y los instrumentos que pudieran haber entrado en contacto con el virus con lejía al 10%.
- Virus utilizados pueden ser congelados de nuevo, teniendo en cuenta que repetidos de congelación / deshielo causan la degradación de los virus.
6. Resultados representante
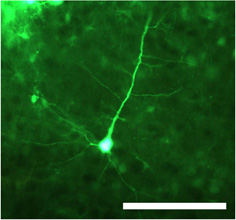
Figura 1. Transducidas neurona después de la inyección de doble hebra del virus adeno-asociado serotipo 1 (S1 dsAAV) la realización de la proteína verde fluorescente (GFP) bajo el control del promotor CMV. El cuerpo de la célula, así como las dendritas proximales y distales son claramente visibles en las secciones fijas fotografiado usando un microscopio de epifluorescencia. Barra de escala = 100 micras.
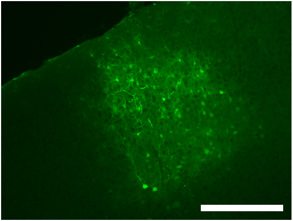
Figura 2. Etiquetado típico de una inyección de virus intracraneal en corteza visual primaria con S1 dsAAV muestra el grado de propagación viral, así como neuronas marcadas, la glía y procesos. Barra de escala = 250 micras.
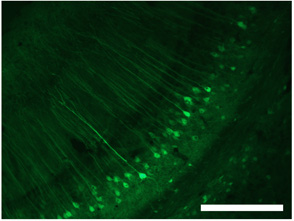
Figura 3. Etiquetado de las células en el hipocampo con S1 dsAAV. Barra de escala = 250 micras. Estas cifras son una adaptación de Lowery et al. 2009 1
Discusión
Viral mediada por la entrega de genes tiene un gran potencial para el estudio de los procesos neurológicos y el tratamiento de trastornos cerebrales 1,2,3. La gran versatilidad de esta técnica también puede ser aprovechado para marcar con fluorescencia células para obtener imágenes tanto in vitro como in vivo 4. Aquí se demuestra un procedimiento detallado para la transducción de las neuronas y la glía en la corteza visual del ratón con una doble cadena adeno-virus que ex...
Divulgaciones
Agradecimientos
Este trabajo fue posible gracias a subvenciones del NIH (EY012977), el Premio de carrera en las Ciencias Biomédicas del Fondo Burroughs Wellcome, la Fundación de Whitehall, y la Fundación Sloan (AKM).
Materiales
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
Referencias
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados