Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Injection intracrânienne des vecteurs adéno-associés virale
Dans cet article
Résumé
Nous présentons ici l'injection intracrânienne de vecteurs AAV pour le marquage fluorescent des neurones et cellules gliales dans le cortex visuel.
Résumé
L'injection intracrânienne de vecteurs viraux pour exprimer une protéine fluorescente est une technique de marquage polyvalent pour la visualisation des sous-ensembles spécifiques de cellules dans différentes régions du cerveau in vivo et dans les sections du cerveau. Contrairement à l'injection de colorants fluorescents, l'étiquetage virale offre ciblant des types cellulaires individuels et est moins coûteux et fastidieux que d'établir des lignées de souris transgéniques. Dans cette technique, une viraux adéno-associés (AAV) est injecté par voie intracrânienne en utilisant les coordonnées stéréotaxique, une micropipette et une pompe automatique pour la livraison précise de l'AAV à la zone désirée avec un minimum de dommages aux tissus environnants. Paramètres d'injection peuvent être adaptées à des expériences individuelles en ajustant l'âge des animaux à un taux d'injection, l'emplacement d'injection, le volume d'injection, d'injection, AAV de sérotype et le promoteur dirigeant l'expression des gènes. Selon les conditions choisies, viro-induit l'expression du transgène peut permettre la visualisation des groupes de cellules, des cellules individuelles ou d'une amende de processus cellulaires, jusqu'au niveau des épines dendritiques. L'expérience montre ici représente une injection de double-brin AAV exprimant la protéine fluorescente verte pour l'étiquetage des neurones et cellules gliales dans le cortex visuel primaire de souris.
Protocole
1. Manipulation du virus et le stockage
- Une protection adéquate et des techniques de manipulation doivent être choisis en fonction du niveau de biosécurité du virus à être utilisé. Ces pratiques peuvent être trouvés dans la biosécurité dans les laboratoires ème édition microbiologique et biomédicale 5, disponible sur le site du CDC
( http://www.cdc.gov/od/OHS/biosfty/bmbl5/bmbl5toc.htm ). L'utilisation de vecteurs AAV est approuvé pour la biosécurité de niveau 1 (BSL-1). Pour l'expérience présentée ici, une blouse et des gants seront portés lors de la manipulation du virus, conformément aux procédures de traitement BSL-1 agents. - Afin de préserver l'activité du virus, il est préférable de le diviser en petites portions pour éviter le gel et le dégel répétés.
- Préparer une enceinte de sécurité biologique (BSC) de classe II pour aliquotage virus par le BSC compensation de tous les objets inutiles et de stérilisation de la surface avec de l'EtOH 70%. Placer un bécher contenant une solution javellisée à 10% dans la hotte de la collecte des déchets contaminés AAV. Également placée dans le BSC sont stériles tubes de 0.5ml et un récipient de glace sèche.
- Dégel stock viral sur la glace en dehors de la BSC.
- Virus de Vortex et ouvrir le tube à l'intérieur du BSC.
- Pipeter le volume aliquote désirée (par exemple 5 uL) dans un tube de 0.5ml, fermer le tube et le placer dans la glace sèche pour flash-geler le virus.
- Lorsque tous les virus a été aliquotés débarrasser de ce tube de virus et des embouts de pipette dans le récipient de déchets contenant Javel à 10%.
- Retirez le conteneur de déchets provenant de la hotte et d'ajouter l'eau de Javel à 10%, puis verser l'eau de javel dans l'évier. Eliminer les déchets en plastique dans un container prévu comme indiqué par l'agent de votre institut de biosécurité.
- Nettoyer tout équipement ou des surfaces qui sont entrés en contact avec le virus de Javel à 10%. Jeter les gants.
- Conserver dans aliquotes à -80 ° C au congélateur.
2. Chirurgie
- Couvrir la zone chirurgicale avec un papier de laboratoire banc absorbant. Instruments chirurgicaux doivent être stérilisés et de la chirurgie effectuée dans des conditions aseptiques en conformité avec la biosécurité de votre institution et les directives d'utilisation d'animaux.
- Choisissez une zone adjacente à la zone chirurgicale qui sera dédié au chargement des micropipettes avec le virus, et le couvrir avec du papier absorbant de laboratoire banc. Placer une aliquote de virus dans un récipient de glace dans ce domaine, et permettre au virus de dégel sur la glace que la chirurgie est effectuée.
- Installation d'un conteneur de déchets d'eau de Javel à 10% dans la zone de manipulation du virus dédié pour l'élimination des embouts de pipette, etc qui viennent en contact avec le virus.
- Tirez une micropipette de verre Wiretrol à un diamètre de la pointe d'environ 20 microns. Placer une petite goutte d'huile minérale sur la fin brutale de la micropipette et insérez le piston de fil fourni avec le micropipettes.
- Fixez la micropipette dans la pince du bras micropompe.
- Injecter une souris avec la buprénorphine par voie sous cutanée à la dose de 0,5 mg / kg. Anesthésier la souris avec Avertin par injection intrapéritonéale avec une dose de 200 mg / kg et enlever les poils du dessus de la tête avec des ciseaux chirurgicaux, en veillant à laisser des marges assez grandes pour empêcher les cheveux d'entrer dans l'incision.
- Fixer une couverture chauffante à la base d'un stereotax pour maintenir une température corporelle de 37 ° C toute l'opération et assurer la souris dans la stereotax.
- Baignez la tête avec trois gommages alternance d'éthanol et bétadine pour stériliser la région.
- Déposer une goutte de pommade ophtalmique Tobradex sur chaque œil à garder les yeux humides pendant la chirurgie.
- Faire une incision le long de la ligne médiane de la tête et tirer la peau du dos pour exposer le crâne.
- Retirez délicatement la façade du crâne à l'aide à pointe fine pince.
- Localisez la zone à être injecté en utilisant les coordonnées stéréotaxiques et marquer le crâne avec un stylo chirurgical.
- En utilisant une fraise de dentiste avec une bavure 1.4mm, fine une zone du crâne d'environ 2mm de diamètre jusqu'à la fissure du crâne, en divisant la zone amincie en plusieurs segments.
- Tout au long de cette procédure, garder le crâne humide avec des applications de solution saline stérile.
- Effectuer une craniotomie en enlevant doucement les segments du crâne à l'aide aminci extra-fine pince à pointe.
3. Préparation à l'injection
- Avec un Kimwipe placé sur le couvercle, ouvrir le tube de virus et de la pipette 1.5uL (pour une injection 1UL) du virus sur un petit morceau de parafilm.
- Placez la pointe de la micropipette dans le stock viral et manuellement retirer le piston. En cas de difficulté de dessin stock viral dans la micropipette, la pointe peut être agrandi être légèrement percer un Kimwipe à la micropipette pour casser une petite partie de la vitre.
- Bras inférieur sur micropompe piston jusqu'à ce qu'une petite quantité de virus est dissipé depuis la pointe de la micropipette. Retirer cette petite goutte avec un coton-tige et l'applicateur jeter dans étaiscontenant e.
- Appliquez une goutte d'huile minérale à la pointe de la micropipette pour éviter le colmatage de la micropipette est descendue dans le cerveau.
4. Injection du virus
- Utilisation de X et Y coordonnées stéréotaxique, la position de la micropipette sur la zone à injecter. Dans cette expérience, la stéréotaxie coordonnées utilisé pour localiser cortex visuel primaire sont postérieurs à 2,7 mm et 2,5 mm bregma latéral à la ligne médiane. Très lentement le micropipette (à un taux approximatif de 1mm/1minute) à la bonne position Z.
- Entrez les paramètres d'injection souhaitée dans la boîte SYS Micro4 contrôleur de micropompe et initier l'injection. Pour cette expérience, 1 microlitre de plus de 10 minutes sera utilisé comme un taux d'injection.
- Lorsque l'injection est terminée, laisser la pipette au repos pendant une à deux minutes pour empêcher l'efflux de virus lors de l'enlèvement. Après cette période, très lentement retirer la micropipette par le cerveau (même taux que ci-dessus).
- Suture du cuir chevelu et le sceller avec de la colle tissulaire. Injecter de l'animal sous-cutanée avec la buprénorphine à la dose de 0,1 mg / kg toutes les 8-12 heures au cours des 72 prochaines heures, ou aussi longtemps que l'animal manifeste des signes de douleur. Permettre à l'animal de retrouver sous une lampe chauffante jusqu'à ce qu'il soit ambulantes et prêt à être retourné à sa cage. Des expériences d'imagerie peuvent être engagées après le temps d'incubation désirée (jours ou semaines après l'injection virale).
5. Nettoyage
- Rincer la micropipette avec l'eau de Javel à 10% et le jeter dans un contenant pour objets pointus.
- Jeter le contenant des déchets de la même manière que la section 1.
- Jeter le papier dans le bac paillasse biorisques et essuyez toutes les surfaces et les instruments qui ont pu entrer en contact avec le virus de l'eau de Javel à 10%.
- Le virus inutilisés peuvent être congelés à nouveau, en gardant à l'esprit que répétées cycles gel / dégel provoque la dégradation des virus.
6. Les résultats représentatifs
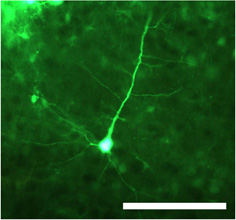
Figure 1. Transduction neurone après l'injection du double brin du virus adéno-associé de sérotype 1 (dsAAV S1) transportant la protéine fluorescente verte (GFP) sous contrôle du promoteur CMV. Le corps de la cellule ainsi que les dendrites proximales et distales sont clairement visibles dans les sections fixes imagée en utilisant un microscope à épifluorescence. Barre d'échelle = 100 pm.
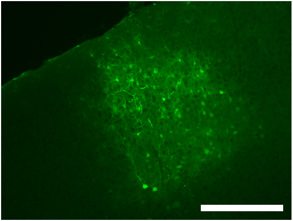
Figure 2. Étiquetage typiques d'une injection de virus intracrânienne dans le cortex visuel primaire en utilisant S1 dsAAV montrant l'ampleur de la propagation virale ainsi que des neurones marqués, glie et les processus. Barre d'échelle = 250 um.
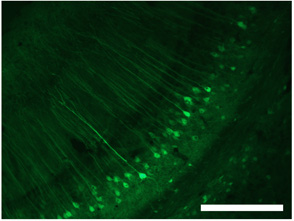
Figure 3. Étiquetage des cellules dans l'hippocampe en utilisant S1 dsAAV. Barre d'échelle = 250 um. Ces chiffres sont adaptés de Lowery et al. 2009 1
Discussion
Livraison de gènes médiée par Virally détient un grand potentiel pour l'étude des processus neurologiques et le traitement des troubles du cerveau 1,2,3. La grande polyvalence de cette technique peut aussi être exploitée pour marquer les cellules par fluorescence pour l'imagerie in vitro et in vivo 4. Ici nous démontrons une procédure détaillée pour la transduction de neurones et cellules gliales dans le cortex visuel de la souris en utilisant un double brin d&#...
Déclarations de divulgation
Remerciements
Ce travail a été rendu possible par des subventions du NIH (EY012977), une bourse de carrière dans les sciences biomédicales de l'Burroughs Wellcome Fund, la Fondation de Whitehall, et la Sloan Foundation (AKM).
matériels
| Name | Company | Catalog Number | Comments |
| St–lting Mouse and Neonatal Rat Adaptor | Stoelting Co. | 51625 | Regular stereotax for securing animals for surgery may be substituted |
| Extra Fine Bonn Scissors, 8.5cm, straight tip, cutting edge 13mm | Fine Science Tools | 14084-08 | |
| Eye Dressing Forceps, 10cm, tip width 0.5mm, curved | Fine Science Tools | 11152-10 | |
| Dumont #5/45 Forceps- Dumoxel Standard Tip, 11cm, angled | Fine Science Tools | 11251-35 | Extra-fine tipped forceps for performing craniotomy |
| Standard Pattern Forceps, straight, 2.5mmx1.35mmtip, 12cm | Fine Science Tools | 11000-12 | |
| Microtorque Control Box and Tech2000 handpiece | Ram Products, Inc. | TECH2000ON/OFF | Dental drill |
| Micro Drill Stainless Steel Burrs 1.4mm tip diameter | Fine Science Tools | 19008-14 | |
| Wiretrol micropipettes, to deliver 1-5 Ul | VWR international | 5-000-1001 or 53480-287 | |
| Mineral oil | VWR international | 29447-338 | |
| Manual Micromanipulator and Tilting Base (right-handed) | World Precision Instruments, Inc. | M3301-M3-R | Used for determining stereotaxic co-ordinates |
| UltraMicroPump (UMP3) (one) with SYS-Micro4 Controller | World Precision Instruments, Inc. | UMP3-1 | |
| Sutures | VWR international | 95056-952 | |
| P-97 Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Tobradex | Available from your institution’s veterinary services |
Références
- Kaplitt, M. G., Leone, P., Samulski, R. J., Xiao, X., Pfaff, D. W., O'Malley, K. L., During, M. J. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain. Nat Genet. 8, 148-154 (1994).
- Harding, T. C., Dickinson, P. J., Roberts, B. N., Yendluri, S., Gonzalez-Edick, M., Lecouteur, R. A., Jooss, K. U. Enhanced gene transfer efficiency in the murine striatum and an orthotopic glioblastoma tumor model, using AAV-7- and AAV-8-pseudotyped vectors. Hum Gene Ther. 17, 807-820 (2006).
- Lo, W. D., Qu, G., Sferra, T. J., Clark, R., Chen, R., Johnson, P. R. Adeno-associated virus-mediated gene transfer to the brain: duration and modulation of expression. Hum Gene Ther. 10, 201-213 (1999).
- Lowery, R. L., Zhang, Y., Kelly, E. A., Lamantia, C. E., Harvey, B. K., Majewska, A. K. Rapid long-term labeling of cells in the developing and adult rodent visual cortex using double-stranded adeno-associated viral vectors. Dev Neurobiol. 69, 674-688 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon