Method Article
Visualisierung der interstitiellen Zellen von Cajal (ICC) Netzwerk in Mäuse
In diesem Artikel
Zusammenfassung
Die interstitiellen Zellen von Cajal (ICC) sind die Schrittmacher-Zellen des Magen-Darm (GI-Trakt). Sie bilden komplexe Netzwerke zwischen glatten Muskelzellen und postganglionären Neuronen Fasern GI Kontraktilität zu regulieren. Hier präsentieren wir Immunfluoreszenzverfahren Querschnitts-und Ganzkörper-Mount-Visualisierung von Maus-ICC-Netzwerke.
Zusammenfassung
Die interstitiellen Zellen von Cajal (ICC) sind mesenchymale abgeleitet "Schrittmacher-Zellen" des Magen-Darm (GI-Trakt), die eine spontane langsame Wellen für Peristaltik erforderlich generieren und vermitteln neuronalen Input aus der enterischen Nervensystems system1. Verschiedene Subtypen des ICC Form unterschiedliche Netze in der Muscularis des GI-Trakts 2,3. Verluste oder Verletzungen zu diesen Netzen ist mit einer Reihe von Motilitätsstörungen 4 zugeordnet. ICC-Zellen exprimieren den KIT-Rezeptor-Tyrosin-Kinase an der Plasmamembran und KIT Immunfärbung für die letzten 15 Jahre verwendet wurde, um die ICC-Netz 5,6 Etikett. Wichtig ist, dass normale KIT Aktivität für ICC Entwicklung 5,6 erforderlich. Neoplastischen Transformation von ICC-Zellen führt zu gastrointestinalen Stromatumoren (GIST), die häufig Hafen gain-of-function Mutationen KIT 7,8. Wir haben kürzlich gezeigt, dass ETV1 einer Linie-spezifische Überleben Faktor in der ICC / GIST Linie zum Ausdruck kommt und ist ein Meister Transkriptionsregulator sowohl für normale ICC-Netzwerk Bildung und des GIST Tumorgenese 9 benötigt. Wir zeigen ferner, dass es mit aktivierenden KIT-Mutationen in der Tumorgenese kooperiert. Hier beschreiben wir Methoden zur Visualisierung von ICC-Netzwerke in Mäusen, die weitgehend auf bereits veröffentlichten Protokollen 10,11 basieren. In jüngerer Zeit hat die Chlorid-Kanal anoctamin 1 (ANO1) auch als Membran-Marker der ICC 11,12 charakterisiert worden. Aufgrund ihrer Plasmamembran-Lokalisierung, können Immunfluoreszenz beider Proteine verwendet werden, um die ICC-Netzwerke zu visualisieren. Hier beschreiben wir die Visualisierung der ICC-Netzwerke durch feste gefrorene cyrosections und whole mount Präparaten.
Protokoll
1. Dissection der Maus GI-Trakt
- Eingeschläfert Mäusen durch lokale IUCAC Richtlinien
- Pin jedes Glied auf Styropor Oberfläche und spülen Bauchdecke mit 70% Ethanol. Öffnen Bauchhöhle mit langen Mittellinienschnitt von der Membran bis zum Schambein. Machen Sie einen am distalen Speiseröhre und einen zweiten Schnitt am distalen Dickdarm schneiden und entfernen Sie die GI-Trakt vom Magen bis zum Anus en bloc, sorgfältig schneiden Bänder in den Zwölffingerdarm und Blinddarm mit einer kleinen Schere. Legen GI-Trakt in einer Petrischale mit PBS. Dissect weg Mesenterium mit einer Pinzette (Abbildung 1). Um Magen, Dünndarm und Dickdarm, Schnitt am Pylorus und Bauhin Kreuzung zu trennen. Spülen Sie das Lumen der einzelnen Teile des GI-Trakts mit PBS mit einer 5ml-Spritze an einer Fütterung Nadel (ältere Mäuse) oder stumpfen Nadel (jüngere Mäuse).
- Offene Magen, Dünndarm und Dickdarm entlang der mesenterialen Grenze. Schneiden Sie zwei Stücke für jeden Teil des Magen-Darm-Trakt, eine für ganze Berg Visualisierung und eine für Gefrier.
2. Whole mount Probenvorbereitung und Immunfärbung
- Legen Sie das gesamte Stück von jedem Teil des GI-Trakt in ein 1,5 cm Mikrozentrifugenröhrchen mit 1,0 ml eiskaltem Aceton und fix Proben für mindestens 1 Stunde gefüllt bei 4 ° C. Die Proben können bis zu 1 Woche bei -20 ° C gelagert werden Wir typischerweise Lagerung von Proben in Aceton und fahren Sie mit cyrosections vorzubereiten.
- Wash Probe 2X mit PBS. Wägegut in Petrischale mit PBS. Unter Sezieren miscroscope vorsichtig abkratzen Schleimhautschicht mit einem Skalpell, indem das eine Ende mit einer Pinzette, so dass die Muscularis.
- Muscle können in 5mm Stücke für Färbung mit verschiedenen Antikörpern geschnitten werden. Nicht mehr als 2 Tage in PBS vor der Färbung.
- Block-und Inkubationsschritte können in einer Vertiefung einer 24-Well-Platte oder in einem 1,5 ml Mikrozentrifugenröhrchen durchgeführt werden. Block mit 0,5 ml Blocking-Puffer (5% Ziegenserum, 0,1% Triton X-100 in PBS für 1 Stunde bei 4 ° C).
- Inkubieren mit dem primären Antikörper in Blocking-Puffer verdünnt und drehen über Nacht bei 4 ° C. Wir haben erfolgreich ACK-2 Ratte anti-Kit, Kaninchen-Anti-Ano1 und Kaninchen-Anti-Pgp9.5 Antikörper für ganze Berg Immunfärbung verwendet.
- Wash für 5 min 2X mit PBS auf Rotator bei Raumtemperatur.
- Inkubieren mit sekundärem Antikörper in Blocking-Puffer für 2 Stunden bei Raumtemperatur auf Rotator verdünnt. Wir verwenden in der Regel Alexa Fluor 488 Anti-Kaninchen-und Alexa Fluor 594 Anti-Ratte-Antikörper.
- Wash für 15 min 3X mit PBS auf Rotator bei Raumtemperatur.
- Berg auf dem Objektträger, serösen Seite nach oben, um die Orientierung des Gewebes während der Mikroskopie zu gewährleisten. Diese Ausrichtung wird sichergestellt, der serösen Seite des Deckglases Gesicht und erste angetroffen werden als in die Folie auf einem Mikroskop fokussiert. Wir tun dies auf einem Binokular. Manchmal gehen wir kurz untersuchen das Gewebe unter der Fluoreszenzmikroskopie richtig orientieren. Unter Fluoreszenzmikroskopie Kit oder Ano1 visualisieren, sollte man die ICC-MY-Netzwerk der ersten Begegnung von der Seite des Deckglases. Als nächstes absaugen PBS so viel wie möglich, ohne sie komplett trocknen. Add 50 ul hart eingestellt Eindeckmittel (wir verwenden Verlängern Gold) und sanft Ort Deckglas auf Gewebe. Erlaubt das Setzen der Montage über Nacht bei Raumtemperatur und Objektträger bei -80 ° C.
- Für die mikroskopische Untersuchung verwendeten wir eine Weitfeld-Mikroskop mit einem Z-Antrieb. Wir haben entweder einen 20X Luft Objektiv (NA 0,75, Plan-Apochromat) oder 60X Öl-Objektiv (NA 1.4, Plan-Apochromat) und nahm 2 um oder 1 mu m Z-Profile, die sich über die gesamte muscularis. Die Bilder wurden anschließend zerlegt mit Autoquant Dekonvolution Software. Alternativ haben viele andere konfokale Mikroskopie, anstatt mit ähnlichen Ergebnissen verwendet.
3. Gefrier Vorbereitung und Immunfärbung
- Legen Sie jeden Teil des GI-Trakts, serösen Seite nach unten flach auf Filterpapier. Cut-Filter Papier um das Gewebe. Legen Gewebe auf Filterpapier in 4% Paraformaldehyd (PFA) in PBS (wir verdünnte 32% Paraformaldehyd in verschlossenen Fläschchen in PBS kurz vor Gebrauch) für 2 Stunden bei Raumtemperatur. Oder 12-Well-Platte je nach Größe des Gewebes, oder in einem 1,5 ml Mikrozentrifugenröhrchen - Fixation kann in einem 6 durchgeführt werden. Wenn in der Platte getan, um Parafilm minimieren PFA Exposition. Längere Fixierung Zeiten können in Antigen Maskierung führen, insbesondere für die ACK-2 anti-Kit-Antikörper.
- Entfernen Gewebe aus PFA und in 30% Saccharose in PBS. Lassen Gewebe über Nacht versinken in 4 ° C.
- Äquilibrieren Gewebe mit 1:1-Verhältnis von 30% Saccharose und OCT für 1 Stunde. Dann montieren Gewebe vertikal in cryomold mit OCT gefüllte Die Längsachse des GI-Trakts sollte parallel zu den cyrosections werden. Bei der Prüfung Mäuse mit unterschiedlichen Genotypen oder mit verschiedenen Behandlungen, kann es nützlich sein, um Gewebe aus verschiedenen Mäusen auf gleiche cryomold montieren, um parallele Verarbeitung zu gewährleisten. Freeze auf Trockeneis und in -80 ° C Tiefkühltruhe für die Lagerung.
- Cut 10 pm Kryoschnittenauf Rutsche und bei -80 ° C Gefrierschrank. Wir in der Regel schneiden Sie zwei Abschnitte pro Folie. Wir übernehmen in der Regel H & E Färbung eines Gefrier gleiten.
- Für Immunfluoreszenz zunächst ausgleichen slide bei Raumtemperatur für 15 Minuten. Dann ziehen Kreis um Gewebe mittels PAP Stift.
- Block mit 150 ul Blocking-Puffer (wie bei Whole Mount Immunfärbung) für 1 Stunde.
- Saugen Sie Blockierungspuffer und fügen 150 pl primärer Antikörper in Blocking-Puffer verdünnt und inkubieren Nacht bei 4 ° C in einer feuchten Kammer.
- Wash 5 min 2X mit PBS.
- Inkubieren mit sekundärem Antikörper in Blocking-Puffer für 2 Stunden bei Raumtemperatur verdünnt. Wir verwenden in der Regel Alexa 488 Anti-Kaninchen-und Alexa 594-anti-Ratte Antikörper.
- Wash für 15 min 3X mit PBS.
- Saugen Sie gleiten, ohne vollständig trocknen Gewebe. Fügen Sie einen Tropfen hart eingestellt Eindeckmittel mit DAPI (wir verwenden Verlängern Gold) und Platz # 1.5 Deckglas. Legen Sie gleiten über Nacht bei Raumtemperatur zu setzen und in -80 ° C Gefrierschrank lagern.
- Erwerben Sie dreifach Fluoreszenzbilder mit DAPI, FITC und Texas Red-Filter-Sets.
4. Repräsentative Ergebnisse:
Hier verwenden wir den Dickdarm als Beispiel. H & E eines Saccharose Flecken geschützt festen gefrorenen Abschnitt Immunfluoreszenz verwendet zeigt einige Artefakte, um einen Verweis Paraffinschnitt (Abbildung 2), verglichen, wo die gelbe Linie renzeichen der Plexus myentericus zwischen der Kreis-und Längs-Muskelschichten und die grüne Linie renzeichen der Grenze zwischen den Schleimhaut und muscularlis. Die Untersuchung der Gefrier, von der Serosa zu Schleimhaut Sie die erste Begegnung der dünneren Längsmuskulatur (LM)-Schicht durch die dickeren Ringmuskel (CM) Schicht. Der Abschnitt sollte parallel zu den Längs-Muskel, so dass die Kerne der LM etwas länglich sein sollte, während die Kerne der CM sollte klein und rund. Zwischen den LM und CM sind myentericus plexi von Neuronen, die mit Pgp9.5 Fleck gemacht. Pgp9.5 auch Flecken neuronale Prozesse in der gesamten CM. Die myentericus ICC-Netzwerk (ICC-MY) umgeben den Plexus myentericus und der multipolaren Zellen. Innerhalb der Längs-Muskelschicht, gibt es seltene intramuskuläre ICCs (ICC-IMs), die bipolare Zellen laufen parallel zu den Muskeln. Innerhalb der Ringmuskelschicht, gibt es reichlich ICC-IMs, die auch bipolare Zellen, die parallel mit der kreisförmigen Muskeln und sind im Querschnitt mit diesem Schnitt. An der Kreuzung der Muscularis und Submucosa, ist die submuköse ICC-Netzwerk, bestehend aus ICC-SMP einem flachen Netz von multipolaren ICCs. Die Untersuchung der ganze Berg Kit Immunfärbung des Dickdarms, sollte man erwarten, dass die ICC-MY-Netzwerk der ersten Begegnung, und dann das ICC-IM des CM und ICC-SMP-Netzwerke, wie man aus dem Deckglas konzentriert (Figure. 3) . Volumetrische Messung der ICC-Netzwerke mit 3D-Rekonstruktion von ganzen-mount Bilder wurden 10 beschrieben. Mit Weitwinkel-Mikroskop, gibt es signifikante out-of-plane-Fluoreszenz in den RAW-Bildern, die nach Entfaltung entfernt werden (Abbildung 3) kann. Unvollständige Abisolieren der Schleimhaut wird in hoher Hintergrundfluoreszenz führen. ANO1 ist ein weiterer Marker für ICC und Co-Immunfärbung von KIT und ANO1 zeigt die vollständige Überlappung von ICC-Färbung (Abbildung 4).
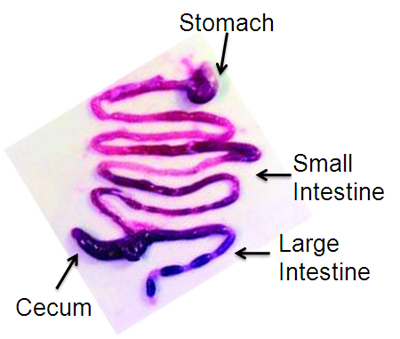
Abbildung 1. Representative seziert Maus Gastrointestinaltrakt, mit Genehmigung 13.
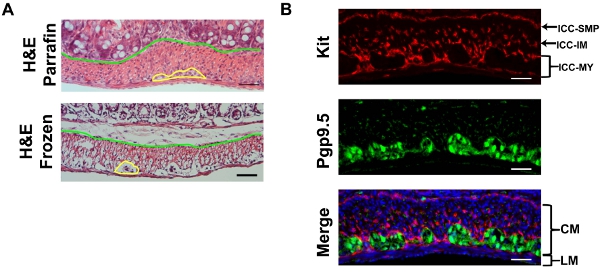
Abbildung 2. A) Repräsentative H & E Färbung der Maus Dickdarm Kryoschnitten wie beschrieben hergestellt und Referenz in Paraffin eingebetteten Abschnitt zeigt eine gewisse Schrumpfung Artefakte Kryoschnitten. Die gelbe Linie renzeichen der Plexus myentericus und die blaue Linie trennt die Schleimhaut von der muscularis. B) Vertreter Kit (rot, ACK-2) und Pgp9.5 (grün) Doppel-Immunfluoreszenz mit DAPI (blau) Gegenfärbung der Maus Dickdarm. LM: Längsmuskel CM: Ringmuskel. Maßstabsleiste 20 um.

Abbildung 3. Representative Kit (rot, ACK-2) ganz-mount Immunfluoreszenz von dem gleichen Feld in drei Fokusebenen, die ICC-MY-Ebene an der LM / CM Grenze, die ICC-IM Flugzeug in der CM und die ICC- SMP-Ebene an der CM / Submukosa Grenze. Raw-Bilder und entfalteten Bilder angezeigt werden. Maßstabsleiste 20 um.
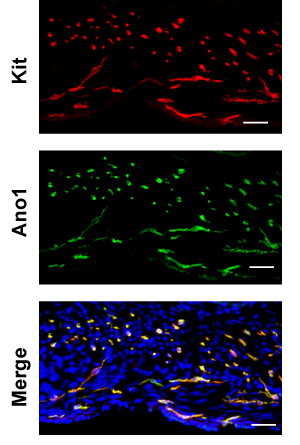
Abbildung 4. Representative Doppel-Immunfluoreszenz Ano1 (grün) und Kit (rot, ACK-2) im Dickdarm. Maßstabsleiste 20 um.
Diskussion
Interstitiellen Zellen von Cajal wurden zunächst von Santiago Ramóón y Cajal genau ein Jahrhundert zuvor mit Methylenblau und Silberchromat Flecken von Magen-Darm-muscularis aus. Cajal ursprünglich angenommen ICC wurden Neuronen auf ihre Prozesse zugrunde, dass die an der Axone und Dendriten sind. Über viele darauf folgenden Jahren hat Studium der Biologie ICC durch einen Mangel an spezifischen Markern bis zur Entdeckung des KIT ist nicht nur in ICC ausgedrückt beschränkt, sondern ist auch für ihre Entwicklung 6 erforderlich. Seitdem hat sich KIT Immunfluoreszenz weithin in das Studium der ICC Biologie verwendet und hat auch auf die Aufwertung des ICC in anderen kontraktilen Organe wie die Harnblase geleitet. Vor kurzem hat ANO1 als zweite zuverlässiger ICC-Marker identifiziert worden.
Es hat zahlreiche Publikationen über die vergangenen 15 Jahre mittels Immunfluoreszenz auf ICC identifizieren anhand verschiedener Fixierung und Montage-Techniken wurden. In unseren Händen "fixed-frozen" Gefrierschnitte, die mit Paraformaldehyd und Saccharose geschützt wurden vorangestellt funktioniert am besten in Aceton oder Paraformaldehyd Postfixierung nach Kryoschneiden verglichen. Für ganze Reittiere, haben wir festgestellt, dass Aceton-Fixierung durch Schleimhaut-Dissektion folgte der robustesten Ergebnisse liefert.
Historisch gesehen hat die ACK-2 die Kit-Antikörper der Wahl für die Maus ICC Identifizierung. Es ist eine Ratte monoklonale dass die extrazelluläre Domäne erkennt und es ist auch eine blockierende Antikörper, Ileus verursacht, wenn gegeben, um Mäuse zu leben. Allerdings ist die ACK-2 Epitop langsam durch Paraformaldehyd Fixierung zerstört und wird nicht von Standard-Antigen-Retrieval-Methoden gerettet. Wir haben festgestellt, dass die ACK-4-Epitop widerstandsfähiger gegen Paraformaldehyd Fixierung ist. Im Vergleich zu festen gefrorenen Blöcke und Sektionen, in Paraffin eingebettete Blöcke und Sektionen bewahrt Morphologie besser aus und ist eher für die langfristige Archivierung (Abbildung 4). Weder ACK-2 noch ACK-4 wurden erfolgreich in Paraffinschnitten verwendet. Wir haben dadurch gekennzeichnet, dass D13A2, ein neues Kaninchen monoklonaler Antikörper, außergewöhnlich gut funktioniert in beide Fest-gefroren und Paraffinschnitten des GI-Trakts.
Kit wird in verschiedenen anderen Zelltypen, einschließlich Melanozyten, hämatopoetischen Zellen, Keimzellen, insbesondere Mastzellen, die auch in der GI-Trakt finden ihren Ausdruck. Glücklicherweise sind die meisten Mastzellen gefunden wird die Schleimhaut und nicht in der Muscularis. Doppelfärbung mit Kaninchen-Anti-Ano1 und Ratte anti-Kit beseitigen können nicht-spezifische Färbung jedes Antikörpers (Abbildung 4). Es ist auch erwähnenswert, dass die relative Expression von Kit und Ano1 zwischen Unterklassen von ICC verschiedenen scheint. Zum Beispiel in den Dünndarm, ist Kit Färbung viel intensiver in myentericus ICC im Vergleich zum ICC der tiefen Muskulatur Plexus während Ano1 Färbung ist vergleichbar.
Offenlegungen
Danksagungen
Diese Arbeit wurde von der National Cancer Institute (K08CA140946, um YC), (5F32CA130372 zu PC), (R01CA102774 und R01HL055748 zu PB), das Department of Defense (PC094302 zu YC), die Shuman Family Fund für GIST-Forschung (unterstützt PC), und die Starr Cancer Consortium (auf PC, YC, CLS-und PB). Wir möchten Katia Manova, Ning Fan und Mesurh Turkekul der MSKCC Molekulare Zytologie Core Facility für die Hilfe bei Kryoschneiden und Immunfärbung danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Ratte anti-Kit-Antikörper (Klon ACK-2) | eBioscience | 14-1172 | Verwenden Sie bei 2μg/ml. Epitope ist mit overfixation verloren. |
| Ratte anti-Kit-Antikörper (Klon ACK-4) | Cedarlane | CL8936AP | Verwenden Sie bei 2μg/ml. |
| Kaninchen-Anti-KIT-Antikörper (Klon D13A2) | Cell Signaling | 3074 | Verwenden Sie bei 1:100 Verdünnung. Nur Antikörper hier, das funktioniert auch in Paraffinschnitten aufgeführt. |
| Kaninchen-Anti-Pgp9.5 Antikörper | Abcam | ab10404 | Labels neuronalen Zytoplasma. Nützlich für Kennzeichnung Neuronen des Plexus myentericus. Verwenden Sie bei 1:1000 Verdünnung. |
| Kaninchen-Anti-Ano1 Antikörper | Abcam | ab53212 | Verwenden Sie bei 2μg/ml |
| Alexa Fluor 594 Ziege anti-Ratte-IgG | Invitrogen | A-11007 | Verwenden Sie bei 2μg/ml |
| Alexa Fluor 488 Ziege anti-Kaninchen IgG | Invitrogen | A-11008 | Verwenden Sie bei 2μg/ml |
| Tierfütterung Needle | Fischer | 01-208-87 | Silicon gekippt Nadel nützlich für die Spülung GI-Trakt von erwachsenen Mäusen |
| Stumpfen Nadel | Becton Dickison | 305180 | Stumpfe Nadel nützlich für die Spülung GI-Trakt von pre-entwöhnt Welpen |
| ProLong Gold-Antifade Reagenz mit DAPI | Invitrogen | P-36931 | Mai alternative Hard-Einstellung Eindeckmittel mit DAPI verwenden |
| Tissue-Tek Cryomold | Tissue-Tek | 4557 | |
| Tissue-Tek OCT | Tissue-Tek | 4583 | |
| 32% Paraformaldehyd (10ml versiegelten Ampulle) | EM Sciences | 15714 | Öffnet versiegelte Ampulle und verdünnt auf 4% unmittelbar vor dem Gebrauch |
| Blocking-Puffer | 5% Ziegenserum, 0,1% Triton X-100 in PBS |
Referenzen
- Sanders, K. M. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology. 111, 492-515 (1996).
- Ward, S. M., Sanders, K. M. Physiology and pathophysiology of the interstitial cell of Cajal: from bench to bedside. I. Functional development and plasticity of interstitial cells of Cajal networks. Am J Physiol Gastrointest Liver Physiol. 281, 602-611 (2001).
- Komuro, T. Structure and organization of interstitial cells of Cajal in the gastrointestinal tract. J Physiol. 576, 653-658 (2006).
- Sanders, K. M., Ordog, T., Koh, S. D., Torihashi, S., Ward, S. M. Development and plasticity of interstitial cells of Cajal. Neurogastroenterol Motil. 11, 311-338 (1999).
- Ward, S. M., Burns, A. J., Torihashi, S., Sanders, K. M. Mutation of the proto-oncogene c-kit blocks development of interstitial cells and electrical rhythmicity in murine intestine. J Physiol. 480, 91-97 (1994).
- Huizinga, J. D. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature. 373, 347-349 (1995).
- Rubin, B. P., Heinrich, M. C., Corless, C. L. Gastrointestinal stromal tumour. Lancet. 369, 1731-1741 (2007).
- Hirota, S. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 279, 577-580 (1998).
- Chi, P. ETV1 is a lineage-specific survival factor in Gastrointestinal Stromal Tumour (GIST). Nature. , (2010).
- Kwon, J. G. Changes in the structure and function of ICC networks in ICC hyperplasia and gastrointestinal stromal tumors. Gastroenterology. 136, 630-639 (2009).
- Hwang, S. J. Expression of anoctamin 1/TMEM16A by interstitial cells of Cajal is fundamental for slow wave activity in gastrointestinal muscles. J Physiol. 587, 4887-4904 (2009).
- Gomez-Pinilla, P. J. Ano1 is a selective marker of interstitial cells of Cajal in the human and mouse gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol. 296, G1370-G1381 (2009).
- Sommer, G. Gastrointestinal stromal tumors in a mouse model by targeted mutation of the Kit receptor tyrosine kinase. Proc Natl Acad Sci U S A. 100, 6706-6711 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten