Method Article
Video-rate konfokalen Mikroskopie und Mikroendoskopiesysteme
In diesem Artikel
Zusammenfassung
Die komplette Konstruktion eines eigenen, real-time konfokalen Scanning Imaging-System beschrieben wird. Dieses System, das leicht für Video-rate-Mikroskopie und Mikroendoskopie verwendet werden kann, erlaubt eine Reihe von Imaging-Geometrien und-Anwendungen nicht zugänglich mit handelsüblichen konfokale Systeme, zu einem Bruchteil der Kosten.
Zusammenfassung
Die konfokale Mikroskopie hat sich zu einem wertvollen Werkzeug in der Biologie und der Biomedizin und ermöglicht eine schnelle, hohe Empfindlichkeit und hohe Auflösung optische Schnitte von komplexen Systemen. Die konfokale Mikroskopie wird routinemäßig eingesetzt, zum Beispiel auf bestimmte zelluläre Ziele 1, Monitor Dynamik in lebenden Zellen 2-4 studieren, und visualisieren die dreidimensionale Entwicklung ganzer Organismen 5,6. Erweiterungen der konfokalen Imaging-Systeme, wie die konfokale Mikroendoskopen, für die hochauflösende Bildgebung in vivo 7 zu ermöglichen und werden derzeit für Krankheiten Bildgebung und Diagnostik im klinischen Umfeld 8,9 angewendet.
Die konfokale Mikroskopie bietet dreidimensionale Auflösung durch die Schaffung von so genannten "optischen Schnitten" mit einfachen geometrischen Optik. In einem Standard-wide-field-Mikroskop wird die Fluoreszenz aus einer Probe erzeugt durch ein Objektiv gesammelt und weitergeleitet direkt auf einen Detektor. Während akzeptierenkönnen für die Bildgebung dünnen Proben, zu dicken Proben durch Fluoreszenz oberhalb und unterhalb der Objektivbrennebene generiert verwischt. Im Gegensatz dazu ermöglicht die konfokale Mikroskopie virtuelle optische Schnitte von Proben, die Ablehnung out-of-focus Licht hochauflösende dreidimensionale Darstellungen von Proben zu bauen.
Konfokalen Mikroskopen erreichen dieses Kunststück mit einem konfokalen Blende im Detektionsstrahlengang. Die Fluoreszenz von einer Probe durch das Ziel erhoben wird wieder durch den Scan-Spiegel und durch die primäre dichroitische Spiegel, ein Spiegel sorgfältig ausgewählt, um kürzere Wellenlängen wie die Laser-Anregungsstrahl reflektieren, während das Bestehen der länger Stokes-verschobene Fluoreszenzemission weitergeleitet. Diese langwellige Fluoreszenz-Signal wird dann an ein Paar Linsen auf beiden Seiten einer Lochkamera, die in einer Ebene exakt Konjugat mit der Brennebene des Objektivs positioniert ist vergangen. Photonen aus dem fokalen Volumen des Objekts gesammelt werden gebündeltdurch das Objektiv und werden durch das konfokale Linsen durch die Lochblende fokussiert. Fluoreszenz oberhalb oder unterhalb der Brennebene erzeugt wird daher nicht korrekt kollimiert werden, und wird nicht durch das konfokale Pinhole 1 Pass, die Schaffung einer optischen Abschnitt, in dem nur Licht aus dem Mikroskop Fokus sichtbar ist. (Abb. 1). So ist die Lochkamera effektiv wirkt wie ein virtueller Blende in der Brennebene, die Beschränkung des erkannten Emission nur einen begrenzten räumlichen Lage.
Moderne kommerzielle konfokalen Mikroskopen bieten dem Anwender den vollautomatischen Betrieb, so dass ehemals komplexe bildgebende Verfahren relativ einfach und zugänglich. Trotz der Flexibilität und Leistungsfähigkeit dieser Systeme sind kommerzielle konfokalen Mikroskopen nicht gut für alle konfokalen Imaging-Aufgaben, wie viele in vivo Imaging-Anwendungen geeignet. Ohne die Fähigkeit, maßgeschneiderte Imaging-Systeme zu schaffen, um ihre Bedürfnisse zu erfüllen, können wichtige Experimente bleiben in der Reaktionh für viele Wissenschaftler.
In diesem Artikel stellen wir eine Schritt-für-Schritt-Methode für die komplette Konstruktion eines eigenen, Video-rate konfokalen Imaging-System von Grundkomponenten. Die aufrechte Mikroskop wird unter Verwendung eines resonanten Galvanometer Spiegel, um die schnelle Scan-Achse zu schaffen, während ein Standard-Geschwindigkeit resonant galvanometrische Spiegel der langsamen Achsen-Scan werden. So erstellen Sie eine genaue abgelenkten Strahl in das Objektiv zu konzentrieren, wird dieser Spiegel bei den sogenannten telezentrischen Flugzeuge mit vier Relais-Linsen positioniert werden. Konfokalen Detektion wird durch die Verwendung einer Standard-, Off-the-shelf Photomultiplier (PMT) werden, und die Bilder werden erfasst und angezeigt werden mit einem Matrox Framegrabber-Karte und der mitgelieferten Software.
Protokoll
Die Wahl der Wellenlänge des Lasers, dichroitischen Spiegel und optische Filter sollte auf der Grundlage der spezifischen Farbstoffen in dem Experiment verwendete bestimmt werden. Zum Beispiel ist die konfokale Abbildung einer Probe mit Alexa Fluor 488 gefärbt am besten mit einem 488 nm Laser, einem 500 nm langen Pass dichroitischen Spiegel und eine 30 nm Bandbreite Bandpass-Spiegel bei 515 nm zentriert. Im Gegensatz dazu würde konfokale Bildgebung des roten Farbstoffes Alexa Fluor 647 erfordern einen anderen Satz von Komponenten. Das Mikroskop in diesem Protokoll wurde errichtet, um jeden Farbstoff, der stark absorbiert bei 400 nm und emittiert über 450 nm zu visualisieren. Deshalb haben wir uns eine 406 nm Anregungs-Laser und einem 425 nm langen Pass dichroitische, um den Laserstrahl zu reflektieren. Aufgeregt Fluorophore selektiv durch Auswahl der entsprechenden Emissionsfilter vorstellen. Es ist wichtig, um eine ordnungsgemäße optische Montage-Hardware im gesamten Protokoll an den angegebenen Stellen unsachgemäße oder behelfsmäßigen Hardware wird nicht halten Ausrichtung als gut und kann zu einem Sicherheitsrisiko werden.
1. Einrichten der Resonanz galvanometrische Spiegel und Relais-Optik
Ein wichtiges Konzept in Gebäude jeder Art von konfokalen Scanning-System ist Telezentrie. In ein telezentrisches optisches System, sind Linsen von einander durch die Summe ihrer Brennweiten, so dass die Vergrößerung des Systems ist einfach durch das Verhältnis der Brennweiten 1 definierten Abstand. Dies ermöglicht den Aufbau eines optischen Relais-System, wo die Vergrößerungen und damit das System Eigenschaften, leicht durch die Wahl der Objektive definiert sind. Ein weiteres wichtiges Konzept um so genannte "stationäre" optischen Ebenen, auch als "Blende Flugzeuge" bezeichnet. Eine Öffnung Ebene ist eine Position entlang der optischen Pfad, wo der Lichtstrahl die keinen Art Seitwärtsbewegung. In diesem Mikroskop-Design, gibt es drei wichtige Öffnung Ebenen: die erste und zweite Scanspiegel, und die Back-Apertur des Objektivs. Um eine optimale Strahl scanning in der Brennebene des Objektivs, muss der Strahl in das zurück Apertur des Objektivs stationär sein, kehren nur in Winkel. Um diese stationär, Winkel-gefegten Ebene zu schaffen, müssen wir die ersten und zweiten Scanspiegel an Konjugat, telezentrische Flugzeuge, um das Ziel Back-Blende Platz. Objektive zwischen den Spiegeln und dem Objektiv platziert sind, dienen zur Weiterleitung der Winkel-gescannten Strahl zwischen diesen stationären Ebenen (Abb. 2). Die Scan-Spiegel sind auf zwei Scan-Galvos, von denen jeder verantwortlich für das Scannen einer bestimmten Richtung der Bildebene (X und Y) montiert ist. Um die gewünschte Zeile Abtastrate für Video-Rate Imaging ist ein Hochfrequenz-Resonanz-Galvo erforderlich, um die x-Achse (auch bekannt als die "schnelle" Achse genannt) zu scannen. Diese Galvos nutzen eine sensible, closed-loop eine Rückkopplung auf eine sinusförmige Scanmuster erstellen und sind geeignet für den Betrieb bei sehr hohen Frequenzen, wählten wir einen 8 kHz Galvo für diese zu bauen.
- Einrichtendie Faser-Kollimator in der optischen montieren und grob steuern den Strahl über die Stellschrauben so dass sie in einer geraden Linie fährt sowohl horizontal als auch vertikal. Nun nehmen Sie eine Iris und legen Sie sie vor dem Faserkollimator, die Anpassung der Blende die vertikale Höhe, so dass der Strahl sauber durchläuft die Iris Center. Anschließend bewegen Sie die Iris vom Kollimator entlang der Strahlengang und beobachten, ob der Strahl immer noch Reisen durch die Iris-Center. Wenn nicht, stellen Sie den Strahl Position auf der Iris mit den beiden Stellschrauben.
- Setzen Sie den montierten dichroitischen Spiegel in den Strahlengang mit dem Laserstrahl ungefähr in der Mitte des Spiegels positioniert. Vor dem Einspannen der Spiegel auf den Tisch, drehen Sie den Spiegelhalter, um den Strahl auf etwa 90 Grad zu reflektieren und in etwa passen die Reflexion, so dass der reflektierte Laserstrahl die Höhe ändert sich nicht.
- Legen Sie eine montierte resonant galvanometrische Spiegel in den Laser-Strahlengang unter dem Autoe, um sicherzustellen, dass der Laserstrahl an der exakten horizontalen Mitte der Spiegelfläche positioniert ist. In diesem Protokoll war die Resonanz Galvo Spiegel direkt auf einen Spiegelhalter expoxied. Drehen Sie den Spiegelhalter, um den Laserstrahl in einem 90-Grad-Winkel zu reflektieren. Rund Einstellung der Reflexion vom Spiegel auf die gleiche Laserstrahl Höhe zu halten.
- Um jeden Lichtstrahl in einer bestimmten Richtung zu lenken, muss man per Definition definieren zwei Punkte im Raum, durch die der Strahl reist. Dieser ist in der Regel, indem man zwei Blenden entlang der gewünschten horizontalen und vertikalen Pfad und die Manipulation der Laserstrahl durch die Mitte jedes Iris Pass erreicht. Vier Freiheitsgrade sind erforderlich, um den Strahl einstellen, zwei horizontale und vertikale Freiheitsgrade für jeden Iris. Die häufigste und einfachste Weg, diese Freiheitsgrade zu erreichen ist, zwei Spiegel, um zu steuern, oder "walk", ein Laserstrahl verwendet.
Nehmen Sie zwei Iris, und legen Sie deren Höhe alsin Schritt 1.1, mit dem Laserstrahl reflektiert die Resonanz Galvo Spiegel als Referenz. Nun kann mit der Schraubenlöcher auf der optischen breadboard als Leitfaden für das Auge, klemmen die beiden Iris in einer geraden Linie. - Stellen Sie den dichroitischen Spiegel und resonant Galvo Spiegel den Laserstrahl durch die Mitte der beiden Iris steuern. Verwenden Sie den ersten Spiegel in den Weg (der dichroitische Spiegel) zum Zentrum des Strahls auf den ersten Iris, dann mit dem zweiten Spiegel in den Weg (die Resonanz Galvo Spiegel) zum Zentrum des Strahls auf die zweite Iris. Iterativ anpassen diesen beiden Spiegeln, bis der Strahl durch beide Iris ausgerichtet ist, sicherzustellen, während der Laserstrahl von der Resonanzfrequenz Galvo Spiegel noch aus der ungefähren Mitte Spiegel reflektiert. Wenn der Strahl abgelenkt, passen Sie die Faserkollimator montieren und wiederholen Sie den iterativen Schritten vor.
- Mit den Strahl auf beiden Iris zentriert, werden wir jetzt Platz zwei Relais-Linsen, die das Image der unsere erste stationäre, telezentrische Plane (dh die Resonanz Galvo Spiegel) auf unsere zweite stationäre, telezentrische Ebene (dh die Standard-Geschwindigkeit Galvo Spiegel). Für diese besondere Mikroskop, das ausgewählte Objektive in der ersten Staffel die gleiche Brennweite, "f" haben, so dass der Abstand zwischen den beiden Spiegeln in unserer telezentrischen System ist einfach 4f. Um sicherzustellen, dass die Linsen genau in den Strahlengang zentriert, verwenden Sie die Anordnung der Linsen Trick. Legen Sie das erste Objektiv in den Strahlengang und Blick auf den Laserstrahl Fleck auf der Iris als nächstes in den Strahlengang nach der Linse. Als nächstes stellen Sie die Linse Höhe vertikal, so dass die vertikale Mitte des Strahls an der Iris entfernt ist. Schließlich stellen Sie die horizontale Strahllage zum Zentrum des Strahls auf der Iris. Führen Sie diesen Vorgang für die zweite Linse.
2. Einrichten der zweiten Scanspiegel und Drehen des Mikroskops
- So finden Sie die genaue Position des zweiten telezentrische Flugzeug, hook up der Resonanz Galvo zuseine Abtasteinheit und schalten Sie ihn ein. Verwenden Sie ein weißes Visitenkarte an der Abtaststrahl durch die beiden Linsen zu verfolgen. Sie werden die telezentrische Flugzeug auf die ungefähre Entfernung von 4f von der Resonanzfrequenz Galvo, wo der Laserstrahl erscheint komplett stationären finden. Markieren Sie diese Position auf dem Steckbrett.
- Positionieren Sie den Standard-Scan-Galvo Spiegel genau dieses telezentrischen Flugzeug Standort, und stellen Sie den Spiegel Höhe und Position, so dass der Strahl an der telezentrischen Flugzeug genau in der Mitte des Scanspiegel Streiks. Es ist wichtig, an die Macht der Spiegel Steuerungs-Hardware und legte eine Spannung von 0 Volt auf dem Scanspiegel Eingang, so dass der Spiegel setzt sich auf seine neutrale Position während dieses Prozesses. Sorgfältig stellen Sie den Spiegel Winkel, um den Strahl senkrecht direkt und leicht anziehen Spiegel in Position.
- Wie bauen wir eine aufrechte Mikroskop sind, werden wir jetzt legen die zweite Steckbrett in einem 90 Grad Winkel mit 90 Grad Halterungen. Vergewissern Sie sich, schalten Sieder Laser-und Scan-Elektronik, trennen die Faser, und ziehen Sie den Scan-Spiegel während dieses Prozesses. Um den Rest der Ausrichtung einfacher, wenn die Klammern vorhanden sind verschraubt, sorgfältig drehen das gesamte Mikroskop, so dass die neue breadboard liegt jetzt flach. Benutzen Sie einen Haken mit dem Steckbrett auf die Arbeitsfläche zu beheben. Nun den Rest der ehemals vertikal Setup kann einfach durchgeführt werden auf dem flachen Steckbrett.
3. Einrichten des Scan-, Rohr-, Objektiv-und
Als nächstes werden wir Einrichten der zweite Satz von Relais-Linsen, die formal als "Scan-Objektiv" und "Tubuslinse" bezeichnet. Es ist wichtig, die richtige Kombination von Linsen, um so die richtige Vergrößerung auf das Ziel konzentrieren zu erreichen und zu optimieren die endgültige Auflösung zu wählen. Erstens, um die maximale numerische Apertur (NA) von jedem beliebigen Objektiv zu erreichen, muss der Laserstrahl fällt der Rückseite des Objektivs füllenzurück Blende komplett, erst dann wird das Objektiv in der Lage sein die engsten Schwerpunkt zu schaffen. Objektive haben eine Reichweite von hinten Maschenweiten; wählte eine Linse Vergrößerung leicht überfüllen zurück Öffnung der gewählten Zielsetzung. Zweitens, um die richtige Vergrößerung zu erreichen, muss das Objektiv mit dem Rohr Brennweite des Objektivs für die es konzipiert wurde angepasst werden. Leider haben verschiedene Mikroskop-Objektiv-Hersteller gewählt, um verschiedene Tubuslinse Brennweiten, so ist es wichtig, ein Mikroskop mit der richtigen Tubuslinse für die spezifischen Objektiv eingesetzt zu bauen. Außerdem sind bestimmte Hersteller wie Zeiss, Design ihrer Tubuslinsen für die spezifische chromatische Aberrationen ihrer abgestimmt Ziel, so dass mit einem falschen Ziel-Tubuslinse Paar wird in der Tat die Einführung neuer Aberrationen, die sonst nicht vorhanden wäre, zu kompensieren. Wir bevorzugen in der Regel Olympus Ziele, wie alle chromatischen Entschädigung in th durchgeführt wirde Ziel selbst, was das Ziel / Tubuslinse Paarung erleichtern. Obwohl das Mikroskop noch funktionieren wird, wenn das Objektiv und Tubuslinse nicht übereinstimmen, wird die tatsächliche Mikroskopvergrößerung wahrscheinlich nicht mit der Vergrößerung auf dem Objektiv angegeben. Für diese spezielle Mikroskop zu bauen, war die optimale zurück Maschenweite bestimmt bis 4 mm betragen, erfordern eine 1:4 Abbildungsmaßstab zwischen den Scan-Objektiv und Tubuslinse. Für diesen Brauch Mikroskop zu bauen, werden wir eine Scanlinse Länge von 75 mm und einer Tubuslinse Länge von 300 mm.
- Wie die gesamte Entfernung zwischen dem zweiten Scanspiegel und objektive Fokus ist groß, bauen dieses Segment des Mikroskops wird zuerst das Layout der Spiegel benötigt, um den Strahl auf das Objektiv zu lenken. Legen Sie die erste große, 2 "(50 mm) Durchmesser Spiegel nahe an den Rand des Steckbrett, und drehen Sie den Spiegelhalter, um den Laserstrahl etwa 90 Grad zu reflektieren. Rund Einstellung der Reflexion des Spiegels gleich hoch zu halten beam Höhe. Legen Sie die anderen 2 "Spiegel an der gegenüberliegenden Kante des Steckbrett bei einer Orientierung, die den Strahl nach unten in einem 90-Grad-Winkel. Verwenden Sie die Stellschrauben, um sicherzustellen, den Strahl der Höhe ändert sich nicht. Richten Sie zwei Iris, wie in Schritt 1,4, und stellen Sie die zwei Spiegel wie in Schritt 1,5 bis Zentrum gerichtet des Strahls auf der Iris.
- Mit der Iris noch vorhanden, legen Sie die Scan-Objektiv in den Strahlengang und stellen Sie die horizontale und vertikale Position auf der Laserspot auf der ersten Blende. Bei einem Abstand von 75 mm + 300 mm von der Linse (zwischen den beiden Spiegeln), vorsichtig die großen 2 "Tubuslinse und passen ihre horizontale und vertikale Position auf den Strahl auf die ersten Iris. Für die Zwecke der Aufrechterhaltung der Ausrichtung in die Zukunft, ist es sinnvoll, diese Iris an ihrem Platz bleiben; für diese Anwendung, eine Visitenkarte mit einem entsprechend kleinen Öffnung könnte zu einem Stand geklebt werden und in den Strahlengang.
- Bei allen Spiegeln und Linsennun in Kraft, mit dem Scannen beginnen die Resonanz Galvo Spiegel und die Standard-Scan-Spiegels. In diesem Aufbau wird die Standard-Scan-Spiegels letztlich die Scan-Rate des resonanten Spiegel durch ein custom-built Regelkreis, wie in Abbildung 3 beschrieben synchronisiert werden, dies sorgt für überlegene vertikale und horizontale Synchronisation. Doch für die Ausrichtung Zwecke und viele Imaging-Anwendungen kann der Spiegel einfach gescannt mit einem Sägezahn-Muster von einem Funktionsgenerator werden. Mit einer Visitenkarte, suchen Sie den Laserstrahl an einer Stelle 300 mm nach der Tubuslinse. Obwohl der Strahl anderswo Scannen ist in das Mikroskop sowohl in vertikaler und horizontaler Richtung, sollte der Strahl völlig stationär in der Nähe dieser Stelle. Dies ist, wo der Rückseite Apertur des Objektivs platziert werden. Wenn die horizontale und vertikale stationäre Flugzeuge nicht auf der gleichen Ebene entlang der Strahlengang übereinstimmen, sorgfältig ausspannen und übersetzen die Tubuslinse entlang des optischen Weges um sicherzustellen, dassbeide Ebenen überlappen so genau wie möglich. Re-Center die vertikale und horizontale Position der Tubuslinse und klemmen Sie sie fest in Position.
- Legen Sie das Objektiv in den Strahlengang, so dass Sie sicher, dass das Objektiv zurück Blende, um die stationäre Flugzeug nahe wie möglich positionieren. Das wahre Ziel zurück Blende kann eigentlich nicht immer auf die physische hintere Öffnung des Objektivs aufgrund unterschiedlicher Hersteller Design-Entscheidungen gefunden werden. Es ist daher immer am besten, die Sie mit dem Hersteller, den wahren zurück Blende Position zu bestimmen.
- Richten Sie die Probe Bühne, um sicherzustellen, dass die Übersetzung montiert, die zur z-Achsen-Bewegung ermöglicht werden kann über den gesamten Bereich, ohne in das Objektiv montieren zu bewegen.
4. Aufstellen und Ausrichten der konfokalen Blende und Detektor
- Trennen Sie alle Netzteile und Faseroptik, und drehen Sie das Mikroskop Montage, so dass es wieder ruht auf dem Steckbrett Halten der Resonanznant Scanspiegel. Clamp dem Steckbrett sicher an seinem Platz, dann wieder an der Faser bis zum Kollimator und re-connect beide Galvos und deren Steuerleitungen. Nach wie vor fahren statt 0 Volt der Steuerspannung die Standard-Scan-Galvo.
- Auf der Probenbühne, statt einer Visitenkarte oder einem kleinen Volumen eine helle Farbe in das Ziel zu konzentrieren, zwischen zwei Deckgläsern eingebettet. Die Wahl des Farbstoffes auf der Laser-und dichroitische ausgewählten abhängen; in diesem Fall werden wir die Fluoreszenzemission von einem weißen Visitenkarte verwenden, um die konfokalen Detektionssystem auszurichten. Quantenpunkte können auch zur Ausrichtung Zwecke nützlich, da sie hell sind und nicht photobleach. Andere Alternativen beinhalten fluoreszierende Kügelchen und / oder Gewebeproben ausgesetzt Farbe / Wäsche Aufheller, die beide hell leuchten. Schalten Sie die Laserquelle und bringen die Probe in das Mikroskop Fokus mit der Übersetzung der Bühne. Einmal im Mittelpunkt, sollte die Fluoreszenz von der Probe erzeugt werden sichtbar hinter ter dichroitischen Spiegel, wie im nächsten Schritt beschrieben. Maximieren Sie die Laserleistung, die Fluoreszenz so hell wie möglich zu machen.
- Mit einer Visitenkarte, verfolgen Sie die Fluoreszenzemission von der Probe durch das Objektiv und zurück durch das Scanning-System auf dem dichroitischen Spiegel. Der dichroitische Spiegel überträgt der Fluoreszenzemission während reflektiert den Laserstrahl, finden diese Fluoreszenz-Signal auf der anderen Seite des dichroitischen Spiegels. Nun, einen Spiegel hinter den dichroitischen Spiegel und es verwenden, um die Emission in einem 90-Grad-Winkel zu reflektieren. Nehmen Sie eine Iris, wie in Schritt 1.1 geschehen war, und verwenden Sie es zusammen mit dem Spiegel, um die Fluoreszenz Strahl als gerade und parallel mit dem Steckbrett wie möglich zu lenken. Dieser Schritt kann am besten durchgeführt werden bei schwachem Licht.
- Richten Sie die konfokale Lochblende Einheit, wie in Abb. 2 beschrieben. Wir haben festgestellt, dass die räumliche Filter Käfigmontage Montage von ThorLabs ideal für diese Aufgabe ist. Es ist wichtig, eine geeignete Pinhol wählene Größe, um sicherzustellen, dass die konfokale System seine optimale Auflösung erreicht, ohne dabei zu viel Signal. Für diesen Brauch Mikroskop wurde ein Loch von 100 um ausgewählt. Legen Sie die räumliche Filtereinheit im Einklang mit der Fluoreszenz-Strahlengang, wobei darauf zu Mitte der ersten Fokussierlinse Halterung an der Fluoreszenzemission Strahl. Nach der Montage einer kurzen Brennweite in das Gerät (ein Mikroskop-Objektiv kann auch verwendet werden), schieben Sie die z-Übersetzung Halterung, bis eine klare Fokussierung auf das Pinhole Oberfläche beobachtet werden kann. Achten Sie darauf, die gesamte Einheit ist entlang der exakt gerade Linie durch die Fluoreszenzstrahlengang gesetzt orientiert. Spannen Sie das Gerät mit dem Steckbrett.
Die Emission von den meisten Proben ist schwach im Vergleich zu Umgebungslicht sogar in dunklen Räumen. Es ist daher entscheidend, dass eine ausreichende Abschirmung / Licht verblüffende verwendet entlang der Emission Weg sein, von Streulicht Verschmutzung zu schützen. Darüber hinaus wird hellem Umgebungslicht Überlastung und Zerstörung vieler PMTs, insbesondere diejenigen, die keine cktuelle Schutz. Die Leser werden daher dringend aufgefordert, Linse Röhren verwenden, um die Emission Strahlengang zu umschließen; ein ordnungsgemäß abgeschirmtes System, wie das hier gezeigt, ist in der Lage den Betrieb im Zimmer Licht mit wenig bis gar kein Streulicht Kontamination. - Nun kann mit der Einstellknöpfe an der Übersetzung der Bühne, systematisch bewegen die konfokale Blende auf den Punkt, wo das Fluoreszenz-Signal durch die Lochblende wird maximiert, zu finden. Diese Position lässt sich am einfachsten durch iterative Anpassung der beiden Achsen um eine 2D-Suche über die Lochkamera Montagefläche führen identifiziert. Sobald das Signal zu maximieren Position gefunden ist, legen Sie die Kollimationslinse auf dem Käfig montiert, nachdem die Lochkamera. Finden Sie die Fluoreszenzemission, die durch den konfokalen Gerät mit einer Visitenkarte geht, und schieben Sie die Kollimationslinse entlang der Beiträge bis zum emittierten Fluoreszenz-Signal wird so weit wie möglich gebündelt. Sobald der Strahl kollimiert, sollten Sie den entsprechenden Filter in den Strahlengang in einer Linse Badewannee.
- Richten Sie den Photomultiplier (PMT) Montage. Legen Sie eine 50 mm Brennweite in der Fluoreszenzemission Strahlengang und findet seinen Schwerpunkt mit einer Visitenkarte. Markieren Sie diese Position auf dem Steckbrett. Nun schalten Sie den Laser komplett - das ist wichtig, wie Streu-oder ungedämpft Laserlicht dauerhaft beschädigen können die meisten PMTs. Positionieren Sie den PMT so, dass seine aktive Fläche möglichst nahe an den markierten Mittelpunkt wie möglich liegt. Schließen Sie das PMT Montage der fokussierenden Linse mit einstellbarer Linse Röhren und sorgfältig einzuwickeln dunklen Klebeband um alle exponierten Strahlengänge nach der Lochkamera.
- Schalten Sie den Laser, aber sicher sein, seine Macht äußerst gering, so dass die Fluoreszenz-Emission kaum zu sehen ist zu halten. Schalten Sie die PMT, sorgfältig zu lesen ihre Spannung auf einem Oszilloskop als die Steuerspannung erhöht. Eine PMT erzeugt ein Signal durch eine Reihe von Elektronen multipliziert Stadien, wenn der Photostrom ist zu hoch für die Lichtintensität, die Röhre kannirreversibel geschädigt. PMTs mit Strombegrenzung Schaltungen sind daher dringend empfohlen, vor allem für Anwender, die nicht mit solchen Detektoren gearbeitet haben.
Erhöhen Sie die PMT-Steuerspannung bis zu einem Spike-wie Auslesen und / oder ein DC-Offset auf dem Oszilloskop-Bildschirm zu sehen ist, für die meisten PMTs, dieses Signal wird negativ gegen Erde werden. Bestätigen Sie, dass dieses Signal in der Tat ergibt sich aus der Fluoreszenz durch Drehen der Laserleistung ab zu einem Verlust des Signals zu beobachten. - Schließlich iterativ ausrichten Lochkamera für maximale Signal auf dem Oszilloskop, indem Sie zuerst die Manipulation der fokussierenden Linse z-Position, und dann die Anpassung der yz-Übersetzung Bühne.
- Das Video-rate Mikroskop Hardware ist komplett! Hängen Sie nun den Spiegel, Custom Controls etc. und Computer wie in Abb. 3 schematisch dargestellt. Wie erwähnt, ist es empfehlenswert, den Imaging-System verwenden, zunächst visualisieren eine bekannte Größe Standard, um die optimale Auflösung des Mikroskops zu finden und berechnen Sie die Pixel--To-Auflösung Konstante für die Imaging-System. Es gibt viele Größe Normen, die verwendet werden können, wie weiße Visitenkarten mit bekannten Brief Größen-, Fluoreszenz-oder reflektierende Luftwaffe Ziele und fluoreszierenden Mikrosphären.
5. Vorbereiten des Systems für die konfokale Scanning Mikroendoskopie
In diesem Build verwenden wir ein kohärentes Bild-Faser, die aus einem Bündel von vielen Tausenden von Faserkerne besteht, eine solche Anordnung ermöglicht ein Bild, um durch die Faser und einfach rekonstruiert und / oder erweitert am anderen Ende (Abb. 4) übertragen werden. Die kohärente Faserbündel in den Bau dieses Endoskop verwendet wird an beiden Enden poliert, so dass es eine sogenannte "contact-mode" Mikroendoskops. Ein in-focus Bild wird daher nur dann gebildet, wenn die Mikroendoskops Spitze steht in engem Kontakt mit einem Objekt gebracht werden. In diesem pseudo-konfokale Anordnung, konzentriert sich das Mikroskop die Scan-Aktion des Lasers auf einen fiber Kern in einer Zeit, während die konfokale Blende gewährleistet, dass keine Out-of-focus Licht von den umgebenden Fasern erlaubt ist, passieren auf den Detektor. Für verschiedene Imaging-Anwendungen kann eine Reihe von Objektiven an der distalen Spitze hinzugefügt werden, um für nach vorn gerichtete, Fern-Fluoreszenz-Bildgebung ermöglichen. Mikrooptischen Linsen, sowie Gradienten Brechungsindex (GRIN) Linsen können problemlos für diese Anwendung angepasst werden, und kann bis zum distalen Faserspitze mittels optischer Qualität Kleber angebracht werden.
- So richten Sie das Imaging-System für Mikroendoskopie, entfernen Sie vorsichtig die Probe Bühne und ersetzen sie durch eine Faser hält Stufe (Abb. 5). Tauchen Sie ein Ende des Faserbündels in einer schwachen Lösung des Farbstoffes, so dass Fluoreszenzemission gleichmäßig auf alle der Faserkerne erzeugt wird. Schalten Sie den Scan-System und passen Sie die Faserhalter an das andere Ende der Faserbündel (proximalen Ende oder das Ende am nächsten an der Mikroskop-Optik) in den Fokus zu bringen. Erstens verwenden Währungsumrechnung screws zum Zentrum der Faser in den gescannten Bereich. Jetzt, in der Fluoreszenzemission image Blick von der proximalen Faserspitze während des Scannens. Wenn die komplette Mikroendoskops Oberfläche in der Brennebene des Objektivs ist, wird die Fluoreszenzemission in allen Faserkerne so einheitlich wie möglich. Verwenden Sie den Winkel Einstellknöpfe an der Faser Gesicht anpassen, um alle Faserkerne gleichmäßig hell sein. Bei dieser Einstellung wird es wahrscheinlich notwendig sein, durch Veränderung der Übersetzung der Lage, wieder in den Mittelpunkt der Faser in den gescannten Bereich. Durchlaufen Sie diese Anpassungen bis die gesamte Faserspitze richtig im Fokus.
- Vor der Verwendung der Mikroendoskops, sanft reinigen die distale Spitze mit einem Brillenputztuch leicht mit HPLC-reines Methanol benetzt. Nach wie vor nutzen eine bekannte Größe Standard zu messen und zu berechnen, die Auflösung des Mikroendoskops Imaging-System.
6. Repräsentative Ergebnisse:
Abbildung 6 zeigt ein Beispiel eines fertigen upright konfokalen Laser Scanning Mikroskop für Mikroendoskopie konfiguriert. Die Laser-und Emissions-Strahlen haben als Leitfaden für das Auge gezogen. Ein Faserhalterung hält das Bild Faser in die während Mikroendoskopie Betrieb. Diese Faser Halterung kann leicht mit einem xy oder xyz-Übersetzung Bühne für die Verwendung als einem aufrechten Mikroskop-Plattform ersetzt werden. ThorLabs Teile PT3 (XYZ-Übersetzung) oder zwei übereinander PT1 Stufen (XY-Übersetzung) eignen sich gut für diese Anwendung, zusammen mit einem rechten Winkel wie ThorLabs Teil AP90.
Ein Video-rate Framegrabber-Karte wird verwendet, um Bilder aus dem ankommenden Signal zu generieren. Abbildung 7 zeigt einen repräsentativen Test Bild eines Kleinbuchstaben genommen "m" auf einem weißen Visitenkarte mit dem Video-rate-Mikroskop-Scanning-System gedruckt werden. Bleached Whitepaper enthält Fluorophore, die durch UV-und blaues Licht angeregt werden, was in dem hellen Hintergrund hinter dunklen Buchstaben "m". Ein Emissionsfilter bei 515 nm zentriert wurde gewählt, um diese Fluoreszenzemission zu sammeln. A mInor Verzerrung des Bildes zu beobachten, vor allem in der Nähe der seitlichen Ränder des Bilds. Diese Verzerrung ergibt sich aus der sinusförmige Verlauf der 8kHz gavlo Spiegel, und wird im Detail diskutiert werden.
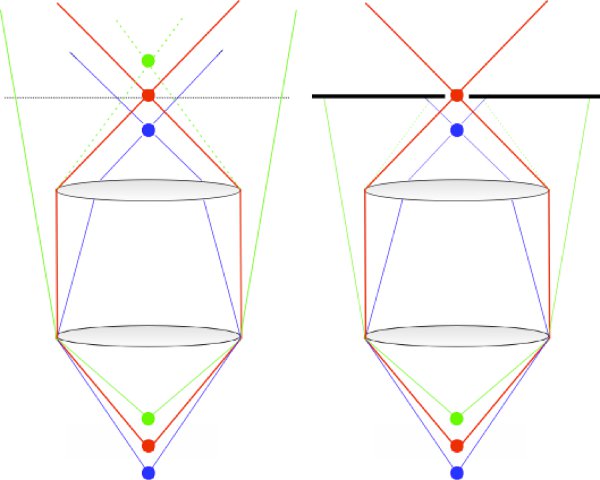
Abbildung 1. Diagramm zeigt das Funktionsprinzip eines konfokalen Mikroskops. Rays aus der objektiven Schwerpunkt sind wieder durch das System weitergeleitet und konzentriert durch die konfokale Blende (rot). Rays stammen entweder oben (blau) oder unten (grün) das Ziel konzentrieren sich nicht von dem Ziel gebündelt entstehen, und sind daher nicht effizient durch das konfokale Pinhole übertragen.
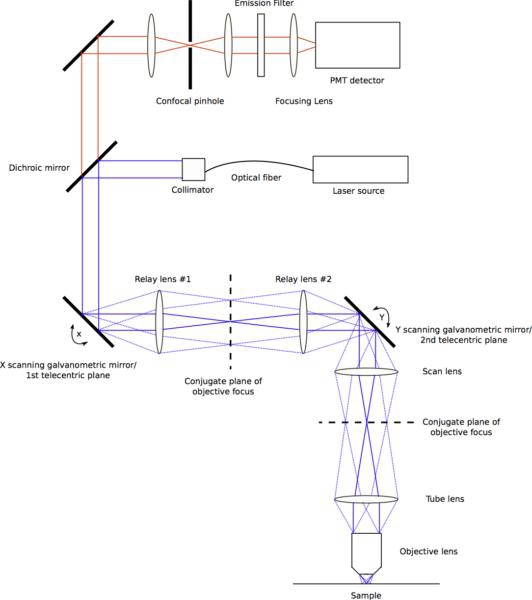
Abbildung 2. Diagramm alle Lichtwege durch den Strahl-Scanning-System. Die Scan-Spiegel sitzen an Flugzeugen telezentrische mit der stationary, objektive zurück Aperturebene. Paar Gläser zwischen der stationären Ebenen wirken auf Relais der gescannten Balken. Die ersten beiden Relais-Linsen haben den gleichen Brennweiten und bildet eine 1:1-Teleskop. Das zweite Paar von Linsen, die formal als Scan-Objektiv und Tubuslinse bekannt, brauchen nicht zu sein in der Brennweite gleich, und oft als Strahlaufweitungsteleskop auf das Ziel zurück-Blende ist überfüllt sicherzustellen dienen. Licht von der Probe emittierte reist durch die Scan-System und wird durch den dichroitischen Spiegel weitergegeben. Ein Objektiv mit kurzer Brennweite fokussiert die Lichtemission durch das konfokale Pinhole, die dann durch eine Linse kollimiert ist. Eine endgültige Linse fokussiert das konfokale-gefilterte Emission auf einen Photomultiplier. Klicken Sie hier, um eine Full-Size-Version dieses Bildes zu sehen.
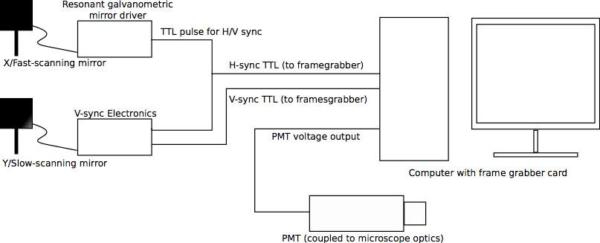
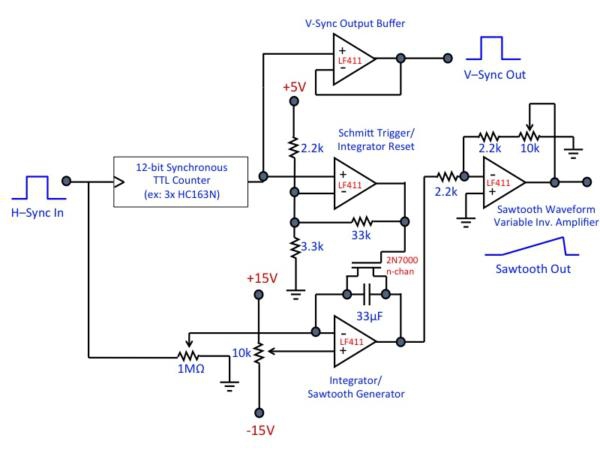
Abbildung 3. (A) Übersichtsplan der Scan-Elektronik-Setup. Das Mikroskop insgesamt Referenzsignal und Zeitbasis ist die "sync" TTL-Ausgang der schnellen Achse resonant Galvo Spiegel, der einen TTL-Puls erzeugt am Ende jeder Zeile abgetastet (dh, wenn die Galvo hat einen Zyklus abgeschlossen). Dies bietet die H-Sync-Signal an den Framegrabber-Karte. Die Galvo der Sync-Ausgang ist auch für die V-sync Steuerkarte, die schrittweise erhöht seine Ausgangsspannung als Reaktion auf jede H-Sync-Impuls auf die Sägezahn, dass die langsame Abtastung Achsantriebe generieren verbunden. Wenn alle Linien gescannt wurden, erzeugt das V-Sync-Board setzt den Sägezahn und ein TTL-Puls, der als Framegrabber ist V-Sync-Signal dient. Die letzte Eingabe in die Framegrabber-Karte wird das analoge Signal aus dem Photomultiplier (Beachten Sie, dass viele PMTs negative Ausgangsspannung zu erzeugen; achten Sie darauf, Ihre Schaltung Design eind Wählen Sie Ihre Hardware entsprechend). Die Video-Bilder bewerten generiert und in der Matrox Framegrabber-Software. (B) Beispiel Regelkreis. In diesem Entwurf wird die Spannung der einzelnen H-Sync-Impuls "added" / integrierter am Operationsverstärker-Integrator die Sägezahn Rampe zu erzeugen; Impulse werden gleichzeitig an der TTL-Zähler Bühne gezählt. Wenn die gewünschte Anzahl der Zeilen erreicht ist (dh, wenn die Raster-Scan abgeschlossen ist), erzeugt der Zähler eine active-low "carry out"-Impuls, der den Schmitt-Trigger-Laufwerke, um einen Reset-Impuls für den Integrator zu generieren. Dies setzt sowohl den Zähler und den Operationsverstärker-Integrator, bereitet die Schaltung für den nächsten Zyklus. Entsprechende Komponente Wahl macht diese Schaltung allgemein anwendbar auf eine Vielzahl von Raster-Größen. Dies ist nur eine Umsetzung, zahlreiche andere Implementierungen sind möglich und können unter Umständen vorzuziehen. Auch ist diese Schaltung für die Verwendung mit Matrox Framegrabber-Karte konzipierts, die erkennen und zu korrigieren Bildphase automatisch. Wenn der Stromkreis mit anderen Framegrabber verwendet werden kann Phasenkorrekturschaltungen oder Software erforderlich sein. Klicken Sie hier, um eine Full-Size-Version dieses Bildes zu sehen.

Abbildung 4. Bildübertragung durch ein kohärentes Faserbündel. In dieser schematischen sind die Linsen auf beiden Seiten des Bündels in Ort, um sowohl das Bild auf die Faserbündel-Eingang sowie erweitern das Bild auf dem Faserbündel Ausgang geplanten Umfang.

Abbildung 5. Beispiel für ein Faserbündel in einem 5-Achs-mount. Eine kleine Durchmesser von 1 "Aluminium-Block wurde gebohrt, so dass das Bild Faserbündel eingesetzt werden könnte. Die Faser wurde in der Aluminium-Block bot geklebth der Ober-und Unterseite des Blocks für Stabilität.

Abbildung 6. Das Bild des fertigen Mikroskopie-System mit dem Mikroendoskops befestigt. Zur besseren Visualisierung der Lichtwege, ist die Anregung Strahlengang in blau gezeichnet, während die Emission Strahlengang nach dem dichroitischen Spiegel als rote Linie gezeichnet wird.
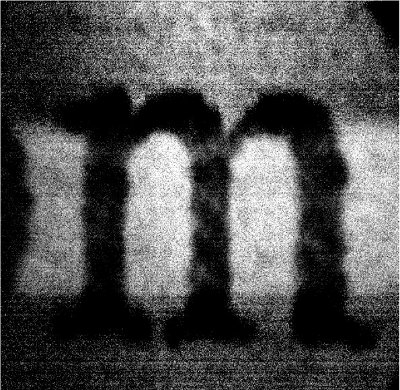
Abbildung 7. Beispielbild von der Video-rate konfokalen Mikroskopie-System generiert. Ein dunkler Kleinbuchstaben "m" auf dem hellen Fluoreszenz Hintergrund eines weißen Visitenkarte.
Diskussion
Dieses Video-Rate Imaging-System nutzt eine Resonanz galvanometrische Spiegel der bei etwa 8 kHz. Resonant Spiegel kann sehr laut werden, wenn bei voller Leistung laufen, und ihre hohe Tonhöhe kann störend oder gar gefährlich in ausreichender Belichtungszeiten. Obwohl nicht nachgewiesen hier empfiehlt es sich, die Resonanz galvanometrische Spiegel in dem transparenten Gehäuse Schild deutlich zu reduzieren die Lautstärke des Systems und / oder geeignete Gehör Schutzausrüstung, wie Ohrstöpsel zu tragen.
Die Resonanz galvanometrische Spiegel Scans in einem sinusförmigen Muster. Allerdings lesen Framegrabber-Karten in Signal der Annahme einer vollständig linearen Sweep-Geschwindigkeit in horizontaler und vertikaler Richtung. Da eine sinusförmige sweep verlangsamt an den Rändern des Scans kann Bildkompression Artefakte entlang der schnellen (horizontal) Bild Achse beobachtet werden. Ein Weg, um dieses Problem zu minimieren, ist absichtlich treiben die Resonanz Galvo Spiegel Reichweite deutlich größer als dieRelais Linsendurchmesser. Dabei werden nur die nahezu lineare zentrale Schwung des Sinus-Scan-Muster verfahren der Probe minimiert Bildverzerrungen. Ein anderer Ansatz wäre, um post-Prozess gesammelten Bildern werden zur schnellen Achse linearisieren. Dies kann durch bildgebende erreicht werden einem bekannten fluoreszierenden Muster (wie ein Gitter) und mit dem bekannten Muster Maße zu einer Verarbeitung Skript, das die gesammelten Bilder unwarps erstellen.
Diese besondere Scan-System wurde für die Zwecke der in-vivo-Bildgebung, die oft nur eine aufrechte orientierten Video-rate Mikroskop. Für zelluläres Imaging Experimenten werden inverse Mikroskope mehr typischerweise verwendet. Das Design präsentierte hier kann leicht geändert werden, um eine solche inverse Mikroskop zu bauen, alles, was erforderlich ist eine Drehung der letzten 2 "Durchmesser Spiegel. Statt der Ausrichtung des Spiegels der Abtaststrahl nach unten direkt, kann der Spiegel den Strahl nach oben zu lenken. Platzierung der objektiven Objektivt den gleichen Abstand vom Spiegel zusammen mit einer Probe der Bühne wäre für die Bildgebung in einem invertierten Geometrie ermöglichen. Wenn das Imaging-System wird ausschließlich für mikro Bildgebung gebaut wurden, gibt es keinen Grund, "fold" das Mikroskop Design vertikal überhaupt. Stattdessen kann der gesamte Scan-System auf einer einzigen horizontalen Steckbrett mit dem Objektiv parallel zur optischen Tisch aufgebaut werden.
Beachten Sie, dass das Mikroskop in diesem Build eine feste Pinhole-Konfiguration verwendet, während dies sorgt für höchste bauen Einfachheit und Ausrichtung, Nutzern in dem Wunsch ein vielseitiges System könnte prüfen, dass eine variable Blende, wie in den meisten kommerziellen konfokale Mikroskope gefunden werden kann. Indem der Benutzer die Größe der Lochblende für Proben unterschiedlicher Emissionsintensität kompensieren anzupassen, erlaubt dies dem Benutzer eine bessere Optimierung der Kompromiss zwischen Signalstärke und Auflösung für eine bestimmte Probe.
Die chOICE von Bild-Faser für das Mikroskop ausgewählt ist wichtig. Wir empfehlen die Verwendung Sumitomo kohärentes Bild Fasern aufgrund ihrer Nähe Faserkern Abstand und geringer relativer Autofluoreszenz. Bild Fasern durch Fujikura hergestellt wurden gefunden, um große Mengen an Autofluoreszenz 10, die schwache Fluoreszenzsignale aus einer Probe zu überwältigen und können den ultimativen Empfindlichkeit des Mikroendoskops haben. Sumitomo hergestellte Fasern, wie zum Beispiel die 8-30N in dieses spezielle Setup verwendet werden, haben viel geringere Autofluoreszenz Ebenen als ihre Fujikura Äquivalente. Während Blutegel Faserbündel könnte als attraktiv für Mikroendoskopie werden, deren Gestaltung in der Regel Orte einzelnen Faserkerne zu weit auseinander, so dass die Faserkerne dünn Probe Objekte aus verlassen bedeutenden Regionen von potentiellem Interesse.
Schließlich ist darauf hinzuweisen, dass, während das Mikroskop hier beschriebenen werden in eine Vielzahl von nützlichen in vitro und in vivo applicati werdenons und für einen Bruchteil der Kosten einer voll ausgestatteten kommerzielles System geschaffen werden kann, muss es nicht Funktionen wie Durchlicht-Erkennung, ein Okular zur Betrachtung oder einen Strahlengang für nicht-konfokalen Weitfeld Epifluoreszenz. Während es möglich ist, ein System mit diesen Features von Grund auf neu konstruieren, darf der Leser in dem Wunsch ein solches System wollen ein bestehendes kommerzielles System, um ihre Bedürfnisse zu erfüllen, anstatt zu initiieren eine ganz neue bauen zu ändern.
Offenlegungen
Die Produktion dieses Video-Dieses Video wurde von Thorlabs, Inc. gesponsert
Danksagungen
Die Autoren bedanken sich bei ThorLabs für ihre Unterstützung dieses Projekts danken. AJN möchte die Unterstützung eines NSF Graduate Fellowship anzuerkennen.
Diese Arbeit wurde teilweise durch die National Institutes of Health durch New Innovator des NIH Director Award Program, gewähren die Nummer 1 DP2 OD007096-01 finanziert. Informationen zu den neuen Innovator Award Program richtet sich an http://nihroadmap.nih.gov/newinnovator/ . Die Autoren bedanken sich bei Tom Hayes für die Nutzung der Harvard Electronics Labor danken.
Materialien
| Name | Company | Catalog Number | Comments | |
| Part Name | Hersteller | Artikelnummer | Technische Daten | Menge |
| 515 nm Bandpass Filter | Chroma | HQ515/50M | 46 FWHM | 1 |
| Achromatische Doublet Objektiv 25,4 mm Dia. x 50mm FL, MgF2 Coating | Edmund Optics | NT49-766 | 1 | |
| Achromatische Doublet Objektiv 25,4 mm Dia. x 76,2 mm FL, MgF2 Coating | Edmund Optics | NT49-768 | 1 | |
| Achromatische Doublet Objektiv 25,4 mm Dia. x 88.9mm FL, MgF2 Coating | Edmund Optics | NT49-769 | 2 | |
| Achromatische Doublet Objektiv 50mm Dia. x 300mm FL, MgF2 Coating | Edmund Optics | NT45-179 | 1 | |
| 8 kHz R High Frequency Optical Scanner | Electro-Optical Products Corporation (EOPC) | SC-30 | 8 kHz | 1 |
| AGC-Treiber | Electro-Optical Products Corporation (EOPC) | ACG: 8K | ||
| H7422-PA Fotosensor Module | Hamamatsu | H7422-PA | Strombegrenzung empfohlen | 1 |
| M9012 Power Supply | Hamamatsu | M9012 | Für die Verwendung mit H7422-PA | 1 |
| HC PL APO CS Ziel | Leica | 11506284 | 10x/0.40 | 1 |
| Solios eA / XA Framegrabber-Karte | Matrox | Solios eA / XA | MIL-Software erforderlich; OEM-Verbindungen empfohlen | 1 |
| 12V Netzteil | Meanwell | LPV-100-12 | +12 V, 8,5 A | 1 |
| 5x Mikroskopobjektivs | Newport | M-5X | 0,10 NA, 25,4 mm Brennweite | 1 |
| Coherent Bild Fiber | Sumitomo | 8-30N | 1 | |
| 1 / 4 "-20 Cap Screw und Hardware Kit | ThorLabs | HW-KIT2 | 1 | |
| 100 pm Mounted Pinhole | ThorLabs | P100S | Ideal für den Bau räumliche Filter | 1 |
| 30 mm Cage Clamp Cube | ThorLabs | B6C | 1 | |
| 30 mm Cage System Cube, 4-Way | ThorLabs | C4W | 1 | |
| 406 nm, 5 mW, B Pin Code, SM Faseranschluss Laser Diode, FC / PC | ThorLabs | LPS-406-FC | Produkt veraltet; durch LP405-SF10 ersetzt | 1 |
| 5-Minuten Epoxy, 1 Unze | ThorLabs | G14250 | 1 | |
| 6 Achsen Kinematische Optikhalter | ThorLabs | K6X | 1 | |
| 8-32 Cap Screw und Hardware Kit | ThorLabs | HW-KIT1 | 1 | |
| 8-32 Stellschraube und Hardware Kit | ThorLabs | HW-KIT3 | 1 | |
| Adapter mit externem RMS Themen und interne SM1 Themen | ThorLabs | SM1A4 | 1 | |
| Adj. FC / PC und FC / APC Collimator, f = 2,0 mm, ARC: 400-600 nm | ThorLabs | CFC-2X-A | f = 2,0 mm | 1 |
| Einstellbare Faserkollimator Adapter, SM1 Threaded | ThorLabs | AD9.5F | 1 | |
| Aluminum Breadboard, 12 "x 18" x 1 / 2 " | ThorLabs | MB1218 | 1 / 4 "-20 Gewinde | 2 |
| Benchtop Laser Diode / TEC-Controller | ThorLabs | ITC4001 | 1 A/96 W | 1 |
| DMLP 425 nm Long-Pass Dichroitische Spiegel | ThorLabs | DMLP425 | 1 | |
| Kinematische Halterung für Ø1 "Optics | ThorLabs | KM100 | 3 | |
| LD / TEC Halterung für ThorLabs Fiber-Pigtailed Laserdioden | ThorLabs | LM9LP | 1 | |
| Objektivanschluss für Ø18 mm Optik | ThorLabs | LMR18 | Ein Sicherungsring enthalten | 1 |
| Linsenhalter für 2 "Optics | ThorLabs | LMR2S | Mit internen und externen Threading; Haltering enthalten | 2 |
| Mini Series Cage Assembly Rod, 6 "Long, Ø 4 mm, Anz. 1 | ThorLabs | SR6 | 4 | |
| Ø1.0 "Pedestal Pillar Beitrag, 8-32 Taps, 1" Long | ThorLabs | RS1P8E | 4 | |
| Ø1 "Pillar Beitrag Extension, Länge = 0,5 | ThorLabs | RS05 | 4 | |
| Ø1 "Pillar Beitrag Extension, Länge = 0,75" | ThorLabs | RS075 | 4 | |
| Ø1 "Protected Silver Mirror, 3,2 mm dick | ThorLabs | ME1-P01 | 1 | |
| Ø1 "SM1 Rotating Einstellbare Fokussierung Element, L = 1" | ThorLabs | SM1V10 | 1 | |
| Ø2 "Protected Silver Mirror, 3,2 mm dick | ThorLabs | ME2-P01 | 2 | |
| P100S - Ø100 um Mounted Pinhole | ThorLabs | P100S | 1 | |
| Polaris Low Drift Ø1 "Kinematische Spiegelhalter | ThorLabs | POLARIS-K1 | Low Drift | 1 |
| SM1 Tubus, L = 1 " | ThorLabs | SM1L-10 | Ein Sicherungsring enthalten | 4 |
| SM1 Gewinde 30 mm Cage Plate, 0,35 "Thick | ThorLabs | CP02 | 2 | |
| SM1 bis M25 Optical Component Threading-Adapter | ThorLabs | SM1A24 | Externe SM1 Themen und interne M25.5x0.5 Themen | 1 |
| Kleine Breite Diameter Galvo-System | ThorLabs | GVSM001 | 1 | |
| Kleine Befestigungsklemme | ThorLabs | CF125 | 1 / 25 "versenkte Slot, universal | 15 |
| Spatial-Filter-System | ThorLabs | KT310 | Pinhole separat erhältlich | 1 |
| TE-gekühlte Berg für 5,6 und 9 mm Laser | ThorLabs | TCLDM9 | 1 | |
| Vertikale Halterung für Breadboards | ThorLabs | VB01 | Jeder | 2 |
| Plan-Apochromat | Zeiss | 1101-957 | 20x/0.75 NA | 1 |
Referenzen
- Pawley, J. B. . Handbook of biological confocal microscopy. , 985-985 (2006).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nature Reviews Molecular Cell Biology. 2, 444-456 (2001).
- Klonis, N., Rug, M., Harper, I., Wickham, M., Cowman, A., Tilley, L. Fluorescence photobleaching analysis for the study of cellular dynamics. European Biophysics Journal. 31, 36-51 (2002).
- Stephens, D. J. Light Microscopy Techniques for Live Cell Imaging. Science. 300, 82-86 (2003).
- McMahon, A., Supatto, W., Fraser, S. E., Stathopoulos, A. Dynamic Analyses of Drosophila Gastrulation Provide Insights into Collective Cell Migration. Science. 322, 1546-1550 (2008).
- Wallingford, J. B. Dishevelled controls cell polarity during Xenopus gastrulation. Nature. 405, 81-85 (2000).
- Laemmel, E. Fibered Confocal Fluorescence Microscopy (Cell-viZio) Facilitates Extended Imaging in the Field of Microcirculation. Journal of Vascular Research. 41, 400-411 (2004).
- Moussata, D. The confocal laser endomicroscopy. Acta Endoscopica. 39, 448-451 (2010).
- Dunbar, K., Canto, M. Confocal endomicroscopy. Current Opinion in Gastroenterology. 24, 631-637 (2008).
- Udovich, J. A. Spectral background and transmission characteristics of fiber optic imaging bundles. Applied optics. 47, 4560-4568 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten