Method Article
Video-tasso di Microscopia confocale e scansione Microendoscopy
In questo articolo
Riepilogo
La costruzione completa di una consuetudine, in tempo reale del sistema di imaging confocale scansione è descritto. Questo sistema, che può essere facilmente utilizzato per il video-rate microscopia e microendoscopy, consente una vasta gamma di geometrie e le applicazioni di imaging non accessibili utilizzando le normali sistemi commerciali confocale, ad una frazione del costo.
Abstract
Microscopia confocale è diventato uno strumento prezioso nel campo della biologia e delle scienze biomediche, consentendo una rapida, ad alta sensibilità, e ad alta risoluzione sezionamento ottico di sistemi complessi. Microscopia confocale è abitualmente usato, per esempio, per studiare specifici obiettivi cellulari 1, dinamiche monitor in cellule viventi 2-4, e visualizzare l'evoluzione tridimensionale di interi organismi 5,6. Estensioni di sistemi di imaging confocale, come microendoscopes confocale, permettono di imaging ad alta risoluzione in vivo 7 e vengono attualmente impiegati per l'imaging della malattia e la diagnosi in ambito clinico 8,9.
Microscopia confocale offre tridimensionale risoluzione con la creazione di cosiddette "sezioni ottiche" utilizzando semplici ottica geometrica. In uno standard a largo campo microscopio a fluorescenza generata da un campione viene raccolto da una lente obiettivo e trasmesso direttamente ad un rivelatore. Anche se accettareper i campioni in grado di imaging sottili, campioni di spessore si confondono con fluorescenza generata sopra e sotto il piano focale dell'obiettivo. Al contrario, la microscopia confocale permette virtuale, il sezionamento ottico di campioni, rifiutando out-of-focus luce ad alta risoluzione per costruire rappresentazioni tridimensionali di campioni.
Microscopio confocale realizzare questa impresa utilizzando un'apertura confocale nel percorso ottico di rilevamento. La fluorescenza raccolti da un campione l'obiettivo è inoltrati attraverso gli specchi di scansione e attraverso lo specchio dicroico primario, uno specchio accuratamente selezionati per riflettere lunghezze d'onda minori, come il raggio laser di eccitazione durante il passaggio lungo la, Stokes in differita emissione di fluorescenza. Questa lunghezza d'onda del segnale di fluorescenza viene quindi passata a un paio di lenti su entrambi i lati di un foro che è posizionato in un aereo esattamente coniugato con il piano focale della lente obiettiva. Fotoni raccolti dal volume focale dell'oggetto sono collimatidalla lente dell'obiettivo e sono concentrati dalle lenti confocale attraverso il foro stenopeico. Fluorescenza generata sopra o sotto il piano focale quindi non sarà adeguatamente collimato, e non passare attraverso il foro stenopeico confocale 1, la creazione di una sezione ottica in cui solo la luce dal fuoco microscopio è visibile. (Fig. 1). Così il pinhole agisce effettivamente come un'apertura virtuale al piano focale, limitando l'emissione rilevato a una sola posizione spaziale limitata.
Moderni microscopi confocale commerciali offrire agli utenti il funzionamento completamente automatico, rendendo complesse procedure di imaging in precedenza relativamente semplice e accessibile. Nonostante la flessibilità e la potenza di questi sistemi, commerciali microscopi confocale non sono adatti per tutte le attività di imaging confocale, come molte applicazioni di imaging in vivo. Senza la possibilità di creare sistemi di imaging personalizzati per soddisfare le loro esigenze, importanti esperimenti può rimanere fuori dalla reazioneh per molti scienziati.
In questo articolo forniamo un passo-passo metodo per la costruzione completa di una consuetudine, video-rate sistema di imaging confocale da componenti di base. Il microscopio verticale sarà costruito utilizzando uno specchio risonante galvanometrico per fornire l'asse veloce di scansione, mentre un normale specchio velocità di risonanza galvanometrico analizzerà l'asse lento. Per creare un fascio preciso nella scansione la messa a fuoco dell'obiettivo, questi specchi verranno posizionati gli aerei telecentrica cosiddetto con quattro lenti relè. Rilevazione confocale sarà realizzato utilizzando uno standard, off-the-shelf tubo fotomoltiplicatore (PMT), e le immagini saranno catturati e visualizzati utilizzando una scheda Matrox framegrabber e il software incluso.
Protocollo
La scelta della lunghezza d'onda laser, specchi dicroici e filtri ottici dovrebbe essere determinata sulla base dei coloranti specifici utilizzati nell'esperimento. Per esempio, l'imaging confocale di un campione colorato con Alexa Fluor 488 è meglio realizzato utilizzando un laser a 488 nm, 500 nm a lungo passaggio specchio dicroico, e una larghezza di banda 30 nm specchio banda centrata a 515 nm. Al contrario, l'imaging confocale del colorante rosso Alexa Fluor 647 richiederebbe un diverso insieme di componenti. Il microscopio in questo protocollo è stato costruito per poter visualizzare qualsiasi colorante che assorbe fortemente a 400 nm ed emette oltre 450 nm. Abbiamo quindi scelto un laser a 406 nm di eccitazione e 425 nm a lungo passaggio dicroico per riflettere il raggio laser. Fluorofori eccitati possono essere selettivamente immaginato selezionando l'emissione di filtri appropriati. E 'importante l'uso corretto hardware ottico di montaggio in tutto il protocollo dove indicato; hardware improprio o di fortuna non terrà allineamento così e può essere un pericolo per la sicurezza.
1. Configurare lo specchio di risonanza galvanometrico e ottica relè
Un concetto importante nella costruzione di qualsiasi tipo di sistema di scansione confocale è telecentricità. In un sistema telecentrico ottica, lenti sono distanziati l'uno dall'altro dalla somma delle loro lunghezze focali, in modo tale che l'ingrandimento del sistema è semplicemente definito dal rapporto tra le lunghezze focali 1. Questo consente la costruzione di un sistema ottico in cui il relè ingrandimenti, e quindi la proprietà del sistema, sono facilmente definiti dalla scelta degli obiettivi. Un altro concetto importante riguarda il cosiddetto "fermo" piani ottici, noto anche come "piani di apertura". Un piano di apertura è una posizione lungo il percorso ottico in cui il fascio di luce non subisce alcun tipo di movimento laterale. In questo disegno microscopio, ci sono tre piani importanti aperture: la prima e la seconda specchi di scansione, e il back-apertura della lente obiettiva. Al fine di raggiungere ottimale fascio scanning nel piano focale dell'obiettivo, il fascio di ingresso l'apertura posteriore della lente obiettivo deve essere fermo, solo spazzare in angolo. Per creare questo fermo, angolo spazzato aereo, abbiamo bisogno di mettere gli specchi prima e la seconda scansione a coniugare, aerei telecentrico con l'obiettivo di back-apertura. Lenti posto tra gli specchi e la lente obiettiva servono per trasmettere l'angolo-scansionato trave fra questi aerei fissi (Fig. 2). Gli specchi di scansione sono montati su due galvos scansione, ognuna delle quali è responsabile per la scansione di una data direzione del piano di imaging (X e Y). Per ottenere la necessaria velocità di scansione linea per il video-rate imaging ad alta frequenza di risonanza galvo richiesta per la scansione delle ascisse (noto anche come l'asse "veloce"). Queste galvos utilizzano una sensibile, a circuito chiuso circuiti di feedback per creare un andamento sinusoidale scansione e sono in grado di operare a frequenze molto alte, abbiamo selezionato un 8 galvo kHz per questa build.
- Impostareil collimatore in fibra nel supporto ottico e circa dirigere il fascio con le viti di regolazione in modo tale che viaggia in linea retta sia orizzontalmente che verticalmente. Ora, prendete un iris e metterlo di fronte al collimatore in fibra, regolando l'altezza verticale in modo che il fascio passa pulito attraverso il centro dell'iride dell'iride è. Quindi, spostare l'iride dal collimatore lungo il percorso del raggio e osservare se il raggio viaggia ancora attraverso il centro dell'iride. In caso contrario, regolare la posizione del fascio sul dell'iride utilizzando le due viti di regolazione.
- Posizionare lo specchio dicroico montato nel percorso ottico con il raggio laser posizionato a circa il centro dello specchio. Prima di bloccare lo specchio alla tabella, ruotare il supporto specchio per riflettere il raggio di circa 90 gradi e più o meno regolare la riflessione in modo che l'altezza verticale del raggio laser riflesso non cambia.
- Posizionare un specchio montato risonante galvanometrico nel percorso del raggio laser, tenendo autoe far sì che il raggio laser è posizionato esattamente al centro orizzontale della superficie a specchio. In questo protocollo, lo specchio di risonanza galvo era expoxied direttamente ad un attacco specchio. Ruotare il supporto specchio per riflettere il raggio laser in un angolo di 90 gradi. Circa regolare il riflesso dallo specchio a mantenere la stessa altezza del fascio laser verticale.
- Al fine di indirizzare ogni raggio di luce in una determinata direzione, si deve per definizione definire due punti nello spazio attraverso il quale il raggio viaggerà. Questo in genere viene eseguita mettendo due iridi lungo il percorso desiderato orizzontale e verticale e la manipolazione del raggio laser di passare attraverso il centro di ogni dell'iride. Quattro gradi di libertà sono tenuti a regolare il fascio, due gradi in orizzontale e verticale di libertà per ogni iride. Il modo più comune e semplice per raggiungere questi gradi di libertà è quella di utilizzare due specchi di guidare, o "passeggiata", un raggio laser.
Prendete due iris, e impostare l'altezza verticale comeal punto 1.1, utilizzando il raggio laser riflesso dallo specchio di risonanza galvo come riferimento. Ora, usando i fori delle viti sulla basetta ottica come una guida per gli occhi, fissare i due iridi giù in linea retta. - Regolare lo specchio e lo specchio dicroico galvo risonante per orientare il fascio laser attraverso il centro delle due iridi. Utilizzare il primo specchio nel percorso (lo specchio dicroico) al centro del fascio sul iride, poi utilizzare il secondo specchio nel percorso (lo specchio di risonanza galvo) al centro del fascio sul iride secondo. Iterativamente regolare questi due specchi fino a quando il raggio è allineato con entrambe le iridi, assicurando che tutto il raggio laser riflesso dallo specchio risonante galvo si riflette ancora dal centro specchio approssimativa. Se il raggio è deviato, regolare il supporto in fibra di collimatore e ripetere l'iterativo passaggi precedenti.
- Con il raggio centrata su entrambi iris, ci sarà ora posto le due lenti relè che l'immagine del nostro primo fermo, piano telecentricae (cioè, lo specchio di risonanza galvo) sul nostro secondo fermo, aereo telecentrica (cioè, la velocità standard galvo specchio). Per questo microscopio particolare, le lenti selezionati nel primo relè hanno la stessa lunghezza focale, "f", per cui la distanza tra i due specchi nel nostro sistema telecentrico è semplicemente 4f. Per garantire che le lenti sono perfettamente centrata nel percorso ottico, utilizzare il trucco di allineamento lente. Posizionare il primo obiettivo nel percorso ottico e guardare il raggio laser posto sul prossimo nel percorso ottico iride dopo la lente. Successivamente, regolare l'altezza lente verticalmente in modo che il centro verticale del fascio è al centro dell'iride. Infine, regolare la posizione orizzontale del fascio di centro il fascio sul iride. Eseguire la stessa procedura per la seconda lente.
2. Impostare il secondo specchio di scansione e ruotando il microscopio
- Per trovare l'esatta posizione del piano telecentrica secondo, collegare il galvo risonante dila sua unità di scansione e accenderlo. Utilizzare una scheda bianca di business per tenere traccia del fascio di scansione attraverso le due lenti. Troverete il piano telecentrico alla distanza approssimativa di 4f dalla risonanza galvo, dove il raggio laser apparirà completamente fermo. Segnare la posizione sulla basetta.
- Posizionare lo standard specchio di scansione galvanometrica in questa posizione esatta aereo telecentrica, e regolare l'altezza specchio e posizione tale che il fascio sul piano telecentrico colpisce il centro esatto dello specchio di scansione. E 'fondamentale per alimentare l'hardware di controllo specchio e mettere una tensione di 0 volt sull'ingresso specchio di scansione in modo che lo specchio si deposita alla sua posizione neutrale durante questo processo. Regolare con cura l'angolo di specchio per dirigere il fascio in senso verticale, e delicatamente stringere lo specchio in posizione.
- Come stiamo costruendo un microscopio verticale, noi ora fissare la basetta secondo un angolo di 90 gradi con 90 gradi staffe di montaggio. Assicurarsi di spegnereil laser e l'elettronica di scansione, scollegare la fibra, e scollegare gli specchi di scansione durante questo processo. Per rendere il resto del tracciato più facile, una volta che le parentesi sono lanciati in luogo, con attenzione ruotare l'intero microscopio in modo che la basetta è ora in posizione orizzontale. Utilizzare un morsetto per fissare la basetta alla superficie di lavoro. Ora il resto del setup precedentemente verticale può essere facilmente effettuata sulla basetta piana.
3. Configurazione della scansione, il tubo, e lenti dell'obiettivo
Il prossimo sarà creato il secondo gruppo di lenti a relè, formalmente denominato "lente di acquisizione" e "lente di tubo". E 'importante scegliere la giusta combinazione di lenti in modo da ottenere l'ingrandimento corrette al centro obiettivo e ottimizzare la risoluzione finale dell'immagine. In primo luogo, per ottenere la massima apertura numerica (NA) di qualsiasi obiettivo determinato obiettivo, il raggio laser che colpisce la parte posteriore del obiettivo deve riempire ilposteriore ad apertura completamente, solo allora la lente obiettivo in grado di creare più stretti messa a fuoco. Lenti dell'obiettivo hanno una gamma di dimensioni di apertura indietro, ha scelto un rapporto di ingrandimento lente per riempire troppo poco l'apertura posteriore dell'obiettivo selezionato. In secondo luogo, al fine di ottenere l'ingrandimento a destra, la lente obiettivo deve essere abbinato con la lunghezza focale dell'obiettivo del tubo per la quale è stato progettato. Purtroppo, diversi produttori di obiettivo microscopio è scelto di utilizzare differenti lunghezze focali del tubo, per cui è importante costruire un microscopio con la lente del tubo corretto per la lente dell'obiettivo specifico impiegato. Inoltre, alcuni produttori, come Zeiss, il design delle lenti tubo per compensare le aberrazioni cromatiche specifiche del loro obiettivo abbinate, in modo tale che con un improprio obiettivo-tubo di coppia obiettivo sarà di fatto introducono aberrazioni nuovi che altrimenti non sarebbero presenti. Noi di solito preferiamo obiettivi Olympus, come tutti compensazione cromatica viene effettuata in thobiettivo e per sé, rendere l'obiettivo / lente tubo accoppiamento più facile. Anche se il microscopio continua a funzionare se l'obiettivo e la lente del tubo non corrispondono, l'ingrandimento microscopio reale probabilmente non corrisponde l'ingrandimento indicati sulla lente dell'obiettivo. Per costruire questo microscopio particolare, la dimensione ottimale di apertura di nuovo è stato determinato da 4 mm, che richiedono un rapporto di ingrandimento 01:04 tra la lente di acquisizione e lente del tubo. Per questo microscopio di generazione personalizzata, utilizzeremo una lunghezza di scansione lente di 75 mm e una lunghezza focale tubo di 300 mm.
- Come la distanza totale tra lo specchio seconda scansione e mettere a fuoco obiettivo è di grandi dimensioni, questo segmento del microscopio build prima stesura gli specchi necessari per guidare il fascio alla lente obiettiva. Luogo la prima grande, 2 "(50 mm) diametro specchio vicino al bordo della basetta, e ruotare il supporto specchio per riflettere il raggio laser di circa 90 gradi. Circa regolare il riflesso dallo specchio a mantenere la bea stessa verticalem di altezza. Posizionare l'altro "specchio 2 al bordo opposto della basetta in un orientamento che indirizza il fascio verso il basso in un angolo di 90 gradi. Utilizzare le viti di regolazione per assicurare l'altezza verticale del fascio non cambia. Impostare due iridi, come al punto 1.4, e regolare i due specchi come indicato al punto 1.5 a centrare il fascio sul iris.
- Con l'iride ancora al suo posto, posto la lente di acquisizione nel percorso ottico e regolarne la posizione orizzontale e verticale per centrare il punto laser sul primo iride. Ad una distanza di 75 mm + 300 mm dalla lente (tra i due specchi), posizionare con attenzione il grande "lente 2 tubi e regolarne la posizione orizzontale e verticale per centrare il fascio sul primo iride. Allo scopo di mantenere l'allineamento, in futuro, è utile lasciare queste iris sul posto; per questa applicazione, un biglietto da visita con un foro di dimensioni adeguate può essere incollata ad un supporto e inserita nel percorso ottico.
- Con tutti gli specchi e lentiattualmente in vigore, avviare la scansione lo specchio di risonanza galvo e lo specchio di scansione standard. In questa build, lo specchio di scansione di serie alla fine sarà sincronizzato con la frequenza di scansione dello specchio di risonanza attraverso un custom-built circuito di controllo, come quello descritto in figura 3, questo garantisce un'elevata sincronizzazione verticale e orizzontale. Tuttavia, ai fini di allineamento e molte applicazioni di imaging, lo specchio può facilmente essere acquisiti utilizzando un modello a dente di sega da un generatore di funzioni. Utilizzando un biglietto da visita, individuare il raggio laser in una posizione di 300 millimetri dopo la lente del tubo. Anche se il raggio è la scansione in altre parti del microscopio in entrambe le direzioni orizzontale e verticale, il fascio deve essere perfettamente fermo vicino a questa posizione. E 'qui che l'apertura posteriore della lente obiettivo sarà collocato. Se i piani orizzontali e verticali fissi non coincidono sul piano stesso lungo il percorso del raggio, con attenzione sbloccaggio e tradurre la lente del tubo lungo il percorso ottico per garantire cheentrambi i piani si sovrappongono più fedelmente possibile. Ricentrare la posizione verticale e orizzontale della lente tubo e bloccarlo saldamente in posizione.
- Posizionare la lente obiettivo nel percorso ottico, avendo cura di posizionare la lente dell'obiettivo indietro apertura il più vicino al piano stazionario possibile. La vera apertura posteriore obiettivo non può effettivamente essere sempre situato in apertura posteriore fisico dell'obiettivo a causa di scelte diverse produttore di design. E 'quindi sempre meglio il rivolgersi al produttore per determinare la vera posizione di apertura posteriore.
- Impostare la fase di campionamento, facendo in modo che il monte di traduzione che permetterà di asse z movimento può spostare sulla sua gamma completa senza incorrere nel supporto lente dell'obiettivo.
4. Impostazione e allineando il foro stenopeico confocale e rivelatore
- Scollegare tutte le alimentazioni e fibre ottiche, e ruotare l'assemblea microscopio in modo tale che poggia ancora sulla basetta tenendo la risonanzadominante specchio di scansione. Fissare la basetta saldamente in posizione, quindi ricollegare la fibra al collimatore, e ri-collegare sia galvos e la loro cavi di controllo. Come prima, posto 0 volt la tensione di controllo della guida del galvo standard di scansione.
- Sul palco del campione, posto un biglietto da visita o di un piccolo volume di un colorante brillante nel fuoco dell'obiettivo, inserito tra due lamelle. La scelta del colorante dipenderà dal laser e dicroici selezionati, in questo caso useremo l'emissione di fluorescenza da un biglietto da visita bianchi per allineare il sistema di rilevamento confocale. Quantum dots possono essere utili anche ai fini di allineamento, in quanto sono luminose e non photobleach. Altre alternative sono perline fluorescenti e / o campioni di tessuto esposto a colori di lavanderia / sbiancante, entrambi reagiscono brillantemente. Accendere la sorgente laser e portare il campione nel microscopio con attenzione la fase di traduzione. Una volta a fuoco, la fluorescenza generata dal campione dovrebbe essere visibile dietro tlo specchio dicroico, come descritto nel passaggio successivo. Massimizzare la potenza del laser per rendere la fluorescenza più brillante possibile.
- Utilizzando un biglietto da visita, traccia l'emissione di fluorescenza del campione attraverso le lenti dell'obiettivo e indietro attraverso il sistema di scansione a specchio dicroico. Lo specchio dicroico trasmetterà l'emissione di fluorescenza, mentre riflette il raggio laser; trovare questo segnale di fluorescenza al di là dello specchio dicroico. Ora, uno specchio posto dietro lo specchio dicroico e utilizzarlo per riflettere l'emissione ad un angolo di 90 gradi. Prendete un iride, come è stato fatto nella fase 1.1, e usarlo con lo specchio per dirigere il fascio di fluorescenza come dritti e paralleli alla basetta possibile. Questo passaggio potrebbe essere meglio svolte in penombra.
- Impostare l'unità confocale foro come descritto in Fig. 2. Abbiamo scoperto che il filtro spaziale di montaggio su rack da Thorlabs è l'ideale per questo compito. E 'importante selezionare un appropriato pinholdimensioni e per garantire che il sistema confocale raggiunge la sua risoluzione ottimale del segnale senza sacrificare troppo. Per questo microscopio personalizzati, una dimensione foro stenopeico di 100 micron è stato selezionato. Posizionare l'unità spaziale filtro in linea con il percorso del raggio fluorescenza, avendo cura di centrare il primo obiettivo montare concentrarsi sulla trave emissione di fluorescenza. Dopo aver montato una lente corta focale in unità (un obiettivo microscopio può anche essere utilizzato), far scorrere il z-traduzione montare fino a quando una chiara focalizzazione si possono osservare sulla superficie foro stenopeico. Assicurarsi che l'intera unità è orientato lungo la linea retta perfetta impostata dal fascio fluorescenza. Fissare l'unità alla basetta.
Le emissioni dalla maggior parte dei campioni è debole rispetto ai livelli di luce ambientale anche in stanze buie. E 'quindi cruciale che un'adeguata schermatura / luce sconcertante essere utilizzato lungo il percorso di emissioni per proteggere dalla contaminazione luce diffusa. Inoltre, alti livelli di luce ambiente PMT sovraccarico e molti danni, in particolare quelli che non cprotezione ATTUALE. I lettori sono dunque caldamente invitati a utilizzare tubi lente per racchiudere il percorso del fascio di emissione; un sistema adeguatamente schermati, come quello mostrato qui, è in grado di funzionare in luce ambiente con poca o nessuna contaminazione luce parassita. - Ora, usando le manopole di regolazione sul palco traduzione, sistematicamente spostare il foro stenopeico confocale per trovare il punto in cui è massimizzato il segnale di fluorescenza attraverso il foro stenopeico. Questa posizione è più facilmente identificabile attraverso iterativo di regolazione dei due assi per eseguire una ricerca 2D sulla superficie di montaggio a foro stenopeico. Una volta che la posizione del segnale massimizzare viene trovato posto la lente di collimazione sul monte gabbia dopo il foro stenopeico. Trova l'emissione di fluorescenza che passa attraverso l'unità confocale utilizzando un biglietto da visita, e far scorrere la lente di collimazione lungo i pali fino a quando il segnale di fluorescenza emessa è collimato possibile. Una volta che il fascio è collimato, assicurarsi di inserire il filtro appropriato nel percorso del fascio in una vasca lentee.
- Impostare il tubo fotomoltiplicatore (PMT) di montaggio. Posizionare un obiettivo 50 mm di lunghezza focale del percorso del fascio di emissione di fluorescenza e di trovare il suo punto focale utilizzando un biglietto da visita. Segnare la posizione sulla basetta. Ora, spegnere il laser completamente - questo è importante, come la luce laser randagi o non attenuato può danneggiare permanentemente più PMT. Posizionare il PMT in modo che la sua area attiva è il più vicino al punto focale indicata come possibile. Collegare il gruppo PMT alla lente di messa a fuoco utilizzando tubi lente regolabile, e con attenzione avvolgere nastro scuro intorno tutti i percorsi travi a vista seguendo il foro stenopeico.
- Accendere il laser, ma essere sicuri di mantenere il suo potere estremamente basso in modo tale che l'emissione di fluorescenza è appena visibile. Accendere il PMT, leggendo attentamente la sua tensione su un oscilloscopio come la tensione di controllo è aumentato. Un PMT genera il segnale attraverso una serie di fasi di elettroni moltiplicando, se la fotocorrente è troppo alto per il livello di luce incidente, il tubo può esserePMT irreversibilmente danneggiato. con le attuali circuiti limitanti sono quindi altamente consigliata, soprattutto per gli utenti che non hanno lavorato con i rilevatori come prima.
Aumentare la tensione PMT di controllo finché un picco simile lettura e / o un offset DC può essere visto sullo schermo dell'oscilloscopio, per la maggior parte PMT, questo segnale sarà negativa rispetto a massa. Verificare che questo segnale nasce infatti dalla fluorescenza girando la potenza del laser fuori ad osservare una perdita di segnale. - Infine, iterativamente allineare il foro per il massimo segnale sull'oscilloscopio per prima cosa manipolando l'obiettivo di messa a fuoco z-posizione, e quindi regolando la fase di traduzione yz.
- Il video-microscopio tasso hardware è completa! Ora collegare gli specchi, quadri controllo personalizzato, e il computer come diagramma in Fig. 3. Come sopra, si consiglia di utilizzare il sistema di imaging per visualizzare prima un formato standard noto per trovare la risoluzione ottimale del microscopio e calcolare il pixelA risoluzione costante per il sistema di imaging. Ci sono molte dimensioni standard che possono essere utilizzati, come ad esempio biglietti da visita bianco con ben noti formati lettera, fluorescenza o riflettenti obiettivi forza aerea, e microsfere fluorescenti.
5. Preparazione del sistema per la scansione confocale microendoscopy
In questa build si utilizza una fibra coerente immagine, che consiste in un fascio di molte migliaia di nuclei di fibra; tale disposizione consente una immagine da trasmettere attraverso la fibra e facilmente ricostruito e / o espanso all'altra estremità (Fig. 4). Il fascio di fibre coerente utilizzati nella costruzione di questo endoscopio è lucida su entrambi i lati, il che rende un cosiddetto microendoscope "contact-mode". Una messa a fuoco dell'immagine sarà quindi solo essere formata quando la punta microendoscope è portato a stretto contatto con un oggetto. In questo pseudo-confocale disposizione, l'azione di scansione al microscopio si concentra il laser su una fnucleo Iber alla volta, mentre il foro stenopeico confocale assicura che non out-of-focus luce dalle fibre circostanti è permesso di passare attraverso il rivelatore. Per le applicazioni di imaging diverse, una serie di lenti possono essere aggiunti sulla punta distale per consentire rivolti in avanti, a lunga distanza di imaging di fluorescenza. Microottiche lenti, così come indice di rifrazione gradiente (GRIN), le lenti possono essere facilmente adattate per questo uso, e può essere apposta sulla punta della fibra distale utilizzando collanti qualità ottica.
- Per impostare il sistema di imaging per microendoscopy, rimuovere con attenzione la fase di campionamento e sostituirlo con uno stadio tenendo fibra (Fig. 5). Immergere una estremità del fascio di fibre in una soluzione debole di colorante in modo che l'emissione di fluorescenza viene generato in modo uniforme in tutti i core della fibra. Accendere il sistema di scansione e regolare il supporto in fibra di portare l'altra estremità del fascio di fibre ottiche (l'estremità prossimale, o dalla parte più vicina al microscopio ottico) a fuoco. In primo luogo, utilizzare traduzione regolazione screws al centro la fibra nel campo scansione. Ora, guardate l'immagine di emissione di fluorescenza dalla punta della fibra prossimale durante la scansione. Quando la superficie microendoscope completo è nel piano focale dell'obiettivo, l'emissione di fluorescenza su tutti i core di fibre sarà più uniforme possibile. Utilizzare le manopole di regolazione dell'angolo di regolare la faccia in fibra di rendere tutti i core di fibre uniformemente luminoso. Durante questa regolazione, sarà probabilmente necessario ri-regolare la posizione di traduzione per ricentrare la fibra nel campo scansione. Scorrere queste regolazioni fino alla punta della fibra tutto è correttamente a fuoco.
- Prima di utilizzare il microendoscope, pulire delicatamente la punta distale utilizzando la carta di pulizia lenti leggermente bagnato con HPLC metanolo. Come prima, utilizzare uno standard noto formato per misurare e calcolare la risoluzione del sistema di imaging microendoscope.
6. Rappresentante dei risultati:
La Figura 6 mostra un esempio di finito UPRight microscopio a scansione confocale configurato per microendoscopy. I raggi laser e le emissioni sono state elaborate come guida per l'occhio. Un supporto in fibra mantiene la fibra immagine in posizione durante il funzionamento microendoscopy. Questa staffa in fibra può essere facilmente sostituito con un xy o xyz fase di traduzione da utilizzare come piattaforma microscopio verticale. Thorlabs parti PT3 (traduzione XYZ) o due sovrapposti PT1 fasi (XY traduzione) funzionano bene per questa applicazione, insieme a un angolo retto parentesi come parte Thorlabs AP90.
Un video-scheda tariffe framegrabber viene utilizzato per generare le immagini dal segnale in ingresso. La figura 7 mostra un'immagine rappresentativa di prova conto di una minuscola "m" stampato su un biglietto da visita bianco con il video-sistema dei tassi di microscopio a scansione. Sbiancata carta bianca contiene fluorofori che sono eccitati dalla luce UV e blu, con la conseguente sfondo luminoso dietro lettera oscuro "m". Un filtro di emissione centrato a 515 nm è stato scelto di raccogliere questa emissione fluorescente. A minor distorsione delle immagini può essere osservato, soprattutto vicino ai bordi laterali della cornice dell'immagine. Il risultato è una distorsione dal modello di scansione sinusoidale dello specchio 8kHz gavlo, e sarà discusso in dettaglio di seguito.
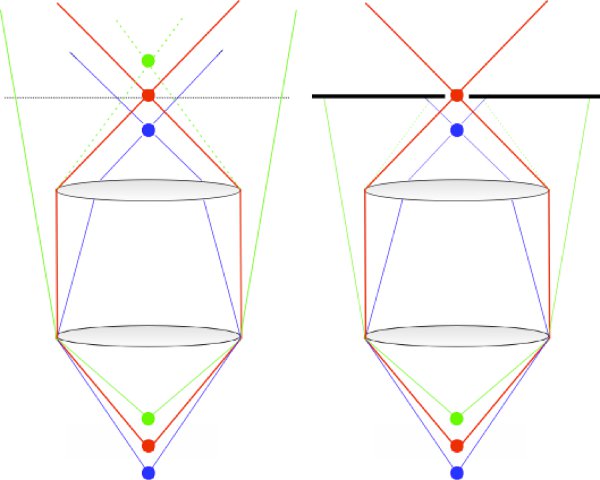
Figura 1. Schema dimostrando il principio di funzionamento di un microscopio confocale. I raggi provenienti dal fuoco obiettivo sono inoltrati attraverso il sistema e focalizzata attraverso il foro stenopeico confocale (rosso). I raggi provenienti sia sopra (blu) o sotto (verde) la messa a fuoco obiettivo non emergono dall'obiettivo collimato, e quindi non sono efficacemente trasmesse attraverso il foro stenopeico confocale.
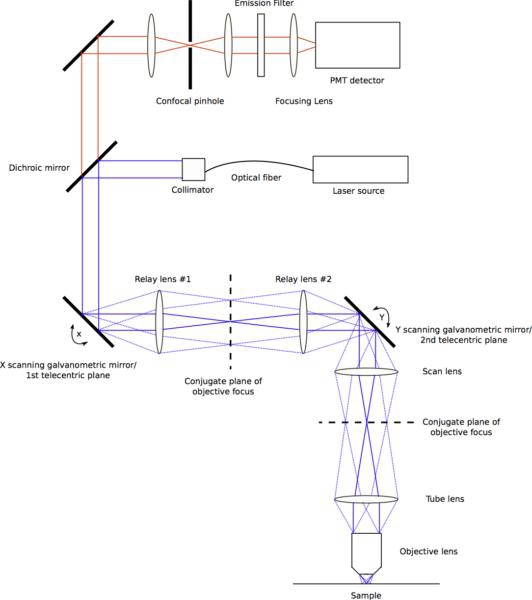
Figura 2. Diagramma che mostra tutti i percorsi di luce attraverso il sistema di scansione del fascio. Gli specchi di scansione sedersi a telecentrico aerei con la stazionediscrezionali, obiettivo aereo per tornare apertura. Paia di lenti tra i piani fissi agire per inoltrare le travi a scansione. Le prime due lenti relè hanno pari lunghezze focali, formando un telescopio 1:1. Il secondo paio di lenti, conosciuta ufficialmente come la lente di acquisizione e lente del tubo, non hanno bisogno di essere uguali in lunghezza focale, e servono spesso da un telescopio fascio espansione per assicurare l'obiettivo è troppo pieno di back-apertura. La luce emessa dal campione viaggia indietro attraverso il sistema di lettura ed è passato attraverso lo specchio dicroico. Una lente focale corta focalizza la luce di emissione attraverso il foro stenopeico confocale, che viene poi collimato da una lente. Una lente concentra la finale confocale-filtrata emissione su un tubo fotomoltiplicatore. Clicca qui per vedere una versione full-size di questa immagine.
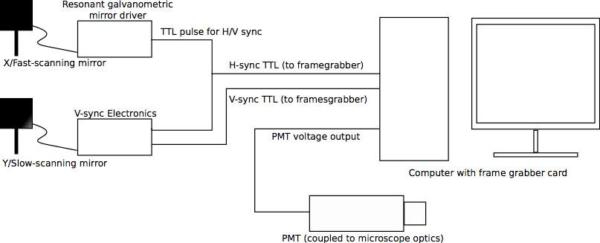
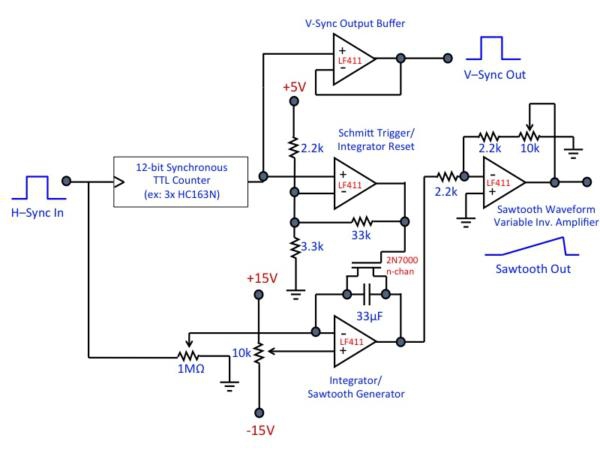
Figura 3. (A) Schema generale della configurazione elettronica di scansione. Segnale di riferimento complessivo del microscopio e la base dei tempi è l'uscita "sync" TTL del digiuno specchio risonante asse galvo, che genera un impulso TTL, alla fine di ogni riga acquisita (cioè, quando il galvo ha completato un ciclo di scansione). Ciò fornisce l'H-sync segnale alla scheda framegrabber. Uscita sincronizzare il galvo è anche collegato al V-sync scheda di controllo, che aumenta gradualmente la sua tensione di uscita in risposta ad ogni H-sync impulso a generare la forma d'onda a dente di sega che spinge l'asse di scansione lenta. Una volta che tutte le linee sono state scansionate, il V-sync azzera bordo della forma d'onda a dente di sega e genera un impulso TTL che funge da framegrabber V-sync del segnale. L'ingresso finale per la scheda framegrabber è il segnale analogico dal tubo fotomoltiplicatore (PMT Si noti che molte di generare tensione negativa in uscita; essere sicuri di progettare il circuito di und scegliere l'hardware di conseguenza). Il video-rate le immagini vengono generate e visualizzate nel software framegrabber Matrox. (B) Esempio circuito di controllo. In questo disegno, la tensione di ogni H-Sync impulso è "aggiunto" / integrato al integratore amplificatore operazionale per generare la rampa d'onda a dente di sega; impulsi vengono contati in concomitanza nella fase contatore TTL. Quando il numero desiderato di righe è stato raggiunto (cioè, quando la scansione raster è completa), il contatore genera un attivo-basso "svolgere" impulso, che spinge il trigger di Schmitt per generare un impulso di reset per l'integratore. Questo azzera sia il contatore e l'integratore op amp, preparando il circuito per il prossimo ciclo. Scelta dei componenti appropriati rende questo circuito ampiamente applicabile ad una varietà di formati raster. Questo è solo uno attuazione; numerose altre implementazioni sono possibili e possono essere preferito in determinate circostanze. Inoltre, questo circuito è stato progettato per essere utilizzato con scheda Matrox framegrabbers, che rilevare e correggere automaticamente l'immagine di fase. Se il circuito è da utilizzare con framegrabbers altri circuiti di correzione di fase o software può essere richiesta. Clicca qui per vedere una versione full-size di questa immagine.

Figura 4. Trasmissione delle immagini attraverso un fascio di fibre coerente. In questo schema, le lenti su entrambi i lati del bundle sono in atto a scala sia l'immagine proiettata sulla ingresso fascio di fibre così come espandere l'immagine sull'uscita fascio di fibre.

Figura 5. Esempio di un fascio di fibre ottiche montato in un attacco a 5 assi. Un piccolo 1 "blocco di alluminio del diametro si annoiava in modo che il fascio di fibre immagine potrebbe essere inserita. La fibra è stato incollato con resina epossidica all'interno del blocco di alluminio a both parte superiore e inferiore del blocco per la stabilità.

Figura 6. Immagini del sistema di microscopia completato con il microendoscope allegato. Per meglio visualizzare i percorsi di luce, il percorso del fascio di eccitazione viene disegnata in blu, mentre il percorso del fascio di emissione dopo lo specchio dicroico è disegnata come una linea rossa.
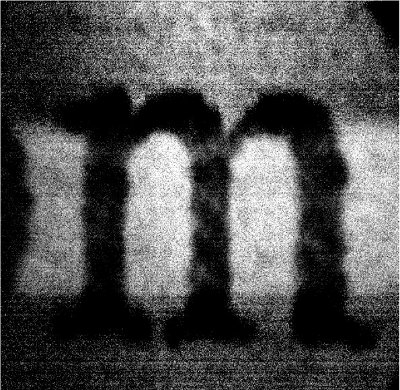
Figura 7. Immagine di esempio generato dal video-sistema dei tassi di microscopia confocale scansione. Un buio minuscolo lettera "m" appare sullo sfondo luminoso di fluorescenza di un biglietto da visita bianco.
Discussione
Questo video-rate sistema di imaging si avvale di un sistema operativo risonante specchio galvanometrica a circa 8 kHz. Specchi di risonanza può essere molto forte quando viene eseguito a piena potenza, e il loro tono alto può essere fastidioso o addirittura pericolose, a volte l'esposizione sufficiente. Anche se non dimostrato qui, si raccomanda di proteggere lo specchio di risonanza galvanometrico all'interno di una custodia trasparente per ridurre significativamente il volume di sistema e / o di indossare attrezzature di protezione dell'udito adeguati, come i tappi per le orecchie.
Lo specchio di risonanza galvanometrico scansioni in un andamento sinusoidale. Tuttavia, le schede framegrabber letto segnale assumendo un tasso di scansione completamente lineare in entrambe le direzioni orizzontale e verticale. Dal momento che uno sweep sinusoidale rallenta ai bordi della scansione, gli artefatti di compressione delle immagini si può osservare lungo il digiuno (orizzontale) dell'immagine. Un modo per minimizzare questo problema è quello di guidare volutamente la risonanza gamma specchio galvo scansione significativamente più grandi dellente diametro relè. In questo modo, solo lo sweep quasi lineare centrale del pattern di scansione sinusoidale attraverserà il campione, riducendo al minimo le distorsioni di immagine. Un altro approccio sarebbe quello di post-elaborazione delle immagini raccolte per linearizzare l'asse veloce. Questo può essere ottenuto attraverso l'immagine un modello conosciuto fluorescente (come ad esempio una griglia) e utilizzando il modello di dimensioni conosciute per creare uno script di elaborazione che unwarps le immagini raccolte.
Questo sistema di scansione particolare è stato progettato allo scopo di imaging in vivo, che spesso richiede un montante orientati video-tasso microscopio. Per gli esperimenti di imaging cellulare, microscopi invertiti sono più tipicamente usato. Il progetto qui presentato può essere facilmente modificato per costruire un simile microscopio invertito, tutto ciò che serve è una rotazione della finale "specchio 2 di diametro. Invece di orientare lo specchio per dirigere il fascio di scansione verso il basso, lo specchio può dirigere il raggio verso l'alto. Ponendo la lente obiettivat la stessa distanza dallo specchio insieme a uno stadio campione permetterebbe di imaging in una geometria invertita. Se il sistema di imaging è stato costruito esclusivamente per l'imaging microendoscopica, non vi è alcuna ragione di "piegare" la progettazione microscopio verticale a tutti. Invece, il sistema di scansione intero può essere costruito su una basetta singola orizzontale con il parallelo obiettivo obiettivo orientato al tavolo ottico.
Si noti che il microscopio in questa build utilizza una configurazione fissa a foro stenopeico, mentre questa prevede la massima semplicità e facilità di costruire l'allineamento, gli utenti che desiderano un sistema più versatile potrebbe prendere in considerazione che incorpora un foro stenopeico variabile, come si possono trovare in microscopi confocale più commerciale. Consentendo all'utente di regolare le dimensioni del foro stenopeico per compensare i campioni di varia intensità di emissione, questo permette all'utente di ottimizzare al meglio il compromesso tra potenza del segnale e la risoluzione di un dato campione.
ChOICE di fibra dell'immagine selezionata per il microscopio è importante. Si consiglia di utilizzare fibre un'immagine coerente Sumitomo a causa della loro distanza chiudere nucleo della fibra e basso autofluorescenza relativa. Fibre di immagine prodotto da Fujikura sono stati trovati per avere elevate quantità di autofluorescenza 10, che può sopraffare deboli segnali di fluorescenza da un campione e limitare la sensibilità finale del microendoscope. Sumitomo fibre prodotte, come la 8-30N utilizzato in questa configurazione particolare, hanno molto più bassi livelli di autofluorescenza rispetto ai loro equivalenti Fujikura. Mentre fasci di fibre leeched potrebbe essere considerato attraente per microendoscopy, il loro design luoghi tipicamente core singola fibra troppo distanti, il che significa che i nuclei delle fibre scarsamente oggetti campione, lasciando le regioni significative di potenziale interesse.
Infine, va notato che, mentre il microscopio qui descritti saranno utili in una varietà di in vitro e in vivo applions e può essere creato per una frazione del costo di un completo sistema commerciale, non ha caratteristiche come il rilevamento luce trasmessa, un oculare per la visualizzazione, o di un percorso del fascio per non confocale widefield epifluorescenza. Mentre è possibile costruire un sistema con queste caratteristiche da zero, i lettori che desiderano un sistema del genere potrebbe voler modificare un sistema commerciale esistente per soddisfare le loro esigenze, piuttosto che avviare una costruzione completamente nuova.
Divulgazioni
La produzione di questo video-questo video è stato sponsorizzato da Thorlabs, Inc.
Riconoscimenti
Gli autori desiderano ringraziare Thorlabs per il loro sostegno di questo progetto. AJN desidera ringraziare per il supporto di una Graduate Fellowship NSF.
Questo lavoro è stato parzialmente finanziato dal National Institutes of Health tramite il programma New Innovator il direttore NIH Award, il numero di sovvenzione 1 DP2 OD007096-01. Informazioni sul nuovo programma Innovator Award è a http://nihroadmap.nih.gov/newinnovator/ . Gli autori desiderano ringraziare Tom Hayes per l'uso del laboratorio di Elettronica di Harvard.
Materiali
| Name | Company | Catalog Number | Comments | |
| Nome parte | Fabbricante | Item Number | Specificazioni | Quantità |
| 515 nm filtro passa-banda | Chroma | HQ515/50M | 46 FWHM | 1 |
| Acromatico Doublet Dia Lens 25,4 mm. FL x 50 mm, rivestimento MgF2 | Edmund Optics | NT49-766 | 1 | |
| Acromatico Doublet Dia Lens 25,4 mm. FL x 76,2 millimetri, rivestimento MgF2 | Edmund Optics | NT49-768 | 1 | |
| Acromatico Doublet Dia Lens 25,4 mm. FL x 88,9 millimetri, rivestimento MgF2 | Edmund Optics | NT49-769 | 2 | |
| Obiettivo acromatico Dia Doublet 50mm. FL x 300 mm, rivestimento MgF2 | Edmund Optics | NT45-179 | 1 | |
| 8 kHz R scanner ad alta frequenza ottica | Electro-Optical Products Corporation (EOPC) | SC-30 | 8 kHz | 1 |
| AGC driver | Electro-Optical Products Corporation (EOPC) | ACG: 8K | ||
| H7422-PA fotosensore modulo | Hamamatsu | H7422-PA | Limitazione di corrente raccomandato | 1 |
| M9012 Alimentazione | Hamamatsu | M9012 | Per l'utilizzo con H7422-PA | 1 |
| HC PL APO Obiettivo CS | Leica | 11506284 | 10x/0.40 | 1 |
| Solios EA / XA Framegrabber Carta | Matrox | Solios EA / XA | MIL software necessario; OEM interconnessioni raccomandato | 1 |
| Alimentazione 12V | Meanwell | LPV-100-12 | +12 V, 8.5A | 1 |
| 5x Microscope Lens Obiettivo | Newport | M-5X | 0,10 NA, Lunghezza focale 25,4 millimetri | 1 |
| Immagine fibra Coherent | Sumitomo | 8-30N | 1 | |
| 1 / 4 "-20 Vite e Kit Hardware | Thorlabs | HW-KIT2 | 1 | |
| 100 micron montati Pinhole | Thorlabs | P100S | Ideale per la costruzione di filtri spaziali | 1 |
| 30 millimetri Cage Clamp Cubo | Thorlabs | B6C | 1 | |
| 30 millimetri di sistema Cubo Cage, 4-Way | Thorlabs | C4W | 1 | |
| 406 nm, 5 mW, B Pin Code, fibra SM Pigtailed diodo laser, FC / PC | Thorlabs | LPS-406-FC | Prodotto obsoleto, sostituita dalla LP405-SF10 | 1 |
| 5-Minute Epoxy, 1 oncia | Thorlabs | G14250 | 1 | |
| 6 assi cinematica ottica Monte | Thorlabs | K6X | 1 | |
| 8-32 Vite e Kit Hardware | Thorlabs | HW-KIT1 | 1 | |
| 8-32 Vite di fermo e Kit Hardware | Thorlabs | HW-KIT3 | 1 | |
| Adattatore con esterno e interno RMS Discussioni Discussioni SM1 | Thorlabs | SM1A4 | 1 | |
| Agg. FC / PC e FC / APC collimatore, f = 2,0 mm, ARC: 400-600 nm | Thorlabs | CFC-2X-A | f = 2,0 millimetri | 1 |
| Regolabile collimatore Adapter Fiber, filettato SM1 | Thorlabs | AD9.5F | 1 | |
| Breadboard in alluminio, 12 "x 18" x 1 / 2 " | Thorlabs | MB1218 | 1 / 4 "-20 Threaded | 2 |
| Diodo laser da banco / TEC controller | Thorlabs | ITC4001 | 1 A/96 W | 1 |
| DMLP 425 nm a lungo Passo specchio dicroico | Thorlabs | DMLP425 | 1 | |
| Monte cinematica per Ø1 "Ottica | Thorlabs | Km100 | 3 | |
| LD / TEC monte per Thorlabs fibra Pigtailed Diodi laser | Thorlabs | LM9LP | 1 | |
| Attacco obiettivo di Ø18 millimetro Ottica | Thorlabs | LMR18 | Un anello di fissaggio inclusa | 1 |
| Supporti Lens per 2 "Optics | Thorlabs | LMR2S | Con filettatura interna ed esterna; anello di fermo incluso | 2 |
| Mini Serie Cage Assemblea Rod, 6 "Long, mm Ø4, Qty 1. | Thorlabs | SR6 | 4 | |
| Ø1.0 "Post Pilastro piedistallo, 8-32 Taps, 1" Long | Thorlabs | RS1P8E | 4 | |
| Ø1 "Post Pilastro estensione, lunghezza = 0,5 | Thorlabs | RS05 | 4 | |
| Ø1 "Pillar Messaggio estensione, lunghezza = 0,75" | Thorlabs | RS075 | 4 | |
| Ø1 "Protected Silver Mirror, 3,2 mm di spessore | Thorlabs | ME1-P01 | 1 | |
| Ø1 "SM1 rotante Elemento di messa a fuoco regolabile, L = 1" | Thorlabs | SM1V10 | 1 | |
| Ø2 "Protected Silver Mirror, 3,2 mm di spessore | Thorlabs | ME2-P01 | 2 | |
| P100S - Ø100 micron montati Pinhole | Thorlabs | P100S | 1 | |
| Polaris bassa deriva Ø1 "cinematica Specchio Monte | Thorlabs | POLARIS-K1 | Bassa deriva | 1 |
| SM1 Lens Tube, L = 1 " | Thorlabs | SM1L-10 | Un anello di fissaggio inclusa | 4 |
| SM1 Cage piastra filettata 30 mm, 0,35 "Thick | Thorlabs | CP02 | 2 | |
| SM1 a M25 adattatore Component ottica Threading | Thorlabs | SM1A24 | Discussioni SM1 esterno e interno M25.5x0.5 Discussioni | 1 |
| Larghezza Diam piccolieter galvanometrica sistema | Thorlabs | GVSM001 | 1 | |
| Piccola Forcella di serraggio | Thorlabs | CF125 | 1 / 25 "svasati slot, universale | 15 |
| Spaziale Filter System | Thorlabs | KT310 | Pinhole venduto separatamente | 1 |
| TE-raffreddato monte per 5,6 e 9 Laser millimetri | Thorlabs | TCLDM9 | 1 | |
| Supporto verticale per Circuiti sperimentali | Thorlabs | VB01 | Ogni | 2 |
| Plan-Apochromat | Zeiss | 1101-957 | 20x/0.75 NA | 1 |
Riferimenti
- Pawley, J. B. . Handbook of biological confocal microscopy. , 985-985 (2006).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nature Reviews Molecular Cell Biology. 2, 444-456 (2001).
- Klonis, N., Rug, M., Harper, I., Wickham, M., Cowman, A., Tilley, L. Fluorescence photobleaching analysis for the study of cellular dynamics. European Biophysics Journal. 31, 36-51 (2002).
- Stephens, D. J. Light Microscopy Techniques for Live Cell Imaging. Science. 300, 82-86 (2003).
- McMahon, A., Supatto, W., Fraser, S. E., Stathopoulos, A. Dynamic Analyses of Drosophila Gastrulation Provide Insights into Collective Cell Migration. Science. 322, 1546-1550 (2008).
- Wallingford, J. B. Dishevelled controls cell polarity during Xenopus gastrulation. Nature. 405, 81-85 (2000).
- Laemmel, E. Fibered Confocal Fluorescence Microscopy (Cell-viZio) Facilitates Extended Imaging in the Field of Microcirculation. Journal of Vascular Research. 41, 400-411 (2004).
- Moussata, D. The confocal laser endomicroscopy. Acta Endoscopica. 39, 448-451 (2010).
- Dunbar, K., Canto, M. Confocal endomicroscopy. Current Opinion in Gastroenterology. 24, 631-637 (2008).
- Udovich, J. A. Spectral background and transmission characteristics of fiber optic imaging bundles. Applied optics. 47, 4560-4568 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon