Method Article
Microscopie à balayage vidéo confocale et à taux Microendoscopy
Dans cet article
Résumé
La construction complète d'une coutume, en temps réel du système d'imagerie confocale à balayage est décrite. Ce système, qui peut être facilement utilisé pour la vidéo-microscopie et taux de microendoscopy, permet une gamme de géométries d'imagerie et les applications ne sont pas accessibles à l'aide de systèmes commerciaux standard confocale, à une fraction du coût.
Résumé
La microscopie confocale est devenu un outil précieux dans la biologie et les sciences biomédicales, permettant rapide, haute sensibilité, haute résolution et sectionnement optique de systèmes complexes. La microscopie confocale est couramment utilisé, par exemple, pour étudier des cibles cellulaires spécifiques 1, la dynamique de moniteur dans des cellules vivantes 2-4, et de visualiser l'évolution en trois dimensions de l'ensemble des organismes 5,6. Extensions de systèmes d'imagerie confocale, comme microendoscopes confocal, permettant l'imagerie haute résolution in vivo 7 et sont actuellement appliquées à l'imagerie et le diagnostic des maladies dans les milieux cliniques 8,9.
La microscopie confocale permet la résolution en trois dimensions en créant soi-disant «sections optiques» en utilisant l'optique géométrique simple. Dans un standard à grand champ de microscope, fluorescence générée à partir d'un échantillon est prélevé par une lentille de l'objectif et relayés directement à un détecteur. Alors que d'acceptermesure pour des échantillons d'imagerie fine, des échantillons d'épaisseur deviennent floues générées par fluorescence au-dessus et ci-dessous le plan objectif focale. En revanche, la microscopie confocale permet virtuel, sectionnement optique des échantillons, en rejetant hors de focaliser la lumière pour construire une haute résolution en trois dimensions des représentations d'échantillons.
Microscopes confocaux réaliser cet exploit en utilisant une ouverture confocale dans le faisceau de détection. La fluorescence recueillies auprès d'un échantillon par l'objectif est relayée à travers les miroirs de balayage et à travers le miroir primaire dichroïque, un miroir soigneusement choisis pour refléter les courtes longueurs d'onde tels que le faisceau d'excitation laser en passant plus la, Stokes décalée d'émission de fluorescence. Ce signal longueur d'onde de fluorescence est ensuite transmis à une paire de lentilles de chaque côté d'un trou d'épingle qui est positionnée à un plan exactement conjugué avec le plan focal de l'objectif. Photons collectés à partir du volume focal de l'objet sont collimatéspar l'objectif et sont focalisés par des lentilles confocale à travers le sténopé. Fluorescence généré au-dessus ou en dessous du plan focal ne seront donc pas collimaté correctement, et ne passera pas à travers le sténopé confocal à 1, la création d'une section optique dans laquelle seule la lumière de l'accent microscope est visible. (Fig 1). Ainsi, le sténopé agit efficacement comme une ouverture virtuelle dans le plan focal, confinant l'émission détectée à une seule localisation spatiale limitée.
Commerciale moderne microscopes confocaux offrir aux utilisateurs un fonctionnement entièrement automatisé, ce qui rend les procédures d'imagerie anciennement complexes relativement simple et accessible. Malgré la souplesse et la puissance de ces systèmes, commerciaux microscopes confocaux sont pas bien adaptés pour toutes les tâches d'imagerie confocale, comme de nombreuses applications d'imagerie in vivo. Sans la possibilité de créer des systèmes d'imagerie personnalisé pour répondre à leurs besoins, des expériences importantes peuvent rester hors de réactionsh pour de nombreux scientifiques.
Dans cet article, nous proposons une méthode étape par étape pour la construction complète d'une coutume, la vidéo à taux système d'imagerie confocale à partir de composants de base. Le microscope droit sera construit en utilisant un miroir galvanométrique de résonance pour fournir l'axe de balayage rapide, tandis qu'une vitesse standard de résonance miroir galvanométrique va scanner l'axe lent. Pour créer un faisceau bien précis numérisés dans la mise au point objectif, ces miroirs sera positionné à l'avion que l'on appelle l'aide de quatre lentilles télécentriques relais. La détection confocale sera accompli en utilisant un standard, tube photomultiplicateur off-the-shelf (PMT), et les images seront capturées et affichées en utilisant une carte Matrox framegrabber et le logiciel inclus.
Protocole
Le choix de la longueur d'onde laser, miroir dichroïque, et des filtres optiques doit être déterminée sur la base des colorants spécifiques utilisés dans l'expérience. Par exemple, l'imagerie confocale d'un échantillon coloré avec Alexa Fluor 488 mieux est accompli en utilisant un laser à 488 nm, un nm 500 longs-pass miroir dichroïque, et un miroir de 30 nm de bande passante passe bande centré à 515 nm. En revanche, l'imagerie confocale de la teinture rouge Fluor Alexa 647 exigerait un ensemble différent de composants. Le microscope dans ce protocole a été construit pour visualiser tout colorant qui absorbe fortement à 400 nm et émet au-delà de 450 nm. Nous avons donc choisi un laser 406 nm et une excitation de 425 nm à long passage dichroïque pour refléter le faisceau laser. Fluorophores excités peuvent être sélectivement imaginé par la sélection des filtres d'émission appropriés. Il est important de la bonne utilisation du matériel de montage optique à travers le protocole à l'endroit indiqué; du matériel inapproprié ou de fortune ne tiendra pas un alignement aussi bien et peut être un danger pour la sécurité.
1. Mise en place du miroir galvanométrique de résonance et de l'optique de relais
Un concept important dans la construction de tout type de système de balayage confocal est télécentricité. Dans un système optique télécentrique, les lentilles sont espacées les unes des autres par la somme de leurs longueurs focales, de telle sorte que l'agrandissement du système est simplement défini par le rapport des focales 1. Cela permet la construction d'un système de relais optique où les grossissements, et donc les propriétés du système, sont faciles à définir par le choix des verres. Un autre concept important implique que l'on appelle «stationnaire» avions optiques, aussi appelés "plans d'ouverture". Un plan d'ouverture est une position le long du chemin optique où le faisceau de lumière ne subit aucune sorte de mouvement latéral. Dans cette conception de microscope, il ya trois plans d'ouverture importants: le premier et deuxième miroirs de balayage, et l'arrière-ouverture de l'objectif. Afin d'atteindre optimale du faisceau SCAnning au plan focal de l'objectif, le faisceau entrant l'ouverture arrière de la lentille de l'objectif doit être immobile, balayant seulement dans l'angle. Afin de créer cet arrêt, l'angle balayé par avion, nous avons besoin de placer les premier et deuxième miroirs de balayage au conjugué, avions télécentrique à l'objectif de retour à ouverture. Lentilles placé entre les miroirs et la lentille de l'objectif servent à relayer l'angle du faisceau à balayage entre ces plans stationnaires (Fig 2). Les miroirs de balayage sont montés sur deux galvos numérisation, dont chacun est responsable de la numérisation d'une direction donnée du plan d'imagerie (X et Y). Pour obtenir le taux de balayage de ligne requis pour la vidéo à taux d'imagerie, un galvo haute fréquence de résonance est nécessaire pour numériser l'axe des x (aussi connu comme le "rapide" axe). Ces galvos utiliser un sensible, un circuit en boucle fermée pour créer un motif de balayage sinusoïdal et sont capables de fonctionner à des fréquences très élevées; nous avons sélectionné une galvo 8 kHz pour cette construction.
- Mettre en place desle collimateur de fibres optiques dans le montage et environ diriger le faisceau à l'aide de la vis de réglage de telle sorte qu'il se déplace en ligne droite à la fois horizontalement et verticalement. Maintenant, prenez un iris et le placer en face du collimateur de fibres, en ajustant la hauteur verticale de l'iris de telle sorte que le faisceau passe par le centre proprement iris. Ensuite, déplacez l'iris loin du collimateur le long du trajet du faisceau et observer si le faisceau se déplace toujours à travers le centre de l'iris. Si non, ajuster la position du faisceau sur l'iris à l'aide des deux vis de réglage.
- Placez le miroir dichroïque montées dans la trajectoire du faisceau avec le faisceau laser positionné à peu près au centre du miroir. Avant de serrage du miroir à la table, faire pivoter le support miroir pour réfléchir le faisceau à environ 90 degrés et environ ajuster la réflexion afin que la hauteur verticale du faisceau laser réfléchi ne change pas.
- Placez un miroir monté résonance galvanométrique dans la trajectoire du faisceau laser, en prenant de voituree afin de s'assurer que le faisceau laser est positionné exactement au centre horizontal de la surface du miroir. Dans ce protocole, le miroir de résonance a été galvo expoxied directement à une monture de miroir. Tournez le support miroir pour réfléchir le rayon laser sur un angle de 90 degrés. Environ ajuster la réflexion sur le miroir afin de maintenir la hauteur même laser faisceau vertical.
- Afin de diriger tout rayon de lumière dans une direction donnée, on doit, par définition, définir deux points dans l'espace à travers lequel le rayon se rendra. Ceci est généralement accompli en plaçant deux iris le long de la trajectoire souhaitée horizontale et verticale et de manipuler le faisceau laser de passer par le centre de chaque iris. Quatre degrés de liberté sont nécessaires pour régler le faisceau; deux degrés horizontal et vertical de la liberté pour chaque iris. La façon la plus courante et facile à atteindre ces degrés de liberté est d'utiliser deux miroirs pour orienter, ou de «marcher», un faisceau laser.
Prenez deux iris, et mettre leur hauteur verticaleà l'étape 1.1, en utilisant le faisceau laser réfléchi sur le miroir de résonance galvo comme une référence. Maintenant, en utilisant les trous de vis sur la carte de test optiques comme un guide à l'œil, serrer les deux iris dans une ligne droite. - Ajustez le miroir dichroïque et miroir galvo résonance pour diriger le faisceau laser à travers le centre des deux iris. Utilisez le premier miroir dans le chemin (le miroir dichroïque) au centre de la poutre sur l'iris d'abord, puis utilisez le second miroir dans le chemin (le miroir de résonance galvo) au centre de la poutre sur l'iris secondes. Itérative d'ajuster ces deux miroirs jusqu'à ce que le faisceau est aligné à la fois par les iris, assurant tout au long que le faisceau laser réfléchi par le miroir de résonance galvo se reflète encore du centre du miroir approximatives. Si le faisceau est dévié, ajuster la monture en fibre collimateur et répétez les étapes itératives ci-dessus.
- Avec le faisceau centré sur les deux iris, nous allons maintenant placer les deux lentilles relais qui sera l'image de notre premier arrêt, le plan de télécentriquee (par exemple, le miroir de résonance galvo) sur notre deuxième arrêt, l'avion télécentrique (à savoir, la vitesse standard galvo miroir). Pour ce microscope particulier, les lentilles de contact choisies dans le premier relais ont la même longueur focale, «f», donc la distance entre les deux miroirs de notre système télécentrique est simplement 4f. Afin de s'assurer que les lentilles sont précisément au centre de la trajectoire du faisceau, utiliser l'astuce d'alignement optique. Placez la première lentille dans le trajet du faisceau et de regarder le spot du faisceau laser sur le côté dans la trajectoire du faisceau d'iris après la lentille. Ensuite, ajuster la hauteur de l'objectif verticalement de sorte que le centre vertical de la poutre est au centre de l'iris. Enfin, régler la position de la poutre horizontale au centre de la poutre sur l'iris. Effectuer la même procédure pour la seconde lentille.
2. Mise en place du miroir de balayage seconde et en tournant le microscope
- Pour trouver la position exacte de l'avion télécentrique secondes, brancher le galvo résonnantson balayage unité et allumez-le. Utilisez une carte de visite blanche pour suivre le faisceau de balayage à travers les deux lentilles. Vous trouverez le plan de télécentrique à la distance approximative de 4f de la résonance galvo, où le faisceau laser va apparaître complètement immobile. Marquez cette position sur la carte de test.
- Placez le miroir de balayage standard de galvo à cet endroit plane télécentrique exacte, et d'ajuster la hauteur et la position de miroir de telle sorte que le faisceau dans le plan télécentrique frappe le centre exact du miroir de balayage. Il est crucial de pouvoir configurer le matériel de contrôle miroir et mettre une tension de 0 volt sur l'entrée miroir de balayage de sorte que le miroir s'installe à sa position neutre pendant ce processus. Soigneusement ajuster l'angle de miroir pour diriger le faisceau verticalement et serrer doucement le miroir en position.
- Comme nous construisons un microscope droit, nous allons maintenant fixer la planche à pain seconde à un angle de 90 degrés à 90 degrés en utilisant les supports de montage. Assurez-vous d'éteindrele laser et l'électronique à balayage, débranchez la fibre, et débranchez les miroirs de balayage pendant ce processus. Pour faire le reste de l'alignement plus facile, une fois les ferrures sont fixées en place, soigneusement tourner le microscope à l'ensemble de telle sorte que la carte de test est désormais nouvelle à plat. Utilisez une pince pour fixer la plaque d'essai à la surface de travail. Maintenant, le reste de la configuration précédemment verticale peut être facilement effectuée sur la planche à pain plat.
3. Mise en place du scanner, du tube, et des lentilles d'objectif
Ensuite, nous allons mettre en place la deuxième série de lentilles relais, officiellement dénommée la «lentille de balayage» et «lentille de tube". Il est important de choisir la bonne combinaison de lentilles de manière à atteindre le grossissement correcte au point de vue objectif et d'optimiser la résolution de l'image finale. Tout d'abord, pour atteindre l'ouverture maximale numérique (NA) de tout objectif donné, le faisceau laser frappe l'arrière de l'objectif doit remplir leRetour d'ouverture complètement; alors seulement l'objectif de pouvoir créer l'objet le plus serré. Objectif lentilles ont une gamme de tailles d'ouverture arrière; a choisi un taux d'agrandissement de l'objectif à légèrement trop remplir l'ouverture arrière de l'objectif choisi. Deuxièmement, afin d'atteindre le grossissement à droite, l'objectif doit être compatible avec la longueur focale lentille de tube pour lequel il a été conçu. Malheureusement, les différents fabricants objectif de microscope avons choisi d'utiliser différentes longueurs focale lentille de tube, il est donc important de construire un microscope avec la lentille de tube correct pour la lentille de l'objectif spécifique employée. Par ailleurs, certains fabricants, comme Zeiss, la conception de leurs lentilles de tube pour compenser les aberrations chromatiques spécifiques de leur objectif appariés, tels que l'utilisation d'une paire de lentilles incorrecte objectif tube sera en effet d'introduire de nouvelles aberrations qui autrement ne seraient pas présents. Nous préfèrent généralement les objectifs Olympus, comme toutes les indemnités chromatique est effectué dans ee objectif lui-même, rendant l'objectif / tube d'appairage facile. Bien que le microscope fonctionnera toujours si l'objectif et la lentille de tube ne correspondent pas, le grossissement de microscope réelle ne sera probablement pas correspondre à l'agrandissement cotée sur l'objectif. Pour ce microscope notamment la construction, la taille optimale d'ouverture de retour a été établi à 4 mm, nécessitant un rapport d'agrandissement 01h04 entre la lentille et la lentille de tube de balayage. Pour ce microscope personnalisée, nous allons utiliser une longueur d'objectif de balayage de 75 mm et une longueur lentille de tube de 300 mm.
- Comme la distance totale entre le miroir et de se concentrer second scan objectif est grand, ce segment de la construction du microscope sera mise d'abord le miroir nécessaire pour diriger le faisceau vers l'objectif. Placez la première grande, 2 "(50 mm) Miroir de diamètre près du bord de la planche à pain, et faire pivoter le support miroir pour réfléchir le faisceau laser d'environ 90 degrés. Environ ajuster la réflexion sur le miroir afin de maintenir le BEA même verticalem de hauteur. Placez l'autre 2 "miroir au bord opposé de la planche à pain à une orientation qui dirige le faisceau vers le bas à un angle de 90 degrés. Utilisez les vis de réglage afin d'assurer la hauteur verticale du faisceau ne change pas. Mettre en place des deux iris, comme à l'étape 1.4, et d'ajuster les deux miroirs comme indiqué dans l'étape 1.5 de centrer le faisceau sur l'iris.
- Avec l'iris encore en place, placer la lentille de balayage dans la trajectoire du faisceau et d'ajuster sa position horizontale et verticale au centre de la tache laser sur l'iris premier. À une distance de 75 mm + 300 mm de la lentille (entre les deux miroirs), placer soigneusement la grande lentille de tube 2 "et d'ajuster sa position horizontale et verticale au centre de la poutre sur l'iris premier. Aux fins de maintenir l'alignement à l'avenir, il est utile de laisser ces iris en place; pour cette application, une carte de visite avec un trou de taille appropriée pourrait être collé à un support et inséré dans le trajet du faisceau.
- Avec tous les miroirs et les lentillesmaintenant en place, commencer à balayer le miroir de résonance galvo et le miroir de balayage standard. Dans cette construction, le miroir de balayage standard sera finalement être synchronisé avec la vitesse de balayage du miroir de résonance à travers un circuit de commande sur mesure, tel que décrit dans la figure 3, ce qui permet la synchronisation supérieure verticale et horizontale. Toutefois, aux fins d'alignement et de nombreuses applications d'imagerie, le miroir peut facilement être scannés en utilisant un motif en dents de scie à partir d'un générateur de fonctions. Utilisation d'une carte d'affaires, localiser le faisceau laser à une position de 300 mm après la lentille de tube. Bien que le faisceau est la numérisation ailleurs dans le microscope à la fois dans les directions verticale et horizontale, le faisceau doit être parfaitement immobile près de cet endroit. C'est là que l'ouverture arrière de la lentille de l'objectif sera placé. Si les plans horizontaux et verticaux stationnaires ne coïncident pas sur le même plan le long de la trajectoire du faisceau, soigneusement débrider et de traduire la lentille de tube le long du chemin optique de s'assurer queles deux plans se chevauchent aussi étroitement que possible. Recentrer la position verticale et horizontale de la lentille de tube et fixez solidement en position.
- Placez la lentille de l'objectif dans la trajectoire du faisceau, en veillant à la position de l'objectif de retour l'ouverture au plus près de l'avion immobile que possible. L'ouverture véritable objectif de retour ne peut pas réellement être toujours situé à l'ouverture retour physique de l'objectif en raison des différents choix de conception du fabricant. Il est donc toujours préférable de vérifier auprès du fabricant pour déterminer la position de retour vraie ouverture.
- Mettre en place la scène de l'échantillon, en s'assurant que le montage de traduction qui permettra de l'axe z de mouvement peut se déplacer sur toute sa gamme sans se heurter à la monture d'objectif objectif.
4. Mise en place et aligner le trou confocal et le détecteur
- Débranchez toutes les alimentations électriques et de fibres optiques, et faire pivoter l'assemblage de microscope de telle sorte qu'il se repose à nouveau sur la planche à pain maintenant le RESONant miroir de balayage. Fixer le breadboard solidement en place, puis rebranchez-la fibre au collimateur, et re-connecter les deux galvos et leurs câbles de commande. Comme avant, placer 0 volt sur la tension de commande de conduite de la galvo standards de numérisation.
- Sur la scène de l'échantillon, placer une carte de visite ou un petit volume d'une teinture brillante dans le point de vue objectif, en sandwich entre deux lamelles. Le choix du colorant dépend du laser et dichroïque sélectionnés, dans ce cas nous allons utiliser l'émission de fluorescence d'une carte d'affaires blancs pour aligner le système de détection confocale. Les quantum dots peuvent aussi être utiles à des fins d'alignement, comme ils sont brillants et ne photobleach. D'autres solutions comprennent billes fluorescentes et / ou des échantillons de tissus exposés à la couleur / buanderie azurant, qui tous deux émettent une fluorescence vive. Allumez la source laser et amener l'échantillon dans la mise au point microscope à l'aide de la phase de traduction. Une fois au point, la fluorescence générée à partir de l'échantillon doit être visible derrière tIl miroir dichroïque, comme décrit dans l'étape suivante. Maximiser la puissance du laser pour faire la fluorescence aussi brillant que possible.
- En utilisant une carte de visite, trace l'émission de fluorescence de l'échantillon à travers la lentille de l'objectif et le dos à travers le système de balayage pour le miroir dichroïque. Le miroir dichroïque transmet l'émission de fluorescence tout en reflétant le faisceau laser; trouver ce signal de fluorescence de l'autre côté du miroir dichroïque. Maintenant, placez un miroir derrière le miroir dichroïque et l'utiliser afin de refléter l'émission à un angle de 90 degrés. Prenez un iris, comme cela s'est fait à l'étape 1.1, et l'utiliser avec le miroir pour diriger le faisceau de fluorescence en droit et parallèle à la planche à pain que possible. Cette étape peut être mieux réalisée dans la pénombre.
- Mettre en place l'unité sténopé confocale comme décrit dans la figure 2. Nous avons constaté que le filtre spatial cage de montage assemblage de Thorlabs est idéal pour cette tâche. Il est important de choisir une pinhol appropriéetaille de l'e pour s'assurer que le système confocal atteint sa résolution optimale sans sacrifier trop de signal. Pour ce microscope personnalisé, une taille de 100 um à sténopé a été sélectionné. Placez l'unité spatiale du filtre en ligne avec le trajet du faisceau de fluorescence, en prenant soin de centrer la monture de l'objectif premier porte sur le faisceau d'émission de fluorescence. Après le montage d'une lentille focale courte dans l'unité (un objectif de microscope peut également être utilisé), faites glisser le support z traduction jusqu'à un accent clair peuvent être observés à la surface sténopé. Assurez-vous que l'unité entière est orientée le long de la ligne exacte droites définies par le faisceau de fluorescence. Attachez l'unité de la planche à pain.
Les émissions provenant de la plupart des échantillons est faible comparée aux niveaux ambiants de la lumière, même dans des pièces sombres. Il est donc crucial que d'une protection adéquate / lumière déconcertante être utilisés le long du chemin d'émission à l'abri de la contamination de la lumière parasite. Par ailleurs, des niveaux élevés de lumière ambiante sera PMT contre les surcharges et les dommages, particulièrement ceux sans cla protection ACTUEL. Les lecteurs sont donc fortement incités à utiliser des tubes lentilles pour enfermer le trajet du faisceau d'émission, un système correctement blindé, comme celui montré ici, est capable de fonctionner dans la lumière de la pièce avec peu ou pas de contamination de la lumière parasite. - Maintenant, en utilisant les boutons de réglage sur la scène de traduction, systématiquement déplacer le sténopé confocal pour trouver le point où le signal de fluorescence à travers le sténopé est maximisée. Cette position est plus facilement identifiés par ajustement itératif des deux axes pour effectuer une recherche en 2D sur la surface de montage sténopé. Une fois la position du signal est trouvé en maximisant, placer la lentille de collimation sur la monture cage après le sténopé. Trouver l'émission de fluorescence qui passe par l'unité confocale en utilisant une carte de visite, et faites glisser la lentille de collimation le long des poteaux jusqu'à ce que le signal de fluorescence émise est que collimaté que possible. Une fois que le faisceau est collimaté, veillez à placer le filtre approprié dans la trajectoire du faisceau dans une baignoire lentillese.
- Mettre en place le tube photomultiplicateur (PMT) de l'Assemblée. Placer une lentille de 50 mm de focale dans la trajectoire du faisceau d'émission de fluorescence et de trouver son point focal en utilisant une carte de visite. Marquez cette position sur la carte de test. Maintenant, éteignez le laser complètement - ce qui est important, comme la lumière laser errants ou non atténué peut endommager définitivement la plupart des PMT. Positionner le PMT de telle sorte que sa zone active se trouve au plus près du point marqué focale possible. Connecter l'ensemble PMT à la lentille de focalisation utilisant des tubes lentille réglable, et soigneusement envelopper ruban noir autour de tous les chemins poutres apparentes après la piqûre.
- Allumez le laser, mais être sûr de garder sa puissance extrêmement faible de telle sorte que l'émission de fluorescence est à peine visible. Allumez le PMT, une lecture attentive de connaître sa tension sur un oscilloscope la tension de commande est augmenté. Un PMT génère un signal à travers une série de phases d'électrons en multipliant, si le photocourant est trop élevé pour le niveau de lumière incidente, le tube peut êtrePMT irréversiblement endommagé. avec un circuit de limitation de courant est donc fortement recommandé, surtout pour les utilisateurs qui n'ont pas travaillé avec de tels détecteurs avant.
Augmenter la tension de commande PMT jusqu'à ce qu'une lecture épi et / ou un décalage CC peut être vu sur l'écran de l'oscilloscope; pour la plupart des PMT, ce signal sera négatif par rapport à la terre. Confirmez que ce signal se pose en effet de la fluorescence en tournant la puissance du laser pour observer une perte de signal. - Enfin, de manière itérative d'aligner le trou pour le maximum de signal sur l'oscilloscope en commençant par la manipulation de la lentille de focalisation z-position, puis ajuster la phase de traduction yz.
- Le matériel vidéo microscope à taux est complète! Maintenant accrocher les miroirs, panneaux de contrôle personnalisés, et l'ordinateur comme schématisé sur la figure 3. Comme précédemment, il est recommandé d'utiliser le système d'imagerie d'abord visualiser une taille standard connues de trouver la résolution optimale du microscope et de calculer le pixelÀ résolution constante pour le système d'imagerie. Il existe des normes de taille beaucoup qui peuvent être utilisés, tels que cartes de visite blanche avec des tailles de lettre bien connue, la fluorescence ou réfléchissantes des cibles armée de l'air et des microsphères fluorescentes.
5. Préparer le système pour le confocal à balayage microendoscopy
Dans cette construction, nous utilisons une image cohérente de fibres, qui se compose d'un faisceau de plusieurs milliers de noyaux de fibres; un tel arrangement permet à une image d'être transmise par la fibre et facile à reconstituer et / ou agrandis à l'autre extrémité (Fig. 4). Le faisceau de fibres cohérentes utilisés dans la construction de cet endoscope est poli aux deux extrémités, ce qui en fait un soi-disant «contacts en mode" microendoscope. Une image de mise au point ne sera donc formé lorsque la pointe microendoscope est amené en contact étroit avec un objet. Dans cet arrangement pseudo-confocale, une action de balayage du microscope se concentre le laser sur une fIber coeur à un moment, tandis que le sténopé confocale assure qu'aucune lumière out-of-focus de fibres environnante est autorisé à passer par le détecteur. Pour les applications d'imagerie différentes, un ensemble de lentilles peuvent être ajoutées sur l'extrémité distale pour permettre orienté vers l'avant, l'imagerie de fluorescence longue distance. Lentilles micro-optiques, ainsi que l'indice de réfraction de gradient (GRIN) lentilles peuvent facilement être adapté pour cet usage, et peut être apposé à l'extrémité distale des fibres en utilisant des colles de qualité optique.
- Pour configurer le système d'imagerie pour microendoscopy, enlevez soigneusement la scène de l'échantillon et de le remplacer par une étape de la tenue de fibres (fig. 5). Trempez une extrémité du faisceau de fibres dans une solution faible de colorant de telle sorte que l'émission de fluorescence est généré uniformément sur l'ensemble des noyaux de fibres. Allumez le système de numérisation et de régler le support en fibre de mettre l'autre extrémité du faisceau de fibres (de l'extrémité proximale, ou à la fin la plus proche de l'optique du microscope) mise au point. Tout d'abord, utiliser la traduction de réglage screws au centre de la fibre dans le champ balayé. Maintenant, regardez l'image d'émission de fluorescence de la pointe de la fibre proximale pendant la numérisation. Lorsque la surface microendoscope complet est dans le plan focal de l'objectif, l'émission de fluorescence dans tous les noyaux de fibres sera aussi uniforme que possible. Utilisez les boutons de réglage de l'angle d'ajuster le visage de fibre de rendre tous les noyaux de fibres uniformément lumineux. Lors de cet ajustement, il sera probablement nécessaire de réajuster la position de la traduction de recentrer la fibre dans le champ balayé. Itérer à travers ces ajustements jusqu'à la pointe de la fibre entière est correctement mis au point.
- Avant d'utiliser le microendoscope, nettoyez délicatement l'embout distal en utilisant du papier de nettoyage légèrement humidifiée avec du méthanol pour HPLC. Comme précédemment, utiliser une taille standard connues de mesurer et de calculer la résolution du système d'imagerie microendoscope.
6. Les résultats représentatifs:
La figure 6 montre un exemple d'un fini de l'EPUight microscope confocal à balayage configuré pour microendoscopy. Les faisceaux laser et d'émission ont été établis comme un guide pour l'œil. Un montage de fibre maintient la fibre image en place pendant le fonctionnement microendoscopy. Ce support de fibre peut être facilement remplacée par une platine de translation XY ou XYZ pour l'utiliser comme une plate-forme de microscope droit. Thorlabs pièces PT3 (traduction XYZ) ou deux étages empilés PT1 (XY traduction) fonctionnent bien pour cette application, avec un crochet à angle droit, comme une partie Thorlabs AP90.
Une carte vidéo framegrabber taux est utilisé pour générer des images à partir du signal entrant. La figure 7 montre une image de test représentatif prélevé d'un minuscule "m" est imprimé sur une carte de visite blanche en utilisant le système de microscope à balayage vidéo-taux. Blanchi papier blanc contient des fluorophores qui sont excités par la lumière UV et bleu, ce qui entraîne le fond lumineux derrière la lettre noire "m". Un filtre d'émission centrée à 515 nm a été choisie pour recueillir cette émission fluorescente. A mInor distorsion de l'image peut être observée, surtout près des bords latéraux de la trame d'image. Il en résulte une distorsion de la recherche de motif sinusoïdal du miroir 8kHz gavlo, et sera discuté en détail ci-dessous.
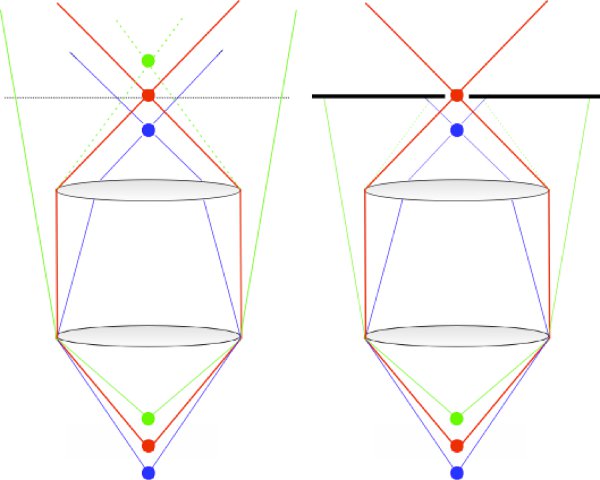
Figure 1. Diagramme montrant le principe de fonctionnement d'un microscope confocal. Rayons en provenance du point de vue objectif sont relayées par le système et ciblée à travers le sténopé confocal (rouge). Rayons d'origine soit au-dessus (en bleu) ou en dessous (en vert) du point de vue objectif ne sort pas de l'objectif collimaté, et donc ne sont pas efficacement transmis à travers le sténopé confocal.
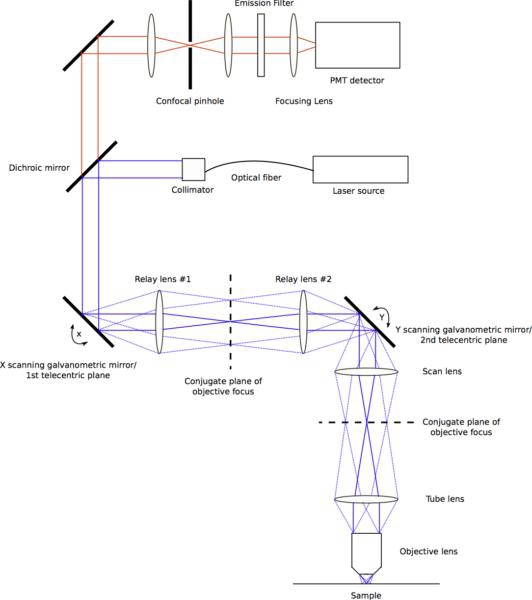
Figure 2. Diagramme montrant tous les chemins de lumière à travers le système de balayage du faisceau. Les miroirs de balayage s'asseoir à télécentrique avions avec la STAnaire, plan objectif l'ouverture arrière. Paires de lentilles entre les plans stationnaires agir pour relayer les poutres numérisés. Les deux premières lentilles relais ont les mêmes longueurs focales, formant un télescope 01h01. La deuxième paire de lentilles, connu officiellement comme la lentille de numérisation et de lentille de tube, n'ont pas besoin d'être égaux en longueur focale, et servent souvent comme un télescope faisceau expansion afin d'assurer l'objectif de retour à ouverture est trop plein. La lumière émise par l'échantillon se déplace en arrière à travers le système de balayage et est passé à travers le miroir dichroïque. Une lentille de focalisation courtes focalise la lumière d'émission à travers le sténopé confocal, qui est ensuite collimaté par une lentille. Une lentille finale de l'émission se concentre confocale filtré sur un tube photomultiplicateur. Cliquez ici pour voir une version pleine grandeur de cette image.
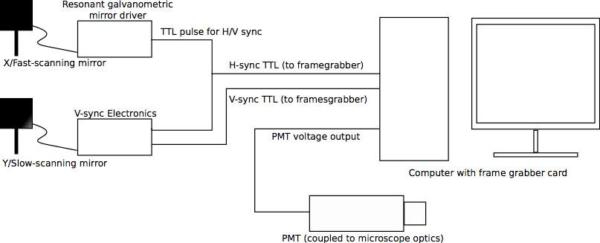
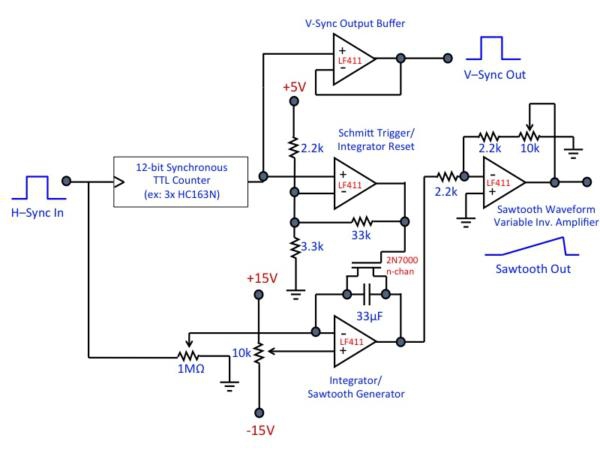
Figure 3. Schéma Aperçu (a) de la configuration de l'électronique à balayage. Le signal du microscope de référence globale et de base de temps est la "synchronisation" sortie TTL de l'axe de résonance miroir rapide galvo, qui génère une impulsion TTL à la fin de chaque ligne scannée (par exemple, lorsque le galvo a terminé un cycle de balayage). Cela donne le signal de H-sync à la carte framegrabber. La sortie de la synchronisation galvo est également connecté à la carte V-sync de contrôle, ce qui augmente progressivement sa tension de sortie en réponse à chaque impulsion H-sync pour générer la forme d'onde en dents de scie qui anime l'axe de balayage lent. Fois toutes lignes ont été scannés, le réinitialise V-sync bord du onde scie et génère une impulsion TTL qui sert V-sync l'framegrabber a signal. L'entrée final au cartes framegrabber est le signal analogique partir le tube photomultiplicateur (Notez que PMTs nombreuses génèrent Tension sortie négative; être sûr pour concevoir votre circuit uned choisissez votre matériel en conséquence). Les images vidéo-taux sont générés et affichés dans le logiciel Matrox framegrabber. (B) du circuit de commande Exemple. Dans cette conception, la tension de chaque impulsion H-Sync est «ajouté» / intégrés à l'intégrateur ampères op de générer de la rampe en dents de scie de forme d'onde; impulsions sont concomitamment en compte au stade du compteur TTL. Lorsque le nombre de lignes souhaité a été atteint (à savoir, quand le balayage de trame est complète), le compteur génère un actif bas "exécuter" le pouls, qui entraîne le trigger de Schmitt pour générer une impulsion de réinitialisation pour l'intégrateur. Ceci réinitialise le compteur à la fois et l'intégrateur ampère op, prépare le circuit pour le prochain cycle. Choix des composants appropriés rend ce circuit largement applicable à une variété de tailles de trame. Ce n'est qu'une mise en œuvre; de nombreuses autres implémentations sont possibles et peuvent être préférés dans certaines circonstances. En outre, ce circuit est conçu pour être utilisé avec la carte Matrox framegrabbers, ce qui déceler et de corriger la phase d'image automatiquement. Si le circuit doit être utilisé avec d'autres framegrabbers, des circuits de correction de phase ou de logiciels peuvent être exigées. Cliquez ici pour voir une version pleine grandeur de cette image.

Transmission de l'image Figure 4. Par un faisceau de fibres cohérentes. Dans ce schéma, les verres de chaque côté du faisceau sont en place à l'échelle tant de l'image projetée sur l'entrée faisceau de fibres ainsi que d'élargir l'image sur la sortie de faisceau de fibres.

Figure 5. Exemple d'un faisceau de fibres monté dans une monture en 5 axes. Un petit 1 "bloc d'aluminium de diamètre s'ennuyait de telle sorte que le faisceau de fibres d'image pourrait être insérée. La fibre a été époxy à l'intérieur du bloc d'aluminium au both le haut et le bas du bloc pour la stabilité.

Figure 6. Image du système de microscopie achevée avec la microendoscope ci-joint. Pour mieux visualiser les chemins de lumière, la trajectoire du faisceau d'excitation est dessiné en bleu, tandis que la trajectoire du faisceau d'émission après le miroir dichroïque est dessiné comme une ligne rouge.
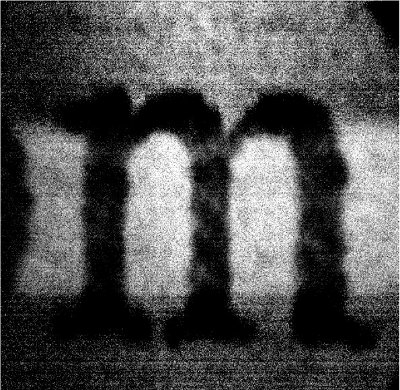
Figure 7. Exemple d'image générée par la vidéo-système de taux de microscopie confocale à balayage. Une sombre minuscules lettre «m» apparaît sur le fond lumineux de fluorescence d'une carte d'affaires blanc.
Discussion
Ce système d'imagerie vidéo-taux fait usage d'une exploitation miroir galvanométrique de résonance à environ 8 kHz. Miroirs résonance peut être assez fort quand il est lancé à pleine puissance, et leur hauteur élevée peut être gênant ou même dangereux à certains moments une exposition suffisante. Bien que n'étant pas démontré ici, il est recommandé de protéger le miroir galvanométrique de résonance dans un boîtier transparent pour réduire considérablement le volume du système et / ou de porter des vêtements de protection appropriés auditive, comme des bouchons.
Le miroir galvanométrique résonance scans dans un modèle sinusoïdal. Toutefois, les cartes framegrabber lire dans le signal en supposant une vitesse de balayage complètement linéaire dans les deux directions horizontale et verticale. Depuis un balayage sinusoïdal ralentit sur les bords de la numérisation, les artefacts de compression d'image peuvent être observés le long de l'axe d'image (horizontale) rapide. Une façon de minimiser ce problème est de volontairement disque de la gamme de résonance galvo numérisation miroir significativement plus grande que ladiamètre de la lentille de relais. En faisant cela, que le balayage presque linéaire centrale du motif de balayage sinusoïdal va traverser l'échantillon, ce qui minimise les distorsions de l'image. Une autre approche serait de post-traitement des images recueillies pour linéariser l'axe rapide. Ceci peut être accompli par imagerie par fluorescence un modèle connu (comme une grille) et en utilisant les dimensions de la forme connue de créer un script de traitement qui unwarps les images recueillies.
Ce système de balayage particulier a été conçu dans le but de l'imagerie in vivo, ce qui nécessite souvent une verticale orientée vidéo-taux microscope. Pour des expériences d'imagerie cellulaire, microscopes inversés sont plus généralement utilisés. La conception présentées ici peuvent être facilement modifiées pour construire un tel microscope inversé, tout ce qui est requis est une rotation de la finale 2 miroirs "de diamètre. Au lieu d'orienter le miroir pour diriger le faisceau de balayage à la baisse, le miroir peut diriger le faisceau vers le haut. Placer la lentille de l'objectif d'unt à la même distance du miroir avec une étape de l'échantillon permettrait d'imagerie dans une géométrie inversée. Si le système d'imagerie est construit exclusivement pour l'imagerie microendoscopic, il n'ya pas de raison de «plier» la conception de microscope verticalement à tous. Au lieu de cela, le système de balayage complet peut être construit sur une planche à pain horizontale simple avec le parallèle objectif orienté vers la table d'optique.
Notez que le microscope dans cette version utilise une configuration sténopé fixes, tandis que la présente offre pour la plus grande simplicité et facilité la construction de l'alignement, les utilisateurs désirant un système plus polyvalent pourrait envisager d'intégrer un sténopé variable, comme on peut le trouver dans la plupart des microscopes confocaux commerciales. En permettant à l'utilisateur d'ajuster la taille du sténopé pour compenser pour les échantillons d'intensité variable d'émission, ce qui permet à l'utilisateur de mieux optimiser le compromis entre la puissance du signal et de résolution pour un échantillon donné.
Le CHoix de la fibre de l'image sélectionnée pour le microscope est important. Nous vous recommandons d'utiliser des fibres Sumitomo image cohérente en raison de leur espacement coeur de la fibre à proximité et à faible autofluorescence relative. Fibres d'images fabriquées par Fujikura ont été trouvés à avoir des quantités élevées de l'autofluorescence 10, qui peut submerger faibles signaux de fluorescence d'un échantillon et de limiter la sensibilité ultime de l'microendoscope. Sumitomo fibres fabriquées, comme le 8-30N utilisé dans cette configuration particulière, ont beaucoup plus bas niveaux de l'autofluorescence que leurs équivalents Fujikura. Alors que les faisceaux de fibres lessivé pourrait être considéré comme attractif pour microendoscopy, leur conception des lieux généralement noyaux de fibres individuelles trop éloignés, ce qui signifie que les noyaux des fibres des exemples d'objets à faible densité, en laissant de côté les régions importantes d'intérêt potentiel.
Enfin, il convient de noter que bien que le microscope décrites ici seront utiles dans une variété de techniques in vitro et in vivo applications et peuvent être créés pour une fraction du coût d'un système complet de commerce, il n'a pas de caractéristiques telles que la détection de lumière transmise, un oculaire pour la visualisation, ou un parcours du faisceau pour les non-confocale à champ large épifluorescence. Bien qu'il soit possible de construire un système avec ces caractéristiques à partir de zéro, les lecteurs désirant un tel système peut souhaiter modifier un système commercial existant pour répondre à leurs besoins plutôt que d'initier une toute nouvelle construction.
Déclarations de divulgation
La production de ce vidéo-cette vidéo a été parrainé par Thorlabs, Inc
Remerciements
Les auteurs tiennent à remercier pour leur soutien Thorlabs de ce projet. AJN tient à souligner le soutien d'une bourse de la NSF supérieures.
Ce travail a été partiellement financé par le National Institutes of Health à travers le directeur des NIH Programme Innovateur nouveau prix, le numéro de subvention de 1 DP2 OD007096-01. Renseignements sur le Programme Innovator Award est à New http://nihroadmap.nih.gov/newinnovator/ . Les auteurs tiennent à remercier Tom Hayes pour l'utilisation du laboratoire de Harvard Electronics.
matériels
| Name | Company | Catalog Number | Comments | |
| Nom de la pièce | Fabricant | Numéro de l'article | Spécifications | Quantité |
| 515 Filtre passe-bande nm | Chroma | HQ515/50M | 46 FWHM | 1 |
| Achromatique lentille doublet 25.4mm Dia. FL x 50mm, revêtement MgF2 | Edmund Optics | NT49-766 | 1 | |
| Achromatique lentille doublet 25.4mm Dia. x 76.2mm FL, revêtement MgF2 | Edmund Optics | NT49-768 | 1 | |
| Achromatique lentille doublet 25.4mm Dia. x 88.9mm FL, revêtement MgF2 | Edmund Optics | NT49-769 | 2 | |
| Achromatique Dia lentille doublet 50mm. FL x 300mm, revêtement MgF2 | Edmund Optics | NT45-179 | 1 | |
| 8 R kHz Fréquence scanner optique haute | Électro-optique Products Corporation (EOPC) | SC-30 | 8 kHz | 1 |
| Pilote AGC | Électro-optique Products Corporation (EOPC) | ACG: 8K | ||
| H7422-PA module photocapteur | Hamamatsu | H7422-PA | Limitation de courant recommandée | 1 |
| M9012 Alimentation | Hamamatsu | M9012 | Pour une utilisation avec H7422-PA | 1 |
| HC PL APO Objectif CS | Leica | 11506284 | 10x/0.40 | 1 |
| Carte Solios framegrabber eA / XA | Matrox | Solios eA / XA | MIL logiciels nécessaires; OEM interconnexions recommandée | 1 |
| Alimentation 12V | Meanwell | LPV-100-12 | +12 V, 8.5A | 1 |
| 5x objectif de microscope | Newport | M-5X | 0,10 NA, Longueur focale 25,4 mm | 1 |
| Fibre image cohérente | Sumitomo | 8-30N | 1 | |
| 1 / 4 "Vis -20 et kit matériel | Thorlabs | HW-KIT2 | 1 | |
| 100 um Gendarmerie sténopé | Thorlabs | P100S | Idéal pour la construction de filtres spatiaux | 1 |
| 30 mm Pince Cube Cage | Thorlabs | B6C | 1 | |
| 30 mm Cube Système Cage, 4-Way | Thorlabs | C4W | 1 | |
| 406 nm, 5 mW, B du code PIN, Fibre SM Diode Laser queue de cochon, FC / PC | Thorlabs | LPS-406-CF | Produit obsolète; remplacé par LP405-SF10 | 1 |
| 5-Minute Epoxy, une once | Thorlabs | G14250 | 1 | |
| 6 Axe cinématique optique mont | Thorlabs | K6X | 1 | |
| 8-32 Vis et Kit Hardware | Thorlabs | HW-KIT1 | 1 | |
| 8-32 Vis sans tête et Kit Hardware | Thorlabs | HW-KIT3 | 1 | |
| Adaptateur avec Threads RMS externes et internes Threads SM1 | Thorlabs | SM1A4 | 1 | |
| Adj. FC / PC et FC / APC collimateur, f = 2,0 mm, ARC: 400-600 nm | Thorlabs | CFC-2X-A | f = 2,0 mm | 1 |
| Adaptateur réglable Collimateur fibre, SM1 fileté | Thorlabs | AD9.5F | 1 | |
| Aluminium Breadboard, 12 "x 18" x 1 / 2 " | Thorlabs | MB1218 | 1 / 4 "-20 fileté | 2 |
| Benchtop Diode Laser / TEC Contrôleur | Thorlabs | ITC4001 | 1 A/96 W | 1 |
| DMLP 425 nm de long-Pass miroir dichroïque | Thorlabs | DMLP425 | 1 | |
| Cinématique de montage pour Ø1 "Optique | Thorlabs | KM100 | 3 | |
| LD / TEC de montage pour Diodes laser à fibre Thorlabs queue de cochon | Thorlabs | LM9LP | 1 | |
| Monture pour Ø18 mm Optique | Thorlabs | LMR18 | Un anneau de retenue inclus | 1 |
| Montures Lens 2 "Optique | Thorlabs | LMR2S | Avec filetage intérieur et extérieur; l'anneau de retenue inclus | 2 |
| Mini Série Cage Assemblée Rod, 6 "de long, ø4 mm, Quantité 1. | Thorlabs | SR6 | 4 | |
| Ø1.0 "Post pilier piédestal, 8-32 Taps, une« longue | Thorlabs | RS1P8E | 4 | |
| Ø1 "Post Extension pilier, Longueur = 0,5 | Thorlabs | RS05 | 4 | |
| Ø1 "Post Extension pilier, Longueur = 0,75" | Thorlabs | RS075 | 4 | |
| Ø1 "protégées Silver Mirror, 3,2 mm d'épaisseur | Thorlabs | ME1-P01 | 1 | |
| Ø1 "SM1 élément rotatif réglable focalisation, L = 1" | Thorlabs | SM1V10 | 1 | |
| Ø2 "protégées Silver Mirror, 3,2 mm d'épaisseur | Thorlabs | ME2-P01 | 2 | |
| P100S - Ø100 um Gendarmerie sténopé | Thorlabs | P100S | 1 | |
| Polaris faible dérive Ø1 "cinématique miroir mont | Thorlabs | POLARIS-K1 | Faible dérive | 1 |
| SM1 lentille de tube, L = 1 " | Thorlabs | SM1L-10 | Un anneau de retenue inclus | 4 |
| SM1 fileté 30 mm Plaque Cage, 0,35 "d'épaisseur | Thorlabs | CP02 | 2 | |
| SM1 à M25 Adaptateur composants optiques Threading | Thorlabs | SM1A24 | Externe et interne Threads SM1 M25.5x0.5 Threads | 1 |
| Diam petit faisceauETER galvanométrique système | Thorlabs | GVSM001 | 1 | |
| Petite Fourche de serrage | Thorlabs | CF125 | 1 / 25 "lamés slot, universel | 15 |
| Système spatial de filtre | Thorlabs | KT310 | Sténopé vendu séparément | 1 |
| TE-refroidis de montage pour 5,6 mm et 9 Lasers | Thorlabs | TCLDM9 | 1 | |
| Support vertical pour les cartes sans | Thorlabs | VB01 | Chaque | 2 |
| Plan-Apochromat | Zeiss | 1101-957 | 20x/0.75 NA | 1 |
Références
- Pawley, J. B. . Handbook of biological confocal microscopy. , 985-985 (2006).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nature Reviews Molecular Cell Biology. 2, 444-456 (2001).
- Klonis, N., Rug, M., Harper, I., Wickham, M., Cowman, A., Tilley, L. Fluorescence photobleaching analysis for the study of cellular dynamics. European Biophysics Journal. 31, 36-51 (2002).
- Stephens, D. J. Light Microscopy Techniques for Live Cell Imaging. Science. 300, 82-86 (2003).
- McMahon, A., Supatto, W., Fraser, S. E., Stathopoulos, A. Dynamic Analyses of Drosophila Gastrulation Provide Insights into Collective Cell Migration. Science. 322, 1546-1550 (2008).
- Wallingford, J. B. Dishevelled controls cell polarity during Xenopus gastrulation. Nature. 405, 81-85 (2000).
- Laemmel, E. Fibered Confocal Fluorescence Microscopy (Cell-viZio) Facilitates Extended Imaging in the Field of Microcirculation. Journal of Vascular Research. 41, 400-411 (2004).
- Moussata, D. The confocal laser endomicroscopy. Acta Endoscopica. 39, 448-451 (2010).
- Dunbar, K., Canto, M. Confocal endomicroscopy. Current Opinion in Gastroenterology. 24, 631-637 (2008).
- Udovich, J. A. Spectral background and transmission characteristics of fiber optic imaging bundles. Applied optics. 47, 4560-4568 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon