Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Murine Oberflächliche Lymphknoten Chirurgie
In diesem Artikel
Zusammenfassung
Um den Verlauf einer Immunantwort im Laufe der Zeit innerhalb der gleichen Maus folgen, können Lymphknoten sequentiell durch eine Operation entfernt werden. Hier beschreiben wir, wie diese Technik durchgeführt werden kann.
Zusammenfassung
Auf dem Gebiet der Immunologie, um das Fortschreiten einer Immunantwort gegen ein Impfstoff, einer Infektion oder eines Tumors zu verstehen, wird die Antwort oft über die Zeit verfolgt. In ähnlicher Weise erfordert die Untersuchung von Lymphozyten Homöostase Zeitverlauf Experimenten. Durchführung dieser Untersuchungen innerhalb der gleichen Maus ist ideal, um die experimentellen Variabilität sowie die Anzahl der Mäuse zu verringern. Blutentnahmesystem ermöglicht Leistung Zeitverlauf Versuche, aber es gibt nur Informationen über zirkulierenden Lymphozyten und eine begrenzte Anzahl von Zellen 1-4. Da Lymphozyten durch den Körper zirkuliert und die ihren Wohnsitz in den Lymphknoten unterschiedliche Eigenschaften haben, ist es wichtig, beide Standorte zu untersuchen. Die sequentielle Entfernung der Lymphknoten durch eine Operation bietet eine einzigartige Gelegenheit, um eine Immunantwort oder Immunzellen Expansion in der gleichen Maus über die Zeit zu folgen. Darüber hinaus liefert diese Technik zwischen 1-2x10 6 Zellen pro Lymphknoten, die ausreicht, EWrform phänotypischen Charakterisierung und / oder funktionellen Assays. Sequential Lymphknoten Operation oder Lymphadenektomie wurde erfolgreich von uns und anderen 5-11 verwendet. Hier beschreiben wir, wie die brachialen und inguinalen Lymphknoten indem Sie einen kleinen Schnitt in der Haut eines anästhesierten Maus entfernt werden kann. Seit der Operation ist oberflächlich und schnell erledigt, die Maus sehr schnell erholt, heilt gut und nicht die Erfahrung, übermäßige Schmerzen. Alle zwei Tage, ist es möglich, ein oder zwei Lymphknoten Berücksichtigung Zeitverlauf Versuche ernten. Diese Technik eignet sich somit, um die Eigenschaften von Lymphknoten-Lymphozyten Wohnsitz im Laufe der Zeit zu untersuchen. Dieser Ansatz ist geeignet, um verschiedene experimentelle Designs und wir glauben, dass viele Labors würden von der Durchführung sequentieller Lymphknoten-Operationen profitieren können.
Protokoll
1. Vorbereitung Vor der Operation
Die Mäuse wurden in Übereinstimmung mit den kanadischen Rat am Animal Care-Richtlinien behandelt.
- Anästhesieren Mäusen durch Injektion von Ketamin / Xylazin (150/300 mg / kg, ip) oder durch Inhalation von Isofluran (2%, 1L Sauerstoff). Sofern vorhanden, sollte Isofluran verwendet, da es für eine bessere Kontrolle der Narkose Zeit und Tiefe ermöglicht werden. Auch wird der Sauerstoff zur gleichen Zeit, die die physiologischen Funktionen des Tieres verabreicht unterstützt. Darüber hinaus ist Isofluran direkt von den Lungen eliminiert und erfordert daher keine Leber oder Niere Stoffwechsel.
- Inject Buprenorphin (0,05 - 0,1 mg / kg, sc) oder ein anderes Analgetikum.
- Anwenden Salbe auf die Mausaugen vor der Operation Augentrockenheit zu vermeiden (wenn Isofluran verwendet wird).
- Stellen Sie sicher, dass die Maus schläft durch Kneifen der Pfote und rollen mit dem Schwanz. Wenn die Maus nicht reagiert, mit der Operation fortzufahren.
2. Die Chirurgie
Es ist möglich, 4 von den oberflächlichen Lymphknoten (LN) durch eine Operation zu entfernen: die 2 Leisten-und die 2 brachialis. Die Isolierung der LN ist einfacher in jungen schlanken Mäuse (6-8 Wochen), da das Vorhandensein von Fettgewebe bei älteren Mäusen kann mit LN Isolierung stören. Allerdings wird diese Einschränkung mit wiederholter Übung zu überwinden. Für die Mäuse Komfort, ernten wir ein Maximum von 2 LNs zu einer Zeit, und wenn wir Zeit-Gang-Experimente durchzuführen, ernten wir LNs jeden zweiten Tag. Auch eine Infektion zu verhindern, könnten Antibiotika zur Maus gegeben werden, aber wir tun nicht und Wunden werden heilen just fine. Man muss beachten, dass in Abhängigkeit von der experimentellen Design, die Verwendung eines Antibiotikums beeinflussen könnten das Ergebnis beobachtet (z. B. wenn eine Antwort auf ein Bakterium gemessen wird). Beachten Sie, dass alle Instrumente nach jedem Gebrauch sterilisiert werden und aseptischen Bedingungen werden während der Verfahren beibehalten.- Legen Sie die Maus auf die Seite.
- Lokalisieren Sie die Region, wo Sie eine incisio durchführen wirdn in Abhängigkeit von der LN Sie ernten. (Abbildung 1).
- Bewerben Chlorhexidin oder ein anderes Desinfektionsmittel, für diese Region.
- Machen Sie einen kleinen Schnitt mit einer scharfen Schere (ca. 5 mm) entweder auf der Rückseite der Vorderbeine oder oberhalb der Hinterpfote in der Nähe des Bauches (Abbildung 1).
- Entfernen Sie die lose Haare du mit der Zange abgeschnitten haben. Wenn Sie möchten, können Sie die Maus vor dem Schnitt zu rasieren. Allerdings verlängert er das Verfahren und wir finden, dass es nicht notwendig, da, wie hier gezeigt, es zu keiner Verbesserung Heilung oder Abnahme Infektion, die beide sind sehr selten.
- Dehnen Sie den Schnitt mit 2 Zangen, um die LN zu sehen. Der Schnitt könnte erreichen 10 mm. Der LN erscheint grau oder dunkler als die umgebende Fett.
- Drücken Sie den Faszien (die dünne Membran, die den Fett-und Gewebe) auf der Oberseite der LN mit einer Zange und ziehen leicht, ohne das umliegende Gewebe.
- Platzieren der zweiten Zange so weit wie möglich underneath den LN. Mit den ersten Pinzette, brechen die Faszie und entfernen Sie den LN. Wenn Sie erfolgreich die LN haben geerntet, sollte ein Blutfleck an der Stelle, wo die LN zuvor befand erscheinen. Beachten Sie, dass die LN versinkt in isotonischer Lösung. Dieser einfache Test erlaubt es zu prüfen, dass Sie ein LN und nicht das Fettgewebe extrahiert.
- Stellen Sie sicher, dass keine Haare in der Wunde sind.
- Die Inzision durch Kleben die 2 Teile der Haut zusammen (die Innenseite der Haut) und durch das Eintreiben sie mit einem Clip. Wir verwenden einige Michel Clip mit den Anlegezange. Installieren eines oder 2 Clips in Abhängigkeit von der Größe des Einschnitts. Meistens fallen die Clips aus, wenn das Gewebe heilt.
3. Postoperative Pflege
- Fügen Sie etwas Nassfutter an den Boden des Käfigs, so dass die Mäuse leicht aufnehmen können nach der Operation.
- Über 6 bis 8 Stunden nach der Operation, überprüfen Sie die Maus, um sicherzustellen, dass sie keine Schmerzen. Beachten Sie sorgfältig ihr Verhalten (Haltung, Gang, inInteraktion mit der Aromabestandteile und Aussehen des Fells). Wenn das allgemeine Erscheinungsbild der Mäuse ist schlecht, verwalten eine zweite Dosis von Buprenorphin. Am nächsten Tag sollten die Mäuse ihr normales Verhalten sonst wieder weiter die Verabreichung von Buprenorphin. Die Mäuse sollten nie erreichen die Endpunkte zuvor ermittelten und akzeptiert von Ihrer Animal Care Council. Vielleicht möchten Sie beraten zu lassen und dabei die Hilfe eines Technikers Tierpflege Vivarium.
4. Lymph Node Handhabung
- Im Labor, um eine einzelne Zelle Suspension zu erhalten, distanzieren die LN nach Ihren üblichen Verfahren. Wir drücken LN gegen gefrostet Dias und routinemäßig erhalten 1-2 x 10 6 Zellen pro LN. Alternativ bereiten wir den LN zur RNA-Extraktion.
- Stain die Zellen wie pro Ihre übliche Protokoll. Sie sollten erhalten erwartet LN Durchflusszytometrie Profile.
5. Repräsentative Ergebnisse
Ein Beispiel für Vorwärts-und Seitwärts-Streulicht pCharge wird LNs von einem anästhesierten Maus durch eine Operation oder von einer Maus getötet (2) geerntet gezeigt. Das Profil und die Prozentsätze der Zellen in der Live-Lymphozyten sind die gleichen Gate zeigt, dass LN Operation eine geeignete Technik zum Ernten der Zellen ist.
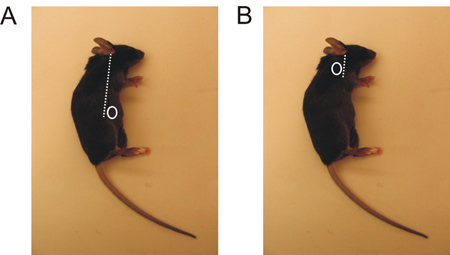
Abbildung 1. Leistenbruch und brachialis LN Lokalisation in der Maus. A. Die inguinalen LN wird knapp oberhalb der Hinterpfote gelegen, leicht in Richtung Bauch. B. Die brachialis LN befindet sich hinter dem Vorderbein entfernt.
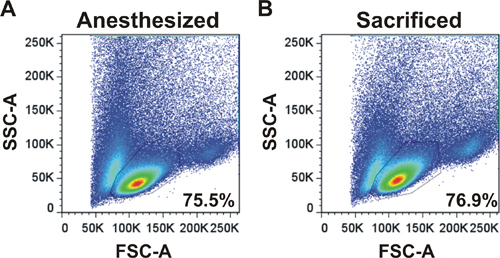
Abbildung 2. Durchflusszytometrie Profil von Lymphozyten nach LN Chirurgie erhalten. Vorwärts-und Seitwärts-Streulicht-Profile werden für LNS aus einer Anesth geerntet gezeigtetized Maus durch eine Operation (A) oder von einer Maus getötet (B). LNs wurden geerntet, dissoziiert und analysiert mit einem Durchflusszytometer. Prozentsätze der Zellen in der Live-Lymphozyten Gate dargestellt.
Diskussion
Wir haben ein Protokoll von LN Operation, die zu vielen experimentellen Systemen anwenden können, beschrieben. Obwohl sehr nützlich, um Immunantworten oder Immunzellen Homöostase zu folgen, hat diese Technik einige Einschränkungen. Erstens kann nur vier LNs geerntet werden. Zweitens muss die Immunantwort untersucht werden systemische oder treten in den oberflächlichen Leisten-oder Arm-(Haut-Entleerung) LNS. Schließlich wird die Anzahl der Zellen geerntet von der Qualität des LN Entfernung, eine technische Beschr?...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir bedanken uns bei Sylvie Lesage und alle Labor-Mitglieder für die kritische Durchsicht des Protokolls. Diese Arbeit wurde durch ein Stipendium (MOP-77545) von der kanadischen Institutes of Health Research (CIHR) unterstützt. Nathalie Labrecque wird durch ein Stipendium unterstützt FRSQ Senioren und Mélissa Mathieu erhielt eine NSERC Alexander Graham Bell Kanada Graduate Scholarship.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenz Namen | Firma | Katalog-Nummer | Kommentare |
| Graefe Feine Muster Premium-Zange | Harvard Apparatus | 52-2144 | Stark gebogen, 10 cm (4 Zoll), 0,8 mm Spitze |
| Michel Clip Anwenden und Entfernen von Pinzetten | Harvard Apparatus | 52-3779 | 12,5 cm (5 Zoll) |
| Michel Clip 100 | Harvard Apparatus | 52-3746 | 7,5 bis 1,75 mm |
| Temgesic (Buprenorphin-Hydrochlorid) | Schering-Plough | ||
| Vetalar (Ketamin Hydrochlorid) | Boniche Animal Healthcare | DIN: 01989529 | |
| Rompun (Xylazin) | Bayer | DIN: 02169592 | |
| Isofluran | ABBOTT | DIN: 02032384 | |
| Hypotears Augensalbe | Novartis Ophtalmics | DIN: 02133288 | |
| Baxedin (Chlorhexidin Gluconat 2% in Isopropylalkohol 70%) | Omega | L0000017 | DIN: 02251477 |
Referenzen
- Zehn, D., Lee, S. Y., Bevan, M. J. Complete but curtailed T-cell response to very low-affinity antigen. Nature. 458, 211-214 (2009).
- Vezys, V. Memory CD8 T-cell compartment grows in size with immunological experience. Nature. 457, 196-199 (2009).
- Zhou, X. Differentiation and persistence of memory CD8(+) T cells depend on T cell factor 1. Immunity. 33, 229-240 (2010).
- Wirth, T. C., Badovinac, V. P., Zhao, L., Dailey, M. O., Harty, J. T. Differentiation of central memory CD8 T cells is independent of CD62L-mediated trafficking to lymph nodes. J. Immunol. 182, 6195-6206 (2009).
- Rooke, R., Waltzinger, C., Benoist, C., Mathis, D. Targeted complementation of MHC class II deficiency by intrathymic delivery of recombinant adenoviruses. Immunity. 7, 123-134 (1997).
- Witherden, D. Tetracycline-controllable selection of CD4(+) T cells: half-life and survival signals in the absence of major histocompatibility complex class II molecules. J. Exp. Med. 191, 355-364 (2000).
- Labrecque, N. How much TCR does a T cell need. Immunity. 15, 71-82 (2001).
- Leignadier, J., Labrecque, N. Epitope density influences CD8+ memory T cell differentiation. PLoS One. 5, e13740 (2010).
- Leignadier, J., Hardy, M. P., Cloutier, M., Rooney, J., Labrecque, N. Memory T-lymphocyte survival does not require T-cell receptor expression. Proc. Natl. Acad. Sci. U.S.A. 105, 20440-20445 (2008).
- Obst, R., van Santen, H. M., Mathis, D., Benoist, C. Antigen persistence is required throughout the expansion phase of a CD4(+) T cell response. J. Exp. Med. 201, 1555-1565 (2005).
- Bassett, J. D. CD8+ T-cell expansion and maintenance after recombinant adenovirus immunization rely upon cooperation between hematopoietic and nonhematopoietic antigen-presenting cells. Blood. 117, 1146-1155 (2011).
- Lacombe, M. H., Hardy, M. P., Rooney, J., Labrecque, N. IL-7 receptor expression levels do not identify CD8+ memory T lymphocyte precursors following peptide immunization. J. Immunol. 175, 4400-4407 (2005).
- Leignadier, J., Rooney, J., Daudelin, J. F., Labrecque, N. Lowering TCR expression on naive CD8+ T cells does not affect memory T-cell differentiation. Immunol. Cell. Biol. 89, 322-325 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten