Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Murine chirurgie superficielle des ganglions lymphatiques
Dans cet article
Résumé
Pour suivre la progression d'une réponse immunitaire au fil du temps au sein de la même souris, des ganglions lymphatiques peut être enlevé par chirurgie séquentielle. Ici, nous décrivons comment cette technique peut être réalisée.
Résumé
Dans le domaine de l'immunologie, de comprendre la progression d'une réponse immunitaire contre un vaccin, une infection ou une tumeur, la réponse est souvent suivie au fil du temps. De même, l'étude de l'homéostasie lymphocytaire nécessite des expériences de cours à temps. La réalisation de ces études dans la même souris est idéale pour réduire la variabilité expérimentale ainsi que le nombre de souris utilisées. De prélèvement de sang permet des performances des expériences de cours à temps, mais il ne donne que des informations sur les lymphocytes circulants et fournit un nombre limité de cellules 1-4. Depuis lymphocytes circulants dans le corps et résidant dans les ganglions lymphatiques ont des propriétés différentes, il est important d'examiner ces deux endroits. La suppression séquentielle des ganglions lymphatiques par la chirurgie offre une occasion unique de suivre une réponse immunitaire ou l'expansion des cellules immunitaires chez la souris même au fil du temps. En outre, cette technique donne entre 1-2x10 6 cellules par des ganglions lymphatiques qui est suffisant pour perform caractérisation phénotypique et / ou des tests fonctionnels. Séquentiel chirurgie ganglionnaire ou lymphadénectomie a été utilisé avec succès par nous et les autres 5-11. Ici, nous décrivons comment les ganglions lymphatiques brachial et inguinales peuvent être retirés en faisant une petite incision dans la peau d'une souris anesthésiée. Depuis la chirurgie est superficielle et fait rapidement, la souris récupère très rapidement, guérit bien et ne pas éprouver de la douleur excessive. Tous les deux jours, il est possible de récolter un ou deux ganglions lymphatiques permettant des expériences de cours à temps. Cette technique est donc appropriée pour étudier les caractéristiques des ganglions lymphatiques des lymphocytes résidant au fil du temps. Cette approche est adaptée aux différents modèles expérimentaux et nous pensons que de nombreux laboratoires gagneraient à effectuer séquentielles chirurgies des ganglions lymphatiques.
Protocole
1. Préparation avant la chirurgie
Les souris ont été traitées conformément au Conseil canadien sur les lignes directrices en soins des animaux.
- Anesthésie souris par injection de kétamine / xylazine (150/300 mg / kg, ip) ou par inhalation d'isoflurane (2%, l'oxygène 1L). Si elle est disponible, l'isoflurane doit être utilisé car il permet un meilleur contrôle de la durée de l'anesthésie et la profondeur. En outre, l'oxygène est administré en même temps qui prend en charge les fonctions physiologiques de l'animal. En outre, l'isoflurane est directement éliminé par les poumons et ne nécessite donc pas d'insuffisance hépatique ou rénale du métabolisme.
- Injecter la buprénorphine (0,05 - 0,1 mg / kg, sc) ou un autre analgésique.
- Appliquer une pommade sur les yeux de souris avant la chirurgie pour éviter la sécheresse oculaire (si l'isoflurane est utilisé).
- Vérifiez que la souris est endormi en pinçant sa patte et rouler sa queue. Si la souris ne réagit pas, procéder à la chirurgie.
2. La chirurgie
Il est possible de retirer 4 des ganglions lymphatiques superficiels (LN) par la chirurgie: le inguinaux 2 et le brachial 2. L'isolement de la LN est plus facile chez les jeunes souris maigres (6-8 semaines) depuis la présence de tissu adipeux dans les souris plus âgées peuvent interférer avec l'isolement LN. Toutefois, cette limitation est dépassée à la pratique répétée. Pour le confort des souris, nous récoltons un maximum de 2 ganglions à un moment et quand nous effectuons le temps de cours des expériences, nous récoltons tous les deux jours ganglions. En outre, pour prévenir l'infection, les antibiotiques pourraient être donnés à la souris, mais nous ne faisons pas et les plaies se cicatrisent très bien. Il faut être conscient du fait que selon la conception expérimentale, l'utilisation d'un antibiotique pourrait influencer le résultat observé (par exemple si une réponse à une bactérie est mesurée). Notez que tous les instruments sont stérilisés après chaque utilisation et des conditions d'asepsie sont maintenus tout au long des procédures.- Placez la souris sur le côté.
- Localiser la région où vous effectuez une incision, en fonction de la LN vous voulez récolter. (Figure 1).
- Appliquer la chlorhexidine, ou un autre désinfectant, dans cette région.
- Faire une petite incision avec des ciseaux pointus (environ 5 mm), soit sur le dos de la patte avant ou au-dessus de la patte arrière près de l'abdomen (figure 1).
- Retirer les poils que vous avez coupés avec des pinces. Si vous préférez, vous pouvez raser la souris avant de faire l'incision. Cependant, il allonge la procédure et nous constatons qu'il n'est pas nécessaire puisque, comme indiqué ici, il n'améliore pas l'infection de guérison ou de la diminution, qui sont à la fois très rare.
- Étirez l'incision avec une pince à 2 afin de voir le LN. L'incision peut atteindre 10 mm. La LN apparaît grisâtre ou plus foncée que la graisse environnante.
- Pincer le fascia (la membrane mince couvrant la graisse et de tissus) sur le dessus de la LN avec un pince et tirer légèrement sans rompre le tissu environnant.
- Placez la pince deuxième, autant que possible de l'UEDNrneath la LN. Avec la pince premiers, briser le fascia et retirez la LN. Si vous avez réussi à récolter la LN, une tache de sang devrait apparaître à l'endroit où l'LN se trouvait précédemment. Notez que les puits de LN en solution isotonique. Ce test simple permet de valider que vous avez extrait une LN et les tissus non gras.
- Vérifiez qu'aucun poils sont dans la plaie.
- Fermer l'incision par collage des parties de la peau 2 ensemble (l'intérieur de la peau) et en les agrafage avec un clip. Nous utilisons un certain Michel clip avec les pinces applicables. Installer un ou deux pinces selon la taille de l'incision. Le plus souvent, les clips de tomber lorsque le tissu guérit.
3. Soins post-opératoires
- Ajoutez un peu de nourriture humide au fond de la cage de sorte que les souris peuvent se nourrir facilement après la chirurgie.
- Environ 6 à 8 heures après la chirurgie, vérifiez les souris afin de s'assurer qu'ils ne connaissent pas la douleur. Observez attentivement leur comportement (posture, la démarche, enteraction avec congénère et l'apparence de la fourrure). Si l'apparence générale des souris est pauvre, d'administrer une deuxième dose de buprénorphine. Dès le lendemain, les souris doivent retrouver leur comportement normal sinon poursuivre l'administration de la buprénorphine. Les souris ne doit jamais atteindre les critères d'évaluation préalablement définis et acceptés par votre Conseil de protection des animaux. Vous voudrez peut-être demander des conseils et l'aide de votre technicien vivarium des soins aux animaux.
4. Manipulation des ganglions lymphatiques
- Dans le laboratoire, pour obtenir une suspension cellulaire unique, dissocier la LN selon la procédure habituelle. Nous appuyer sur LN contre diapositives givrées et obtenir systématiquement 1-2 x 10 6 cellules par LN. Sinon, nous préparons la LN pour l'extraction de l'ARN.
- Colorer les cellules selon le protocole habituel. Vous devriez obtenir attendus profils LN cytométrie en flux.
5. Les résultats représentatifs
Un exemple de diffusion vers l'avant et p côtélot étant indiqué pour LNS récoltées à partir d'une souris anesthésiée par la chirurgie ou d'une souris sacrifiées (figure 2). Le profil et les pourcentages de cellules dans la grille en direct des lymphocytes sont les mêmes qui démontre que la chirurgie LN est une technique appropriée pour les cellules de la récolte.
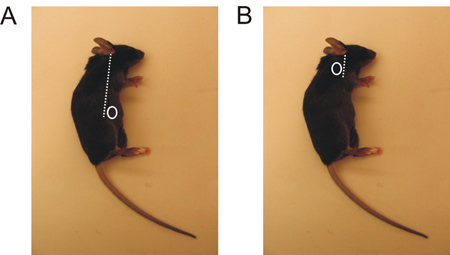
Figure 1. Inguinale et la localisation LN brachial chez la souris. A. La LN inguinale est situé juste au-dessus de la patte arrière, légèrement vers le ventre. B. Le LN brachiale est situé derrière la patte antérieure.
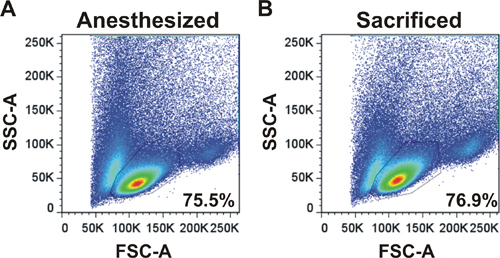
Figure 2. Profil cytométrie de flux des lymphocytes obtenus suite à une chirurgie LN. Profils de dispersion avant et latérale sont indiqués pour LNS récoltées à partir d'un Anesthla souris etized par la chirurgie (A) ou d'une souris sacrifiées (B). LN ont été récoltés, dissociés et analysés sur un cytomètre de flux. Les pourcentages de cellules dans la grille en direct des lymphocytes sont présentés.
Discussion
Nous avons décrit un protocole de chirurgie LN qui peut s'appliquer à de nombreux systèmes expérimentaux. Bien que très utile pour suivre les réponses immunitaires ou l'homéostasie des cellules immunitaires, cette technique a quelques limitations. Tout d'abord, seulement quatre ganglions peuvent être récoltés. Deuxièmement, la réponse immunitaire étudiée doit être systémique ou se produire dans les inguinaux superficiels ou brachiale (la peau de vidange) LNS. Enfin, le nombre de cellules réc...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous tenons à remercier Sylvie Lesage et tous les membres du laboratoire pour la lecture critique du protocole. Ce travail a été soutenu par une subvention (MOP-77545) à partir de l'Institut canadien de recherche en santé (IRSC). Nathalie Labrecque est soutenu par une bourse du FRSQ principal et Mélissa Mathieu a reçu une CRSNG Alexander Graham Bell Canada Bourses d'études supérieures.
matériels
| Name | Company | Catalog Number | Comments |
| Nom réactif | Entreprise | Le numéro de catalogue | Commentaires |
| Graefe Beaux Forceps haut de gamme de modèle | Harvard Apparatus | 52-2144 | Fortement courbé, 10 cm (4 po), 0,8 mm pointe |
| Clips Michel application et le retrait Forceps | Harvard Apparatus | 52-3779 | 12,5 cm (5 po) |
| Clips Michel 100 | Harvard Apparatus | 52-3746 | De 7,5 à 1,75 mm |
| Temgésic (chlorhydrate de buprénorphine) | Schering-Plough | ||
| Vetalar (chlorhydrate de kétamine) | Boniche animale Santé | DIN: 01989529 | |
| Rompun (xylazine) | Bayer | DIN: 02169592 | |
| L'isoflurane | ABBOTT | DIN: 02032384 | |
| Pommade oculaire Hypotears | Novartis ophtalmiques | DIN: 02133288 | |
| Baxedin (gluconate de Clorhexidine 2% dans l'alcool isopropylique à 70%) | Oméga | L0000017 | DIN: 02251477 |
Références
- Zehn, D., Lee, S. Y., Bevan, M. J. Complete but curtailed T-cell response to very low-affinity antigen. Nature. 458, 211-214 (2009).
- Vezys, V. Memory CD8 T-cell compartment grows in size with immunological experience. Nature. 457, 196-199 (2009).
- Zhou, X. Differentiation and persistence of memory CD8(+) T cells depend on T cell factor 1. Immunity. 33, 229-240 (2010).
- Wirth, T. C., Badovinac, V. P., Zhao, L., Dailey, M. O., Harty, J. T. Differentiation of central memory CD8 T cells is independent of CD62L-mediated trafficking to lymph nodes. J. Immunol. 182, 6195-6206 (2009).
- Rooke, R., Waltzinger, C., Benoist, C., Mathis, D. Targeted complementation of MHC class II deficiency by intrathymic delivery of recombinant adenoviruses. Immunity. 7, 123-134 (1997).
- Witherden, D. Tetracycline-controllable selection of CD4(+) T cells: half-life and survival signals in the absence of major histocompatibility complex class II molecules. J. Exp. Med. 191, 355-364 (2000).
- Labrecque, N. How much TCR does a T cell need. Immunity. 15, 71-82 (2001).
- Leignadier, J., Labrecque, N. Epitope density influences CD8+ memory T cell differentiation. PLoS One. 5, e13740 (2010).
- Leignadier, J., Hardy, M. P., Cloutier, M., Rooney, J., Labrecque, N. Memory T-lymphocyte survival does not require T-cell receptor expression. Proc. Natl. Acad. Sci. U.S.A. 105, 20440-20445 (2008).
- Obst, R., van Santen, H. M., Mathis, D., Benoist, C. Antigen persistence is required throughout the expansion phase of a CD4(+) T cell response. J. Exp. Med. 201, 1555-1565 (2005).
- Bassett, J. D. CD8+ T-cell expansion and maintenance after recombinant adenovirus immunization rely upon cooperation between hematopoietic and nonhematopoietic antigen-presenting cells. Blood. 117, 1146-1155 (2011).
- Lacombe, M. H., Hardy, M. P., Rooney, J., Labrecque, N. IL-7 receptor expression levels do not identify CD8+ memory T lymphocyte precursors following peptide immunization. J. Immunol. 175, 4400-4407 (2005).
- Leignadier, J., Rooney, J., Daudelin, J. F., Labrecque, N. Lowering TCR expression on naive CD8+ T cells does not affect memory T-cell differentiation. Immunol. Cell. Biol. 89, 322-325 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon