Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Planarien Immobilisierung, partielle Bestrahlung, und Gewebetransplantation
In diesem Artikel
Zusammenfassung
Eine effektive Methode für die Transplantation von Gewebe definierte und einheitliche Größe zwischen Planarien beschrieben wird. Ebenfalls enthalten ist eine Beschreibung, wie die Immobilisierung Technik zur Transplantation verwendet werden ausgebildet, in Verbindung mit Blei Schilde, für die partielle Bestrahlung von lebenden Tieren werden.
Zusammenfassung
Die Planarien, ein Süßwasser-Plattwurm, hat sich als ein leistungsstarkes System zum Präparieren Metazoen Regeneration und Stammzellbiologie 1,2 sein. Planarien Regeneration jedes fehlende oder beschädigte Gewebe wird möglich bezeichnet Neoblasten 3 von adulten Stammzellen. Obwohl diese Stammzellen endgültig gezeigt haben, dass pluripotente und einzigartig in der Lage eine komplette Wiederherstellung Tier 4, bleiben die Heterogenität innerhalb des Stammzell-Population und der Dynamik ihrer zellulären Verhaltensweisen weitgehend ungelöst. Aufgrund der großen Anzahl und Verbreitung von Stammzellen im gesamten Körper Planarie Plan, werden fortgeschrittene Methoden zur Manipulation von Subpopulationen von Stammzellen für die molekulare und funktionelle Studien in vivo benötigt.
Gewebetransplantation und partielle Bestrahlung gibt zwei Methoden, mit denen eine Subpopulation von Planarien Stammzellen für die weitere Untersuchung isoliert werden kann. Jede Technik hat deutliche Vorteile. TAusgabe der Transplantation ermöglicht die Einführung von Stammzellen in einem naiven Host, die entweder inhärent genetisch verschieden sind oder die zuvor behandelten pharmakologisch. Alternativ können partielle Bestrahlung zur Isolierung von Stammzellen aus dem Host, um Gewebe nebeneinander frei von Stammzellen, ohne die Einführung einer Wunde oder einer Verschlusses in Gewebeintegrität. Mit diesen beiden Methoden kann man untersuchen die Zelle autonomen und nicht autonomen Faktoren, die Kontrolle Stammzell-Funktionen, wie Proliferation, Differenzierung und Migration.
Sowohl Gewebetransplantation 5,6 und partielle Bestrahlung 7 wurden in der Vergangenheit bei der Definition viele der Fragen zu Planarie Regeneration, die unter-Studie noch heute verwendet. Allerdings sind diese Techniken blieb wegen der aufwendigen und unzuverlässigen Natur von den bisherigen Methoden nur unzureichend genutzt. Die hier vorgestellten Protokolle stellen einen großen Schritt vorwärts bei der Verringerung der Zeit einND Aufwand notwendig, um reproduzierbar erzeugen eine große Anzahl von aufgepfropft oder teilweise bestrahlten Tiere mit Wirkungsgraden von ca. 100 Prozent. Wir decken die Kultur der großen Tiere, Ruhigstellung, Vorbereitung für die partielle Bestrahlung, Gewebetransplantation, sowie die Optimierung von Tier Erholung. Darüber hinaus zeigt die hier beschriebene Arbeit die erste Anwendung der partiellen Bestrahlung Verfahren zur Verwendung mit den am häufigsten untersuchten Planarien, Schmidtea mediterranea. Außerdem öffnet effiziente Gewebetransplantation in Planarien die Tür für die Funktionsprüfung von Subpopulationen von naiven oder behandelten Stammzellen in der Wiederbesiedlung Assays, die schon seit langem der Goldstandard-Verfahren zur Untersuchung adulter Stammzellen Potenzial bei Säugetieren 8. Breite Akzeptanz dieser Techniken wird zweifellos zu einem besseren Verständnis der zellulären Verhalten von adulten Stammzellen in Gewebe Homöostase und Regeneration.
Protokoll
Hinweis: Dieses Protokoll legt die Verwendung potenziell gefährlicher Stoffe (Blei und Chloreton). Zu erwerben, lesen und befolgen Sie die Sicherheitsdatenblätter für alle potenziell gefährlichen Materialien.
1. Tierische Kultur, Auswahl, Vorbereitung und
- Für Tiere Kultur und Handling Einsatz Planarie Wasser (1X Montjuïc Salze 9) und Kunststoff Transferpipetten.
- Sexuelle Biotyp Schmidtea mediterranea kann verwendet werden, wenn im Labor unter normalen Kulturbedingungen 10 angehoben werden. Um ungeschlechtliche Exemplare der erforderlichen Größe zu erzeugen, S. mediterranea angehoben bei Raumtemperatur unter normalen Bedingungen bei 9 Doppel sollte auf dreifache normale Frequenz (2-3 mal pro Woche) werden für ein bis zwei Monate vor der Verwendung zugeführt. Alternativ kann asexuellen Tiere bei normaler Frequenz gespeist bei 10 Grad Celsius auf unbestimmte Zeit aufbewahrt werden, um ihre durchschnittliche Größe zu erhöhen.
- Wählen Tieren, die zwischen 1 bis 2 cm im sindLänge und breiter als 2 mm und dann verhungern Tieren 3-7 Tage vor der Verwendung.
- Wenn Sie bei sämtlichen pharmakologischen oder radiologischen Behandlungen auf Gastgeber bestimmt, Spender, oder teilweise bestrahlten Tiere, führen Behandlung (en) an dieser Stelle.
- Wenn pharmakologische Behandlungen wurden durchgeführt, dass die Fütterung der Tiere erforderlich ist, verhungern Tiere zusätzlich 3 bis 7 Tage vor dem Gebrauch.
2. Herstellung von Lösungen und Materialien
- Planen Chloreton Lösung, eine milde lokale Anästhetikum, durch Auflösen von 0,1-0,2% w / v Chloreton in Planarie Wasser und Kühlen der Lösung auf Eis.
- Wenn die Ausführung partieller Bestrahlung nur, fahren Sie mit Schritt 2,7. Für Gewebetransplantation weiter auf 2,3 fort.
- Mit einem Brenner, biegen 0,75 mm Innendurchmesser, zum Schneiden des Transplantatgewebe verwendet, und 0,7 mm Außendurchmesser, zum Erstellen eines Loches in dem Host, die das Transplantat, eine Kapillare nach einem 90 °-Winkel 1-2 cm erhalten verwendet vom Ende des STch Rohr. Um Material zu sparen, biegen die beiden Enden jedes Kapillarrohr und brechen sie in eineinhalb bis zwei Werkzeuge zu produzieren. Darauf achten, dass die Flamme sehr Enden der Röhren.
- Schneiden Sie die folgenden Papiere zu den angegebenen Größen:
- Schwarz Filterpapier (Schnitt in Rechtecke ca. 2,5 cm x 1,5 cm)
- Whatman # 3 Filterpapier (Schnitt in Rechtecke ca. 2 cm. X 0,5 cm)
- Kimwipe (gefaltet und geschnitten in wads ca. 3 cm x 0,5 cm x 4 Lagen)
- Zigaretten Zigarettenpapier (entfernen Gummistreifen und in Rechtecke schneiden ca. 3 cm x 2 cm)
- Bereiten geändert Holtfreter-Lösung (3,5 g / l NaCl, 0,2 g / l NaHCO 3, 0,05 g / l KCl, 0,2 g / l MgSO 4, 0,1 g / l CaCl 2, pH 7,0 bis 7,5) und Kasein-Lösung gesättigt Holtfreter und Chill sowohl auf 4 ° C
- Bringen Sie einen gefalteten Kimwipe zu einem Quadrat von Parafilm und findet am Peltier-Kühler Platte oder andere Kühlvorrichtung unter einem Binokular entfernt. Tränken Sie das Kimwipe mit gekühltem Holtfreter-Lösung und Platz zwei schwarze Rechtecke Filterpapier auf dem Kimwipe.
- Line-Petrischalen mit Whatman Nr. 2 Filterpapier. Befeuchten Sie das Filterpapier mit Holtfreter-Lösung und chillen das Geschirr auf dem Eis. Für partielle Bestrahlung eine größere Schüssel und Filterpapier Liner verwendet werden.
3. Betäubung und Ruhigstellung
- Füllen Sie eine Petrischale mit gekühltem Chloreton Lösung und Würmer Pipette in die Schüssel. Für die Transplantation nur betäuben einem Host und einem Spender zu einer Zeit. Für partielle Bestrahlung viele (n> 10) Tiere können narkotisiert auf einmal.
- Erlauben Sie Würmer in der Chloreton Lösung einweichen, bis sie bewegungslos geworden (5-10 min).
- Spülen Würmer durch Pipettieren sie in eine Schüssel mit kaltem Holtfreter-Lösung gefüllt.
- Immobilisieren Tiere durch Pipettieren sie auf schwarzen Filterpapier mit gekühltem Holtfreter-Lösung und orientieren sie Bauchseite nach unten mit einer Pinzette gesättigt. Wenn Tiere in der Lage, locOmote, aufsaugen überschüssige Holtfreter-Lösung, leicht sinken die Temperatur Ihres Peltier oder kalte Platte, oder erhöhen Sie die Länge der Chloreton Behandlung.
4. Partielle Bestrahlung
Hinweis: Befolgen Sie diese Schritte, um Tiere für die partielle Bestrahlung vorzubereiten. Wenn die Durchführung der Transplantation statt, § 5 fortfahren.
- Legen Sie eine gekühlte Petrischale aus Schritt 2,7 auf Eis in einem Eiskübel, die innerhalb einer Top-Quelle Röntgen-Strahler passen.
- Anordnen betäubten Tieren in einer Petrischale durch Bewegen des schwarzen Filter, auf dem sie immobilisiert sind. Mit einer Pinzette an narkotisierten Würmer direkt bewegen kann verletzen.
- Transport angeordnet Tieren zu einer oberen Source-X-ray-Strahler und den Eisbehälter anzuordnen, so dass der Abstand von der Kathodenstrahlröhre zu den Tieren minimiert wird und somit eine maximale effektive Dosis Rate.
- Bleiabschirmung Position (en) (1) zwischen den Tieren und der Kathode tube wie gewünscht. Shields sollte 4,5 bis 6 mm dick ist, um für 97 bis 99% Dämpfung eines 325kV Röntgenstrahl 11 zu erlauben sein.
- Deliver Röntgendosis. Wenn eine vollständige Ablation von Stammzellen nicht abgeschirmten Bereiche gewünscht wird, liefert 30 Gy oder mehr unter Verwendung einer Röntgen-Strahler. Als Referenz ist 30 Gy entsprechend 3,6 Minuten bei 320 Kilovolt und 10 Milliampere in einem Präzisions-X-Ray Inc. XRAD320 mit einer Feld-zu-Source-Abstand von 30 cm.
- Unmittelbar nach der Anwendung abgeschlossen ist, Umgang mit Würmern durch den schwarzen Filterpapier, Transfer Tiere in ein gekühltes Wasser Planarien. Lassen Sie den Planarien Wasser auf Raumtemperatur erwärmt und die Tiere, um sich vor dem schwarzen Filterpapier entfernen. Die partielle Bestrahlung Verfahren ist nun abgeschlossen.
5. Gewebetransplantation
- Mit einer Pipette und Pinzette, arrangieren narkotisierten Gastgeber und Spender Würmer auf separaten Rechtecke aus schwarzem Filterpapier auf dem Kimwipe, die auf der Pelti abgekühlt worden istER oder kühlere Platte unter dem Binokular.
- Mit Hilfe eines 0,75 mm Innendurchmesser Kapillarrohr schneiden Sie den Stecker aus der Transplantat-Donor und, mit einer Pinzette, legen Sie es auf einem aus dem Weg, Teil des Host. Wenn Transplantatmaterial im Kapillarrohr stecken bleibt, mit einer Pinzette entfernen.
- Mit einem 0,7 mm Außendurchmesser Kapillarrohr Entfernen eines Plug vom Host und mit einer Pinzette Position das Transplantat in das Loch, das zurückgelassen wird.
- Übertragen Sie die transplantierten Gastgeber auf seine schwarzen Filterpapier Rechteck in der Petrischale in Schritt 2,7 vorbereitet.
- Befeuchten Sie ein Stück Zigarettenpapier mit Kasein gesättigten Holtfreter-Lösung und setzen Sie ihn auf der transplantierten Host wie in 2A diagramed.
- Weichen Sie vier Stücke von Filterpapier in Casein gesättigt Holtfreter-Lösung und umhüllen den transplantierten Host wie in 2B diagramed.
- Einweichen vier Bündel von Schnitt Kimwipe in Kasein-Lösung gesättigt Holtfreter und legt sie überdas Filterpapier aus Schritt 5.6 (2B). Setzen Sie den Deckel und setzen Sie die Petrischale auf Eis.
- Übertragen Sie die Spender Wurm in Planarie Wasser zu erholen, zu heilen und zu regenerieren.
- Wenn alle Transplantationen vorgenommen haben, setzen Sie die transplantierten Würmer in ein 10 ° C Inkubator über Nacht.
- Am nächsten Morgen, dabei nicht zu stören, das Transplantat, den Wurm zu entdecken und zu übertragen (auf der schwarzen Filterpapier) in eine Petrischale mit Planarien Wasser gefüllt.
- Entweder kann der Wurm, sich von dem Filterpapier entfernen oder entfernen Sie diese vorsichtig mit einer Pinzette.
- Ändern Sie den Planarien Wasser alle 2-3 Tage.
6. Repräsentative Ergebnisse
Unmittelbar nach partieller Bestrahlung Planarien erscheint normal und unberührt. Je nach der abgegebenen Dosis und der Geometrie der Abschirmung verwendet wird, kann bestrahlten Gewebes zurückbilden und sogar zerfallen 7. Abgeschirmte Gewebe sollte intakt bleiben. Follaufgrund Gewebe Regression und ein Verlust von Gewebe Integrität wird ein Blastem bilden und fehlende Strukturen wird regeneriert (Abbildung 3A) werden. Wenn eine Amputation in der teilweise bestrahlten Bereich gemacht wird, wird das bestrahlte Gewebe befreit (dh aus der Regression oder Zerkleinern verhindert) werden (3B). Sowohl in der unverletzten und der Fall amputiert Regeneration verzögert, um eine Amputation nicht bestrahlte Planarien (3C) verglichen werden. Wenn ein X-ray Dosis von 30 Gy wurde geliefert, und der teilweise bestrahlten Tier unverletzt, erfolgreiche Stammzelltransplantation Ablation in einem Muster entsprechend mit der Abschirmung der verwendet wird, bestätigt 2 bis 3 Tage nach der teilweisen kann Bestrahlung durch in situ Hybridisierung für die Stammzellen Marker Smed-Piwi-1-12 (aka smedwi-1) (Abbildung 4).
Der Morgen nach der Transplantation, ein erfolgreicher Transplantat des transplantierten Gewebes sollte offensichtlich sein, wnnerhalb die Wirtsgewebe, wobei auf beiden den dorsalen und ventralen Oberflächen der Host (5A) angeklebt ist. Gelegentlich wird das Transplantat nur der ventralen oder dorsalen Oberfläche haften. Wenn die Transplantation war völlig erfolglos, wird keine Spur von dem Transplantat aus sichtbar sein entweder der dorsalen oder ventralen Oberfläche des Wirtes (Abbildung 5B). Kurz nach einem erfolgreichen Transplantat nicht bestrahlten Gewebe in einem Wirt, die von Stammzellen durch eine tödliche Bestrahlung 13,14 hatte abgetragen in situ Hybridisierung für Smed-piwi-1 zeigen, dass Stammzellen vorhanden sind in erster Linie in dem Transplantat (5C ). Darüber hinaus wird eine erfolgreiche Transplantate von nicht-bestrahlten Gewebe in letal bestrahlten Hosts in Rettung von Wirtsgewebe und langfristige Überleben der Host 15 führen.

Abbildung 1. Allgemeine Anordnung der Basiskomponentes für partielles Bestrahlen. In einer Röntgen-Strahler mit einer oben liegenden Röntgenquelle (Kathodenstrahlröhre) die anästhesiert Planarie ist direkt unter der Röntgenquelle im Bestrahlungsfeld positioniert. Um die Röntgendosis zu maximieren, sollte der Abstand zwischen der Planarie und der Röntgenquelle minimiert werden. Eine Abschirmung der sollte zwischen der Kathodenstrahlröhre und dem anästhesierten Wurm, möglichst nahe an der Schnecke als praktische positioniert werden. Die Bleiabschirmung sollte so ausgelegt, hergestellt, und so positioniert, dass sie das gewünschte Gewebe schirmt aber völlig aussetzt der Rest des Wurms. Viele kommerzielle produziert werden benutzerdefinierte Blei schirmt Ihr schlichtes Design aus Diagramm zu erzeugen, haben wir erfolgreich Alpha Systems Corp (Bluffdale, UT) verwendet. Die Zuleitung sollte ausreichend dick sein, um die gewünschte Menge der Abschirmung ermöglicht. Zum Beispiel, wenn nahezu vollständige Abschirmung eines 320 kV Röntgenstrahlung gewünscht wird, sollte der Vorsprung von 4,5 bis 6 mm dick sein. Die Planarien und Schirm auf positionierteines Holtfreter getränkte Filterpapier ausgekleidet Petrischale, die in einem Eiskübel ruht. Bei einem ausreichend großen Röntgenbestrahlung sowie eine Reihe von identischen Blei Schilde können viele Proben teilweise zu einer Zeit (nicht abgebildet) bestrahlt werden.
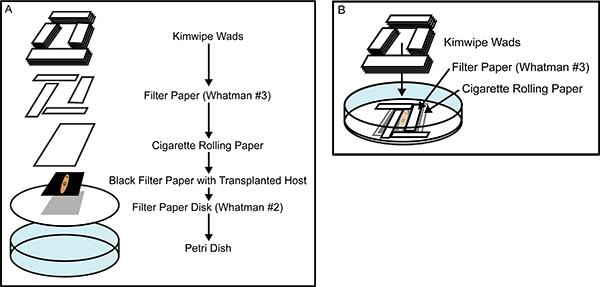
Abbildung 2. Building the Recovery Kammer. (A) Eine Explosionsdarstellung der Gewebetransplantation Erholung Kammer und zeigt alle Komponenten, die auf-einander, nachdem sie in Casein gesättigt Holtfreter Lösung getränkt geschichtet sind. (B) A fast abgeschlossen Erholung Kammer, welche die Verzahnung Platzierung des Whatman # 3 Filterpapier Rechtecke, die fest umklammern Sie die narkotisierten Planarien, um eine Bewegung während der Heilung. Die sorgfältige Konstruktion der Erholung Kammer verhindert, dass Bewegung für Tiere und Austrocknung, rasche Heilung zu fördern und eine größere Wirksamkeit der Gewebetransplantation.

Abbildung 3. Repräsentative Ergebnisse der einfachen hinteren Teil Bestrahlung. Als Dubois 7, (A), wenn die hintere Hälfte der Planarien mit Blei geschützt waren und dann Röntgenbestrahlung ausgesetzt die vordere Gewebe beobachtet wieder zurückbilden an der Grenze zwischen dem bestrahlten und abgeschirmte Gewebe, an welcher Stelle unpigmentierten Blasteme gebildet und die Tiere begannen sich zu regenerieren. (B) Auf der anderen Seite, wenn die Tiere nach dem gleichen partielle Bestrahlung in (A), Gewebe-Regression wurde nicht beobachtet und die verbleibenden bestrahlten vorderen Gewebe gerettet wurde durchgeführt wurden enthauptet. Die bestrahlten Tiere geköpft teilweise regeneriert Köpfe (B), wurde jedoch erheblich verzögert die Regeneration zu unbestrahlten Kontrollen enthaupteten (C) verglichen.

Abbildung 4. Vertreter outcomich von partiellen Stammzell-Ablation nach partieller Bestrahlung. Whole-mount in situ Hybridisierung (WISH) für die Stammzell-Marker Smed-Piwi-1 zeigt, dass Wildtyp Planarien haben Stammzellen in ihrem Körper mit Ausnahme des Gewebes ventral des verteilten Photorezeptoren (Pfeilspitze) und des Rachens richtige (Sternchen) 14. (A) für Smed-Piwi-1 WISH in bestrahlten, aber vollständig abgeschirmt Kontrolle Planarien fixiert 3 Tage nach der Bestrahlung zeigt eine Stammzell-Distribution, die nicht von der der Wildtyp Planarien ist. (B) Auf der anderen Seite, wünschen Smed-piwi-1 in Tieren, die nur teilweise abgeschirmt wurden, so dass die vorderen und hinteren ausgesetzt, sondern sich auch fixiert drei Tage nach der Bestrahlung zeigt, dass Stammzellen von den nicht abgeschirmten Bereiche abgetragen . Scale-Bars sind 500 Mikrometer.

Abbildung 5. Examples von erfolgreichen und nicht erfolgreichen Gewebetransplantation. (A) Live-Bilder von dorsalen und ventralen Ansichten eines erfolgreich transplantiert Planarie drei Tage nach der Transplantation. Das Transplantat (angezeigt) ist deutlich sichtbar auf beiden dorsalen und ventralen Oberflächen und ist mit charakteristischen unpigmentierten Gewebe an der Graft-Host-Schnittstelle umgeben. (B) entsprechend anzuzeigen erfolglosen Transplantationen keine sichtbare Transplantat Gewebe an der Stelle der Transplantation (angedeutet) und stattdessen eine vernarbte, unpigmentierten, seitliche Wunde aus der gescheiterten Transplantation. Ein Transplantat, das nur den dorsalen oder ventralen Oberfläche haftet kann eine erfolgreiche Transplantation (A) von einer Seite und einem erfolglosen Transplantation (B) betrachtet, wenn von der anderen angesehen ähneln. (C) Beim Wildtyp (wt) in einem bestrahlten Gewebe-Host, der ansässigen Stammzellen und den transplantierten Stammzellen wurde abgetragen wird aufgepfropft werden später durch WISH für Smed-Piwi-1 zwei Tage nach der Transplantation zeigten,Der Erfolg der Transplantation ist eindeutig durch die Gegenwart von spezifischen Stammzellen nur in oder um das Transplantat Lage (Pfeilspitzen) angezeigt. Scale-Bars sind 500 Mikrometer.
Diskussion
Die Bedeutung der Immobilisierung
Immobilisierung ist bei weitem der wichtigste Schritt für den erfolgreichen Abschluss nach einem dieser Verfahren. Wenn Planarien unsachgemäß immobilisiert sind vor partielle Bestrahlung, können sie unter der Bleiabschirmung bewegen, Herstellung inkonsistent und verwirrende Ergebnisse. Außerdem, wenn Tiere nach der Transplantation nicht ausreichend immobilisiert werden, wird die Host-Wurm wahrscheinlich weg von dem Transplantat Gewebe, was zu einem Versage...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Chiyoko Kobayashi und Kiyokazu Agata für hilfreiche Tipps Planarie Transplantation sowie ehemaligen und derzeitigen Mitarbeitern des Labors Sánchez bedanken für wertvolle Diskussionen während der Entwicklung dieser Techniken. Diese Arbeit wurde vom NIH Training Grant (5T32 HD0791) zu OCG und NIH R37GM057260 zu ASS unterstützt. ASA ist ein Howard Hughes Medical Institute Investigator.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| General Purpose Transferpipette | Samco | 691 | |
| Kapillarröhrchen (ID 0,75 mm) | FHC | 30-30-0 | |
| Kapillarröhrchen (OD 0,7 mm) | FHC | 30-50-08 | |
| Parafilm M | VWR | 52858-076 | |
| Kimwipes 34155 | VWR | 500029-891 | |
| Schwarzes Filtrierpapier | Schleicher & Schuell | 10310809 | |
| Whatman Nr. 2 Filterpapier 1002-055 | Fisher Scientific | 09-810B | |
| Whatman # 3 Filterpapier 1003-185 | Fisher Scientific | 09-820E | |
| Zigaretten Zigarettenpapier | Zig-Zag, original | NA | |
| PetriGeschirr | VWR | 82050-544 | |
| DUMONT Pinzetten, INOX # 5 | FST | 11251-20 | |
| Chloreton | Sigma Aldrich | 112054 | |
| Kasein | Sigma Aldrich | C3400 | |
| Lead-Shields | Alpha Systems Corp, Bluffdale, UT | Custom Design | |
| XRAD-320 Biologische Irradiator | Präzisions-X-Ray, North Branford, CT | NA |
Referenzen
- Morgan, T. Experimental studies of the regeneration of Planaria maculata. Arch. Entw. Mech. Org. 7, 364-397 .
- Reddien, P. W., Sanchez Alvarado, A. Fundamentals of planarian regeneration. Annu Rev Cell Dev Biol. 20, 725-757 (2004).
- Randolph, H. The regeneration of the tail in lumbriculus. J. Morphol. 7, 317-344 .
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Santos, F. Studies on transplantation in planaria. Biological Bulletin. 57, 188-197 (1929).
- Morgan, L. Regeneration of grafted pieces of planarians. J. Exp. Zoöl. 3, 269-294 (1906).
- Dubois, F. Contribution á l 'ètude de la migration des cellules de règènèration chez les Planaires dulcicoles. Bull. Biol. Fr. Belg. 83, 213-283 (1949).
- Purton, L. E., Scadden, D. T. Limiting factors in murine hematopoietic stem cell assays. Cell Stem Cell. 1, 263-270 (2007).
- Cebria, F., Newmark, P. A. Planarian homologs of netrin and netrin receptor are required for proper regeneration of the central nervous system and the maintenance of nervous system architecture. Development. , 132-3691 (2005).
- Newmark, P. A., Sánchez Alvarado, A. Bromodeoxyuridine specifically labels the regenerative stem cells of planarians. Dev. Biol. 220, 142-153 (2000).
- Miller, W., Kennedy, R. J. X-ray attenuation in lead, aluminum, and concrete in the range 275 to 525 kilovolts. Radiology. 65, 920-925 (1955).
- Pearson, B. J. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- Hayashi, T., Asami, M., Higuchi, S., Shibata, N., Agata, K. Isolation of planarian X-ray-sensitive stem cells by fluorescence-activated cell sorting. Dev. Growth Differ. 48, 371-380 (2006).
- Reddien, P. W., Oviedo, N. J., Jennings, J. R., Jenkin, J. C., Sánchez Alvarado, A. SMEDWI-2 is a PIWI-like protein that regulates planarian stem cells. Science. 310, 1327-1330 (2005).
- Stéphan-Dubois, F. Les cellules de régénération chez la planaire Dendrocoleum lacteum. Bulletin de la Société Zooologique de France. 86, 172-185 (1961).
- Gurley, K. A. Expression of secreted Wnt pathway components reveals unexpected complexity of the planarian amputation response. Dev. Biol. 347, 24-39 (2010).
- Salvetti, A. Adult stem cell plasticity: neoblast repopulation in non-lethally irradiated planarians. Dev. Biol. 328, 305-314 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten