Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Immobilisation planaire, l'irradiation partielle, et la transplantation de tissus
Dans cet article
Résumé
Une méthode efficace pour le greffage des tissus de taille définie et cohérente entre les planaires est décrite. On y trouve aussi une description de la façon dont la technique d'immobilisation utilisée pour la transplantation peut être adapté, en collaboration avec des boucliers de plomb, pour l'irradiation partielle d'animaux vivants.
Résumé
La planaire, un ver plat d'eau douce, s'est révélée être un puissant système pour disséquer la régénération des métazoaires et 1,2 biologie des cellules souches. La régénération des tissus planaire de toute manquants ou endommagés est rendu possible par les cellules souches adultes appelé néoblastes 3. Bien que ces cellules souches ont été définitivement démontré d'être pluripotentes et singulièrement capable de reconstituer un animal entier 4, l'hétérogénéité au sein de la population de cellules souches et de la dynamique de leurs comportements cellulaires restent largement non résolues. En raison du grand nombre et une large diffusion des cellules souches dans le plan du corps planaire, des méthodes avancées de manipulation de sous-populations de cellules souches pour l'étude moléculaire et fonctionnelle in vivo sont nécessaires.
La transplantation de tissus et de l'irradiation partielle sont deux méthodes par lesquelles une sous-population de cellules souches planaires peuvent être isolés pour une étude plus approfondie. Chaque technique présente des avantages distincts. Tla transplantation question permet de l'introduction de cellules souches, dans un hôte naïf, qui sont soit intrinsèquement génétiquement distincte ou qui ont été préalablement traités pharmacologiquement. En variante, l'irradiation partielle permet l'isolement de cellules souches dans un hôte, juxtaposés à un tissu dépourvu de cellules souches, sans l'introduction d'une plaie ou d'une culasse en intégrité des tissus. L'utilisation de ces deux méthodes, on peut étudier les facteurs cellulaires autonomes et non autonomes que les fonctions de contrôle sur les cellules souches, comme la prolifération, la différenciation et la migration.
Les deux tissus de transplantation 5,6 et partielle d'irradiation 7 ont été utilisés historiquement dans la définition de la plupart des questions au sujet de la régénération planaire qui restent à l'étude aujourd'hui. Cependant, ces techniques sont restés sous-utilisés en raison de la nature laborieuse et incohérente des méthodes précédentes. Les protocoles présentés ici représentent un grand pas en avant dans la réduction du temps unee les efforts nécessaires pour générer de manière reproductible un grand nombre d'animaux greffés ou partiellement irradié avec des efficacités de près de 100 pour cent. Nous couvrons la culture des grands animaux, l'immobilisation, la préparation pour l'irradiation partielle, la transplantation de tissus, et l'optimisation de la récupération des animaux. En outre, le travail décrit ici démontre la première application de la méthode par irradiation partielle pour une utilisation avec la planaire le plus largement étudié, Schmidtea mediterranea. En outre, le tissu efficace de greffage dans planaria ouvre la porte pour le test fonctionnel des sous-populations de cellules souches naïfs ou traités dans des essais de repeuplement, qui a longtemps été la méthode étalon-or de dosage adulte potentiel des cellules souches chez les mammifères 8. Une large adoption de ces techniques sera sans aucun doute à une meilleure compréhension des comportements cellulaires de cellules souches adultes au cours de l'homéostasie tissulaire et la régénération.
Protocole
Remarque: ce protocole suggère l'utilisation de matières potentiellement dangereuses (plomb et chloretone). Acquérir, lire et suivre les fiches signalétiques pour tous les matériaux potentiellement dangereux.
1. Culture animale, de sélection et de préparation
- Pour la culture des animaux et de l'eau planaire manipulation utilisation (1X sels Montjuïc 9) et pipettes de transfert en plastique.
- Sexuelle biotype Schmidtea mediterranea peut être utilisée lorsque soulevée dans le laboratoire dans des conditions normales de culture 10. Pour produire des spécimens asexuées de taille requise, S. mediterranea soulevé à la température ambiante dans des conditions normales 9 devrait être alimenté au double au triple fréquence normale (2-3 fois par semaine) pour un à deux mois avant de les utiliser. Alternativement, les animaux nourris asexuées à une fréquence normale peut être maintenue à 10 degrés Celsius indéfiniment afin d'augmenter leur taille moyenne.
- Sélectionnez les animaux qui sont entre 1 à 2 cm delongueur et plus large que 2 mm, puis mourir de faim les animaux 3-7 jours avant de les utiliser.
- Si vous effectuez des traitements pharmacologiques ou radiologique sur les hôtes, les donateurs, destinés ou des animaux partiellement irradiés, effectuer un traitement (s) à ce stade.
- Si les traitements pharmacologiques ont été réalisées que nécessaire pour nourrir les animaux, mourir de faim les animaux environ 3 à 7 jours supplémentaires avant de les utiliser.
2. Préparation des solutions et des matériaux
- Préparer la solution de chloretone, une légère anesthésique local, en dissolvant 0,1-0,2% p / v chloretone dans l'eau planaire et le refroidissement de la solution sur la glace.
- Si vous effectuez une irradiation partielle seulement, passez à l'étape 2.7. Pour la greffe de tissus passez à l'étape 2.3.
- Utilisation d'un bec Bunsen, pliez 0,75 mm de diamètre intérieur, utilisé pour couper le tissu greffé, et 0,7 mm de diamètre extérieur, utilisé pour créer un trou dans l'hôte, qui recevra le greffon, tubes capillaires à un angle de 90 ° à 1-2 cm de la fin de bistube de ch. Pour économiser des matières, plier les deux extrémités de chaque tube capillaire et les couper en deux pour produire deux outils. Veillez à ne pas flamber les confins des tubes.
- Couper les documents suivants aux dimensions indiquées:
- Noir filtre en papier (coupé en rectangles d'environ 2,5 cm. X 1,5 cm)
- Whatman n ° 3 papier filtre (coupé en rectangles d'environ 2 cm. X 0,5 cm)
- Kimwipe (plié et découpé en liasses environ. 3 cm x 0,5 cm x 4 plis)
- Papier à rouler les cigarettes (retirer la bande de gomme et les couper en rectangles d'environ 3 cm. X 2 cm)
- Préparer une solution modifiée Holtfreter de (3,5 g / L de NaCl, 0,2 g / L de NaHCO 3, 0,05 g / L de KCl, 0,2 g / L MgSO 4, 0,1 g / L CaCl 2, pH 7,0-7,5) et de la caséine une solution saturée de Holtfreter et froid à la fois à 4 ° C.
- Joindre une Kimwipe plié à un carré de parafilm et placer sur la plaque refroidisseur Peltier ou autre dispositif de refroidissement situé sous un microscope à dissection. Saturer le Kimwipe avec Holtf réfrigérésreter la solution et le lieu noir deux rectangles de papier filtre sur la Kimwipe.
- Ligne des boîtes de Pétri avec Whatman n ° 2 du papier filtre. Humidifier le papier filtre avec une solution Holtfreter et refroidir les plats sur la glace. Pour l'irradiation partielle une parabole plus grande et de la doublure de papier filtre peut être utilisé.
3. Anesthésie et d'immobilisation
- Remplissez une boîte de Pétri avec une solution chloretone réfrigérés et les vers de la pipette dans le plat. Pour la transplantation que anesthésier un hôte et un donneur à la fois. Pour l'irradiation partielle de nombreux (n> 10) les animaux peuvent être anesthésié à la fois.
- Laissez les vers à tremper dans la solution chloretone jusqu'à ce qu'ils deviennent immobiles (5-10 min).
- Rincer les vers en les pipettant dans un plat rempli d'une solution Holtfreter réfrigérés de.
- Immobiliser les animaux en les pipetage sur du papier filtre noir saturé avec une solution Holtfreter réfrigérés et les orienter face ventrale vers le bas avec une pince. Si les animaux sont capables de locomote, imprégnez-vous une solution Holtfreter excès, légèrement diminuer la température de votre Peltier ou assiette froide, ou d'augmenter la durée du traitement chloretone.
4. L'irradiation partielle
Remarque: Suivez ces étapes pour préparer les animaux pour l'irradiation partielle. Si vous effectuez la transplantation au lieu, passez à la section 5.
- Placez un plat réfrigéré Petri de l'étape 2.7 sur la glace dans un seau à glace qui s'adapte à l'intérieur d'une source de rayons X supérieure irradiateur.
- Disposer les animaux anesthésiés dans une boîte de Pétri en déplaçant le papier filtre noir sur lequel ils sont immobilisés. En utilisant des pinces à se déplacer vers anesthésiés directement peuvent les blesser.
- Le transport d'animaux agencée à un haut-source de rayons X et irradiateur situés le bac à glace de telle sorte que la distance entre le tube à cathode à des animaux est minimisée, afin de maximiser le débit de dose efficace.
- Plomb position de l'écran (s) (figure 1) entre les animaux et la cathode tube comme vous le souhaitez. Boucliers doit être de 4,5 à 6 mm d'épaisseur pour permettre une atténuation de 97 à 99% d'un 325kV faisceau de rayons X 11.
- Délivrer la dose de rayons X. Si complète d'ablation de cellules souches de non-blindés régions est désiré, livrer 30 Gy ou plus en utilisant un irradiateur de rayons X. Pour référence, 30 Gy équivaut à 3,6 minutes à 320 kilovolts et 10 milliampères dans une précision X-Ray Inc XRAD320 avec une distance du champ à la source de 30 centimètres.
- Immédiatement après l'administration est complet, la manipulation des vers par le papier filtre noir, les animaux de transfert dans l'eau glacée planaire. Laisser l'eau planaire se réchauffer à température ambiante et les animaux à se déloger du papier filtre noir. La procédure d'irradiation partielle est maintenant terminée.
5. La transplantation de tissus
- En utilisant une pipette de transfert et de forceps, organiser hôte anesthésié et les vers des donateurs sur les rectangles de papier séparées filtre noir sur le Kimwipe qui a été refroidi sur le Peltiplaque er ou refroidisseur sous la loupe binoculaire.
- L'utilisation d'un tube de 0,75 mm de diamètre interne du capillaire découper la fiche du greffon du donneur et, en utilisant une pince, placez-le sur une sur la partie moyen de l'hôte. Si un matériau de greffe se coince dans le tube capillaire, de déloger avec des pinces.
- L'utilisation d'un tube de 0,7 mm de diamètre extérieur capillaire retirer une fiche de l'hôte et l'utilisation de la position des pinces du greffon dans le trou qui est laissé derrière.
- Transfert de l'hôte transplanté sur son rectangle de papier noir filtre dans la boîte de Pétri préparée à l'étape 2.7.
- Mouillez un morceau de papier à rouler avec une solution saturée de caséine Holtfreter et placez-le sur le dessus de l'hôte transplanté comme schématisé à la figure 2A.
- Faire tremper quatre morceaux de papier filtre dans la caséine solution saturée Holtfreter et envelopper l'hôte transplanté comme schématisé dans la figure 2B.
- Faire tremper quatre liasses de Kimwipe coupe dans la caséine solution saturée Holtfreter et les étendre surle papier filtre provenant de l'étape 5.6 (figure 2B). Replacez le couvercle et mettre la boîte de Pétri sur la glace.
- Transfert le ver planaire des bailleurs de fonds dans l'eau pour récupérer, guérir et se régénérer.
- Lorsque toutes les greffes sont terminées, placez les vers transplantés dans un incubateur à 10 ° C pendant la nuit.
- Le lendemain matin, en prenant soin de ne pas perturber la greffe, de découvrir le ver et le transférer (sur son papier filtre noir) à une boîte de Pétri remplie d'eau planaire.
- Soit permettre au ver de se dégager du papier filtre ou retirez-le délicatement avec une pince.
- Changez l'eau une fois tous les planaire 2-3 jours.
6. Les résultats représentatifs
Immédiatement après l'irradiation partielle planaire apparaît normale et naturelle. En fonction de la dose délivrée et la géométrie du bouclier utilisé, tissu irradié peut régresser et même désintégrer 7. Tissus blindé doit rester intacte. Follla régression du tissu en raison, et une perte de l'intégrité des tissus, un blastème se former et les structures manquantes seront régénérés (figure 3A). Si une amputation est faite dans la région partiellement irradié, le tissu irradié sera sauvé (c.-à-empêché de régression ou de désagrégation) (figure 3B). Dans les deux indemne et la régénération cas amputée sera retardée par rapport à une amputation non-irradié planaria (figure 3C). Si une dose de rayons X de 30 Gy a été délivrée et l'animal partiellement irradié n'a pas été blessé, l'ablation réussie de cellules souches dans un motif correspondant avec le bouclier de plomb utilisé peut être confirmée de 2 à 3 jours après l'irradiation partielle par hybridation in situ pour la cellule souche marqueur Smed-piwi-1 12 (aka smedwi-1) (figure 4).
Le matin, après une transplantation, une greffe réussie du tissu transplanté doit être évidentes wans le tissu de l'hôte, ayant adhéré à la fois les surfaces dorsale et ventrale de l'hôte (figure 5A). Parfois, la greffe se conformera à la seule surface ventrale ou dorsale. Si la transplantation a été un échec total, aucun signe de la greffe sera visible à partir soit de la surface dorsale ou ventrale de l'hôte (figure 5B). Peu de temps après une greffe réussie de tissu non irradié dans un hôte qui avait été une ablation des cellules souches par une irradiation létale 13,14, hybridation in situ pour Smed-piwi-1 révèle que les cellules souches sont présentes essentiellement dans le greffon (figure 5C ). En outre, greffes réussies de tissus non irradiés dans des hôtes irradiées de façon létale se traduira par le sauvetage des tissus de l'hôte et à long terme la survie de l'hôte 15.

Figure 1. Disposition générale de la composante de bases pour une irradiation partielle. Dans un irradiateur de rayons X avec une partie supérieure positionnée source de rayons X (tube cathodique) du planaire anesthésié est positionné directement au-dessous de la source de rayons X dans le champ d'irradiation. Afin de maximiser le débit de dose de rayons X, la distance entre le planaire et la source de rayons X doit être minimisée. Un blindage de plomb doit être placé entre le tube cathodique et le ver anesthésié, au plus près du ver comme pratique. Le blindage de plomb doit être conçu, fabriqué et placé de telle sorte qu'il protège le tissu désiré, mais expose complètement le reste du ver. De nombreux fabricants commerciale produira boucliers de plomb personnalisés à partir de votre schéma de conception simple, nous l'avons utilisé avec succès des systèmes Alpha Corp (Bluffdale, UT). Le fil doit être suffisamment épais pour permettre la quantité désirée de blindage. Par exemple, si près de blindage complet d'une 320 kV faisceau de rayons X est souhaité, le chef de file devrait être de 4,5 à 6 mm d'épaisseur. La planaire et le bouclier sont positionnés surtremper une Holtfreter de papier filtre bordée boîte de Pétri qui repose dans un seau à glace. Étant donné un champ d'irradiation suffisamment grand de rayons X et un certain nombre de boucliers de plomb identiques, de nombreux spécimens peuvent être partiellement irradié à un moment (non illustré).
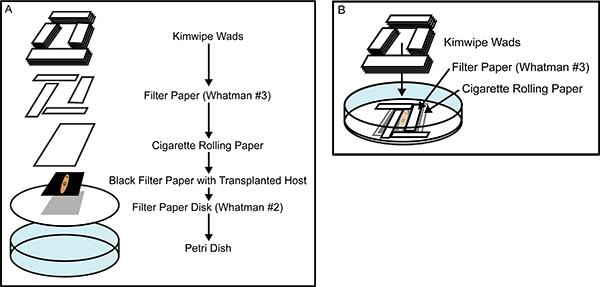
Figure 2. Construction de la chambre de récupération. (A) Une vue éclatée de la chambre de récupération greffes de tissus, montrant tous les composants qui sont posés sur le dessus les uns des autres après avoir été trempé dans une solution saturée de la caséine du Holtfreter. (B) une chambre de récupération presque terminé, illustrant le placement de l'emboîtement Whatman n ° 3 rectangles de papier filtre qui enferment l'serré planaire anesthésié, pour empêcher tout mouvement lors de la cicatrisation. La construction minutieuse de la chambre de récupération empêche les mouvements des animaux et à la dessiccation, la promotion de la guérison rapide et une plus grande efficacité de la transplantation de tissus.

Figure 3. Résultats représentatifs de simples irradiation partielle postérieure. Comme Dubois décrits 7, (A) lorsque la moitié postérieure de planaires ont été protégés avec le plomb et ensuite exposée aux rayons X d'irradiation du tissu antérieure a été observée à régresser à la frontière entre le irradié et blindé tissus au cours de laquelle blastèmes points non pigmentées formé et les animaux ont commencé à se régénérer. (B) D'autre part, lorsque les animaux ont été décapités à la suite de l'irradiation partielle effectuée dans la même (A), la régression du tissu n'a pas été observée et le reste du tissu irradié antérieure a été sauvé. Le décapité animaux partiellement irradiés têtes régénérées (B), cependant, la régénération a été considérablement retardée par rapport à non irradiées contrôles décapités (C).

Figure 4. Représentant outcome de l'ablation partielle de cellules souches après irradiation partielle. Tout montage hybridation in situ (WISH) pour le marqueur de cellules souches Smed-piwi-1 révèle que la planaire de type sauvage ont des cellules souches distribuées tout au long de leur corps à l'exception du tissu antérieure à la photorécepteurs (tête de flèche) et le pharynx bon (astérisque) 14. (A) WISH pour Smed-piwi-1 dans le contrôle irradié, mais entièrement blindé planaria fixé trois jours qui suivent l'irradiation montre une distribution de cellules souches qui est indiscernable de celle des planaires de type sauvage. (B) D'autre part, souhaitent pour Smed-piwi-1 chez les animaux qui n'ont été que partiellement blindés, laissant le exposées antérieure et postérieure, mais ont également fixé les trois jours suivant montre l'irradiation que les cellules souches sont une ablation des régions non-blindés . Barres d'échelle sont de 500 microns.

Figure 5. Examples de la transplantation de tissus réussite et d'échec. (A) Les images en direct de vues dorsale et ventrale d'une planaire transplantés avec succès trois jours après la transplantation. Le greffon (indiqué) est clairement visible sur les deux faces dorsales et ventrales et est entouré de tissus non pigmentée caractéristique à l'interface du greffon hôte. (B) En conséquence, les transplantations infructueuses ne présentent pas de greffe de tissu visible sur le site de transplantation (indiqué) et de plutôt montrer une cicatrisées, non pigmentée, la plaie latérale de la transplantation a échoué. Une greffe qui adhère seulement à la dorsale ou la surface ventrale de ressembler à une transplantation réussie (A) lorsqu'elle est vue à partir d'un côté et une transplantation d'échec (B) lorsqu'elle est vue à partir de l'autre. (C) Lorsque de type sauvage (wt) de tissu est greffé dans un hôte irradié qui a été une ablation de cellules souches résidentes et les cellules souches transplantées sont révélé plus tard par la volonté de Smed-piwi-1 deux jours après la transplantation,le succès de la transplantation est clairement affiché par la présence spécifique des cellules souches que dans ou autour de l'emplacement du greffon (pointes de flèches). Barres d'échelle sont de 500 microns.
Discussion
Importance de l'immobilisation
Immobilisation est de loin l'étape la plus critique pour la réussite de chacun de ces processus. Si planaria sont mal immobilisé avant l'irradiation partielle, ils peuvent se déplacer sous le blindage de plomb, produisant des résultats incohérents et la confusion. En outre, si les animaux ne sont pas suffisamment immobilisé après la transplantation, le ver hôte sera probablement s'éloigner de la greffe de tissu, résultant en un échec de...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Chiyoko Kobayashi et Kiyokazu Agata pour obtenir des conseils utiles sur la transplantation planaire ainsi que les membres passés et présents du laboratoire Sánchez pour les discussions précieuses lors de l'élaboration de ces techniques. Ce travail a été soutenu par le NIH Grant formation (5T32 HD0791) à BCG et les NIH R37GM057260 à l'AAS. ASA est un Howard Hughes Medical Institute.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Transfert général But pipette | Samco | 691 | |
| Tubes capillaires (ID 0,75 mm) | FHC | 30-30-0 | |
| Tubes capillaires (OD 0,7 mm) | FHC | 30-50-08 | |
| Parafilm M | VWR | 52858-076 | |
| Kimwipes 34155 | VWR | 500029-891 | |
| Noir de papier filtre | Schleicher & Schuell | 10310809 | |
| Whatman n ° 2 filtre en papier 1002-055 | Fisher Scientific | 09-810B | |
| Whatman n ° 3 papier filtre 1003-185 | Fisher Scientific | 09-820E | |
| Papier à rouler les cigarettes | Zig-Zag, d'origine | NA | |
| Petrivaisselle | VWR | 82050-544 | |
| Pince DUMONT, INOX n ° 5 | FST | 11251-20 | |
| Chloretone | Sigma-Aldrich | 112054 | |
| Caséine | Sigma-Aldrich | C3400 | |
| Le plomb Shields | Alpha Systems Corp, Bluffdale, UT | Conception sur mesure | |
| XRAD-320 irradiateur biologique | Précision X-Ray, North Branford, CT | NA |
Références
- Morgan, T. Experimental studies of the regeneration of Planaria maculata. Arch. Entw. Mech. Org. 7, 364-397 .
- Reddien, P. W., Sanchez Alvarado, A. Fundamentals of planarian regeneration. Annu Rev Cell Dev Biol. 20, 725-757 (2004).
- Randolph, H. The regeneration of the tail in lumbriculus. J. Morphol. 7, 317-344 .
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Santos, F. Studies on transplantation in planaria. Biological Bulletin. 57, 188-197 (1929).
- Morgan, L. Regeneration of grafted pieces of planarians. J. Exp. Zoöl. 3, 269-294 (1906).
- Dubois, F. Contribution á l 'ètude de la migration des cellules de règènèration chez les Planaires dulcicoles. Bull. Biol. Fr. Belg. 83, 213-283 (1949).
- Purton, L. E., Scadden, D. T. Limiting factors in murine hematopoietic stem cell assays. Cell Stem Cell. 1, 263-270 (2007).
- Cebria, F., Newmark, P. A. Planarian homologs of netrin and netrin receptor are required for proper regeneration of the central nervous system and the maintenance of nervous system architecture. Development. , 132-3691 (2005).
- Newmark, P. A., Sánchez Alvarado, A. Bromodeoxyuridine specifically labels the regenerative stem cells of planarians. Dev. Biol. 220, 142-153 (2000).
- Miller, W., Kennedy, R. J. X-ray attenuation in lead, aluminum, and concrete in the range 275 to 525 kilovolts. Radiology. 65, 920-925 (1955).
- Pearson, B. J. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- Hayashi, T., Asami, M., Higuchi, S., Shibata, N., Agata, K. Isolation of planarian X-ray-sensitive stem cells by fluorescence-activated cell sorting. Dev. Growth Differ. 48, 371-380 (2006).
- Reddien, P. W., Oviedo, N. J., Jennings, J. R., Jenkin, J. C., Sánchez Alvarado, A. SMEDWI-2 is a PIWI-like protein that regulates planarian stem cells. Science. 310, 1327-1330 (2005).
- Stéphan-Dubois, F. Les cellules de régénération chez la planaire Dendrocoleum lacteum. Bulletin de la Société Zooologique de France. 86, 172-185 (1961).
- Gurley, K. A. Expression of secreted Wnt pathway components reveals unexpected complexity of the planarian amputation response. Dev. Biol. 347, 24-39 (2010).
- Salvetti, A. Adult stem cell plasticity: neoblast repopulation in non-lethally irradiated planarians. Dev. Biol. 328, 305-314 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon