È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Planaria immobilizzazione, irradiazione parziale, e di tessuti
In questo articolo
Riepilogo
Un metodo efficace per l'innesto di tessuto di dimensione definita e coerente tra planaria è descritto. È inclusa anche una descrizione di come la tecnica di immobilizzazione utilizzata per il trapianto può essere adattato, in combinazione con scudi piombo, per l'irradiazione parziale di animali vivi.
Abstract
La planaria, un verme piatto d'acqua dolce, ha dimostrato di essere un potente sistema per la rigenerazione dei metazoi dissezione e la biologia delle cellule staminali 1,2. Rigenerazione planaria di eventuali tessuti mancanti o danneggiate è resa possibile da cellule staminali adulte chiamato neoblasts 3. Anche se queste cellule staminali sono state definitivamente dimostrato di essere pluripotenti e singolarmente in grado di ricostituire un animale intero 4, l'eterogeneità all'interno della popolazione di cellule staminali e le dinamiche dei loro comportamenti cellulari rimangono in gran parte irrisolti. A causa del numero elevato e ampia distribuzione di cellule staminali in tutto il corpo piano planarian, metodi avanzati per manipolare sottopopolazioni di cellule staminali per lo studio molecolare e funzionale in vivo sono necessari.
Trapianto di tessuti e di irradiazione parziale sono due metodi con cui una sottopopolazione di cellule staminali planaria possono essere isolati per ulteriori studi. Ogni tecnica ha i suoi vantaggi distinti. Ttrapianto questione permette l'introduzione di cellule staminali, in un ospite ingenuo, che sono intrinsecamente o geneticamente distinte o sono stati precedentemente trattati farmacologicamente. In alternativa, irradiazione parziale consente l'isolamento di cellule staminali all'interno di un host, giustapposti al tessuto privo di cellule staminali, senza l'introduzione di una ferita o culatta in integrità dei tessuti. Utilizzando questi due metodi, si può indagare sui fattori cellulari autonomi e non autonomi che controllano le staminali funzioni cellulari, quali la proliferazione, la differenziazione e la migrazione.
Sia il trapianto di tessuti 5,6 e l'irradiazione parziale 7 sono state utilizzate storicamente nella definizione molte delle domande circa la rigenerazione planaria che rimangono in fase di studio oggi. Tuttavia, queste tecniche sono rimaste sottoutilizzate a causa della natura laboriosa e incoerente dei metodi precedenti. I protocolli presentati qui rappresentano un grande passo in avanti nel ridurre il tempo di unond sforzo necessario per generare in modo riproducibile un gran numero di animali innestati o parzialmente irradiato con efficacie che si avvicinano al 100 per cento. Copriamo la cultura degli animali di grandi dimensioni, l'immobilizzazione, la preparazione per l'irradiazione parziale, il trapianto di tessuti, e l'ottimizzazione del recupero degli animali. Inoltre, il lavoro qui descritto dimostra la prima applicazione del metodo irradiazione parziale per l'uso con la planarian più ampiamente studiato, Schmidtea mediterranea. Inoltre, il tessuto efficiente innesto in planaria apre la porta per il test funzionale di sottopopolazioni di cellule staminali naive o trattati in saggi di ripopolamento, che ha da tempo il metodo di gold-standard di saggiare il potenziale delle cellule staminali dell'adulto nei mammiferi 8. Ampia adozione di queste tecniche sarà senza dubbio portato ad una migliore comprensione dei comportamenti cellulari di cellule staminali adulte durante l'omeostasi dei tessuti e la rigenerazione.
Protocollo
Nota: questo protocollo suggerisce l'uso di materiali potenzialmente pericolosi (piombo e chloretone). Acquisire, leggere e seguire MSDS per tutti i materiali potenzialmente pericolosi.
1. Animal Cultura, selezione e preparazione
- Per la cultura degli animali e l'uso dell'acqua manipolazione planaria (1X sali di Montjuïc 9) e pipette di plastica.
- Sexual biotipo Schmidtea mediterranea può essere utilizzato quando sollevate in laboratorio in condizioni normali condizioni di coltura a 10. Per produrre esemplari asessuali di dimensioni necessarie, S. mediterranea sollevato a temperatura ambiente in condizioni normali 9 dovrebbe essere alimentati a doppia tripla frequenza normale (2-3 volte a settimana) per uno o due mesi prima da utilizzare. In alternativa, gli animali asessuali alimentati a frequenza normale può essere conservato a 10 gradi Celsius indefinitamente per aumentare la loro dimensione media.
- Selezionare animali che sono tra 1 e 2 cmlunghezza e più largo 2 mm quindi fame animali 3-7 giorni prima dell'uso.
- Se l'esecuzione di eventuali trattamenti farmacologici o radiologici su host destinati, i donatori, o animali irradiati in parte, effettuare il trattamento (s) a questo punto.
- Se i trattamenti farmacologici sono stati eseguiti che ha richiesto l'alimentazione degli animali, gli animali muoiono di fame altri 3 a 7 giorni prima dell'uso.
2. Preparazione di soluzioni e materiali
- Preparare la soluzione chloretone, un leggero anestetico locale, sciogliendo 0.1-0.2% w / v in acqua chloretone planarian refrigerazione e la soluzione su ghiaccio.
- Se si esegue l'irradiazione solo parziale, passare al punto 2.7. Per il trapianto di tessuti proseguire con il passo 2.3.
- Utilizzando un becco Bunsen, piegare diametro interno 0,75 mm, usato per tagliare il tessuto trapiantato, e 0,7 mm di diametro esterno, usato per la creazione di un foro in cui l'host riceverà il trapianto, tubi capillari ad un angolo di 90 ° a 1-2 cm dalla fine each tubo. Per salvare i materiali, piegare entrambe le estremità di ogni tubo capillare e rompere a metà per la produzione di due strumenti. Fate attenzione a non fiamma le estremità dei tubi stessi.
- Tagliare i seguenti documenti alle dimensioni indicate:
- Nero filtro di carta (tagliata in rettangoli. Circa 2,5 cm x 1,5 cm)
- Whatman # 3 filtro di carta (tagliata in rettangoli di circa 2 cm x 0,5 cm)
- Kimwipe (piegato e tagliato a circa borre. 3 cm x 0,5 cm x 4 ply)
- Cigarette rolling paper (rimuovere la striscia di gomma e tagliate a rettangoli. Circa 3 cm x 2 cm)
- Preparare modificato Holtfreter la soluzione (3,5 g / L di NaCl, 0,2 g / L NaHCO 3, 0,05 g / L KCl, 0,2 g / L MgSO 4, 0,1 g / L CaCl 2, pH 7,0-7,5) e caseina soluzione satura Holtfreter e freddo sia a 4 ° C.
- Collegare un Kimwipe piegato ad un quadrato di Parafilm e luogo sulla piastra refrigerante Peltier o altro dispositivo di raffreddamento posta sotto un microscopio da dissezione. Impregnare il Kimwipe con Holtf refrigeratesoluzione di reter e posto due rettangoli neri sulla carta da filtro Kimwipe.
- Linea piastre di Petri con Whatman # 2 carta da filtro. Inumidire la carta da filtro con la soluzione Holtfreter e raffreddare i piatti sul ghiaccio. Per irradiazione parziale un'antenna più grande e rivestimento di carta filtro può essere utilizzato.
3. Anestesia e immobilizzazione
- Riempire una capsula di Petri con una soluzione chloretone refrigerati e pipette vermi nel piatto. Per trapianto solo anestetizzare un host e un donatore alla volta. Per irradiazione parziale molti (n> 10) gli animali possono essere anestetizzati in una volta.
- Lasciare in ammollo i vermi nella soluzione chloretone fino a diventare immobili (5-10 min).
- Risciacquare vermi pipettando in un piatto riempito con la soluzione Holtfreter refrigerate di.
- Immobilizzare gli animali pipettando loro nero su carta da filtro con la soluzione satura Holtfreter refrigerate e orientarli lato ventrale verso il basso con una pinza. Se gli animali sono in grado di locomote, assorbire la soluzione Holtfreter in eccesso, leggermente diminuire la temperatura della vostra Peltier o piatto freddo, o aumentare la durata del trattamento chloretone.
4. L'irradiazione parziale
Nota: Seguire questa procedura per preparare gli animali per l'irradiazione parziale. Se si esegue il trapianto, invece, passare alla sezione 5.
- Posizionare un piatto freddo Petri a partire dal punto 2,7 su ghiaccio nel secchiello del ghiaccio che si inserisce all'interno di una fonte top X-ray irradiatore.
- Disporre animali anestetizzati in una capsula di Petri spostando il filtro di carta nera su cui si sono immobilizzati. Utilizzo di pinze per spostare i vermi anestetizzati direttamente possono ferire.
- Trasporto disposti animali ad una top-sorgente di raggi X irradiatore e collocare il contenitore del ghiaccio tale che la distanza dal tubo catodico agli animali viene minimizzata, massimizzando così il tasso di dose efficace.
- Posizione piombo scudo (s) (figura 1) tra gli animali e la t catodoUbe come desiderato. Shields dovrebbe essere 4,5 a 6 mm per consentire l'97-99% di una attenuazione dei raggi X 325kV trave 11.
- Fornire dose di raggi X. Se completa ablazione delle cellule staminali da non schermati regioni si desidera, fornire 30 Gy o superiori utilizzando un X-ray irradiatore. Per riferimento, 30 Gy è equivalente a 3,6 minuti a 320 kilovolt e 10 milliampere in una precisione X-Ray Inc. XRAD320 con un campo-sorgente distanza di 30 centimetri.
- Immediatamente dopo la somministrazione è stata completata, la gestione vermi dal filtro di carta nera, gli animali di trasferimento in acqua refrigerata planaria. Consentire l'acqua planarian a temperatura ambiente e gli animali stessi per rimuovere dalla carta filtro nero. La procedura di irradiazione parziale è ora completa.
5. Trapianto di tessuti
- Utilizzando una pipetta di trasferimento e pinze, organizzare ospite anestetizzato e vermi dei donatori sulla rettangoli separati di nero carta da filtro sul Kimwipe che è stato raffreddato in Peltier piatto o più fredda sotto il microscopio di dissezione.
- Utilizzando un tubo di diametro interno 0,75 millimetri capillare tagliato la spina innesto dal donatore e, utilizzando pinze, posizionarlo su un rimpicciolire la porzione via del host. Se il materiale innesto rimane incastrato nel tubo capillare, rimuovere con una pinza.
- Utilizzando un tubo di 0,7 mm di diametro esterno capillare rimuovere un plug dall'host e utilizzando la posizione pinza l'innesto nel foro che viene lasciato alle spalle.
- Trasferire l'host trapiantato sul suo rettangolo nero carta da filtro nella piastra di Petri preparato nella fase 2.7.
- Bagnare un pezzo di carta laminazione con soluzione satura Holtfreter caseina e posizionarlo sopra dell'host trapiantato come diagramed in Figura 2A.
- Immergere quattro pezzi di carta da filtro in caseina soluzione satura Holtfreter e racchiudono l'host trapiantato come diagramed nella figura 2B.
- Immergere quattro mazzette di Kimwipe taglio caseina soluzione satura Holtfreter e stenderli sula carta da filtro passo 5,6 (Figura 2B). Sostituire il coperchio e mettere il piatto Petri su ghiaccio.
- Trasferire il worm donatore planaria in acqua per recuperare, curare e rigenerare.
- Quando tutti i trapianti sono stati completati, inserire i vermi trapiantate in un incubatore a 10 ° C durante la notte.
- La mattina seguente, facendo attenzione a non disturbare l'innesto, scoprire il worm e trasferirlo (sulla sua carta da filtro nero) in una capsula di Petri riempita con acqua planaria.
- Lasciare che il worm per rimuovere se stesso dalla carta da filtro o rimuoverli delicatamente con una pinza.
- Cambiare l'acqua planaria una volta ogni 2-3 giorni.
6. Risultati rappresentativi
Subito dopo l'irradiazione parziale planaria apparirà normale e inalterati. A seconda della dose erogata e la geometria dello scudo utilizzato, tessuto irradiato può regredire e addirittura disintegrano 7. Tessuto schermato dovrebbe rimanere intatto. Follregressione tessuto seguito e una perdita di integrità del tessuto, un blastoma formerà e strutture mancanti sarà rigenerato (Figura 3A). Se un amputazione viene effettuata nella regione irradiata parzialmente, il tessuto irradiato verrà salvato (cioè impedito di regressione o disintegrazione) (Figura 3B). In entrambi i indenne e la rigenerazione caso amputata sarà ritardato rispetto ad un amputato non irradiato planaria (Figura 3C). Se una dose di raggi X di 30 Gy stato consegnato e l'animale era parzialmente irradiato illeso, successo ablazione cellule staminali in un modello corrispondente con lo scudo piombo usato può essere confermata da 2 a 3 giorni dopo irradiazione parziale mediante ibridazione in situ per la cellula staminale marcatore Smed-piwi-1 12 (aka smedwi-1) (Figura 4).
Il mattino successivo trapianto, un innesto positivo del tessuto trapiantato dovrebbe essere w evidentiell'ambito del tessuto ospite, avendo aderito ad entrambe le superfici dorsale e ventrale del paese ospitante (Figura 5A). Di tanto in tanto, l'innesto aderirà alla sola superficie ventrale o dorsale. Se il trapianto era completamente successo, nessun segno dell'innesto sarà visibile sia dalla superficie dorsale o ventrale dell'ospite (Figura 5B). Poco dopo un innesto positivo di non-tessuto irradiato in un ospite che era stato asportato di cellule staminali per irradiazione letale 13,14, ibridazione in situ per Smed-piwi-1 rivela che le cellule staminali sono presenti prevalentemente nella innesto (figura 5C ). Inoltre, innesti di successo non-tessuto irradiato letalmente irradiati in padroni di casa si tradurrà in salvataggio di tessuto ospite e di sopravvivenza a lungo termine dello Stato membro ospitante 15.

Figura 1. Disposizione generale del componente di bases per irradiazione parziale. In un irradiatore a raggi X con un top posizionato sorgente di raggi X (tubo catodico) il planarian anestetizzato è posizionato direttamente sotto la sorgente di raggi X nel campo di irradiazione. Per massimizzare raggi X dose, la distanza tra il planarian e la sorgente di raggi X dovrebbe essere minimizzato. Uno schermo cavo deve essere posizionato tra il tubo catodico e il verme anestetizzato, più vicino alla vite senza fine come pratico. Lo schermo principale dovrebbe essere progettati, costruiti e posizionati in modo che si protegge il tessuto desiderato, ma espone completamente il resto del worm. Molti produttori commerciali produrrà schermi di piombo personalizzati dal vostro diagramma di design semplice, abbiamo usato con successo Alpha Systems Corp. (Bluffdale, UT). Il cavo deve essere sufficientemente spesso da consentire la quantità desiderata di schermatura. Per esempio, se quasi completa schermatura 320 kV di un fascio di raggi X si desidera, il cavo deve essere 4,5 a 6 mm. La planaria e lo schermo sono posizionati sucarta imbevuta un filtro Holtfreter doppiata capsula di Petri, che riposa in un secchiello del ghiaccio. Dato un sufficientemente grande campo dei raggi X irradiazione e un certo numero di scudi piombo identici, molti campioni possono essere parzialmente irradiato in una sola volta (non raffigurato).
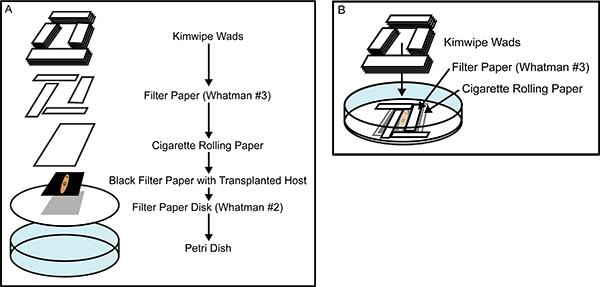
Figura 2. Costruire la camera di recupero. (A) una vista esplosa della camera di raccolta del tessuto trapianto, che mostra tutti i componenti che sono stratificati uno sopra l'altro, dopo essere stati immersi in soluzione satura di caseina di Holtfreter. (B) Una camera di recupero è quasi completata, che illustra il posizionamento ad incastro della Whatman # 3 rettangoli di carta da filtro, che racchiudono perfettamente la planaria anestetizzato, impedendo il movimento durante la guarigione. La costruzione accurata della camera di recupero impedisce il movimento degli animali e di essiccazione, promuovendo rapida guarigione e maggiore efficacia del trapianto di tessuto.

Figura 3. Risultati rappresentativi di semplice irradiazione posteriore parziale. Come descritto Dubois 7, (A) quando la metà posteriore del planarie sono stati schermati con piombo e quindi esposti alla x-ray irradiazione del tessuto anteriore è stato osservato a regredire di nuovo al confine tra la irradiato e schermato tessuto in cui blastemas punto depigmentate formata e gli animali cominciarono a rigenerarsi. (B) D'altro canto, quando gli animali sono stati decapitati seguendo la stessa irradiazione parziale eseguita in (A), regressione tessuto non è stata osservata e il restante tessuto irradiato anteriore stato salvato. Il decapitato animali irradiati in parte le teste rigenerato (B), tuttavia, la rigenerazione è stato significativamente ritardato rispetto ai controlli non irraggiati decapitati (C).

Figura 4. Rappresentante outcome di ablazione parziale di cellule staminali dopo irradiazione parziale. Whole-mount ibridazione in situ (WISH) per il marcatore di cellule staminali Smed-piwi-1 rivela che planaria wild type sono le cellule staminali distribuito in tutto il loro corpo, ad eccezione del tessuto anteriore al fotorecettori (punta di freccia) e la corretta faringe (asterisco) 14. (A) Esprimete un desiderio Smed-piwi-1 nel controllo irradiato, ma completamente schermato planaria fissata tre giorni dopo l'irradiazione mostra una distribuzione di cellule staminali che è indistinguibile da quella della planaria wild type. (B) D'altro canto, voglia di Smed-piwi-1 negli animali che sono stati solo parzialmente schermati, lasciando esposta anteriore e posteriore, ma sono stati anche fissati tre giorni di seguito viene illustrato irradiazione che le cellule staminali vengono asportate dalle regioni non schermati . Barre di scala sono 500 micron.

Figura 5. Examples di trapianto di tessuti di successo e insuccesso. (A) Immagini in diretta di opinioni dorsali e ventrali di una planaria trapiantato con successo tre giorni dopo il trapianto. L'innesto (indicata) è chiaramente visibile su entrambe le superfici dorsale e ventrale ed è circondata da caratteristici del tessuto pigmentato al trapianto di interfaccia host. (B) Di conseguenza, i trapianti non riusciti non visualizzare alcun innesto di tessuto visibile sul sito trapianto (indicata) e invece mostrano un guarito, non pigmentato, ferita laterale dal trapianto fallito. Un innesto che aderisce solo la dorsale o la superficie ventrale può assomigliare ad un trapianto di successo (A) se visto da un lato e un trapianto successo (B) se visto dall'altro. (C) Quando wild type (WT), il tessuto si innesta in un ospite irradiato che è stato asportato di cellule staminali residenti e le cellule staminali trapiantate sono successivamente rivelate da WISH per Smed-piwi-1 due giorni successivi al trapianto, leil successo del trapianto è mostrato chiaramente dalla presenza di cellule staminali solo in o attorno alla posizione innesto (frecce). Barre di scala sono 500 micron.
Access restricted. Please log in or start a trial to view this content.
Discussione
Importanza di immobilizzazione
L'immobilizzazione è di gran lunga il passo più critico per il completamento di qualsiasi di questi processi. Se planaria sono impropriamente immobilizzati prima dell'irradiazione parziale, possono muoversi sotto lo scudo di piombo, producendo risultati inconsistenti e confusione. Inoltre, se gli animali sono sufficientemente immobilizzati dopo il trapianto, il verme host probabilmente allontanarsi dal tessuto innesto, con conseguente fallimento del trap...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Chiyoko Kobayashi e Kiyokazu Agata per utili consigli sul trapianto di planaria così come i membri passati e presenti del laboratorio per le discussioni Sánchez preziosi durante lo sviluppo di queste tecniche. Questo lavoro è stato supportato dal NIH Training Grant (5T32 HD0791) per OCG e NIH R37GM057260 ad ASA. ASA è un Howard Hughes Medical Institute.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| General Purpose pipetta di trasferimento | Samco | 691 | |
| Tubi capillari (ID 0,75 mm) | FHC | 30-30-0 | |
| Tubi capillari (diametro esterno 0,7 mm) | FHC | 30-50-08 | |
| Parafilm M | VWR | 52858-076 | |
| Kimwipes 34155 | VWR | 500029-891 | |
| Nero carta da filtro | Schleicher & Schuell | 10310809 | |
| Whatman # 2 filtro di carta 1002-055 | Fisher Scientific | 09-810b | |
| Whatman # 3 filtro di carta 1003-185 | Fisher Scientific | 09-820E | |
| Cigarette rolling paper | Zig-Zag, originale | NA | |
| Petripiatti | VWR | 82050-544 | |
| Pinza DUMONT, INOX # 5 | FST | 11251-20 | |
| Chloretone | Sigma Aldrich | 112054 | |
| Caseina | Sigma Aldrich | C3400 | |
| Piombo Shields | Alpha Systems Corp., Bluffdale, UT | Design personalizzato | |
| XRAD-320 Irradiator biologica | Precision X-Ray, North Branford, CT | NA |
Riferimenti
- Morgan, T. Experimental studies of the regeneration of Planaria maculata. Arch. Entw. Mech. Org. 7, 364-397 Forthcoming.
- Reddien, P. W., Sanchez Alvarado, A. Fundamentals of planarian regeneration. Annu Rev Cell Dev Biol. 20, 725-757 (2004).
- Randolph, H. The regeneration of the tail in lumbriculus. J. Morphol. 7, 317-344 Forthcoming.
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Santos, F. Studies on transplantation in planaria. Biological Bulletin. 57, 188-197 (1929).
- Morgan, L. Regeneration of grafted pieces of planarians. J. Exp. Zoöl. 3, 269-294 (1906).
- Dubois, F. Contribution á l 'ètude de la migration des cellules de règènèration chez les Planaires dulcicoles. Bull. Biol. Fr. Belg. 83, 213-283 (1949).
- Purton, L. E., Scadden, D. T. Limiting factors in murine hematopoietic stem cell assays. Cell Stem Cell. 1, 263-270 (2007).
- Cebria, F., Newmark, P. A. Planarian homologs of netrin and netrin receptor are required for proper regeneration of the central nervous system and the maintenance of nervous system architecture. Development. , 132-3691 (2005).
- Newmark, P. A., Sánchez Alvarado, A. Bromodeoxyuridine specifically labels the regenerative stem cells of planarians. Dev. Biol. 220, 142-153 (2000).
- Miller, W., Kennedy, R. J. X-ray attenuation in lead, aluminum, and concrete in the range 275 to 525 kilovolts. Radiology. 65, 920-925 (1955).
- Pearson, B. J. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- Hayashi, T., Asami, M., Higuchi, S., Shibata, N., Agata, K. Isolation of planarian X-ray-sensitive stem cells by fluorescence-activated cell sorting. Dev. Growth Differ. 48, 371-380 (2006).
- Reddien, P. W., Oviedo, N. J., Jennings, J. R., Jenkin, J. C., Sánchez Alvarado, A. SMEDWI-2 is a PIWI-like protein that regulates planarian stem cells. Science. 310, 1327-1330 (2005).
- Stéphan-Dubois, F. Les cellules de régénération chez la planaire Dendrocoleum lacteum. Bulletin de la Société Zooologique de France. 86, 172-185 (1961).
- Gurley, K. A. Expression of secreted Wnt pathway components reveals unexpected complexity of the planarian amputation response. Dev. Biol. 347, 24-39 (2010).
- Salvetti, A. Adult stem cell plasticity: neoblast repopulation in non-lethally irradiated planarians. Dev. Biol. 328, 305-314 (2009).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon